精读分享│【JAMA】:特瑞普利单抗联合化疗治疗复发性或转移性鼻咽癌:JUPITER-02随机临床试验
英文题目:Toripalimab Plus Chemotherapy for Recurrent or Metastatic Nasopharyngeal Carcinoma: The JUPITER-02 Randomized Clinical Trial
中文题目:特瑞普利单抗联合化疗治疗复发性或转移性鼻咽癌:JUPITER-02随机临床试验
期刊:JAMA(IF:120.7)
单位:中山大学肿瘤防治中心、广州医科大学附属肿瘤医院
发表时间:2023年11月

摘要
重要性:目前尚无美国食品药品监督管理局批准用于鼻咽癌(NPC)的疗法。吉西他滨-顺铂是目前复发性或转移性鼻咽癌(RM-NPC)的标准一线治疗。
目的:探讨与单独使用吉西他滨-顺铂相比,特瑞普利单抗联合吉西他滨-顺铂作为RM-NPC的一线治疗是否能显著改善无进展生存期和总生存期。
设计、设置和参与者:JUPITER-02是一项国际多中心、随机、双盲的Ⅲ期临床试验。从2018 年 11 月 10 日到 2019 年 10 月 20 日,从中国大陆、台湾和新加坡等鼻咽癌流行地区的35个参与中心招募了289名既往未接受过全身化疗的 RM-NPC 患者。
干预措施:将患者按照1:1随机分配,分别接受特瑞普利单抗(240mg[n=146])或安慰剂(n=143)联合吉西他滨-顺铂6个周期,然后使用特瑞普利单抗或安慰剂维持治疗,直到疾病进展、出现无法耐受的毒性或完成2年的治疗。
主要终点:通过盲法独立中心评估的无进展生存期。次要终点包括客观缓解率、总生存期、研究者评估的无进展生存期、缓解持续时间和安全性。
结果:在入组的289例患者中(中位年龄,46岁[IQR,38-53岁;17%为女性],最终的无进展生存期分析结果显示,特瑞普利单抗组的无进展生存期显著长于安慰剂组(中位无进展生存期:21.4个月 vs 8.2个月;HR:0.52 [95%CI, 0.37-0.73])。中位随访时间为36.0个月,与安慰剂相比,特瑞普利单抗组的总生存期显著改善(HR:0.63 [95%CI:0.45-0.89];双侧P=0.008)。特瑞普利单抗组的患者未达到中位总生存期,而安慰剂组为33.7个月。在PD-L1(程序性死亡配体1)高表达和低表达的亚组中发现,特瑞普利单抗均可改善患者总生存期。两组所有不良事件、3级或以上不良事件和致命不良事件的发生率相似。然而,导致停用特瑞普利单抗或安慰剂的不良事件(11.6% vs 4.9%)、免疫相关不良事件(54.1% vs 21.7%)以及3级或以上免疫相关不良事件(9.6% vs 1.4%)在特瑞普利单抗组中更为常见。
结论和相关性:与单独化疗相比,化疗联合特瑞普利单抗作为 RM-NPC 的一线治疗,无进展生存期和总生存期的获益具有统计学意义和临床意义,且安全性可控。这些研究结果支持使用特瑞普利单抗联合吉西他滨-顺铂作为该患者群体的新标准治疗。
背景
鼻咽癌西方少见,在美国的年发病率不到1/10万,而在中国南部和东南亚更为流行,年发病率约为9/10万。EB病毒的潜伏感染对鼻咽癌的发展至关重要。
美国或欧洲卫生当局至今尚未批准专门针对鼻咽癌的治疗药物。目前复发性或转移性鼻咽癌 (RM-NPC)的标准一线治疗方案是吉西他滨-顺铂化疗。
近期三项Ⅲ期临床试验——JUPITER-02、CAPTAIN-1st和 RATIONALE-309均报告了PD-1抑制剂联合吉西他滨-顺铂化疗可显著改善患者的无进展生存期,然而生存数据尚不完善,尚未报道生存获益的确切分析。特瑞普利单抗是一种常见的PD-1抑制剂。
方法
数据来源
2018年11月10 日到2019年10月20日在中国大陆、台湾和新加坡等鼻咽癌流行地区的35个参与中心招募了289名既往未接受过全身化疗的复发性或转移性鼻咽癌(RM-NPC)患者。本研究纳入标准:(1)18-75岁,(2)经组织学或细胞学检查确诊为RM-NPC,(3)不适合进行局部区域治疗或根治性治疗,(4)既往未接受过全身化疗
试验设计与治疗
患者以1:1随机分配接受特瑞普利单抗联合吉西他滨-顺铂治疗或安慰剂联合吉西他滨-顺铂治疗,每3周1周期,最多6个周期,然后分别接受特瑞普利单抗或安慰剂维持治疗。根据肿瘤状态(复发性、转移性)及ECOG体能状态评分(0完全正常、1轻度受限)进行分层。在化疗阶段,患者将在第1天接受特瑞普利单抗(240 mg)或安慰剂,在第1天和第8天接受吉西他滨治疗(1000 mg/㎡体表面积),并在每个周期的第1天接受顺铂治疗(80 mg/m2)。在维持阶段阶段,患者将每3周接受一次特瑞普利单抗(240 mg)或安慰剂治疗。治疗终止条件是疾病进展、无法耐受的毒性、撤回知情同意或达到最长2年的治疗。
终点
主要终点是盲法独立中心评估的无进展生存期(PFS)。
次要终点包括客观缓解率(ORR)、总生存期(OS)、研究者评估的PFS、缓解持续时间(DOR)、安全性。
结果
1、患者和治疗
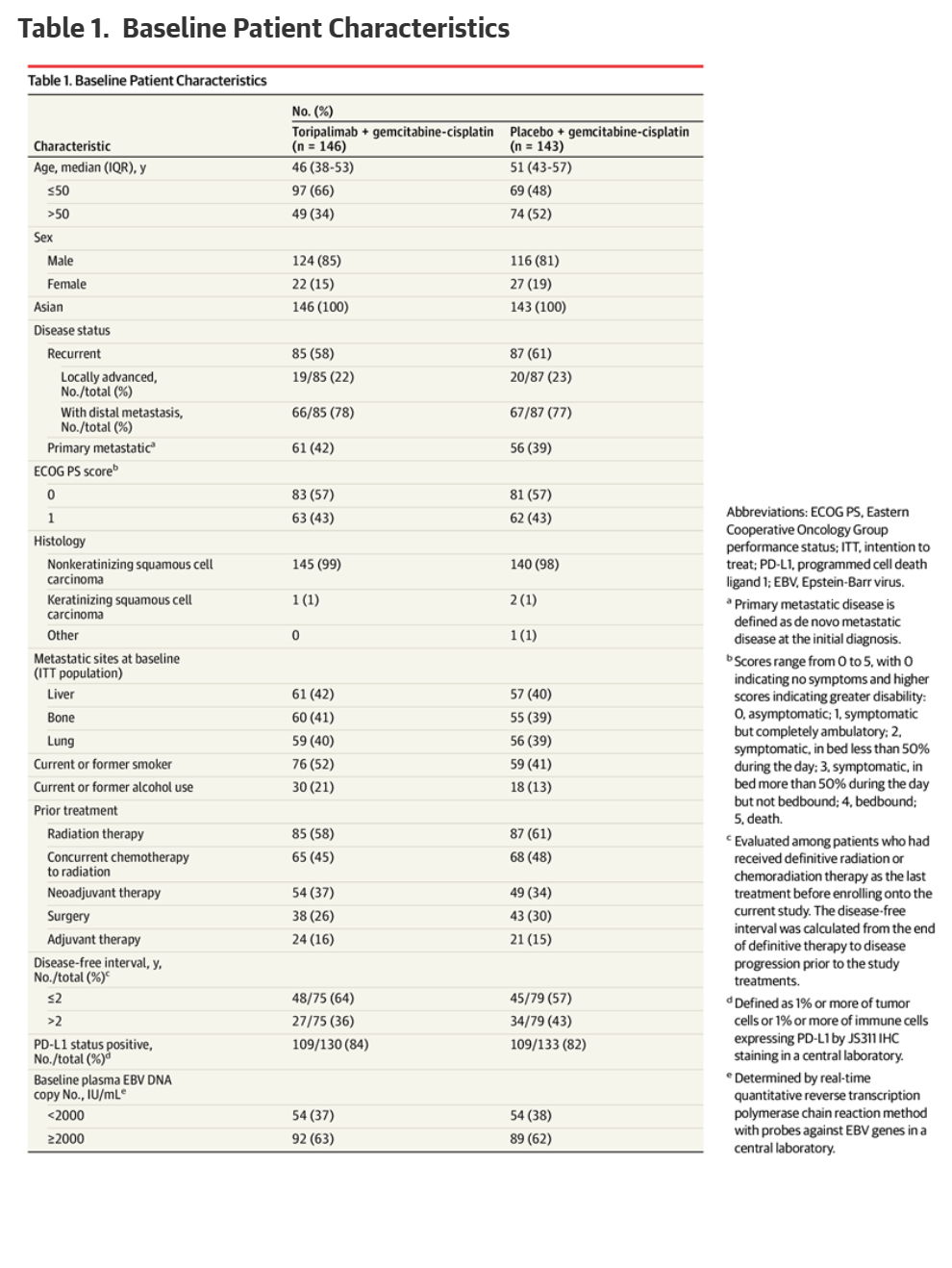
共计纳入289名患者。特瑞普利单抗组146人,中位年龄为46岁(IQR,38-53岁),85%为男性;安慰剂组143人,中位年龄为51岁(IQR,43-57岁),81%为男性。两组的基线人口统计学和特征总体平衡,但特瑞普利单抗组的中位年龄比安慰剂组年轻5岁。
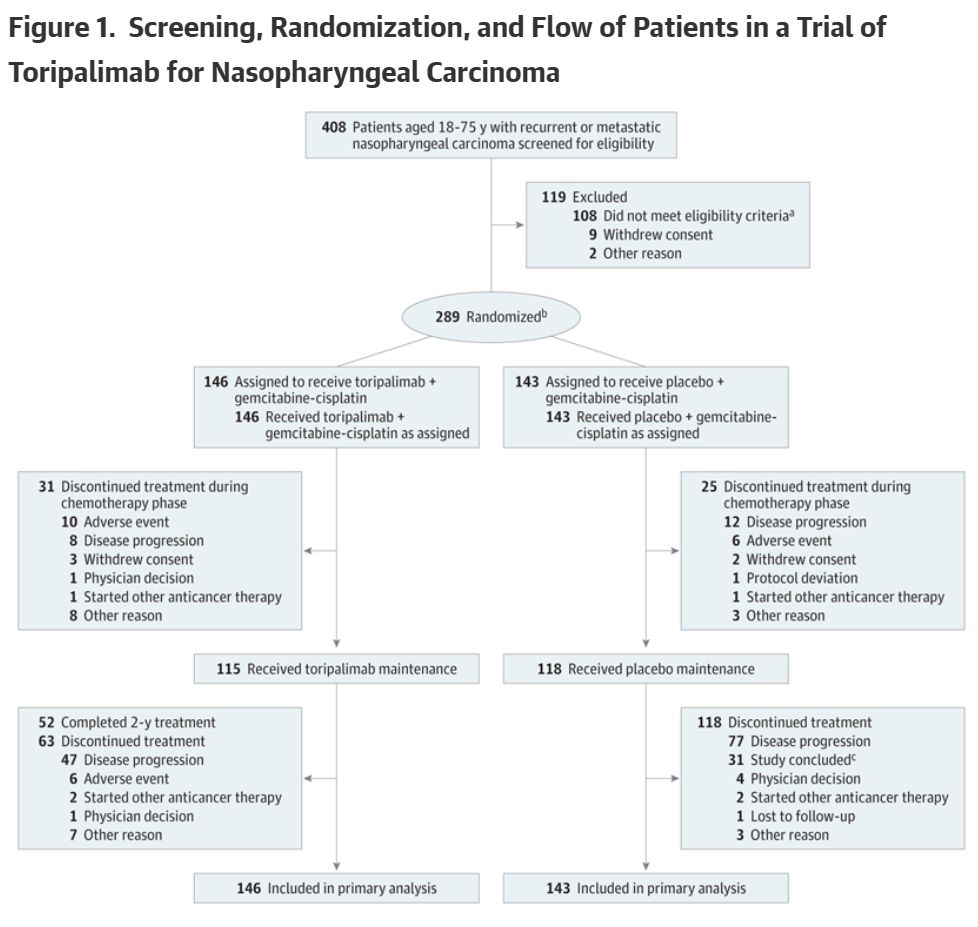
两组中各约80%的患者继续接受维持治疗(115/146 vs 118/143)。
到2021年10月,所有剩余患者(包括特瑞普利单抗组的52名患者)完成了方案规定的最长2年研究治疗,并继续进行生存随访。
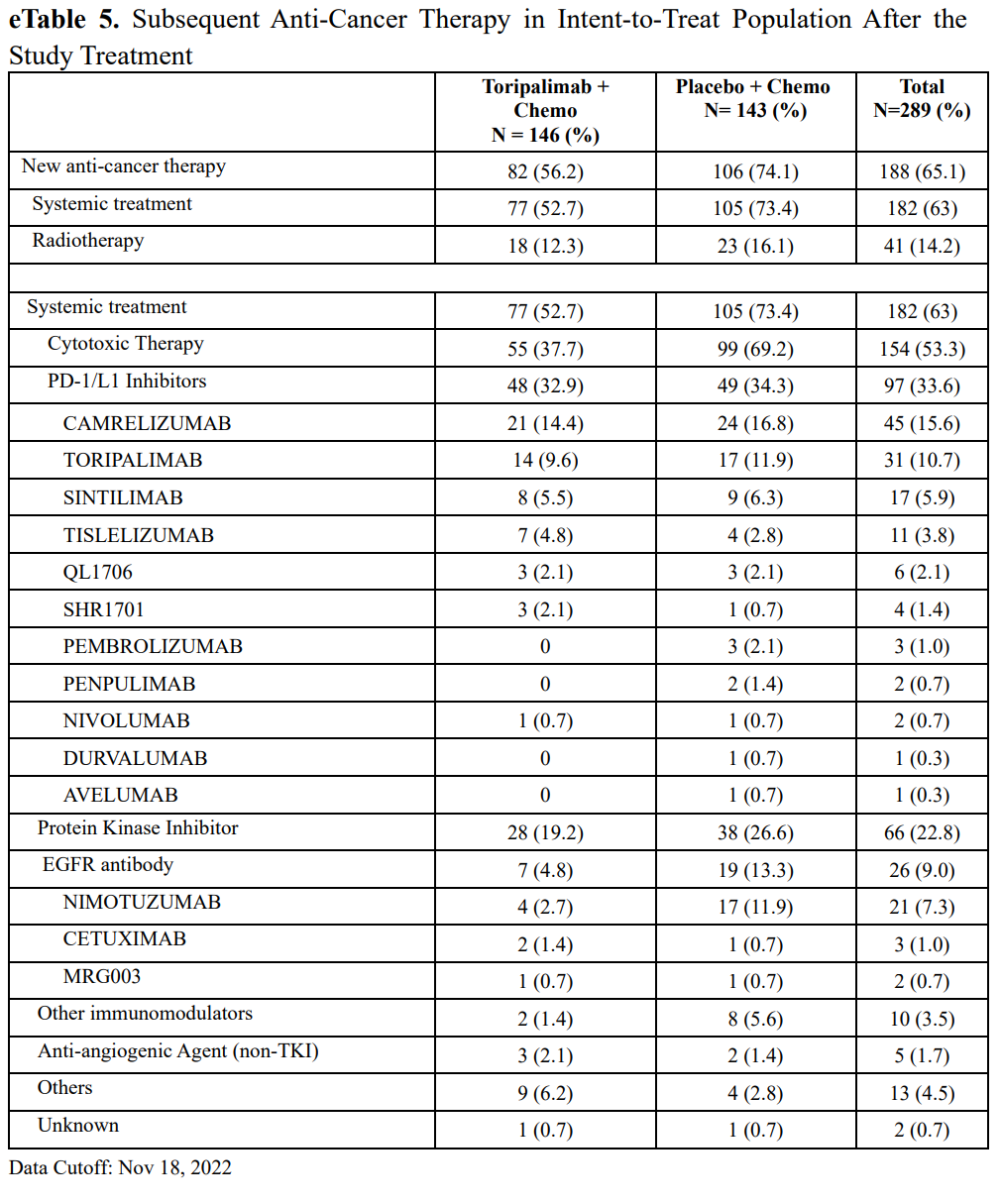
截至2022年11月18日,特瑞普利单抗组146例患者中有82例 (56.2%)和安慰剂组143例患者中有106例(74.1%)在研究治疗后接受了额外的抗癌治疗,其中特瑞普利单抗组的146例患者中有48 例(33%)和安慰剂组的143例患者中有49例(34%)接受了后期抗PD-1/PD-L1治疗。
2、无进展生存期(PFS)
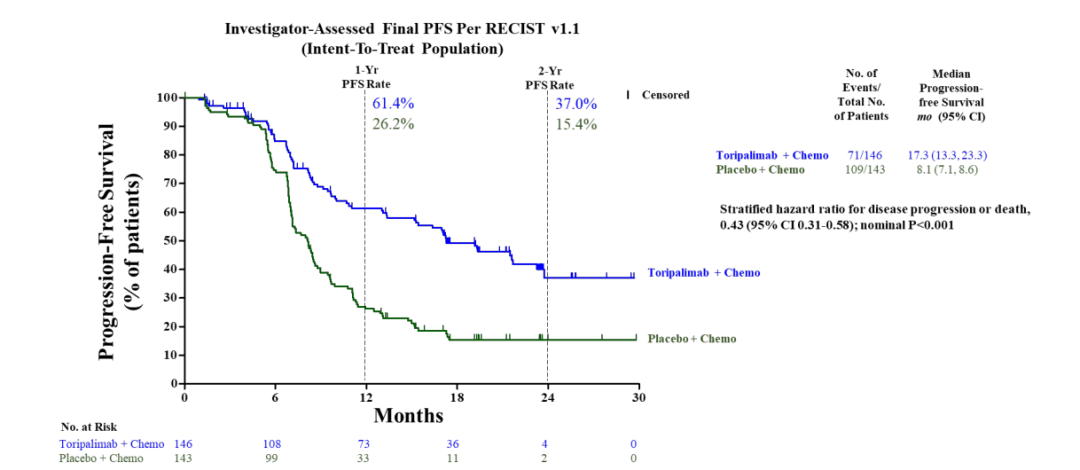
中期PFS结果显示特瑞普利单抗组疗效显著优于安慰剂组,因此最终PFS分析为描述性。
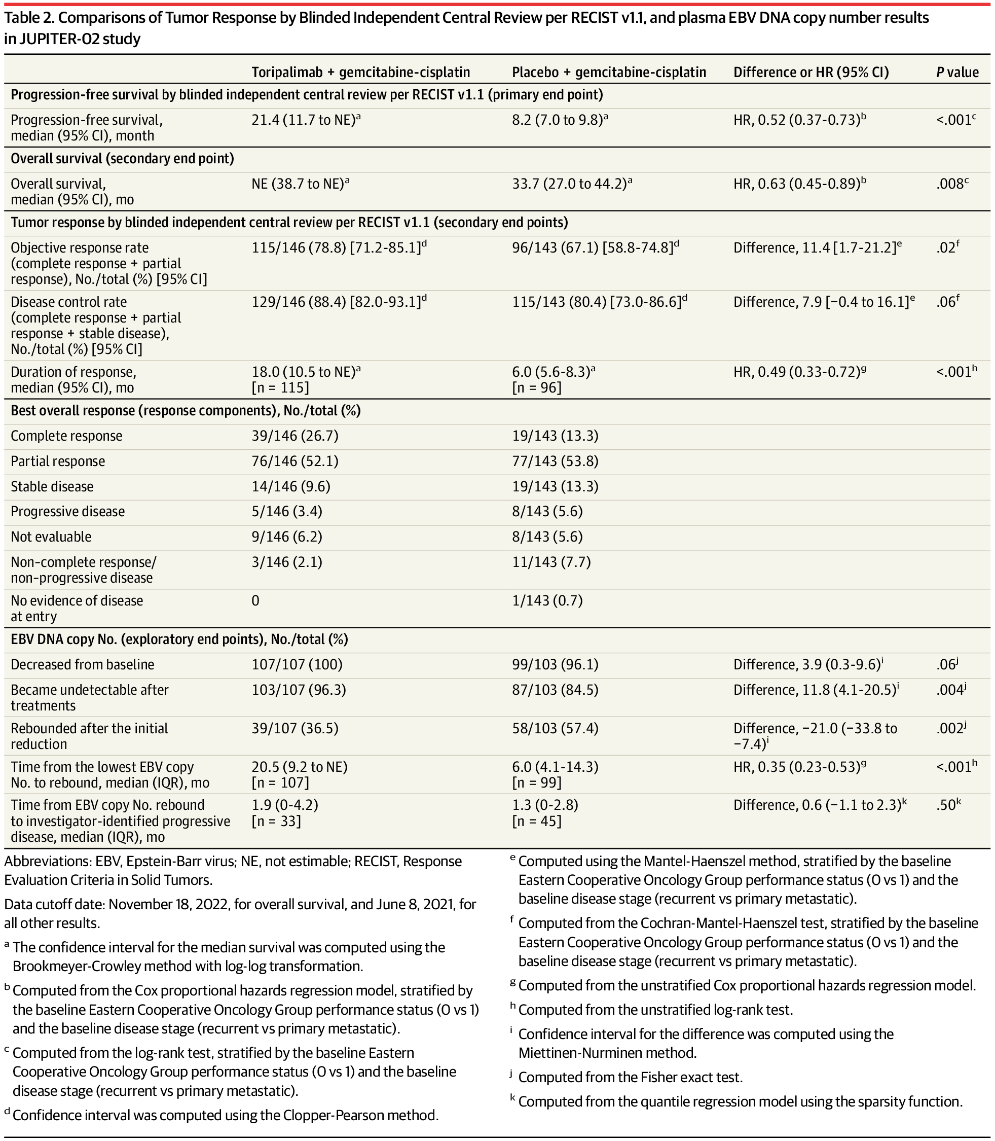
由盲法独立中心评估的特瑞普利单抗组和安慰剂组的中位PFS分别为21.4月和8.2月,风险比为0.52(95%CI, 0.37-0.73;P < 0.001)。
两组1年无进展生存率分别为59.0%和32.9%,2年无进展生存率分别为44.8%和25.4%。
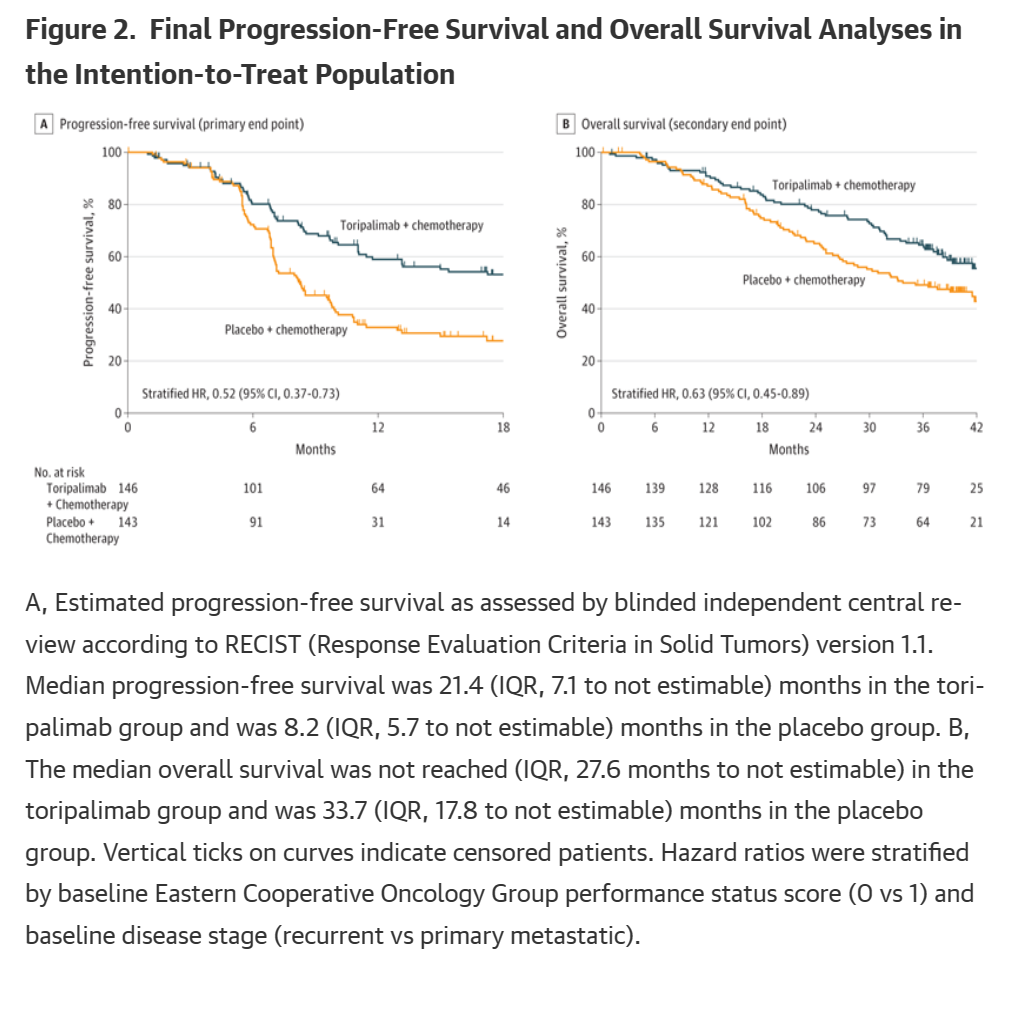
一致性:在盲法独立中心评估的PFS、所有主要亚组的PFS治疗效果以及研究者评估的PFS中,均观察到特瑞普利单抗组对PFS的显著改善效果。

3、总生存期(OS)
特瑞普利单抗组的中位总生存期未达到,而安慰剂组为33.7月。
与安慰剂组相比,特瑞普利单抗组可显著改善总生存期,风险比为0.63 [95%CI,0.45-0.89];双侧P=0.008。
特瑞普利单抗组和安慰剂组1年总生存率分别为90.9%和87.1%,2年总生存率分别为78.0%和65.1%,3年总生存率分别为64.5%和49.2%。
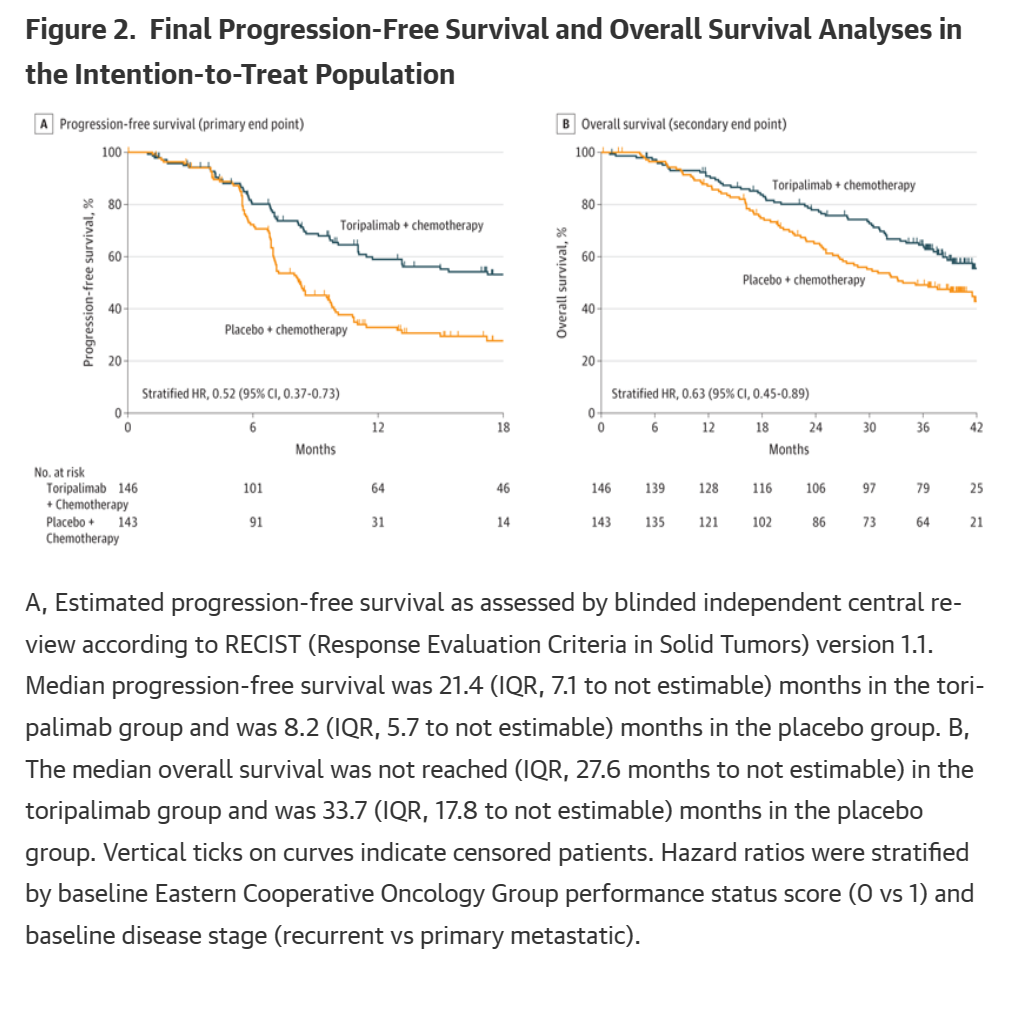
除基线时患有原发性转移性疾病的患者外,主要亚组的总生存期治疗效果总体一致。

一致性:在绝大多数主要亚组的OS治疗效果、所有PD-L1表达亚组以及EB病毒DNA拷贝数亚组中,均观察到特瑞普利单抗组对OS的显著改善效果。

4、肿瘤反应
两组客观缓解率(ORR)分别为78.8%和67.1%,完全缓解率(CRR)分别为26.7%和13.3%。
两组中位缓解持续时间(Median DOR)分别为18月和6月,风险比为0.49(95%CI,0.33-0.72),P<0.001,疗效具有持久性。
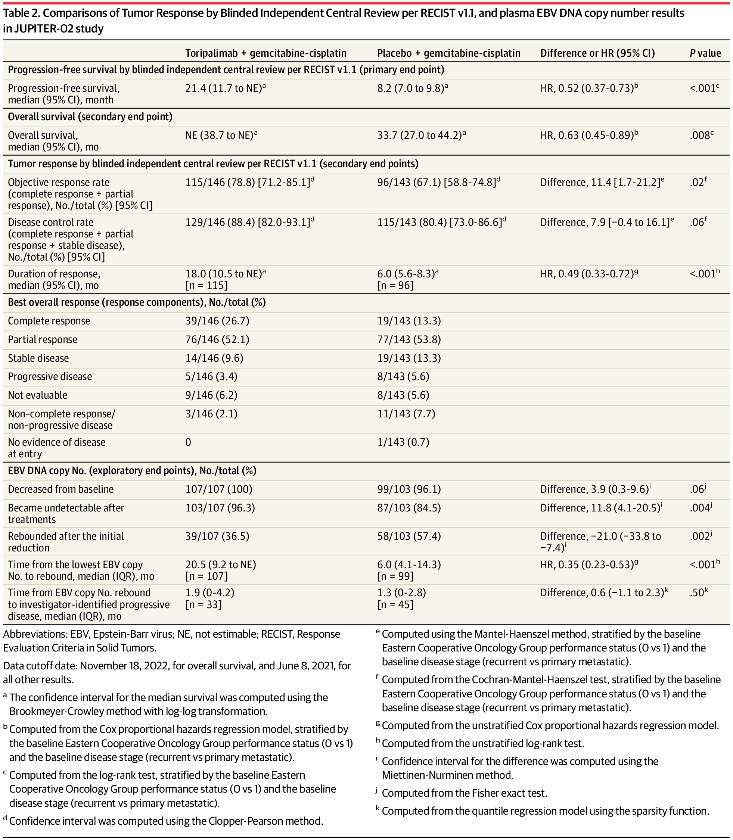
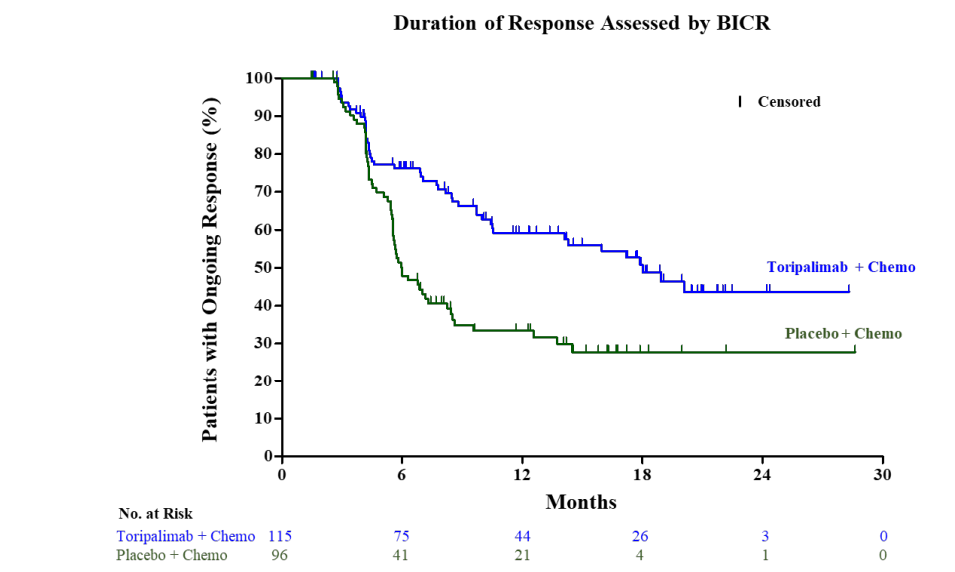
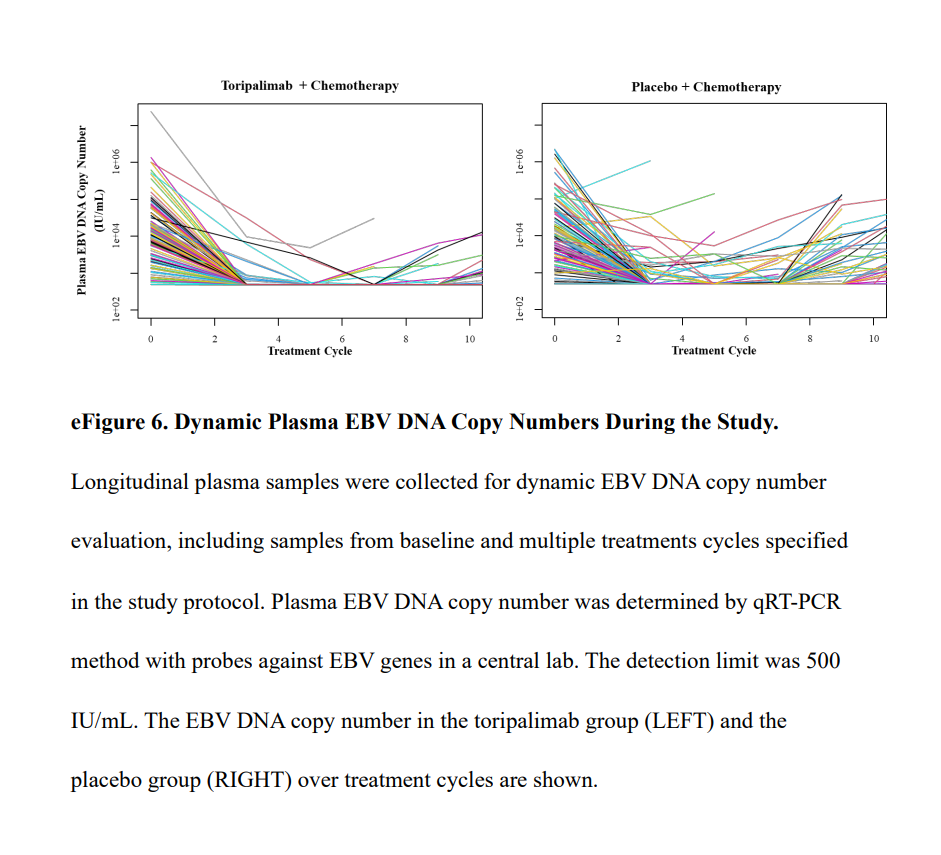
5、EBV DNA拷贝数
两组治疗后出现拷贝数下降分别为107/107(100%)和99/103(96.1%),出现拷贝数下降到不可检测的水平分别为103/107(96.3%)和87/103(84.5%)。
特瑞普利单抗组和安慰剂组治疗过程中出现EBV DNA拷贝数反弹现象患者分别为39/107(36.5%)和58/101(57.4%),两组从最低拷贝数到反弹的中位时间分别为20.5月和6月。值得注意的是,特瑞普利单抗组中,拷贝数反弹到研究者评估的疾病进展的中位间隔时间为1.9月。
6、不良事件:
所有患者至少经历了1次治疗中出现的不良事件(TEAE)。特瑞普利单抗组和安慰剂组中在3 级或以上TEAE(89.7% vs 90.2%)、致命 TEAE(3.4% vs 2.8%)、严重不良事件(43.8% vs 43.4%)和输液反应(4.1% vs 4.2%)不良事件发生率相近。最常见的不良事件和3级或以上不良事件主要与化疗药物带来的毒性有关。特瑞普利单抗组中更常见的TEAE:甲状腺功能减退症(36.3% vs 17.5%)、上呼吸道感染(25.3% vs 14.0%)、肺炎(17.8% vs 7.0%)。免疫相关不良事件(54.1% vs 21.7%)和 3 级或以上免疫相关不良事件(9.6% vs 1.4%)在特瑞普利单抗组更为常见。特瑞普利单抗与同类其他药物相比,未发现新的安全信号。
讨论:
最近的三项Ⅲ期临床试验(JUPITER-02、CAPTAIN-1st 和 RATIONALE-309)都表明PD-1抑制剂联合吉西他滨-顺铂化疗能显著改善复发性或转移性鼻咽癌患者的无进展生存期,而JUPITER-02试验还另外揭示了特瑞普利单抗带来的显著的总生存期获益。这3项试验的结果为在吉西他滨-顺铂化疗基础上加入PD-1抑制剂作为RM-NPC的一线治疗提供了强有力的证据。
尽管与免疫疗法存在广泛交叉,但总生存期仍有明显改善。而出现例外的原发性转移性鼻咽癌患者总生存期的不利结果( HR,1.23 [95%CI,0.70-2.18])可能是受显著交叉效应的影响,但原发性转移性鼻咽癌患者无进展生存期分析(HR,0.60[95%CI,0.37-0.98])及后线抗PD-1/PD-L1治疗比例的差异(原发性转移性鼻咽癌患者42% vs 复发性鼻咽癌患者27%)提示特瑞普利单抗在该亚组中仍具有效益。
潜伏性EBV感染对鼻咽癌的发生至关重要,因此血浆EBV DNA拷贝数的动态变化与放化疗、免疫治疗的反应密切相关。在目前的研究中,与安慰剂组相比,特瑞普利单抗组中有更多患者的EBV DNA拷贝数减少到无法检测的水平,出现拷贝数反弹的患者明显更少。值得注意的是,特瑞普利单抗组中反弹与研究者评估的疾病进展时间中位间隔1.9个月,这表明EBV DNA拷贝数反弹可用于预测疾病进展。
结论
与单独化疗相比,在吉西他滨-顺铂化疗基础上加入特瑞普利单抗作为复发性或转移性鼻咽癌(RM-NPC)的一线治疗,无进展生存期和总生存期获益具有统计学意义和临床意义,且安全性可控。这些发现支持使用特瑞普利单抗联合吉西他滨顺铂作为该患者群体的新标准治疗。

汇报人: 倪恬
导师:赵宇
审核:任建君、王肖宇



