精读分享│【Nature】:cGAS-STING驱动与衰老相关的炎症和神经变性
英文题目:cGAS–STING drives ageing-related inflammation and neurodegeneration
中文题目:cGAS-STING驱动与衰老相关的炎症和神经变性
期刊:Nature(IF: 64.8)
单位:瑞士洛桑联邦理工学院(EPFL)全球健康研究所
发表时间:2023年8月2日


摘要:
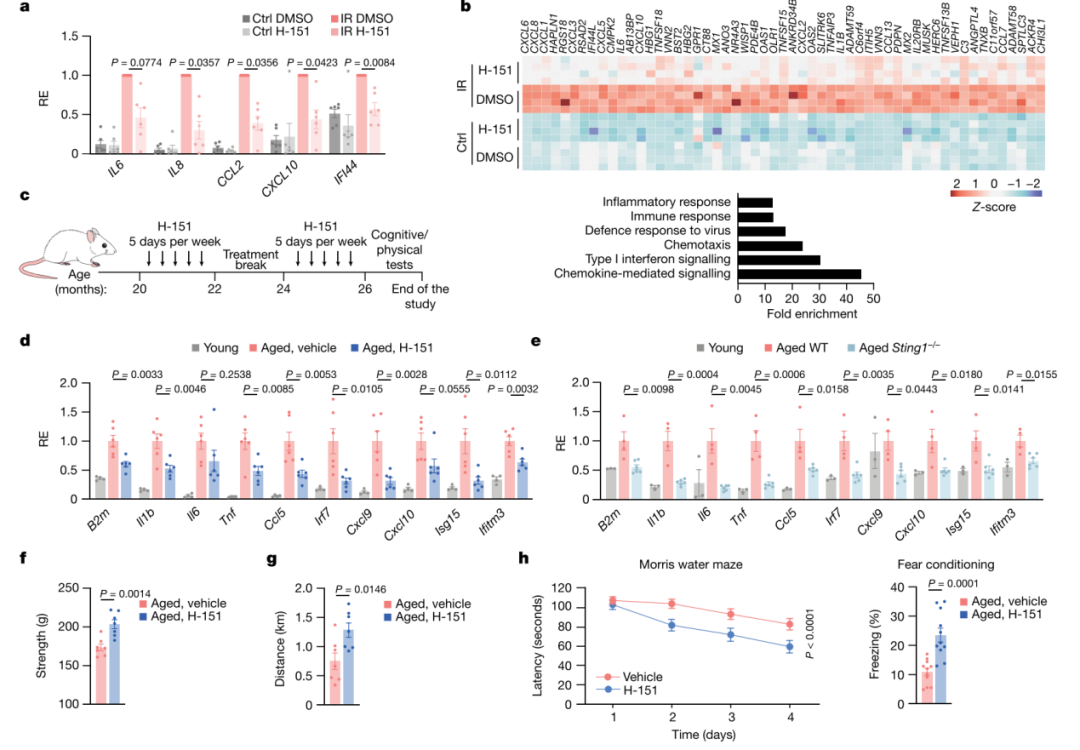
轻度炎症是衰老的标志,也是衰老相关损伤和疾病的主要驱动因素。多种因素可能导致衰老相关炎症;然而,转导异常炎症信号的分子途径及其对自然衰老的影响仍不清楚。本研究发现介导DNA免疫感知的cGAS-STING信号通路是衰老过程中慢性炎症和功能衰退的关键驱动因素。阻断STING可抑制衰老人类细胞和组织的炎症表型,减轻小鼠多个外周器官和大脑中与衰老相关的炎症,并改善组织功能。在衰老小鼠的大脑中,研究发现STING的激活会触发反应性小胶质细胞转录状态、神经变性和认知能力下降。受到干扰的mtDNA会在衰老小胶质细胞中引发cGAS活性,这也是cGAS-STING信号传导参与衰老大脑的机制。对cGAS功能获得性小鼠模型的小胶质细胞和海马的单个细胞核RNA测序分析表明,cGAS在小胶质细胞中足以指导与衰老相关的转录小胶质细胞状态,从而导致旁观者细胞炎症、神经毒性和记忆能力受损。因此,本研究结果表明,cGAS-STING通路是周围器官和大脑中与衰老相关的炎症的驱动因素,并揭示阻断cGAS-STING信号传导是阻止老年神经退行性过程的潜在策略。 研究思维导图: 主要结果 一、STING引发与衰老相关的炎症 在动物水平上,首先测试了耐受性良好的选择性小分子抑制剂H-151来探究对STING的急性抑制是否可以抑制衰老细胞的炎症反应,结果表明STING抑制剂H-151在小鼠体内可以特异性抑制炎症相关基因表达。在细胞水平上,H-151介导的STING抑制可以有效抑制多种方式诱导的衰老情况下多种促炎基因和I型干扰素(IFN)刺激基因(ISG)的表达,而不影响衰老的其他非炎症特征(图1a-b)。与H-151的药理学抑制相比,在完全衰老细胞中针对STING的RNA干扰产生了相似的结果。在人体组织水平上,使用来自肥胖个体的人类脂肪组织的外植体,结果表明H-151对STING的抑制作用抑制了组织水平上衰老细胞释放的促炎信号。这些数据表明,抑制细胞和人体组织中的STING可以阻止衰老细胞的炎症反应——衰老细胞的炎症反应是衰老过程中炎症的主要原因。 选择26月龄衰老小鼠进行检测,发现小鼠的肾脏和肝脏表现出炎症和I型干扰素特征(图1c)。随后用H-151进行处理,结果发现各种与衰老相关的免疫特征基因表达显著减弱(图1d)。并且,在炎症细胞因子减少的同时,与对照老年动物相比,STING抑制的动物肾脏中炎症细胞积累减少,这与肾脏损伤标志物(肌酐、尿素)水平降低以及白色脂肪组织中巨噬细胞数量减少有关。同样,与衰老的野生型小鼠相比,衰老的Sting1−/−小鼠的衰老相关免疫标记物水平降低,独立验证了H-151在小鼠体内抑制STING作用的有效性(图1e)。 之后,检查了STING依赖性炎症的减弱是否会影响老年小鼠的身体和认知功能。与对照小鼠相比,经H-151治疗的老年小鼠的肌肉力量和身体耐力(分别通过握力和跑步机测量)均有所改善(图1f-g)。在测试海马依赖性学习和记忆性能时还观察到STING抑制导致Morris水迷宫测试中的空间记忆和情境恐惧调节测试中的联想记忆显着改善(图1h)。总之,这些结果表明STING是外周和中枢神经系统中与衰老相关的炎症的重要驱动因素,可促进衰老和认知能力下降。 图1 STING可以促进老年小鼠的低度炎症和功能衰退 二、验证cGAS–STING通路影响大脑的衰老 衰老大脑中如何引发适应不良炎症和I型干扰素反应的信号传导机制尚不完全清楚。因此,需要重点了解cGAS-STING通路对大脑衰老的具体影响。海马实质的组织病理学检查显示,衰老小鼠存在小胶质细胞增生,并在STING抑制后减少(图2a)。与此同时,当STING被抑制时,衰老的小胶质细胞表达减少。此外,H-151也减轻了衰老小鼠海马星形胶质细胞的免疫反应性。突触素是突触活动的标志物,研究也发现STING抑制可以减少小鼠海马CA1区域神经元的损失,并增加局部突触素水平(图2b,c)。因此,与衰老野生型小鼠相比,衰老Sting1−/−小鼠的海马区小胶质细胞积累减少,神经元密度增加。综上所述,STING影响衰老小鼠的大脑稳态。 在衰老过程中,全身各种因素都可能会损害神经并导致认知功能障碍。为了确定观察到的影响是否由大脑固有的STING活性引起,进一步分析衰老小鼠全脑裂解物中STING信号传导的生物标志物。结果表明,磷酸化TBK1(Ser172;pTBK1)(负责STING下游信号转导的主要激酶)的水平在老年小鼠大脑中增加(图2d)。衰老小鼠的急性STING抑制也会导致pTBK1信号减少。这表明STING-TBK1信号轴局部参与影响衰老大脑的功能(图2d)。在DNA传导中,STING可以被cGAS内源产生的2'3'-cGAMP(cGAMP)激活。有趣的是,本研究在衰老小鼠的脑裂解液中检测到了丰富的cGAMP产生,年轻小鼠中却并没有(图2e)。因此,这些数据表明STING在衰老小鼠大脑内被激活,并暗示衰老过程中STING信号上游的异常cGAS活性。 图2 cGAS-STING激活驱动衰老大脑的退行性过程 三、衰老小胶质细胞内的STING活性 为了揭示大脑中激活cGAS-STING的潜在机制,对接受或未接受H-151治疗的年轻成年小鼠和衰老小鼠的海马体进行了批量RNA测序分析。结果显示年轻和年老海马之间有459个显著差异表达的基因(DEG),其中很大一部分基因涉及固有免疫,包括与I型IFN信号传导和小胶质细胞功能相关的基因(图3a)。从衰老小鼠大脑中分离出的原代小胶质细胞在维持中枢神经系统的免疫状态中发挥着核心作用,表明其固有免疫基因表达也有类似的增加(图3b)。因此,STING对大脑衰老的神经退行性的影响可能主要是通过小胶质细胞来实现的。为了研究小胶质细胞内的STING反应,进一步在海马区域观察了STING活性的直接标志物,即磷酸化的STING(Ser365;pSTING)。结果表明,相对于年轻小鼠,pSTING灶在衰老小鼠的海马中富集,并且大部分pSTING信号源自IBA1+小胶质细胞(图3c)。对衰老小胶质细胞的离体实验证实了I型IFN和促炎基因的STING依赖性表达(图3d)。综上,衰老小鼠小胶质细胞中的STING激活指导衰老大脑中的固有免疫激活。 图3 衰老小鼠小胶质细胞中异常的cGAS-STING激活涉及mtDNA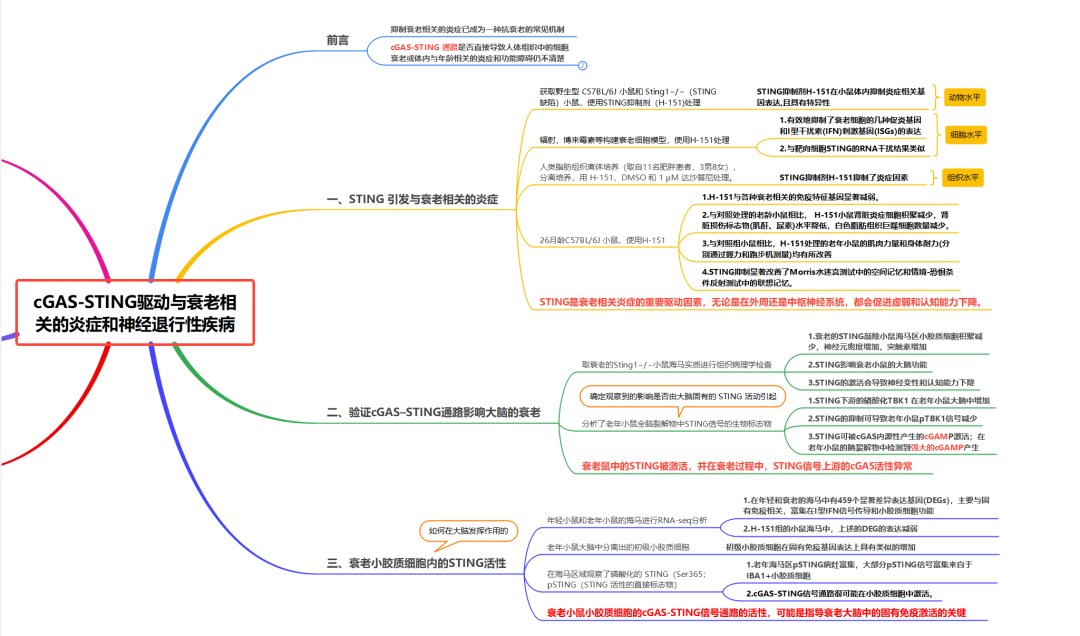
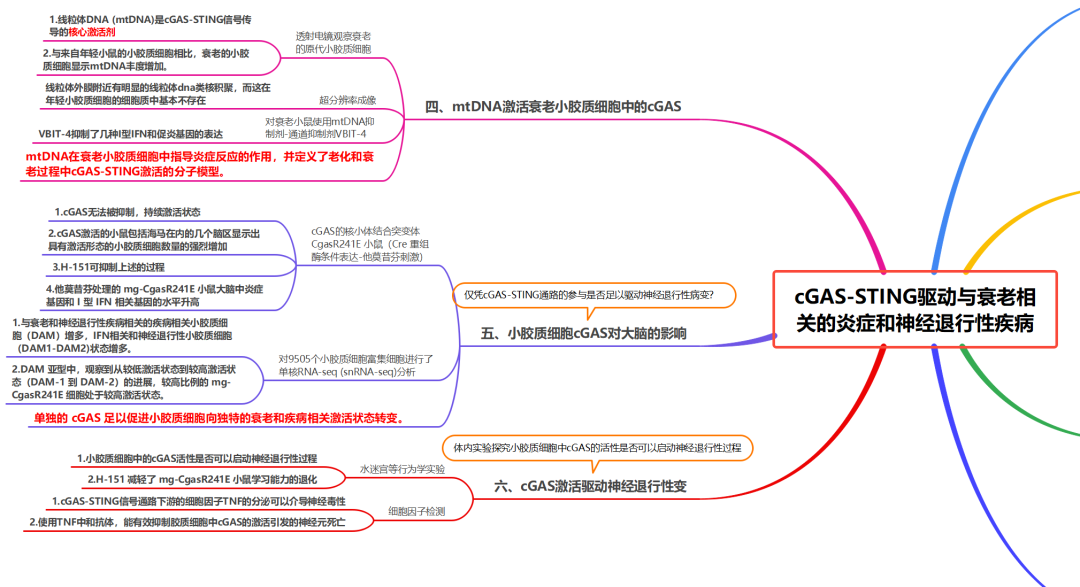
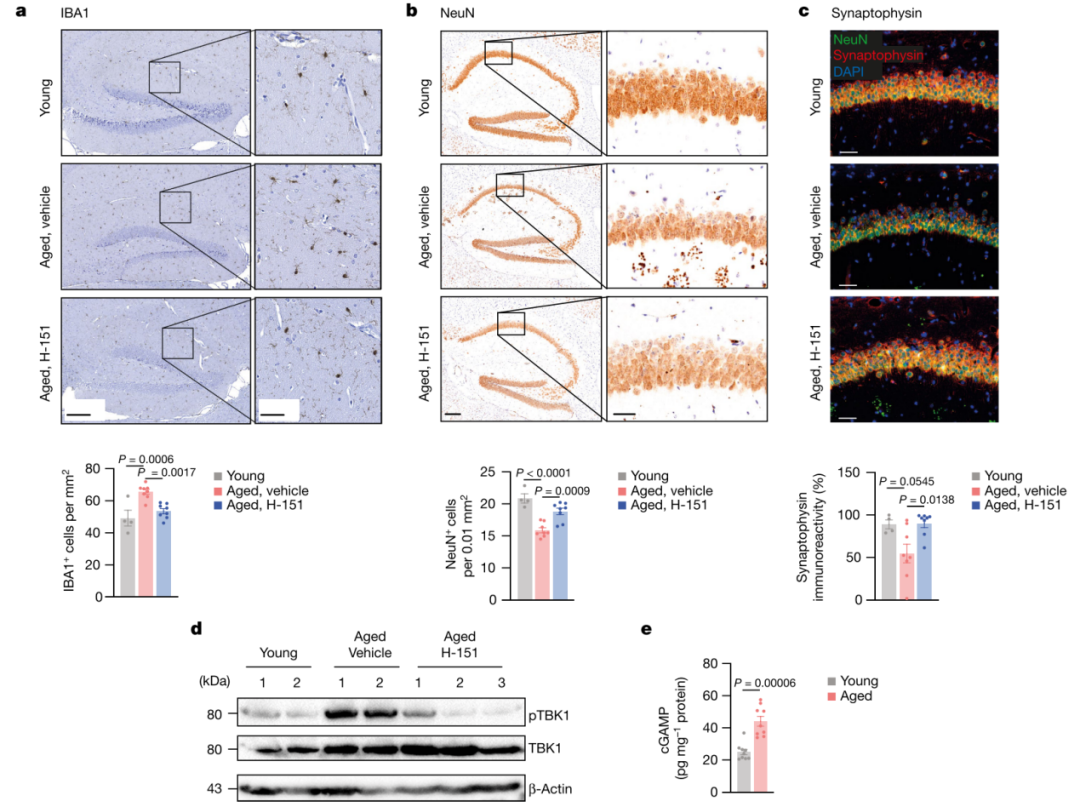
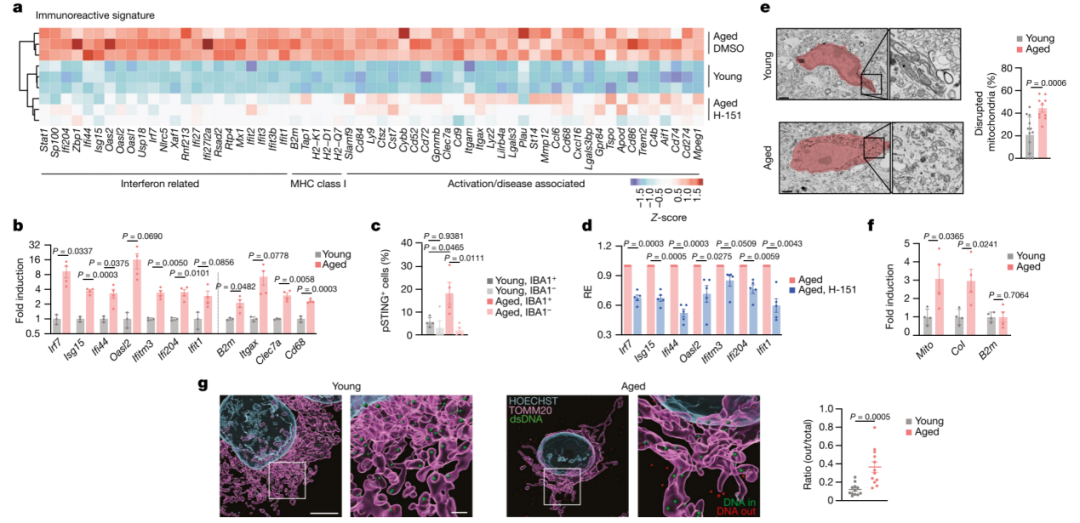
四、mtDNA激活衰老小胶质细胞中的cGAS
线粒体DNA(mtDNA)是cGAS–STING信号传导的核心激活剂,线粒体稳态破坏是衰老和神经退行性疾病的标志。通过对衰老的小胶质细胞的透射电子显微镜观察发现,其线粒体出现畸形并且缺乏线粒体特征性的内部结构(图3e)。为了确定mtDNA是否释放到衰老小胶质细胞的细胞质中,使用逆转录定量PCR(RT-qPCR)分析了原代小胶质细胞的细胞质DNA含量。结果表明,与年轻小鼠的小胶质细胞相比,老年小鼠的小胶质细胞表现出mtDNA丰度增加,但基因组DNA种类却没有增加(图3f)。衰老小胶质细胞的超分辨率成像证实了线粒体外膜附mtDNA核仁在细胞质中的显著积累,而年轻小胶质细胞的细胞质中基本上不存在这种积累(图3h)。 为了探索异常mtDNA是否会导致衰老小胶质细胞的炎症表型,用VBIT-4(一种VDAC寡聚化抑制剂)对衰老的小胶质细胞进行体外处理,结果表明几种I型IFN和促炎基因被抑制。体外细胞衰老模型证实了mtDNA在小胶质细胞衍生的小鼠BV2细胞中触发cGAS依赖性炎症反应中的作用。总之,这些数据表明mtDNA在指导衰老小胶质细胞炎症反应中的作用,并定义了衰老和衰老过程中cGAS-STING激活的分子模型。
五、小胶质细胞cGAS对大脑的影响
神经退行性疾病中涉及不同的免疫信号机制,这些机制可以与cGAS-STING信号轴协同作用,促进与年龄相关的神经退行性病变。为了确定仅cGAS-STING通路的参与是否足以驱动神经病理学改变,本研究设计了一种遗传策略来触发体内cGAS活性。此前已有研究表明,cGAS通过与核小体结合而受到抑制,并且核小体调节的破坏使得cGAS能够实现强大的DNA依赖性激活(图4a)。因此,构建了一种可以通过Cre重组酶条件表达的核小体结合突变体CgasR241E(对应于人CGASR255E)的小鼠。对具有他莫昔芬诱导型Rosa26-creERT2等位基因的小鼠细胞进行体外4-羟基他莫昔芬(4-OHT)处理,导致cGAMP合成和I型IFN应答基因上调,这为CgasR241E小鼠可用于研究提供了概念证明。 生成Tmem119-creERT2-CgasWT/R241E小鼠(之后简称小胶质细胞mg-CgasR241E),其可以限制他莫昔芬诱导的小胶质细胞和脑巨噬细胞表达CgasR241E。在给予他莫昔芬2周后,与对照小鼠相比,mg-CgasR241E小鼠在包括海马在内的多个大脑区域中表现出形态活化的小胶质细胞数量大幅增加(图4b-c)。此外,他莫昔芬治疗的mg-CgasR241E小鼠大脑中炎症基因和I型IFN相关基因的水平升高(图4d)。并且,H-151治疗减弱了mg-CgasR241E小鼠中的小胶质细胞活化。 为了全面定义cGAS控制的小胶质细胞转录程序,对9,505个富含小胶质细胞的细胞进行了单个核RNA测序,并通过生物信息学方法鉴定了从他莫昔芬治疗的mg-CgasR241E小鼠和对照CgasWT/R241E小鼠中获得的5,360个小胶质细胞。聚类分析揭示了小胶质细胞的三种独特转录状态,显示出独特的转录谱,并将它们与主要稳态小胶质细胞群体分开(图4e)。这些转录簇对应衰老和神经退行性的疾病相关(DAM)、干扰素相关和神经退行性相关等小胶质细胞状态。来自三种状态的细胞均强烈上调与IFN特征(Ifits、Oasl1、Oasl2、Isg15、Stat2)、DAM特征(B2m、Ctsb、Ctsd、Ctsz、Cd9、Cd63)和神经退行性特征(Apbb2)相关的基因。此外,在DAM亚型中,观察到从较低激活状态到较高激活状态(DAM-1到DAM-2)的进展,较高比例的mg-CgasR241E细胞处于较高激活状态(图4e,g)。两种小鼠模型之间的比较揭示了mg-CgasR241E细胞中与IFN和DAM状态(最显著的是DAM-2群体相关的基因)相关基因的扩增和更高表达,以及整个小胶质细胞中IFN特征的普遍增加(图4e,g)。此外验证了表达CgasR241E的小胶质细胞中I型IFN和DAM相关基因的上调,并发现mg-CgasR241E小鼠大脑中B2M+小胶质细胞比例的增加。因此,在没有额外触发因素的情况下,单独的cGAS足以促进小胶质细胞向独特的衰老和疾病相关激活状态转变。
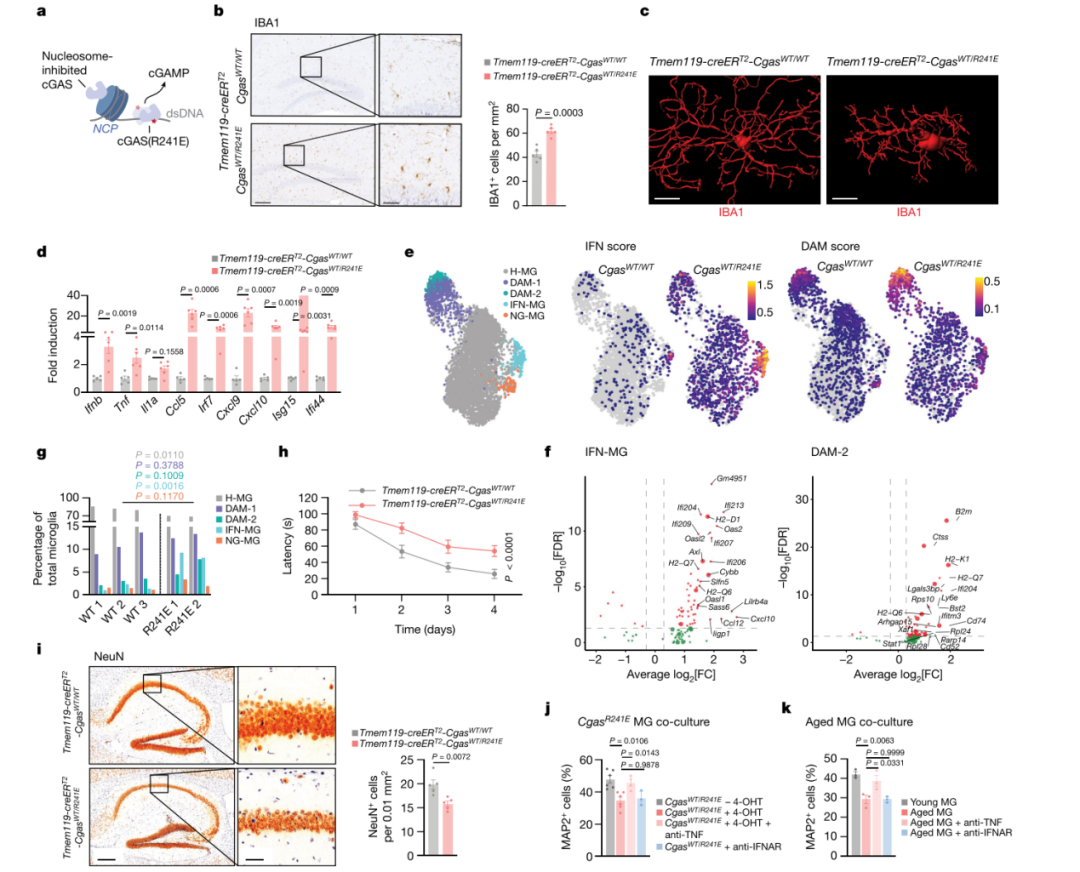
图4 cGAS的选择性参与促进与年龄相关的小胶质细胞状态和神经退行性疾病的特征
六、cGAS激活导致神经退行性变
为了确定小胶质细胞中的cGAS活性是否可以启动神经退行性过程,将海马依赖性学习和海马神经元密度作为大脑可塑性的两个独立指标。与对照组相比,mg-CgasR241E小鼠在Morris水迷宫测试中表现出认知能力受损,并伴有海马神经元密度下降(图4h,i)。与衰老过程一样,H-151减轻了mg-CgasR241E小鼠学习能力的退化,这与STING促炎作用影响神经元功能的模型一致。为了剖析小胶质细胞cGAS-STING活性下游的神经毒性过程,用来自CgasR241E小鼠的原代野生型神经元和小胶质细胞进行了共培养实验。cGAS活性有效抑制神经元细胞存活,并且使用表达CgasR241E的细胞的条件培养基也出现了这种效应,表明cGAS介导的神经毒性涉及可溶性介质的分泌(图4j)。对snRNA小胶质细胞转录组数据集的分析表明,相对于稳态小胶质细胞,TNF在IFN相关小胶质细胞状态中上调,并且在mg-CgasR241E小鼠的大脑中被诱导(图4d)。有趣的是,添加针对TNF的中和抗体可有效挽救CgasR241E诱导的神经元死亡(图4j)。相比之下,阻断I型IFN信号传导则没有效果(图4j)。综上所述,老化小胶质细胞的共培养实验证实了TNF在异常cGAS活性与神经元细胞受损之间的关键作用(图4k)

汇报人: 邹宇豪
导师:吴江
审核:任建君 吴桂儀



