华西耳鼻喉学术前沿速递——文献精读(第57期)
精读分享│【Advanced Science】:AAV介导的多基因协同调控支持细胞重编程和耳蜗毛细胞再生
英文题目:AAV-mediated Gene Cocktails Enhance Supporting Cell Reprogramming and Hair Cell Regeneration
中文题目:AAV介导的多基因协同调控支持细胞重编程和耳蜗毛细胞再生
期刊:Advanced Science(IF=15.1)
单位:
1.江苏省南京市东南大学生命科学与技术学院数字医学工程国家重点实验室
2.山东省济南市山东大学附属山东省耳鼻咽喉头颈外科
3.山东省耳鼻喉科研究所
4.江苏省南通市南通大学神经再生联合创新中心
5.北京市北京理工大学生命科学学院航空航天中心医院神经内科
6.四川省成都市四川省人民医院耳鼻咽喉头颈外科
7.深圳市东南大学深圳研究所
发表时间:2024年5月29日


Abstract
Mammalian cochlear hair cells (HCs) are essential for hearing, and damage to HCs results in severe hearing impairment. Damaged HCs can be regenerated by neighboring supporting cells (SCs), thus the functional regeneration of HCs is the main goal for the restoration of auditory function in vivo. Here, cochlear SC trans‐differentiation into outer and inner HC by the induced expression of the key transcription factors Atoh1 and its co‐regulators Gfi1, Pou4f3, and Six1 (GPAS), which are necessary for SCs that are destined for HC development and maturation via the AAV‐ie targeting the inner ear stem cells are successfully achieved. Single‐cell nuclear sequencing and lineaging tracing results showed that the majority of new Atoh1‐derived HCs are in a state of initiating differentiation, while GP (Gfi1, Pou4f3) and GPS (Gfi1, Pou4f3, and Six1) enhanced the Atoh1‐induced new HCs into inner and outer HCs. Moreover, the patch‐clamp analysis indicated that newborn inner HCs induced by GPAS forced expression have similar electrophysiological characteristics to those of native inner HCs. Also, GPAS can induce HC regeneration in the HC‐damaged mice model. In summary,the study demonstrates that AAV‐mediated co‐regulation of multiple genes, such as GPAS, is an effective means to achieve functional HC regeneration in the mouse cochlea.
Keywords: AAV, hair cell regeneration, multi‐gene co‐regulation
摘要:
哺乳动物的耳蜗毛细胞(HCs)对于听力极为关键,一旦毛细胞受损,会继发严重的听力障碍。受损的毛细胞能够借助邻近的支撑细胞(SCs)实现再生,因此体内恢复听力功能的核心目标在于实现毛细胞的功能性再生。在此,通过AAV-ie精准靶向内耳干细胞,诱导关键转录因子Atoh1及其共调节因子Gfi1、Pou4f3和Six1(GPAS)进行表达,促使耳蜗SC分别向内外毛细胞进行转分化。单细胞核测序与谱系追踪的结果表明,大多数由新的Atoh1衍生出的毛细胞处于起始分化状态,而GP(Gfi1、Pou4f3)和GPS(Gfi1、Pou4f3和Six1)增强了Atoh1诱导产生的新毛细胞向内外毛细胞的转化。另外,全细胞膜片钳分析显示,由GPAS强制表达所诱导生成的新生内毛细胞,其电生理特性与天然内毛细胞相似。并且,GPAS能够在毛细胞受损的小鼠模型中诱导毛细胞再生。总之,该研究证实,由AAV介导的GPAS等多基因协同调控,可以在小鼠耳蜗中有效实现功能性毛细胞再生。
关键词:腺相关病毒,毛细胞再生,多基因协同调节
研究思路与方法:
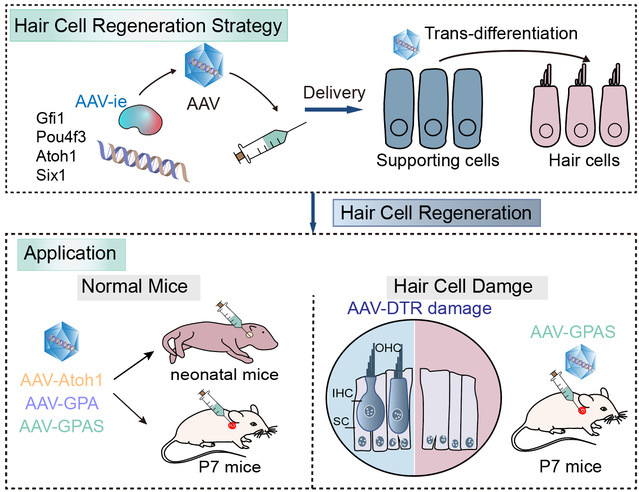
技术路线图
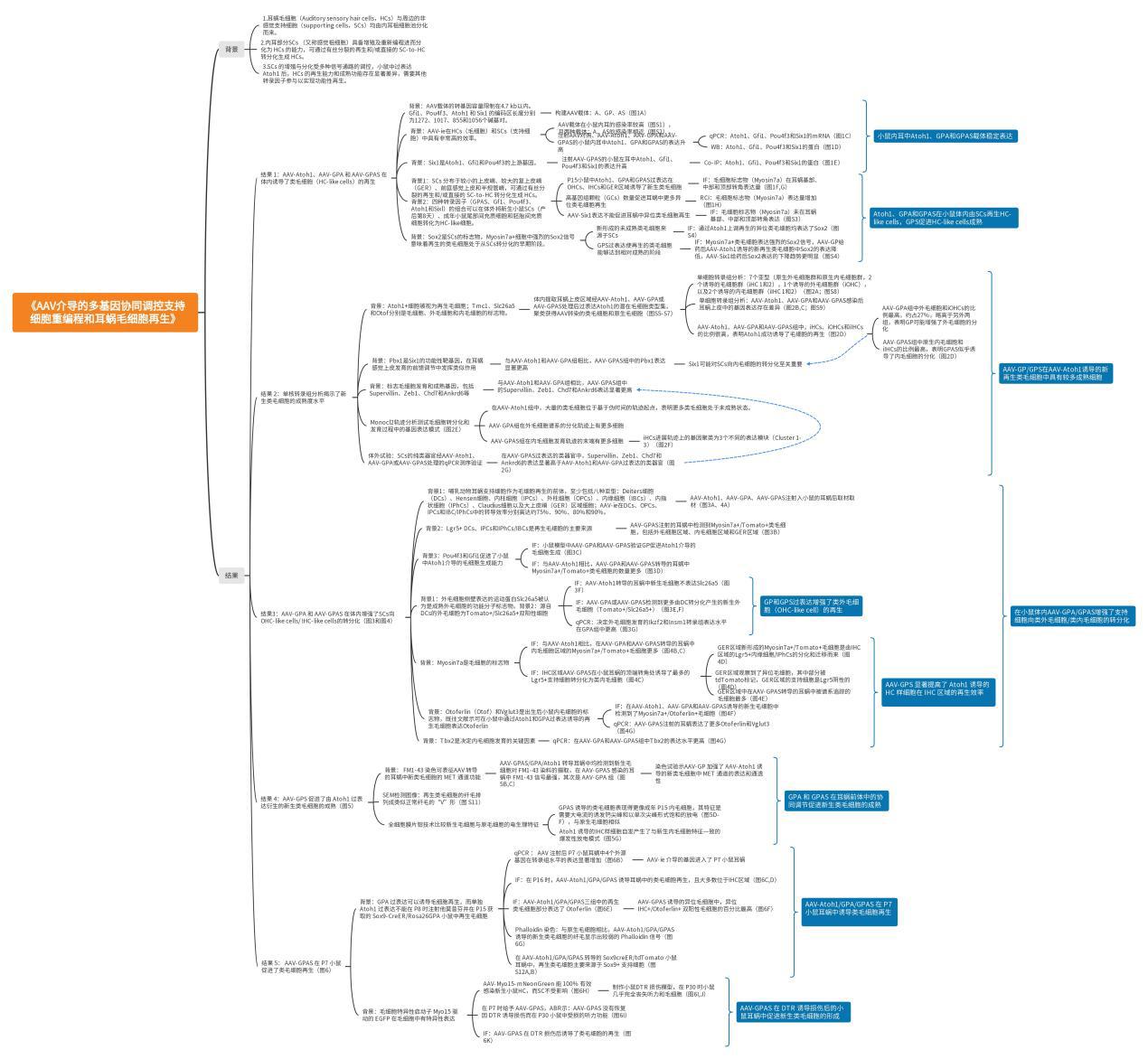
研究思路导图
主要结果:
2.1. AAV-Atoh1、AAV-GPA 和 AAV-GPAS 成功在体内诱导了类毛细胞(HC-like cells)的再生
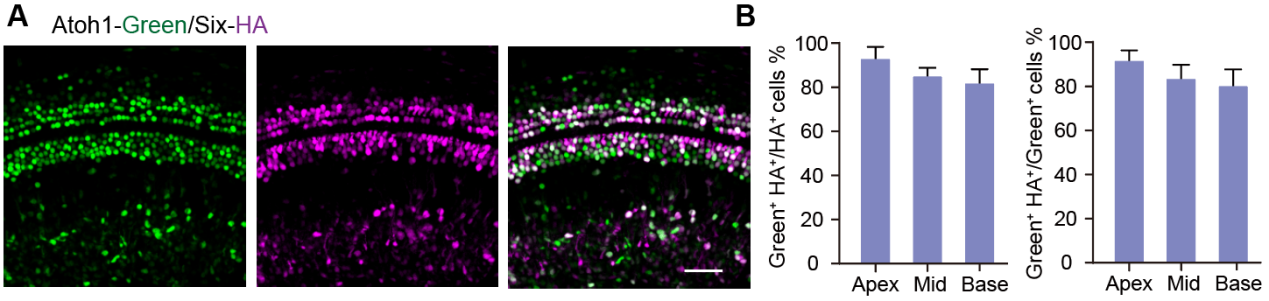
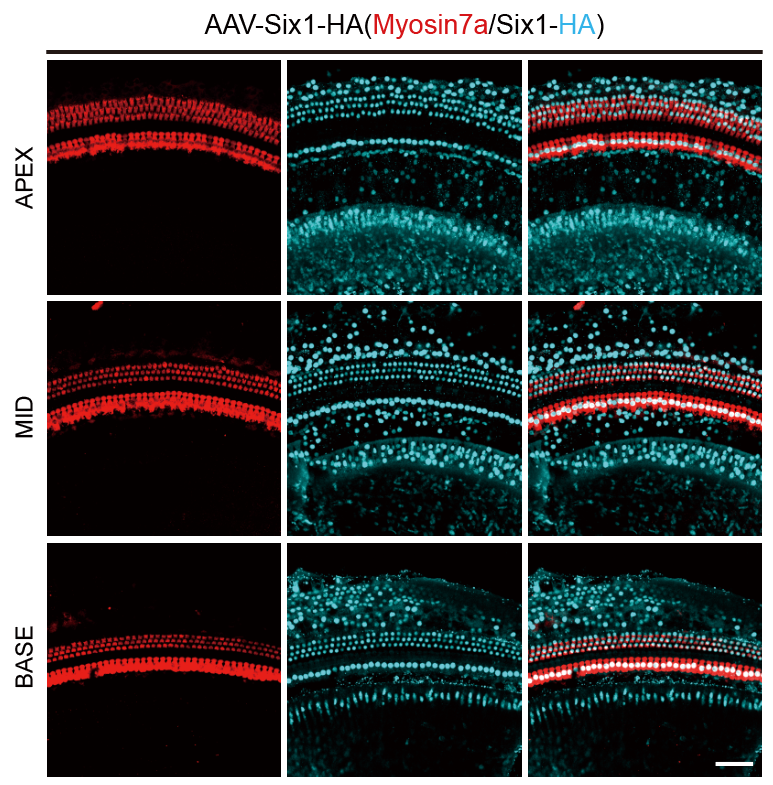
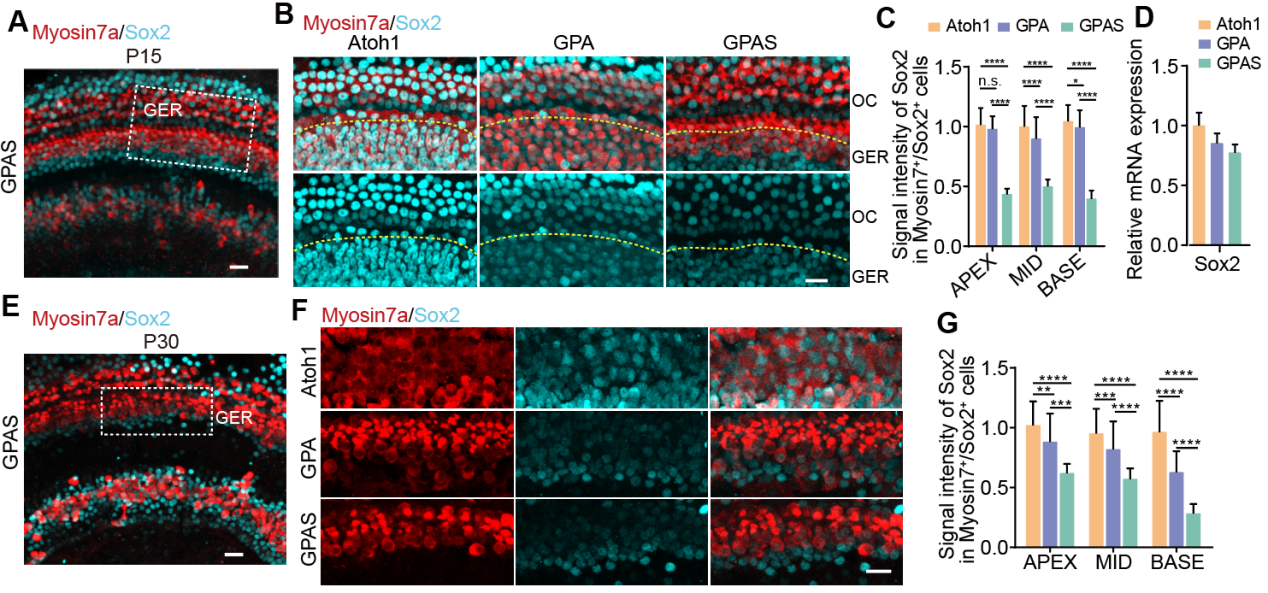
为了实现GPA和GPAS的共调节,研究者构建了包含Atoh1、Atoh1-P2A-Six1(AS)和Gfi1-P2A-Pou4f3(GP)的AAV载体(图1A)。研究者使用AAV-ie作为病毒包装的衣壳蛋白,检验了在P2小鼠中的感染效率(图S1),并且AAV-ie介导的两种AAV在同类细胞中均具有高感染效率(图S2)。因此,AAV载体被注射到P2野生型小鼠的耳蜗中,验证了在相应耳蜗中Atoh1、GPA和GPAS的过表达(图1B),Atoh1、Gfi1、Pou4f3和Six1的表达显著增加(图1C,D),表明AAV-ie介导的Atoh1,GPA,GPAS基因转移成功进入耳蜗。然后,在P15小鼠中的毛细胞的标志物Myosin7a的免疫荧光染色示Atoh1、GPA和GPAS过表达在OHCs(外毛细胞)、IHCs(内毛细胞)和GER(大上皮嵴)区域,诱导了新生类毛细胞(HC-like cells)(图1F,G)。此外,低GC组相比,增加AAV-Atoh1、AAV-GPA和AAV-GPAS的基因组颗粒(GCs)数量可以促进耳蜗中更多的异位类毛细胞再生(图1F,H)。另外,研究者发现几乎所有通过Atoh1上调再生的异位类毛细胞都表达了SCs的标志物——Sox2,表明新形成的类毛细胞来源于SCs(图S4)。而AAV-GP的给药降低了AAV-Atoh1诱导的新再生类毛细胞中Sox2的表达,并且AAV-Six1给药后Sox2表达的下降趋势更明显(图S4),表明GPS过表达使再生的类毛细胞能够达到相对成熟的阶段。
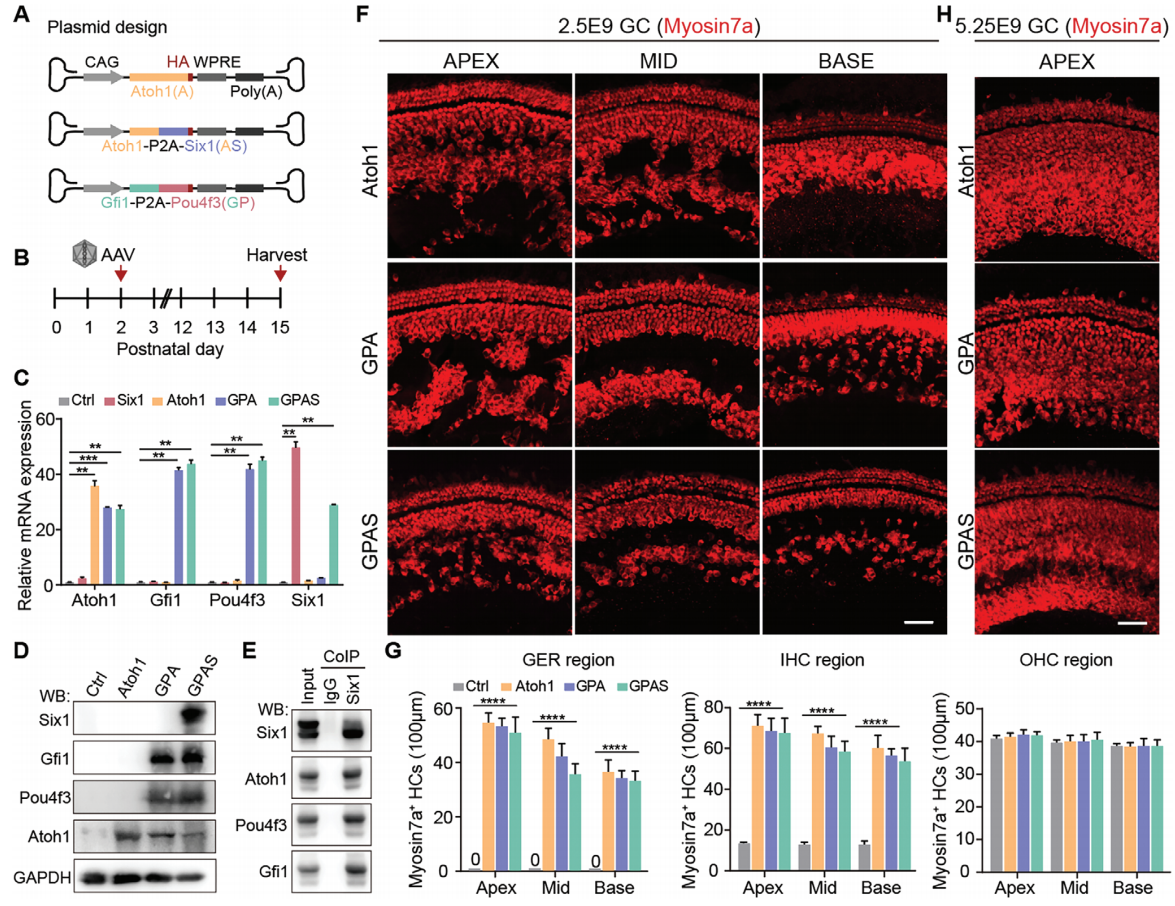
图1. AAV-ie介导的Atoh1、GPA和GPAS在体内有效再生了类毛细胞(HC-like cells)
图S1. 带有NLS标签的AAV-ie-NeonGreen对小鼠的HCs和SCs具有极高的感染率
图S2. 由 AAV-ie 介导的两种 AAV 载体能够高效感染同一类细胞
图S3. 耳蜗中高表达Six1基因无法再生成HCs
图S4. 对注射了 AAV-Atoh1、AAV-GPA 以及 AAV-GPAS 的小鼠进行 Sox2 染色
2.2. 单核转录组分析揭示了新再生类毛细胞成熟度的水平
接下来,研究者探究了多种转录因子协同调节是否能增加毛细胞再生并使其成熟度更接近于体内原生毛细胞。首先,对经过AAV-Atoh1、AAV-GPA或AAV-GPAS处理的耳蜗上皮区域进行了单核转录组分析,成功捕获了来自3个AAV注射组的2722,722个单核,使用无偏聚类分析来识别耳蜗细胞类型。研究者清晰地识别了一小部分包括了AAV注射的过表达Atoh1的细胞的毛细胞类型,从每组中取出这些潜在的毛细胞类型子集,并重新聚类以获得AAV转染的类毛细胞和原生毛细胞(图S5-S7)。通过结合每组中每个集群的类似基因表达模式和基于伪时间的Otof、Slc26a5、Tmc1和Atoh1的表达模式,研究者手动注释7个亚型,包括1个原生外毛细胞群和1个原生内毛细胞群,2个诱导的毛细胞群(iHC 1和2),1个诱导的外毛细胞群(iOHC),以及2个诱导的内毛细胞群(iIHC 1和2)(图2A图S8)。其次,研究者分析了AAV-Atoh1、AAV-GPA和AAV-GPAS感染后耳蜗中的基因表达差异(图2B,C;、图S9)。与AAV-Atoh1和AAV-GPA组相比,AAV-GPAS组中Pbx1的表达显著更高。标志毛细胞发育和成熟基因,包括Supervillin、Zeb1、Chd7和Ankrd6,在AAV-GPAS组中的表达也更高。继而比较了用AAV-Atoh1、AAV-GPA和AAV-GPAS注射的耳蜗上皮样本中的毛细胞组成(图2D)。在AAV-Atoh1、AAV-GPA和AAV-GPAS组中,iHCs、iOHCs和iIHCs的比例很高,表明Atoh1成功诱导了毛细胞的再生。AAV-GPA组中外毛细胞和iOHCs的比例最高,约占27%,略高于另外两组,表明GP可能增强了外毛细胞的分化。相比之下,AAV-GPAS组中原生内毛细胞和iIHCs的比例最高,表明GPAS可能诱导了内毛细胞的分化(图2D)。这些数据表明Six1可能对SCs向内毛细胞的转分化至关重要。因此,为了进一步区分iHCs与原位毛细胞、外毛细胞和内毛细胞(图S8E),研究者通过Monocl2轨迹分析测试了毛细胞转分化和发育过程中的基因表达模式。在AAV-Atoh1组中,大量的类毛细胞位于基于伪时间的轨迹起点,这表明更多的类毛细胞处于未成熟状态。然而,AAV-GPA和AAV-GPAS组的细胞显示出分支轨迹,AAV-GPA组在外毛细胞谱系的分化轨迹上有更多的细胞,而AAV-GPAS组在内毛细胞发育轨迹的末端有更多的细胞(图2E)。研究者使用SCs类器官在体外通过qPCR验证,结果显示,在AAV-GPAS过表达的类器官中,Supervillin、Zeb1、Chd7和Ankrd6的表达显著高于AAV-Atoh1和AAV-GPA器官样体(图2G),这与测序数据一致。
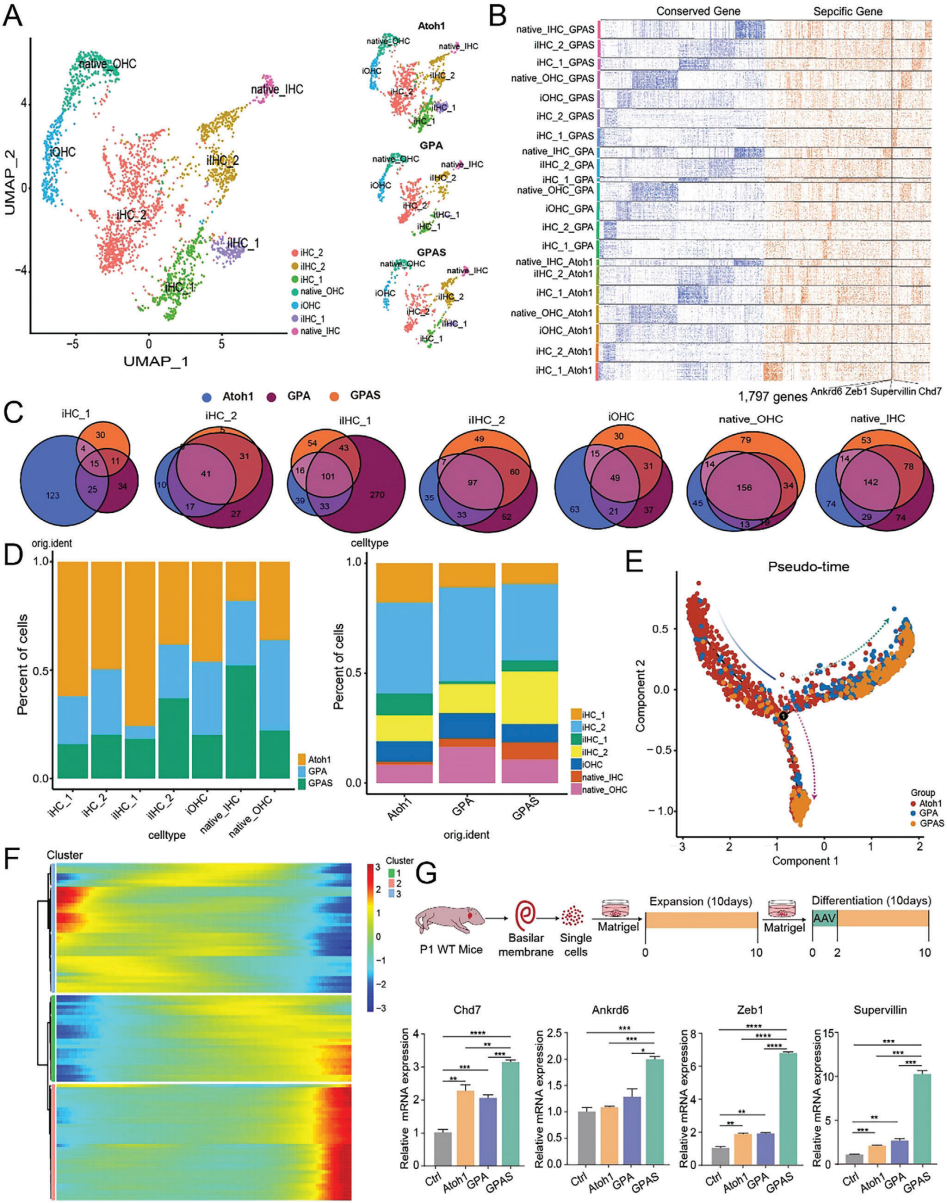 图2. AAV的单细胞转录组分析及细胞轨迹分析
图2. AAV的单细胞转录组分析及细胞轨迹分析
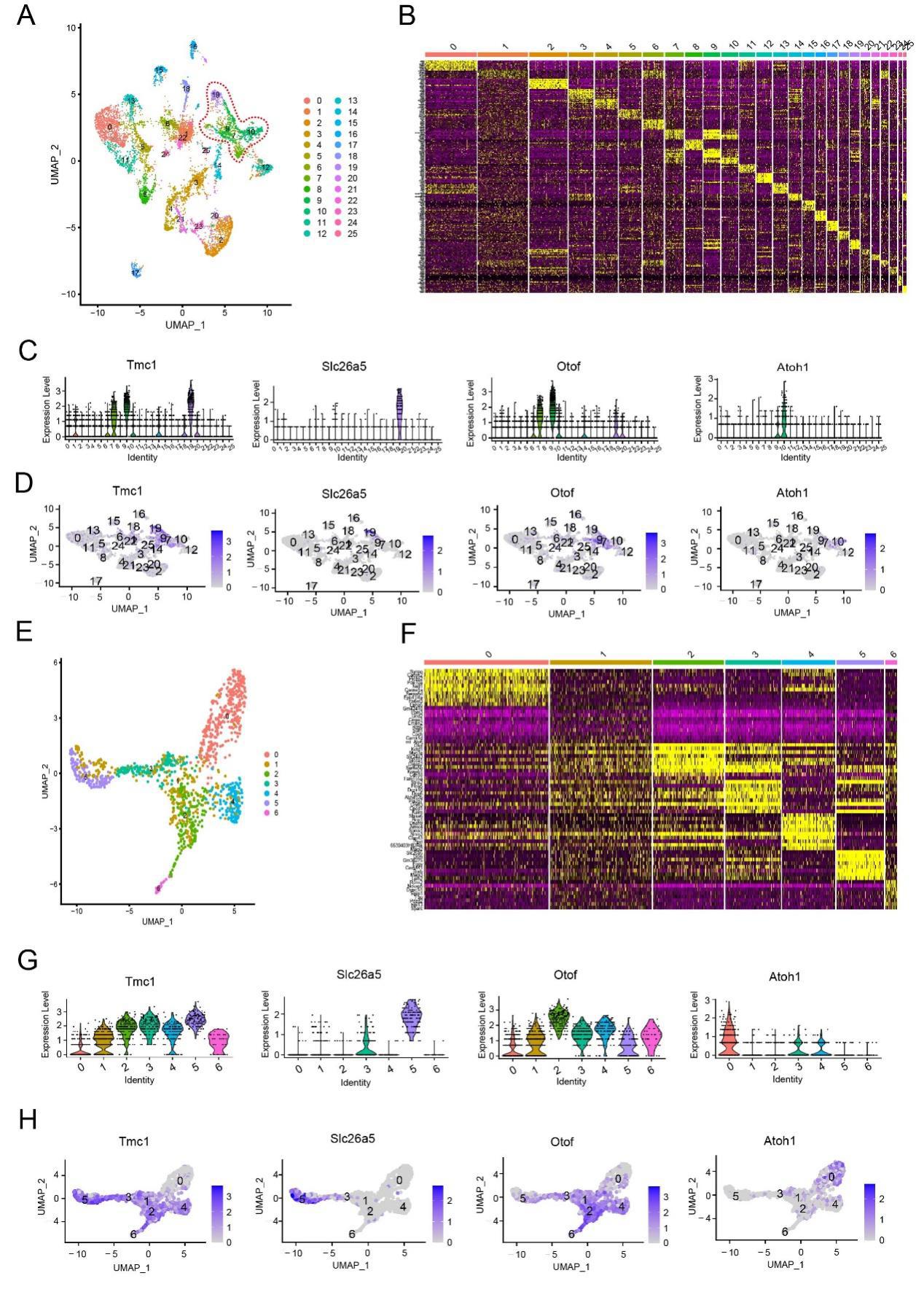
图S5. Atoh1 过表达的耳蜗上皮细胞单细胞转录组图谱

图S6.带有Gfi1、Pou4f3和Atoh1共同表达的耳蜗上皮细胞单细胞转录组图谱
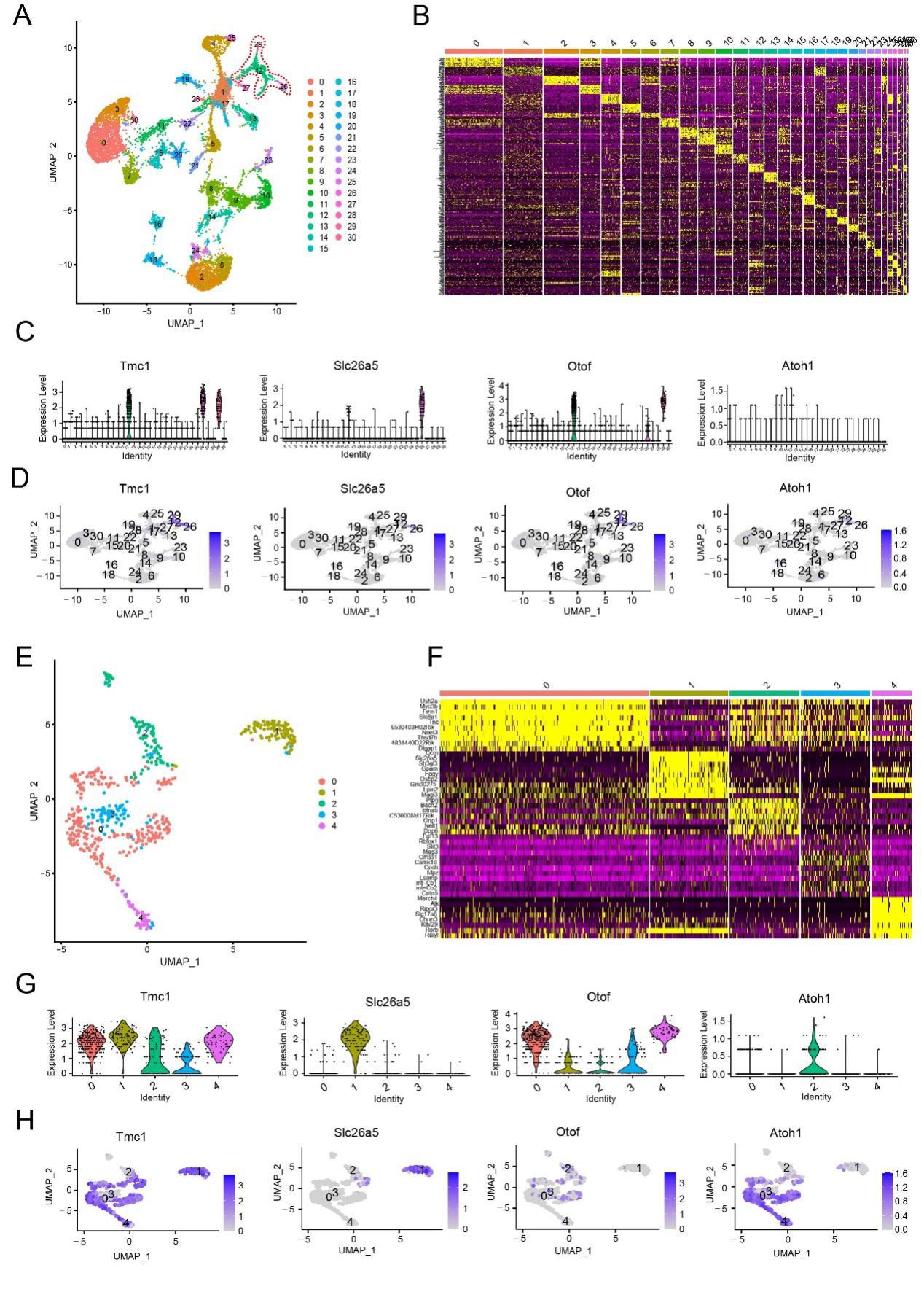
图S7.带有Gfi1、Pou4f3、Atoh1和Six1共同表达的耳蜗上皮细胞单细胞转录组图谱
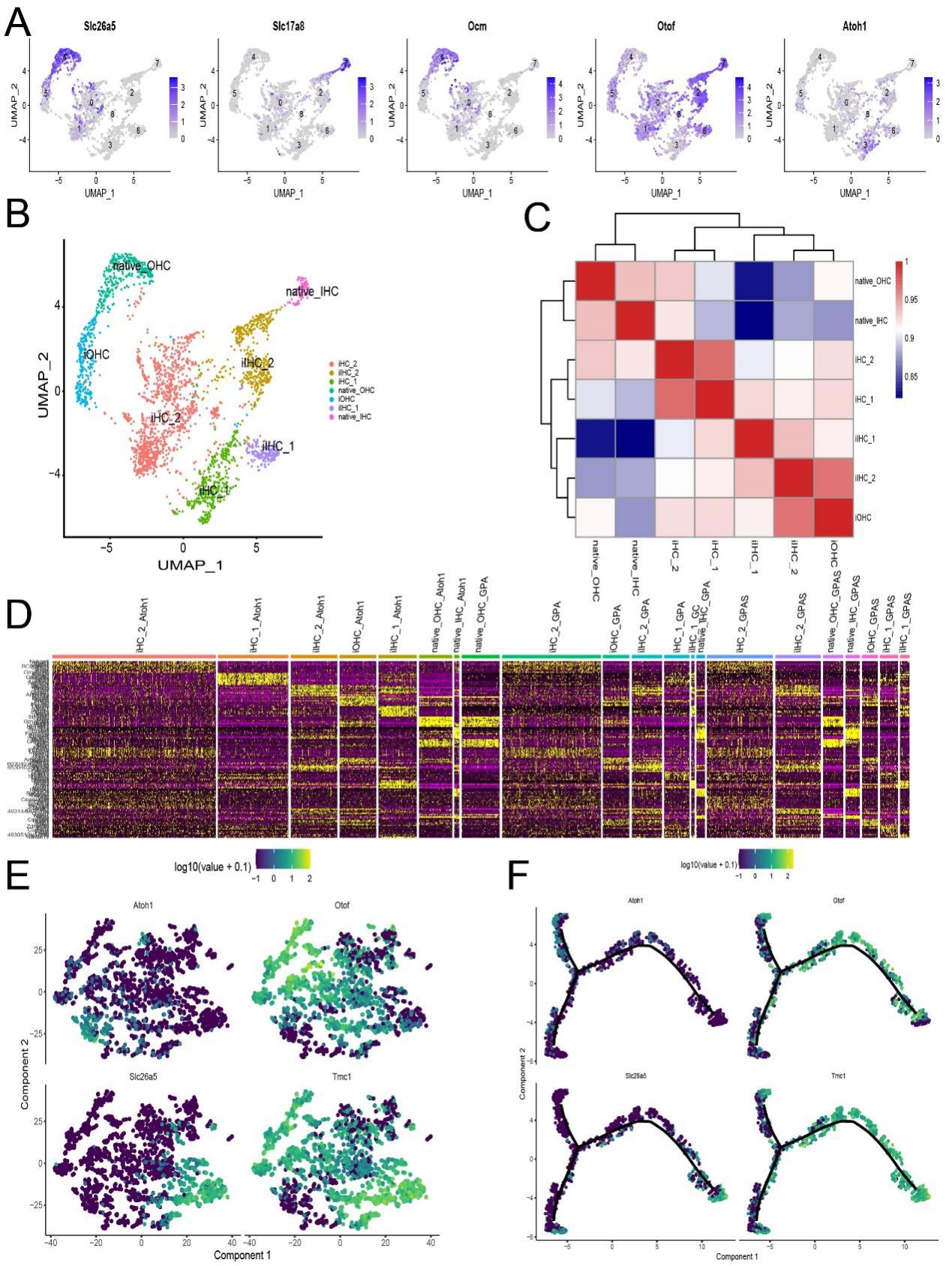
图S8.在感染的HCs中1,3或4个转录因子的AAV共表达的单细胞转录组图谱

图S8.GO注释分析AAV-Atoh1、AAV-GPA和AAV-GPAS感染组间的基因和转录因子差异
2.3. AAV-GPA 和 AAV-GPAS 在体内增强了SCs向OHC-like cells/ IHC-like cells的转分化
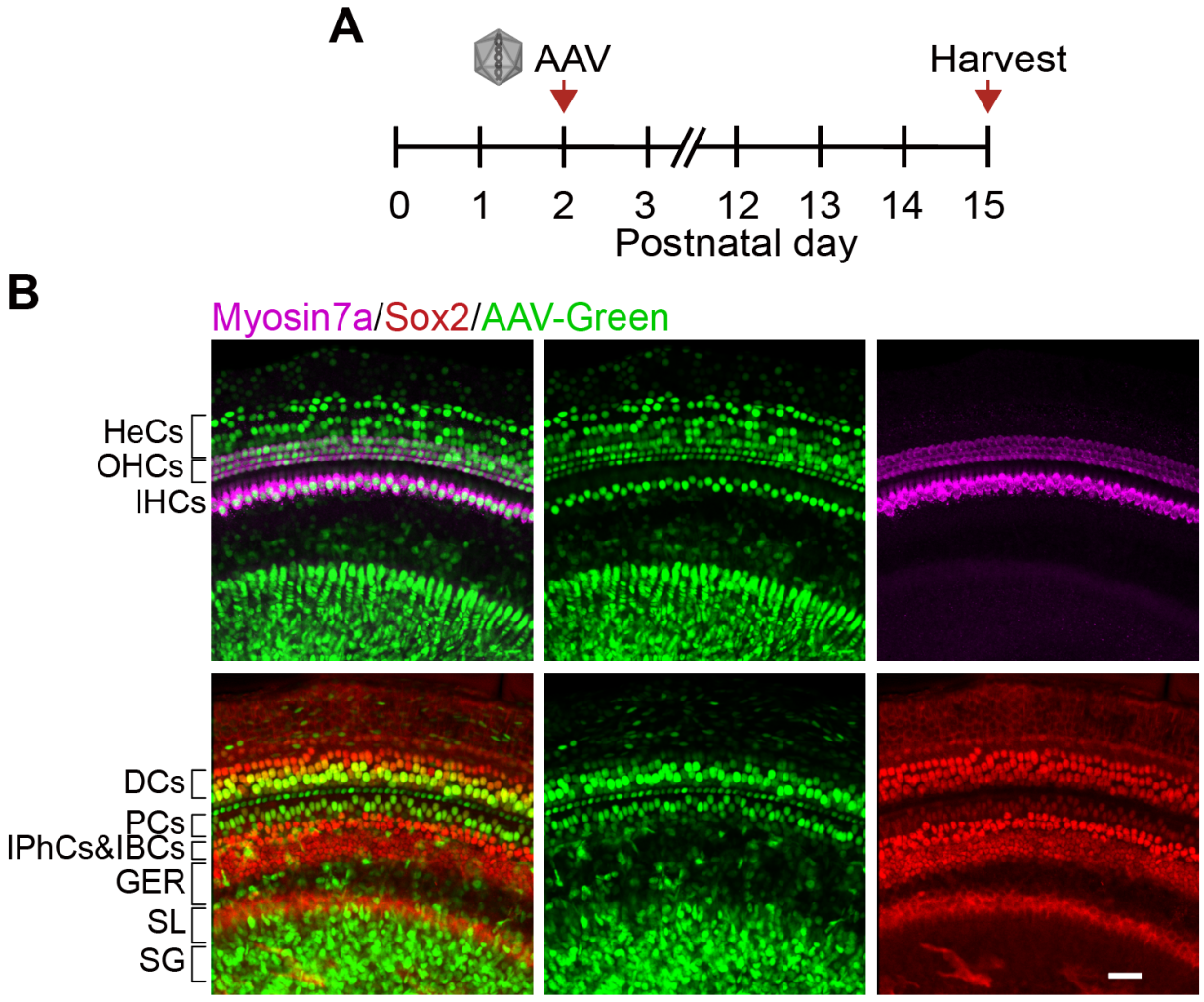
既往报告显示,Lgr5+ DCs、IPCs和IPhCs/IBCs是再生毛细胞的主要来源。因此,研究者使用Lgr5CreER/tdTomatoloxp/+小鼠来追踪再生的毛细胞。在P1时通过腹腔注射他莫昔芬(tamoxifen)激活Cre酶,然后在P2时通过圆窗膜(RWM)向耳蜗注射相应的AAV。两周后收集耳蜗上皮进行免疫荧光染色(图3A)。在AAV-GPAS注射的耳蜗中检测到Myosin7a+/Tomato+类毛细胞,包括外毛细胞区域、内毛细胞区域和GER区域(图3B)。j既往报告显示,Pou4f3和Gfi1促进了小鼠中Atoh1介导的毛细胞生成能力,研究者使用AAV-GPA和AAV-GPAS验证了这一结果(图3C)。此外,研究发现与AAV-Atoh1相比,AAV-GPA和AAV-GPAS转导的耳蜗中Myosin7a+/Tomato+类毛细胞的数量更多(图3D)在外毛细胞侧壁表达的运动蛋白Slc26a5被认为是成熟外毛细胞的功能分子标志物。研究者追踪了Lgr5CreER/tdTomatoloxp/+小鼠耳蜗中注射AAV-Atoh1、AAV-GPA和AAV-GPAS后的新类毛细胞,所有源自DCs的外毛细胞定义为Tomato+/Slc26a5+双阳性细胞。在耳蜗前体中由Atoh1异位表达产生的新毛细胞不表达Slc26a5,这一现象在AAV-Atoh1转导的耳蜗中得到了验证(图3F)。为了进一步提高源自DCs的新生外毛细胞的成熟度,研究者引入了类似于AAV-Atoh1的Gfi1、Pou4f3和Six1。与单独过表达Atoh1相比,过表达AAV-GP或AAV-GPS能检测到更多由DC转分化产生的新生外毛细胞(Tomato+/Slc26a5+)(图3E,F)。此外,qPCR结果显示,决定外毛细胞发育的Ikzf2和Insm1的转录组表达水平在GPA组中更高(图3G)。与其他组相比,GPA转导的耳蜗上皮显示出更多的Tomato+/Slc26a5+外毛细胞样细胞,并且在转录水平上Slc26a5的表达更高(图3E-G)。这些结果表明,AAV-GP和GPS能够促进新外毛细胞样细胞的形成和功能成熟,这与AAV-GP和GPS过表达小鼠以及单核转录组数据中的结果一致。在AAV-GPAS注射的耳蜗中也检测到了Myosin7a+/Tomato+类毛细胞,包括内毛细胞区域(图3B),同样在内毛细胞区域检测到了毛细胞的再生(图4A)。与AAV-Atoh1相比,在AAV-GPA和AAV-GPAS转导的耳蜗中内毛细胞区域有更多的Myosin7a+/Tomato+毛细胞(图4B,C),并且AAV-GPAS在小鼠耳蜗的顶端转角处诱导了最多的Lgr5+支持细胞转分化为类内毛细胞(图4C)。此外,在GER区域也观察到了许多异位毛细胞,其中部分被tdTomato标记(图4D)。GER区域的支持细胞是Lgr5阴性的。因此研究者得出结论,GER区域新形成的Myosin7a+/Tomato+毛细胞是由IHC区域的Lgr5+内缘细胞/IPhCs的分化和迁移而来(图4D)。研究者统计了GER区域中Myosin7a+/Tomato+毛细胞的数量,在AAV-GPAS转导的耳蜗中大多数毛细胞被谱系追踪(图4E)。Otoferlin(Otof)和Vglut3通常被认为是出生后小鼠内毛细胞的标志物,通过Atoh1和GPA过表达诱导的再生毛细胞表达Otoferlin。在AAV-Atoh1、AAV-GPA和AAV-GPAS诱导的新生毛细胞中检测到了Myosin7a+/Otoferlin+毛细胞,并且qPCR结果显示AAV-GPAS注射的耳蜗表达了更多的Otoferlin和Vglut3(图4G)。同样在AAV-GPA和AAV-GPAS组中检测到决定内毛细胞发育的关键因素Tbx2的表达水平更高(图4G)。综上,在小鼠体内AAV-GPA/GPAS增强了支持细胞向类外毛细胞/类内毛细胞的转分化。
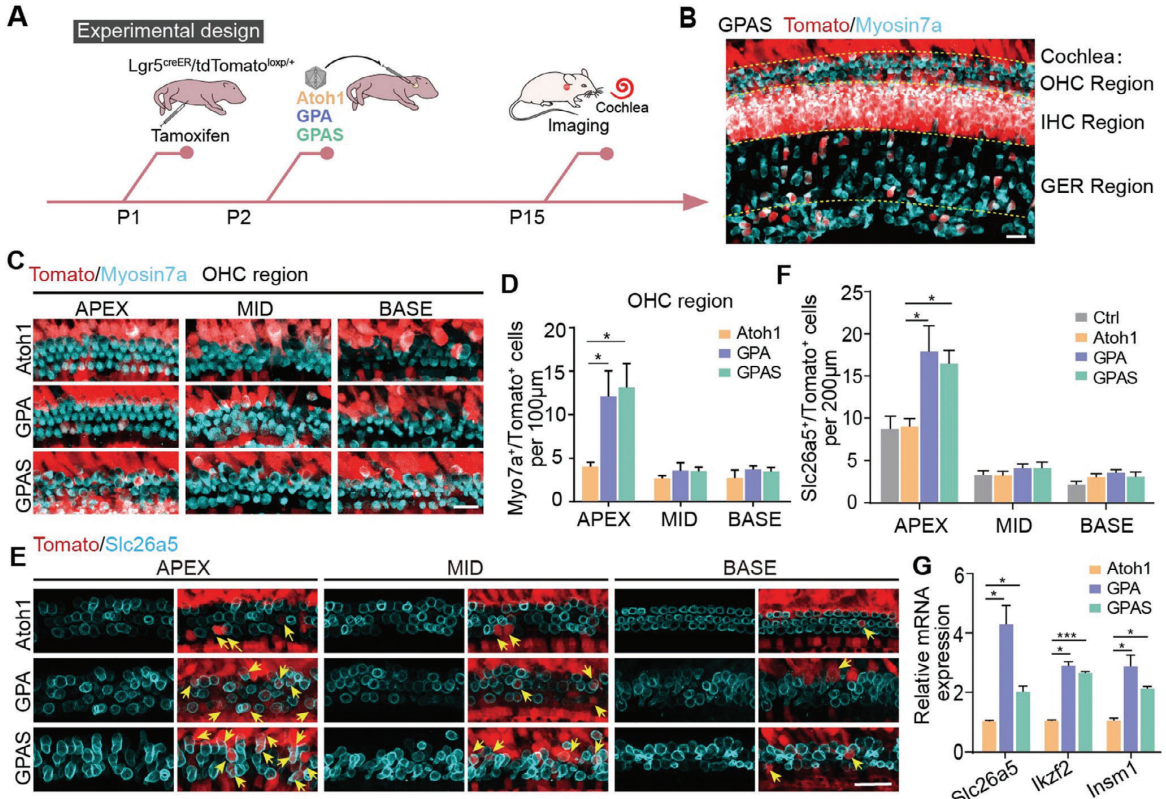
图3. AAV- GP/GPS过表达增强了类外毛细胞(OHC-like cell)的再生。
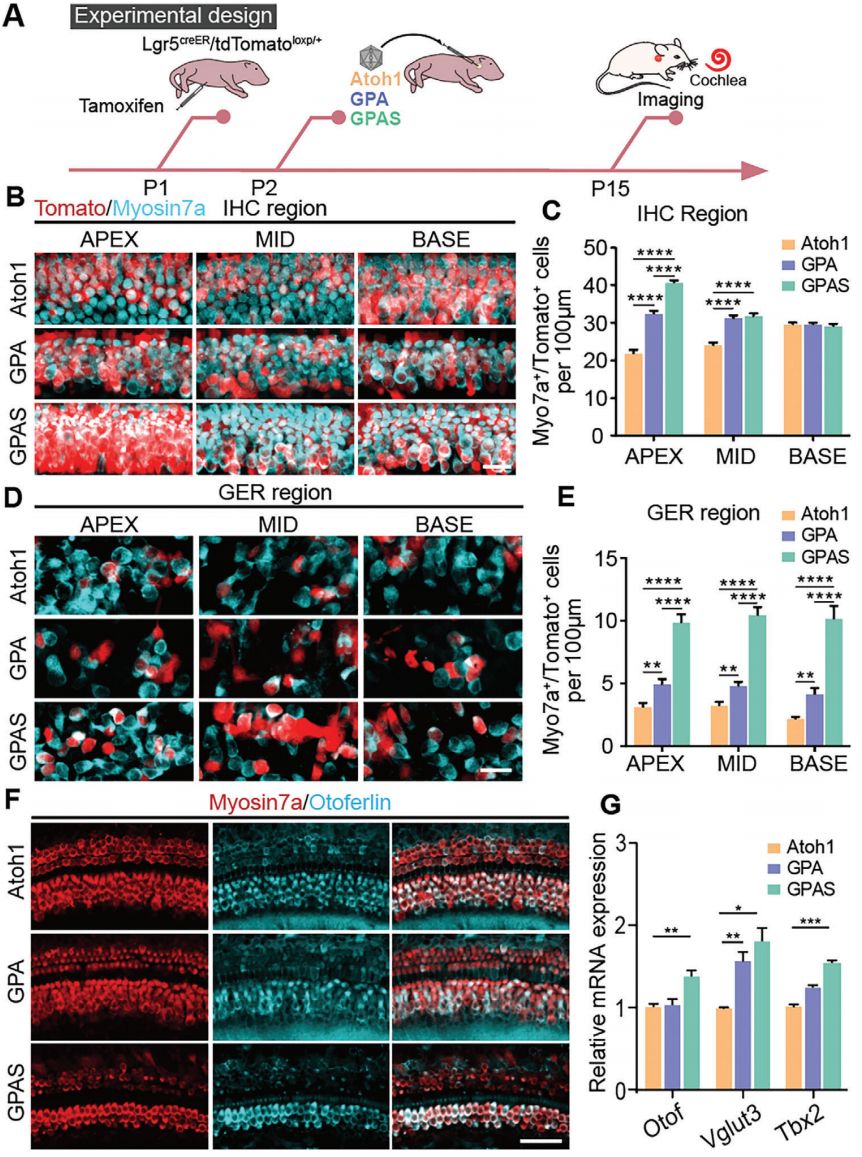
图 4. AAV- GPS 过表达显著提高了 Atoh1 诱导的 HC 样细胞在 IHC 区域的再生效率
2.4. AAV-GPS 促进了由 Atoh1 过表达衍生的新生类毛细胞的成熟
为测试由 AAV-GPAS/GPA/Atoh1 诱导的新生类毛细胞的成熟度和功能性,研究者对 AAV 转导的耳蜗进行了 FM1-43 染色,以显示新生类毛细胞的 MET 通道功能。病毒被注射到 P2(出生后第二天)的野生型小鼠耳蜗中。在 P15(出生后第15天)解剖后,新鲜的耳蜗被 FM1-43 染料短暂渗透45秒(图5A)。所有 AAV-GPAS/GPA/Atoh1 转导耳蜗中检测到了新毛细胞对 FM1-43 染料的摄取。在 AAV-GPAS 感染的耳蜗中观察到的再生类毛细胞中 FM1-43 信号最强,其次是 AAV-GPA 组(图5B,C),表明 AAV-GP 加强了 AAV-Atoh1 诱导的新类毛细胞中 MET 通道的表达和通透性。
此外,研究者过扫描电子显微镜(SEM)检测了再生类毛细胞的形态,图像显示再生类毛细胞的纤毛排列成类似正常纤毛的“V”形(支持信息中的图 S11)。
研究者通过全细胞膜片钳技术对原生毛细胞和类毛细胞进行了电生理记录,以评估 GP/GPS 过表达的类毛细胞是否更类似于原生毛细胞。与单独 Atoh1 或AAV- GPA 诱导的类毛细胞中观察到的多重钙尖峰相比,由 GPAS 诱导的类毛细胞表现得更像成年 P15 内毛细胞,其特征是需要大电流的诱发钙尖峰和以单次尖峰形式饱和的放电(图5D-F)。此外,我们在无间隙模式下对这些诱导的类毛细胞和原生毛细胞进行了记录,以在电流钳制下记录它们的自发放电,发现 AAV-GPAS 诱导的内毛细胞表现出微弱和小的自发波动,这与原生毛细胞非常相似。然而,Atoh1 诱导的内毛细胞样细胞自发产生了与新生内毛细胞特征一致的爆发性放电模式(图5G)。综上,GPA 和 GPAS 在耳蜗前体中的联合调节可以促进新生类毛细胞的进一步成熟,并表明 AAV 介导的多基因协同调节在再生功能性毛细胞以用于临床治疗听力损失方面具有应用前景。
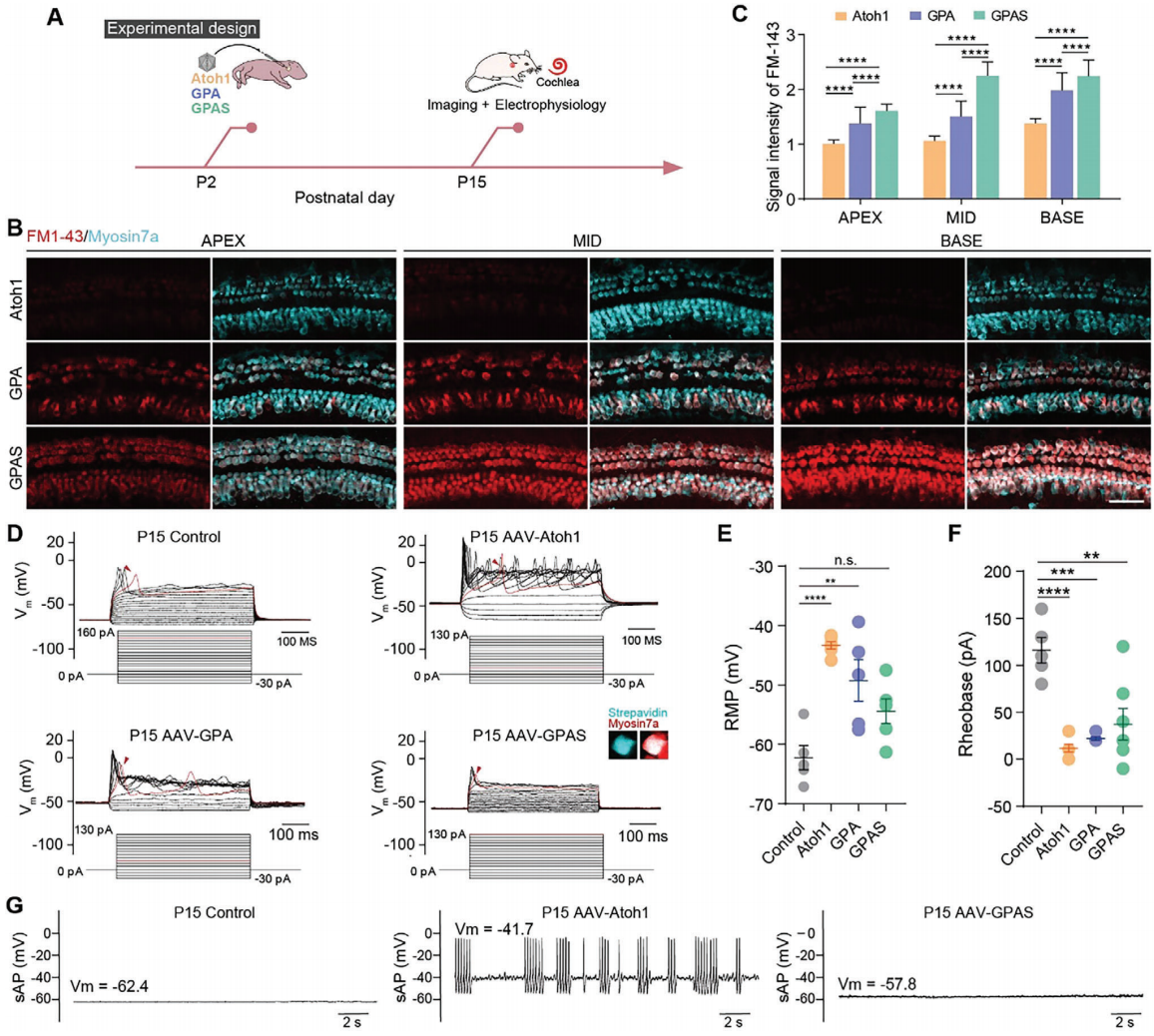
图5. AAV-GPS 过表达促进了 Atoh1 介导的体内 HC 样细胞再生的成熟
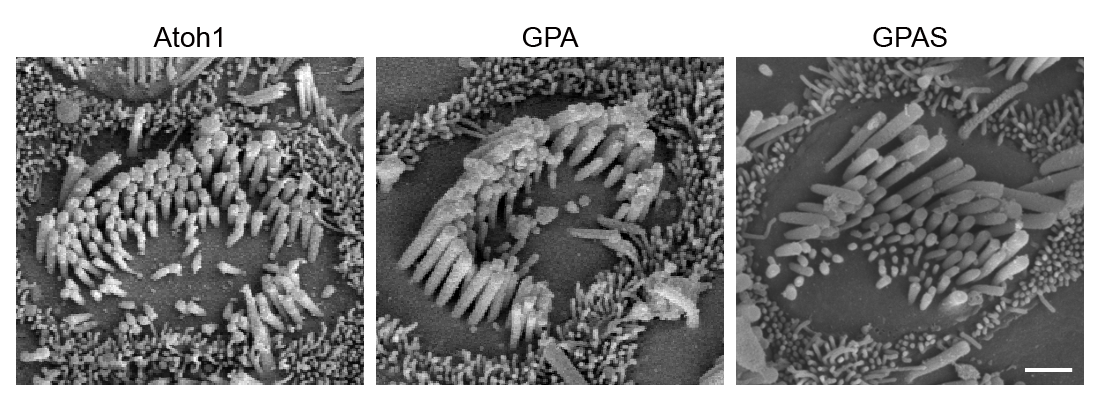
图S11. 扫描电子显微镜图像(SEM)显示了再生类毛细胞的形态
2.5. AAV-GPAS在 P7 小鼠中促进了类毛细胞再生
既往文献表明,GPA 过表达可诱导毛细胞再生,而单独Atoh1 过表达不能在 P8 时注射他莫昔芬并在 P15 获取的 Sox9-CreER/Rosa26GPA 小鼠中再生毛细胞。本研究使用转基因小鼠模型来探索 Atoh1 或 GPA 在毛细胞再生中的作用。研究者使用 AAV 递送系统来研究 GPAS 对老年小鼠毛细胞再生的影响。在 P7 的小鼠耳蜗中使用 AAV 递送了 Atoh1、GPA 和 GPAS,并在 P16 时获取耳蜗(图6A)。qPCR 实验测量了 AAV 注射后4个外源基因在转录组水平的表达,显示均显著增加(图6B),这表明 AAV-ie 介导的基因成功转移进入 P7 小鼠的耳蜗。免疫荧光染色(IF)结果表明,在 P16 时AAV-Atoh1/GPA/GPAS 可以诱导耳蜗中的类毛细胞再生(图6C,D),新再生的类毛细胞大多数位于内毛细胞区域。因此,研究者接着检测了 Otoferlin 的表达,并发现部分再生类毛细胞表达了 Otoferlin(图6E)。定量分析显示,在 AAV-GPAS 诱导的异位毛细胞中,异位 IHC+/Otoferlin+ 双阳性毛细胞的百分比最高(图6F)。此外,研究者通过 Phalloidin 染色检查了再生类毛细胞的纤毛,与原生毛细胞相比,AAV-Atoh1/GPA/GPAS 诱导的新类毛细胞的纤毛显示出较弱的 Phalloidin 信号(图6G)。为了证实既往文章的发现,研究者使用了 Sox9creER/tdTomato 小鼠进行谱系追踪,以验证 AAV 注射后 P7 再生类毛细胞的来源。结果表明,在 AAV-Atoh1/GPA/GPAS 转导的耳蜗中,再生类毛细胞主要来源于 Sox9+ 支持细胞图 S12A,B)。
研究者继而进行了研究以阐明这些再生类毛细胞在 DTR 损伤模型中的功能性。既往研究表明,由毛细胞特异性启动子 Myo15 驱动的 EGFP 在毛细胞中有特异性表达,结果揭示 AAV-Myo15-mNeonGreen 以 100% 感染率有效感染了新生小鼠的HC,而SC则不受影响(图6H)。DTR 损伤模型造模过程是, WT 小鼠在 P1 时注射了 AAV-Myo15-DTR-mNeonGreen,并在 P4 时给予白喉毒素,导致P30 时几乎完全丧失听力和毛细胞(图6I,J)。然后,研究者在 P7 时给予 AAV-GPAS,听觉脑干反应(ABR)数据表明,AAV-GPAS 没有恢复因 DTR 诱导损伤导致的 P30 小鼠中受损的听力功能(图6I)。然而,免疫荧光结果表明,AAV-GPAS 在 DTR 损伤后诱导了类毛细胞的再生(图6K)。综上,AAV-Atoh1/GPA/GPAS 可以在 P7 小鼠的耳蜗中诱导类毛细胞的再生,并且 AAV-GPAS 在 DTR 诱导损伤后促进了新生类毛细胞的形成。
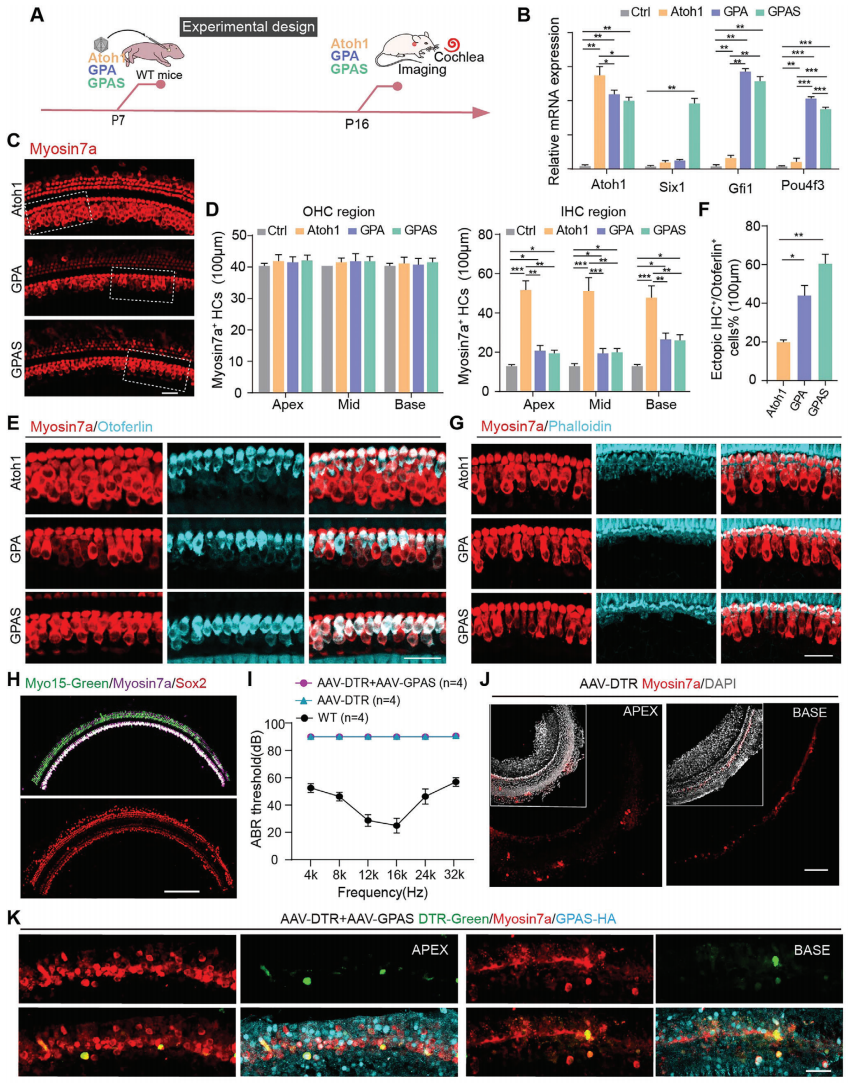
图6. AAV-Atoh1/GPA/GPAS 有效地在 P7 小鼠体内实现类毛细胞再生。
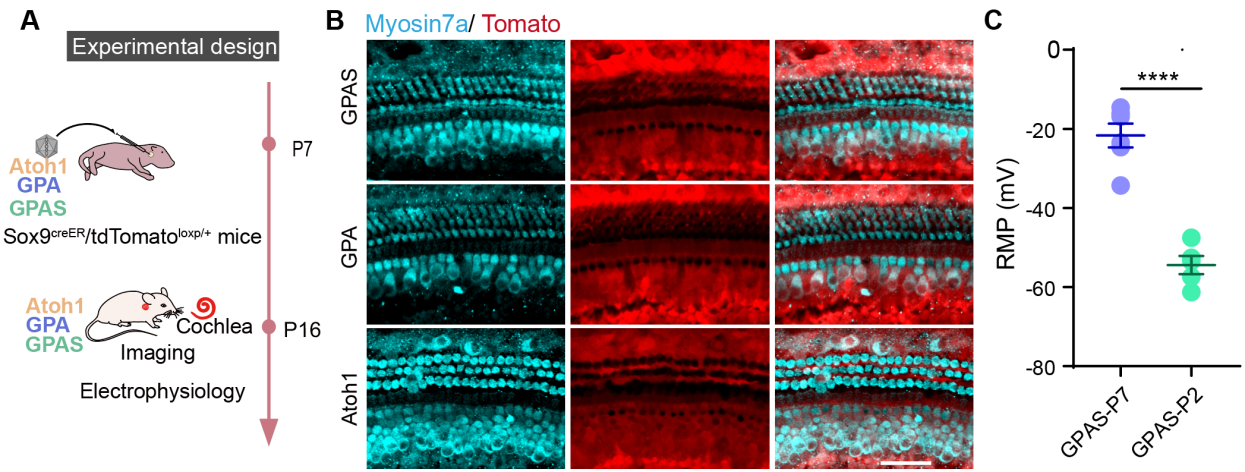
图S12.注射AAV-GPAS后P7小鼠再生毛细胞来源及成熟度

汇报人:王欣怡
导师:赵宇、任建君
审核:李向东、任建君



