精读分享│【Nature Genetics】:透明细胞肾细胞癌的多组学分析可识别与疾病进展相关的代谢重编程
英文题目:Multi-omic profiling of clear cell renal cell carcinoma identifies metabolic reprogramming associated with disease progression
中文题目:透明细胞肾细胞癌的多组学分析可识别与疾病进展相关的代谢重编程
期刊:Nature Genetics(IF: 31.7)
单位:1.华中科技大学同济医学院同济医院泌尿外科,中国武汉
2.华中科技大学同济医学院协和医院泌尿外科,中国武汉
4.上海欧易生物医学科技有限公司,中国上海
5.郑州大学第一附属医院泌尿外科,中国郑州
6.印第安纳大学医学院病理学和检验医学系,美国印第安纳州印第安纳波利斯等
发表时间:2024年03月




技术路线图
摘要:
透明细胞肾细胞癌(ccRCC)是一种复杂的疾病,具有显著的免疫和代谢异质性。在这里,我们对同济医院 RCC(TJ-RCC)队列的100 名ccRCC 患者进行了基因组、转录组学、蛋白质组学、空间转录组学和代谢组学分析。我们的分析确定了四种 ccRCC 亚型,包括去透明细胞分化亚型(DCCD-ccRCC),这是一种具有独特代谢特征的亚型。DCCD癌细胞的特点是脂滴少、代谢活性降低、营养吸收能力强、增殖率高,预后不良。通过单细胞和空间轨迹分析,我们证明了DCCD是ccRCC进展的常见模式。即使在I期患者中,DCCD也与较差的预后和较高的复发率相关,这表明其仅通过肾切除术无法治愈。我们的研究还提出了一种基于亚型特异性免疫细胞浸润的治疗策略,可以指导ccRCC的临床管理。
研究背景:
肾细胞癌(RCC)是全球十大最普遍的恶性肿瘤之一,主要表现为ccRCC。代谢失调是ccRCC的一个关键特征。迄今为止,大多数临床代谢组学研究仅关注代谢组学分析,而基因组、表观基因组或其他改变与代谢紊乱之间的关系在很大程度上尚未得到探索。最近的单细胞和空间测序技术提供了更直观的ccRCC内肿瘤微环境(TME)图谱。然而,由于样本量有限,将这些单细胞数据集与现有的基因组或表观基因组分子亚型相关联一直具有挑战性。因此,包含多组学数据的综合数据集可以进一步充实先前的发现。
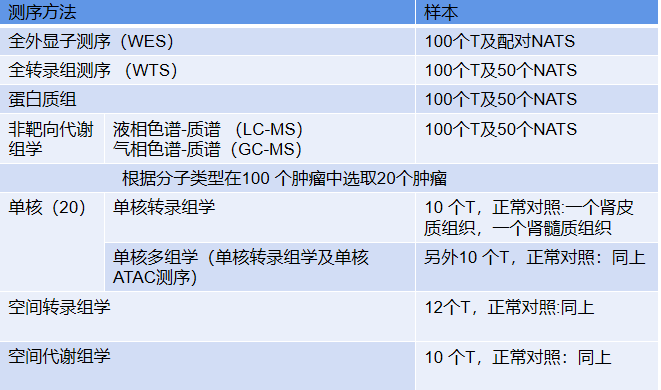
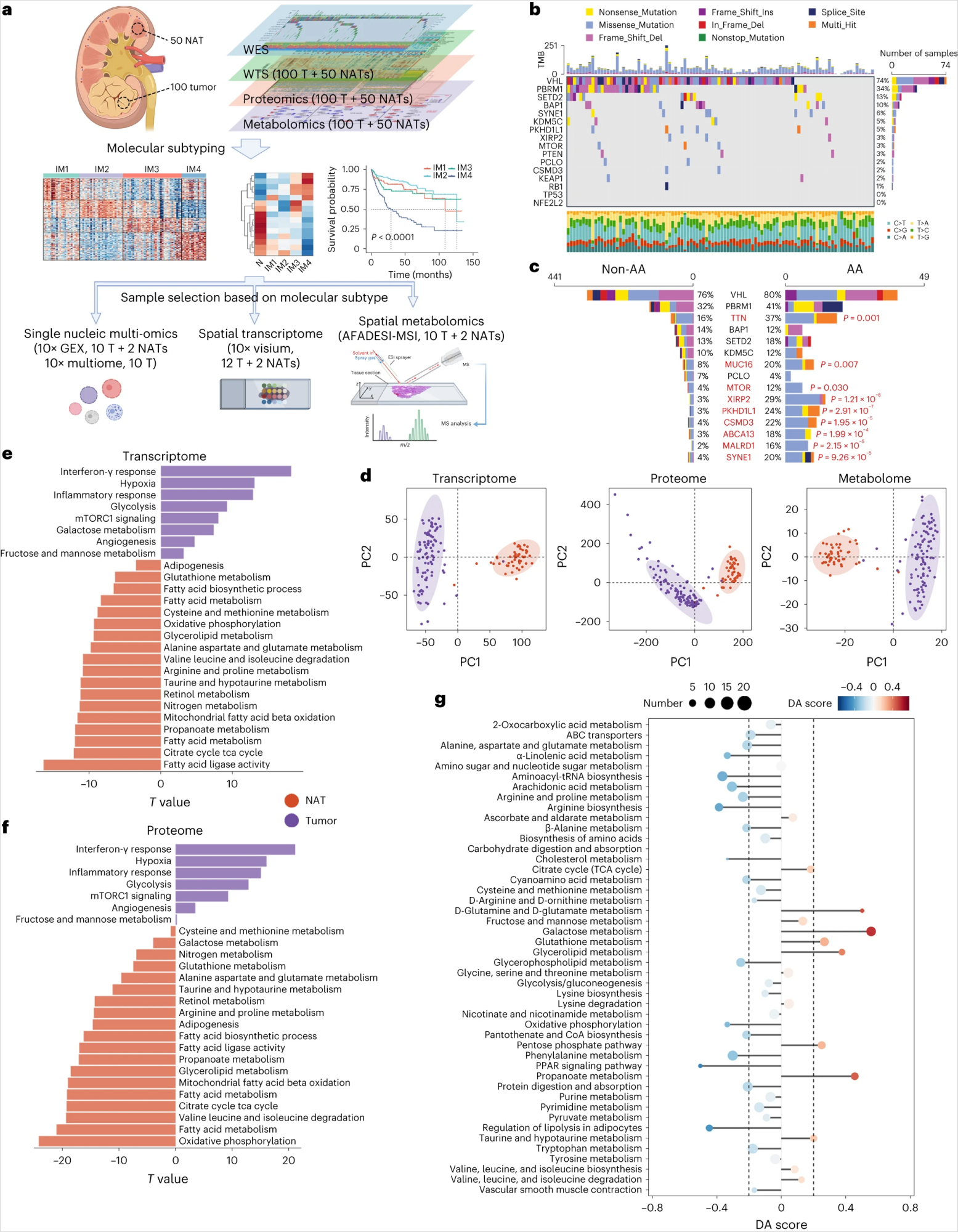
研究人群及测序(Fig 1a):
1.研究人群:纳入了武汉同济医院2020年7月至2021年4月100名初治ccRCC患者,年龄在27-84岁之间,其中男性63名,女性37名,与ccRCC的性别分布一致。
2.测序及样本如下:其中T:肿瘤组织,NATs:正常组织
主要方法及结果:
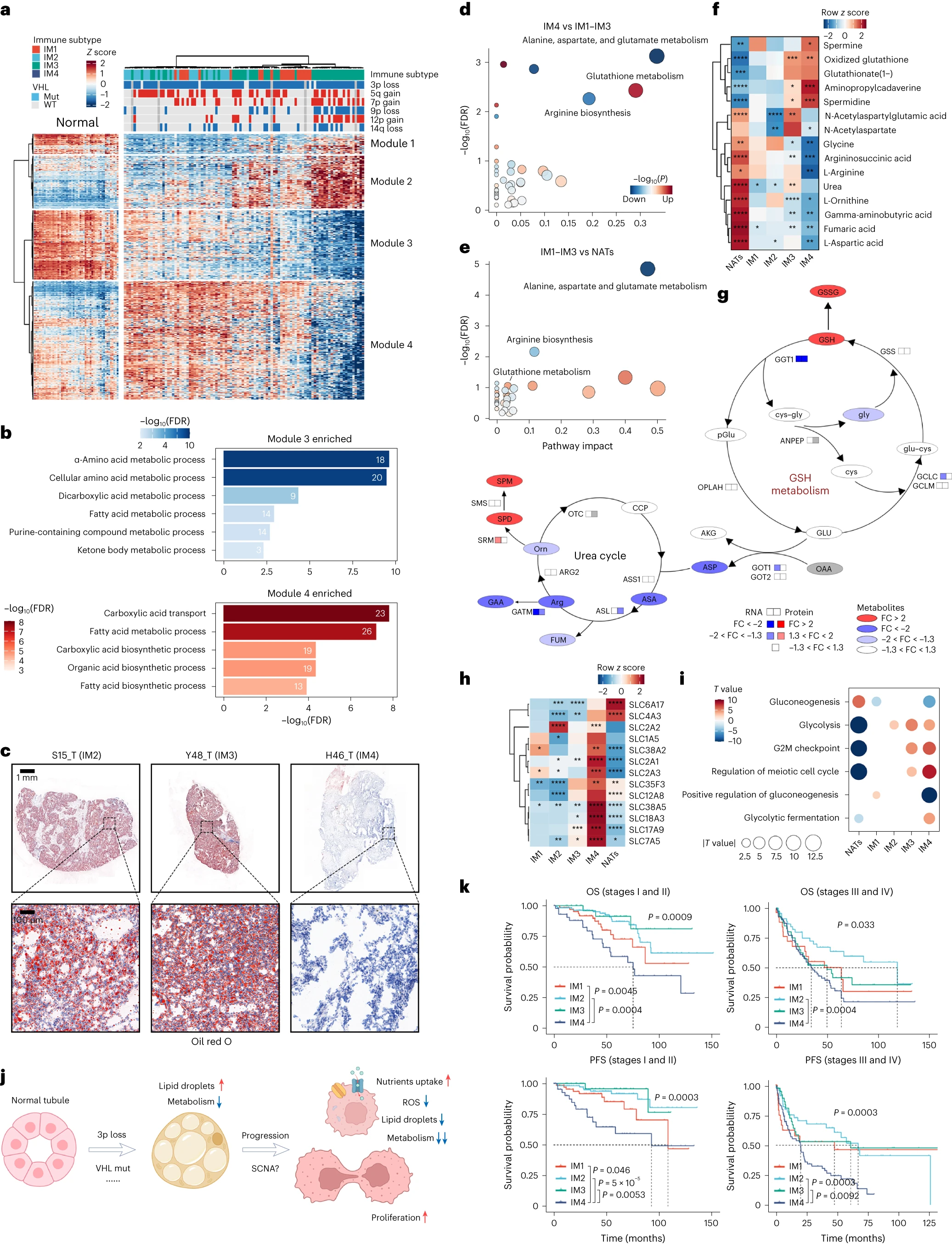
1、基因组景观

既往研究:VHL、PBRM1、BAP1、SETD2和KDM5C 是ccRCC 中最常见的突变基因。此外,在罗马尼亚和中国队列中发现了与马兜铃酸(AA)暴露相关的突变特征,其特征是 T>A 转位。
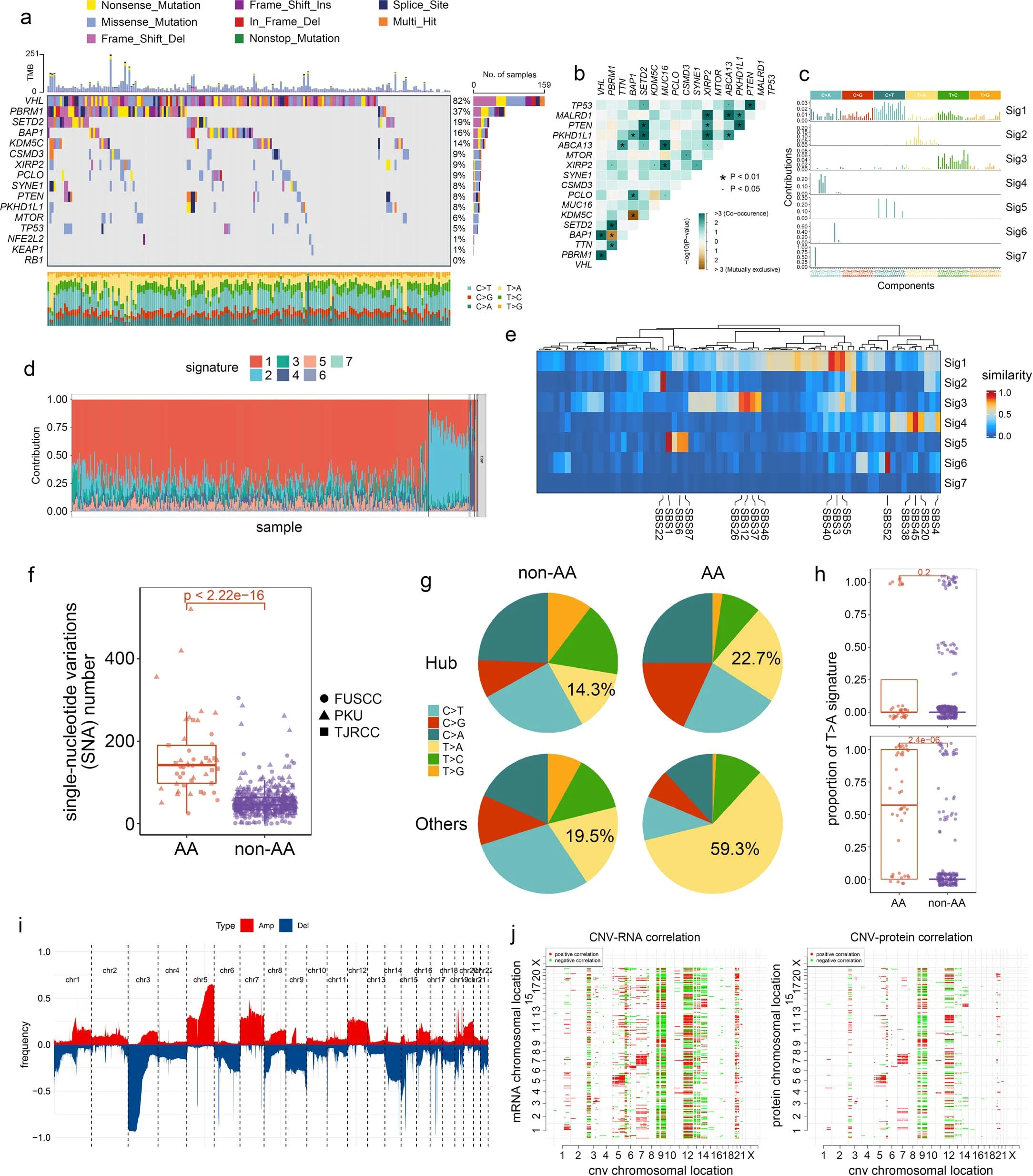
①突变基因:本研究中最常见的突变基因与之前的研究一致(Fig 1b和Extended Fig 1a)。进一步分析确定了以下两个相互排斥的体细胞突变对:PBRM1-BAP1 和 BAP1-KDM5C(Extended fig 1b)。
②突变特征:对荟萃队列(FUSCC、PKU)的非负矩阵分解 (NMF)分析确定了7个体细胞突变特征。所有这些特征都可以在TJ-RCC队列中发现的。总体而言,49个肿瘤被证实具有AA相关突变特征(SBS22;Extended Fig 1c-e),这些肿瘤具有更多的体细胞突变(Extended Fig 1f),与既往研究一致。
③突变基因与突变特征关系:频繁突变的基因在AA相关组中并未显示出显著更高的突变率(Fig 1c)。一致地,AA相关突变特征主要与ccRCC中除VHL、PBRM1、SETD2、BAP1和KDM5C之外的基因突变相关(Extended 1g、h)。由于主要的ccRCC 驱动突变显然与AA 依赖性诱变无关,本研究数据表明 AA在ccRCC中的作用需要重新评估。
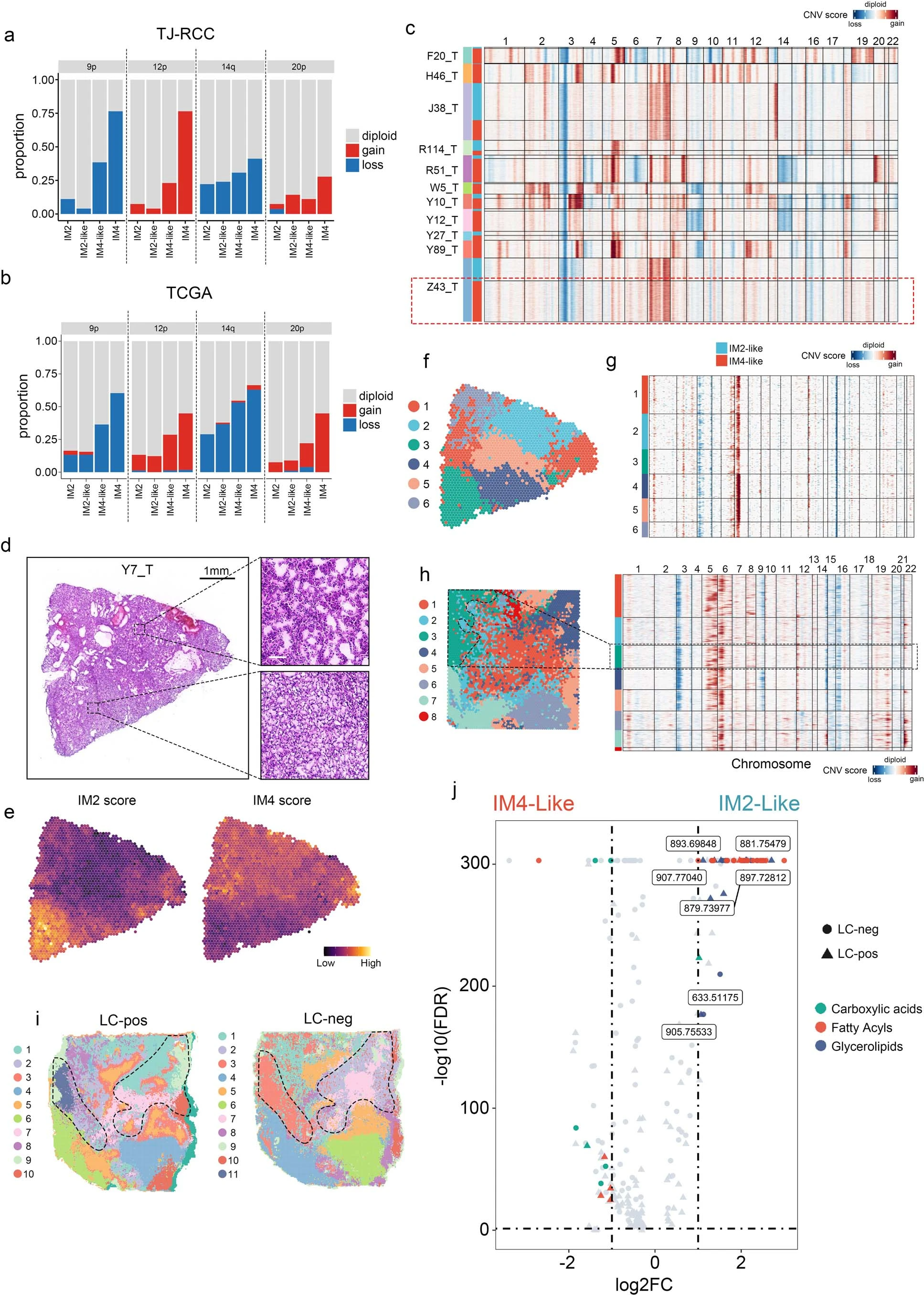
④SCNA的鉴定:染色体3p丢失是最常见的事件,其次是染色体 5q增加、14q丢失、7增加和 9丢失,与其他ccRCC 队列一致(Extended Fig 1i)。

2、转录组学、代谢组学和蛋白质组学分析

①转录组学和蛋白质组学数据都与体细胞拷贝数改变(SCNA)状态密切相关(Extended Fig 1j)。
②主成分分析(PCA):显示肿瘤和NATs之间在转录组、代谢组、蛋白组上均存在显著的区别(Fig 1d)。
③通路分析:转录组及蛋白组中ccRCC组织中血管生成、糖酵解和免疫相关途径被激活,同时抑制了多种代谢途径(Fig 1e、f)。代谢组学分析结果与我们的转录组学和蛋白质组学分析结果相关(Fig 1g),但甘油脂代谢和谷胱甘肽(GSH)代谢途径除外。
④为了探究ccRCC中的代谢失调,我们生成了一个代谢物和代谢酶的综合图谱(Supplementary fig 1a)。我们发现,肿瘤组织中参与脂肪酸生物合成的酶的表达没有改变,这表明ccRCC的标志脂滴(LDs)的积累可能是由β氧化活性降低引起的。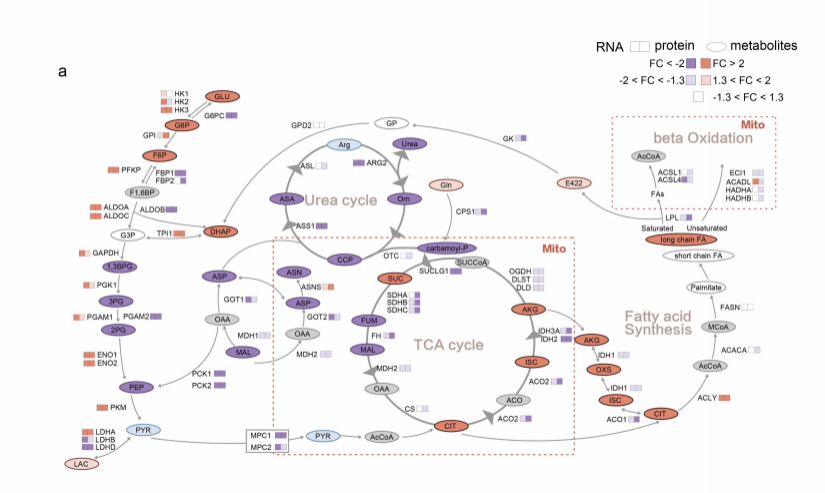

3、ccRCC可分为四种免疫亚型

既往研究:既往定义了一种免疫亚型分类器用于预测ccRCC患者的预后,这项研究和其他研究使用xCell或CIBERSORTx提供的特征矩阵来反卷积肿瘤组织的细胞组成,并且没有考虑组织特异性的表达模式,特别是来自巨噬细胞和肿瘤细胞的特征。
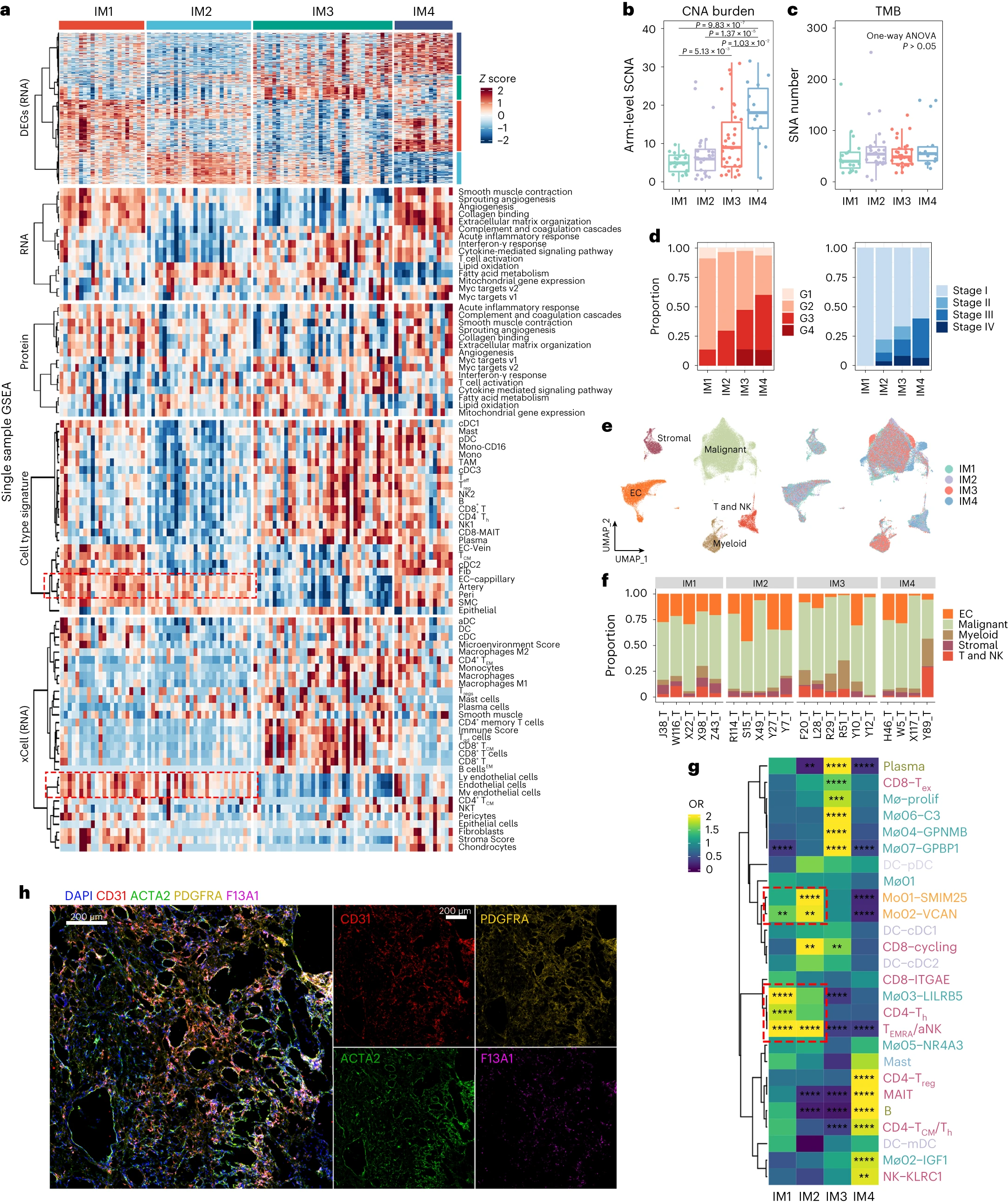
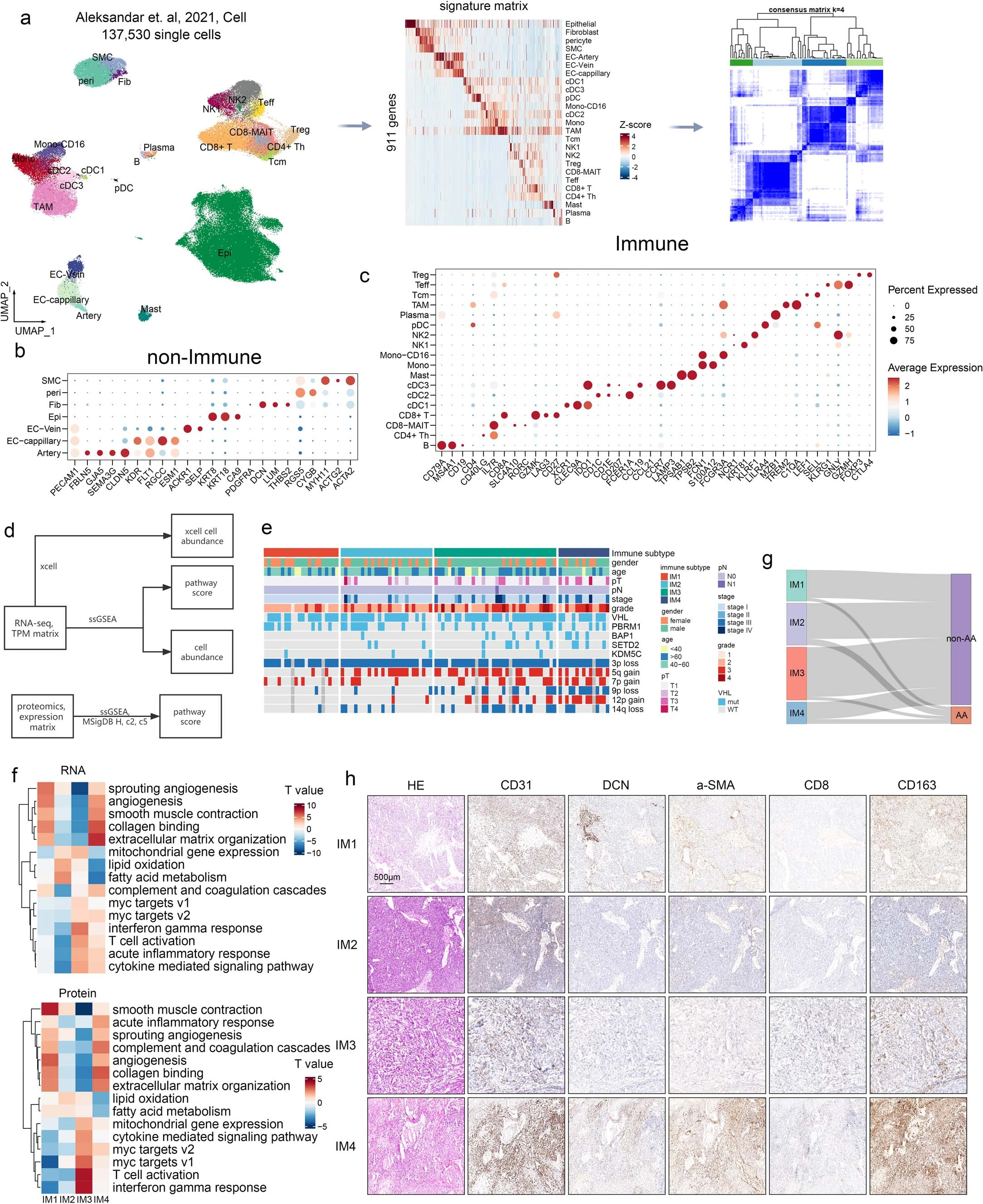
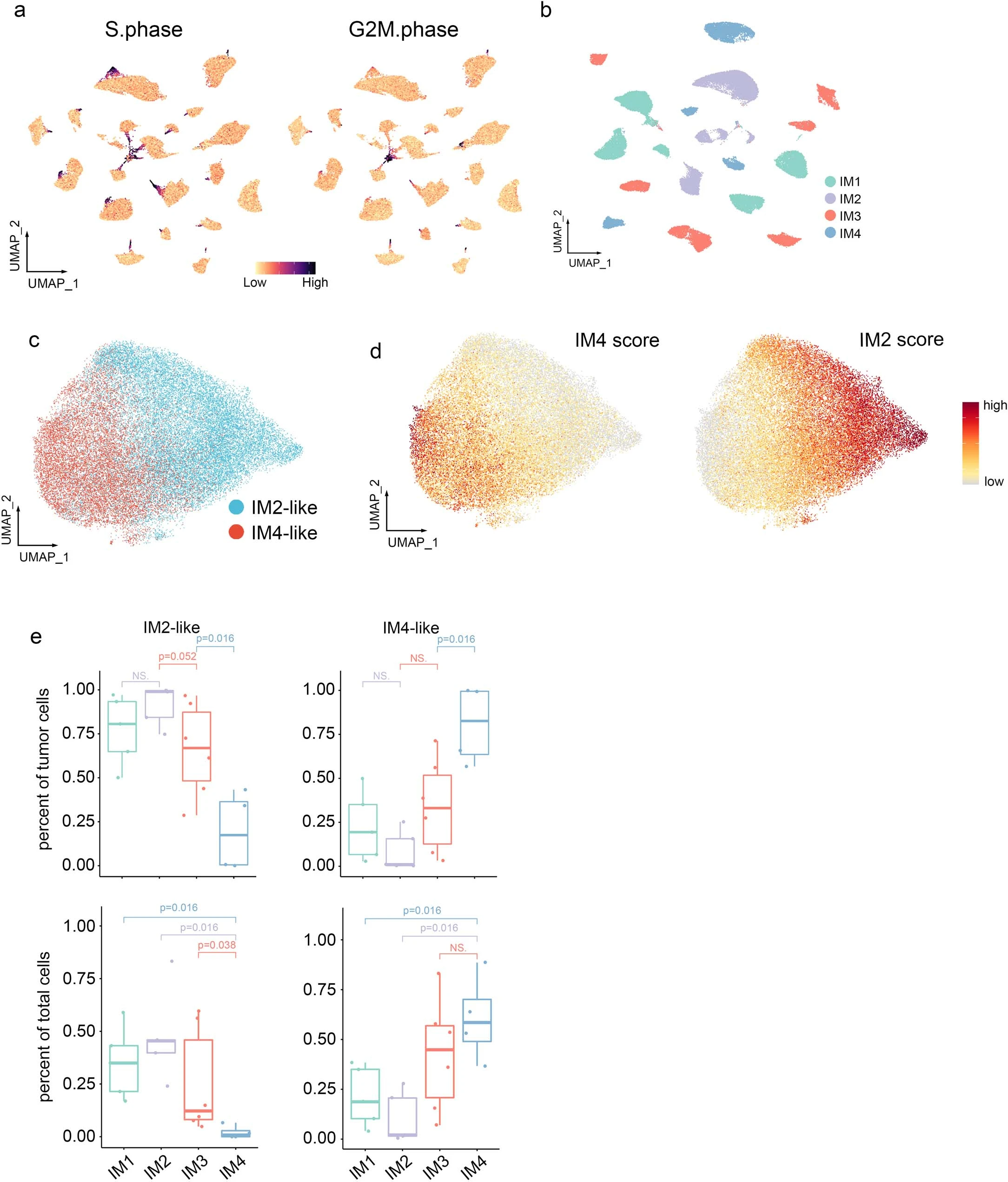
①为了克服这个问题,我们从公共scRNA-seq数据集中生成了一个ccRCC特异性特征矩阵,鉴定出25种不同的细胞类型,又进一步将肿瘤样本分为四种免疫亚型(IM1–IM4; Extended fig 2a–c)。我们还进行了xCell分析,发现这两个反卷积算法通常产生相似的结果(Fig 2a 、Extended fig 2d、e)。
② 四种免疫亚型肿瘤(IM1:n = 22,IM2:n = 27,IM3:n = 36,IM4:n = 15)的特点(Fig 2a):■IM1的特征是丰富的内皮细胞和基质细胞特征,但缺乏免疫细胞特征,提示免疫排斥。■IM2肿瘤也具有丰富的内皮特征,缺乏免疫和基质细胞信号。■在这四个亚组中,IM3肿瘤的内皮细胞和基质细胞特征水平最低,但显示T细胞和肿瘤相关巨噬细胞(TAMs)评分增加。■IM4肿瘤的肿瘤间质和TAM评分最高,T细胞评分中等。对差异表达基因(DEGs)的通路分析显示,急性炎症反应和补体级联反应在IM4肿瘤中具有最高的活性(Extended fig 2f)。
③探究IM亚组与AA相关的突变特征的相关性:没有观察到相关性(Extended fig 2g)。
④验证TME特征:对从四个亚组中选择的样本进行免疫组化(IHC)染色,验证了这些TME特征(Extended fig 2h)。
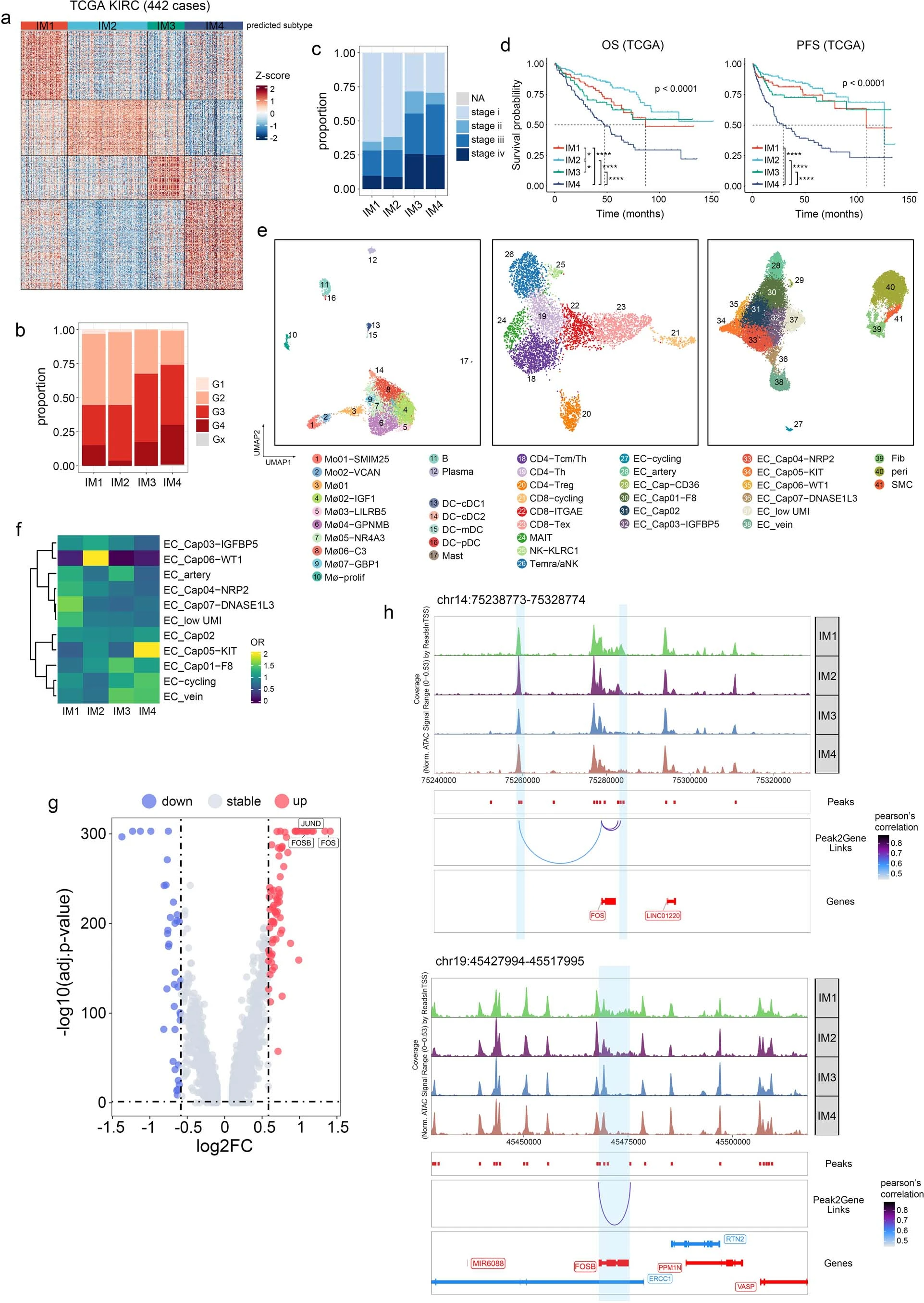
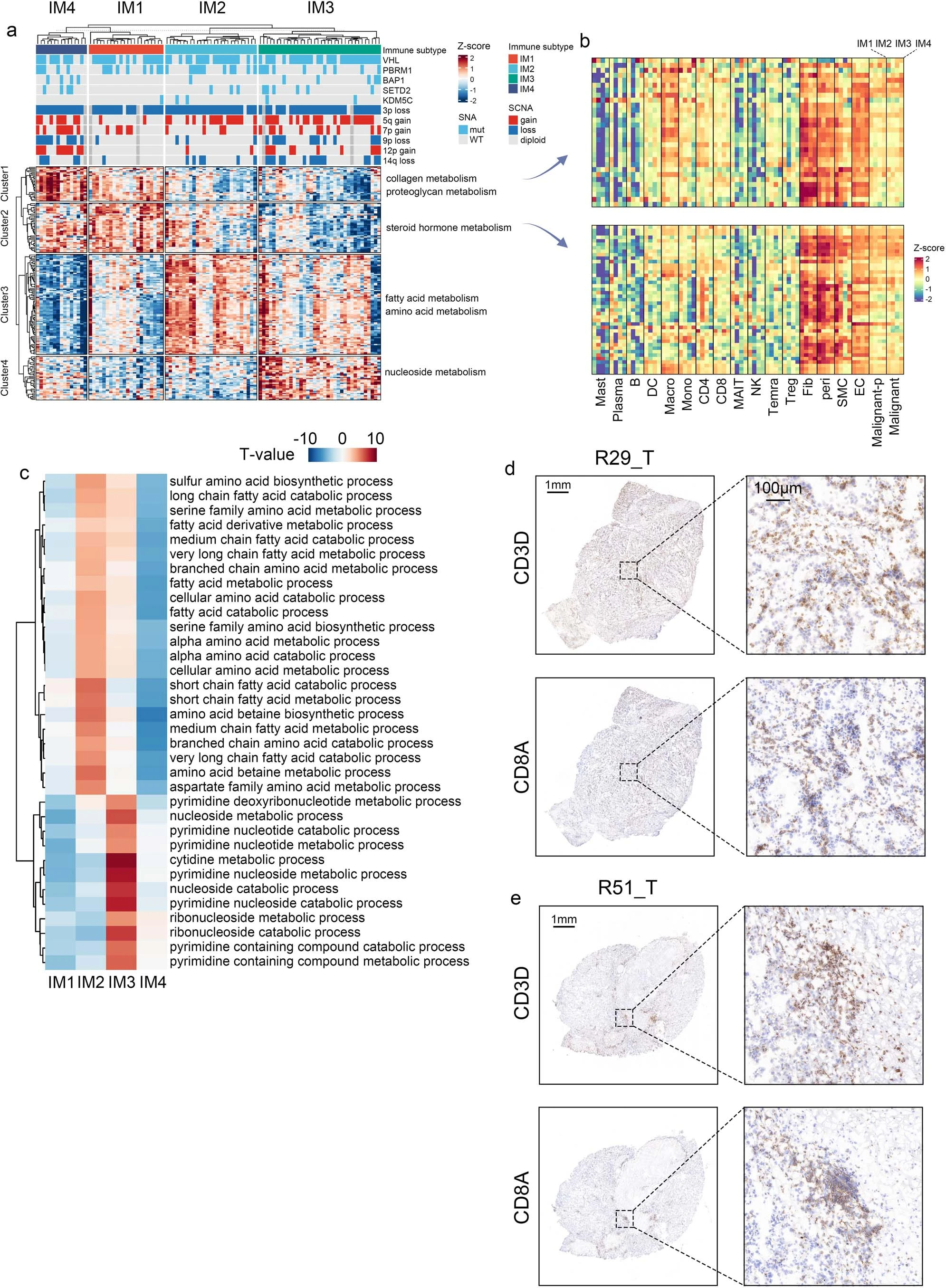
⑤探究了基因组和临床特征是否与免疫亚型相关:Fig 2b示,IM4具有最多的臂水平的SCNA,其次是IM3,而体细胞突变负荷(即单核苷酸变异)在四组中没有差异(Fig 2b、c)。具有更多SCNA的亚组与更高的肿瘤分级和更晚期的疾病相关(Fig 2d)。这些结果在TCGA KIRC(肾透明细胞癌)队列中得到了验证(Extended fig 3a-c)。
⑥IM亚型与生存的相关性:Kaplan-Meier(KM)分析显示,IM2患者具有最佳总生存期(OS)和无进展生存期(PFS),而IM4亚型与较差的预后相关。令人惊讶的是,虽然IM3分类中包含更多的晚期肿瘤,但IM3组的预后与IM1组相当。同样,尽管TCGA中的IM3组和IM4组有相当数量的晚期肿瘤,但IM3亚型与更好的预后相关(Extended fig 3d)。



4、支持IM1-IM4的免疫细胞群

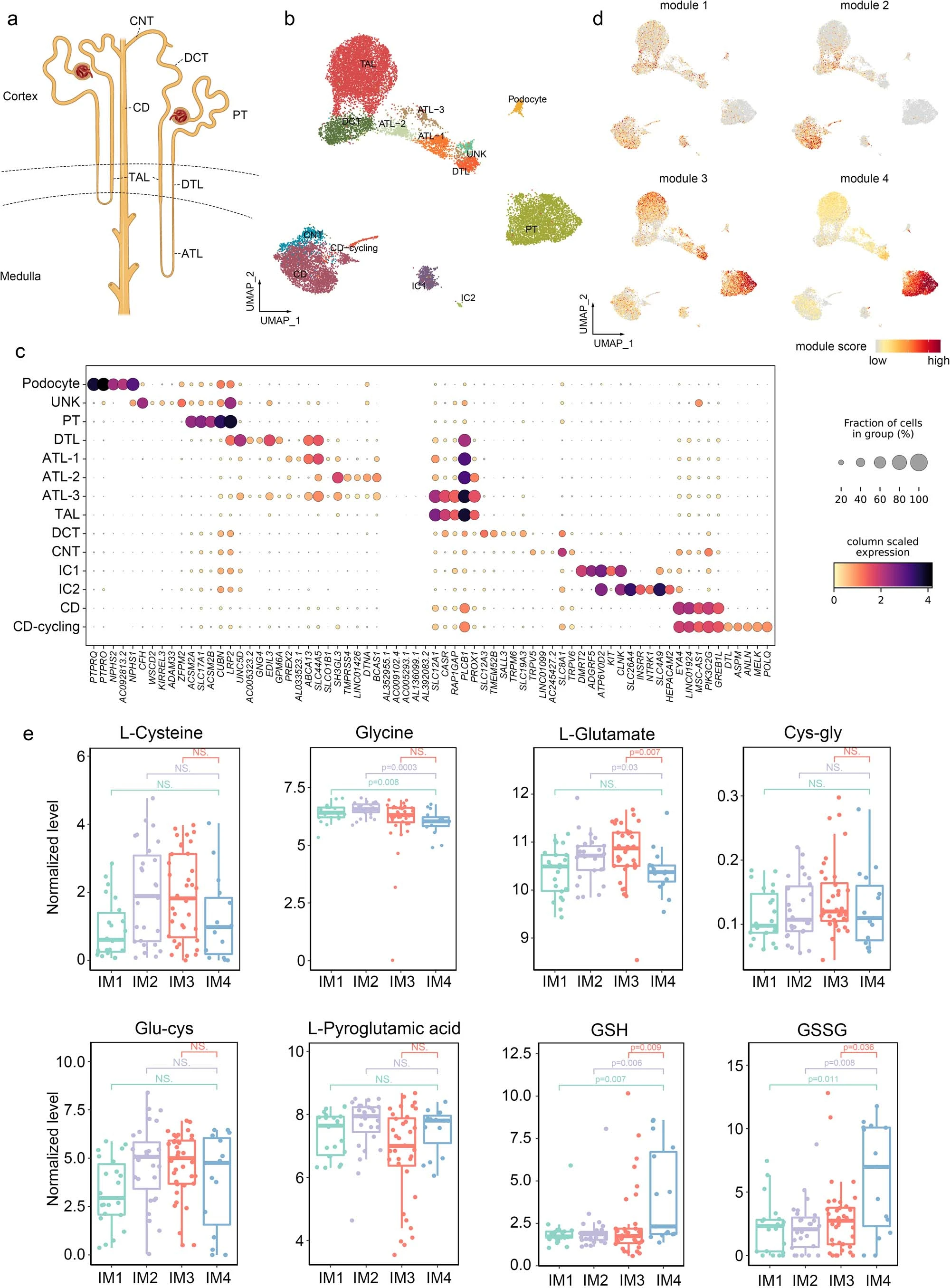
为了进一步研究各免疫亚型(IM1-IM4)肿瘤的细胞组成的异质性,我们对10个样本(4个IM1、2个IM2、2个IM3和2个IM4)进行了单细胞核转录组测序(single-nucleic RNA-seq,snRNA-seq),另外10个样本(1个IM1,3个IM2,4个IM3和2个IM4)进行了单细胞多组学测序(包括snRNA-seq和单核ATAC测序(snATAC-seq))。
①经过质量控制后,将捕获到的97,978个细胞分为5种主要细胞类型和41个细胞亚群(Fig 2e、f,extended Fig 3e和Supplementary fig2)。
②不同免疫亚型的肿瘤中细胞的分布:免疫细胞簇的分布在不同的免疫亚型中有所不同,而内皮细胞亚群则表现出较小的差异(Fig 2g and Extended fig.3f)。具体来说, IM1-IM2中:单核细胞、LILRB5+巨噬细胞(Mø03-LILRB5)、终末分化的效应记忆或效应细胞(TEMRA)和活化的NK(aNK)细胞在IM1和IM2肿瘤中占主导地位。还观察到IM1、IM2肿瘤内皮细胞中FOS、FOSB和JUND(既往研究提示这些基因可激活内皮细胞增殖)的表达水平增高(Extended fig 3g)。snATAC-seq数据证实,FOS和FOSB在IM1和IM2肿瘤的内皮细胞中具有更高的染色质可及性(Extended fig 3h)。IM3中:IM3肿瘤中CD8+ T细胞浸润增加,IM3肿瘤中终末耗竭T细胞的比例也较高,其次是IM4肿瘤,用bulk-seq数据证实(Extended fig 4a、b)。IM3和IM4肿瘤的TAMs存在显著差异。包括增殖型巨噬细胞(Mø-prolif),GPNMB+巨噬细胞(Mø04-GPNMB)、C3+巨噬细胞(Mø06-C3)和 GBP1+巨噬细胞(Mø07-GBP1)(Fig2g)。通路分析(Extended fig 4c)显示,在这些巨噬细胞亚群中,干扰素-γ反应和T细胞毒性调节增强。IM4中:IGF1+巨噬细胞在IM4肿瘤中更为丰富。通路富集分析表明,生长因子复合物通路在该亚群中富集 (Fig2g and Extended fig 4c),IGF1(既往报道可促进成纤维细胞的存活和迁移),可能导致成纤维细胞在ccRCC中的积累(Extended fig 4d–f)。巨噬细胞的丰度与成纤维细胞评分呈正相关,但与其他基质细胞(如周细胞)无关(extended fig 4d、f、g)。免疫组织化学(IHC)染色显示成纤维细胞富集区和周细胞/平滑肌细胞富集区之间存在明显的空间边界(Extended fig 4h)。免疫荧光染色(多色荧光)显示IGF1+巨噬细胞(F13A1+)主要位于成纤维细胞 (PDGFRA+)富集区域,这支持了我们的假设,即巨噬细胞促进IM4肿瘤中成纤维细胞的积累(Fig2h、Extended fig 4i)。相反,尽管ACKR1+内皮细胞和GJA5+动脉内皮细胞在Bulk-RNA测序中也与成纤维细胞呈正相关,但这些细胞在免疫荧光或免疫组化切片上呈分散状态(Extended fig 4f、i–k)。
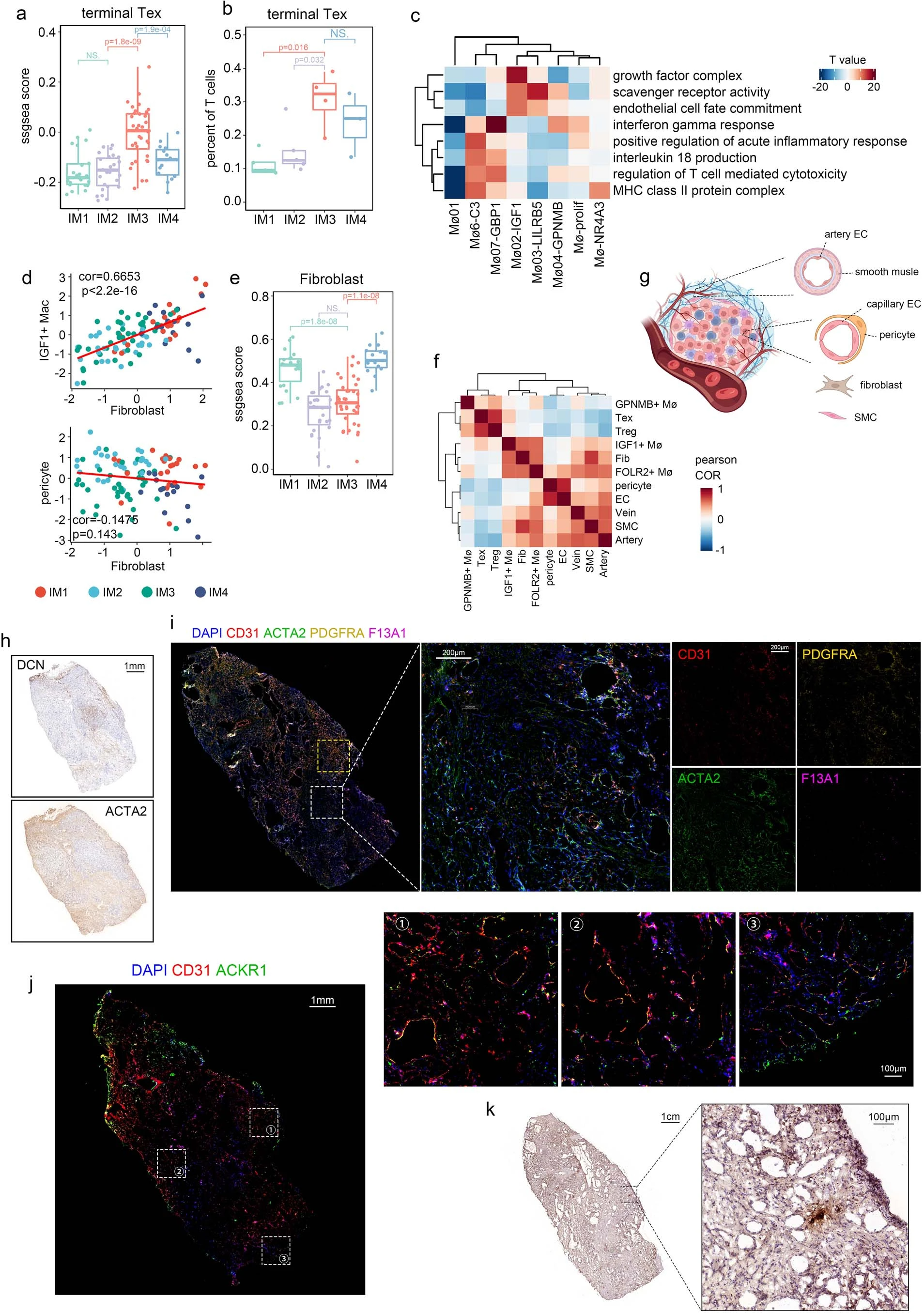

5、TME的免疫和代谢异质性

为了研究代谢在免疫亚型分层中的作用,我们使用Bulk-RNA数据评估了每个样本的代谢相关基因GO分析,然后再行无监督聚类。
①无监督聚类显示了四个不同的代谢基因表达簇(Extended fig 5a)。
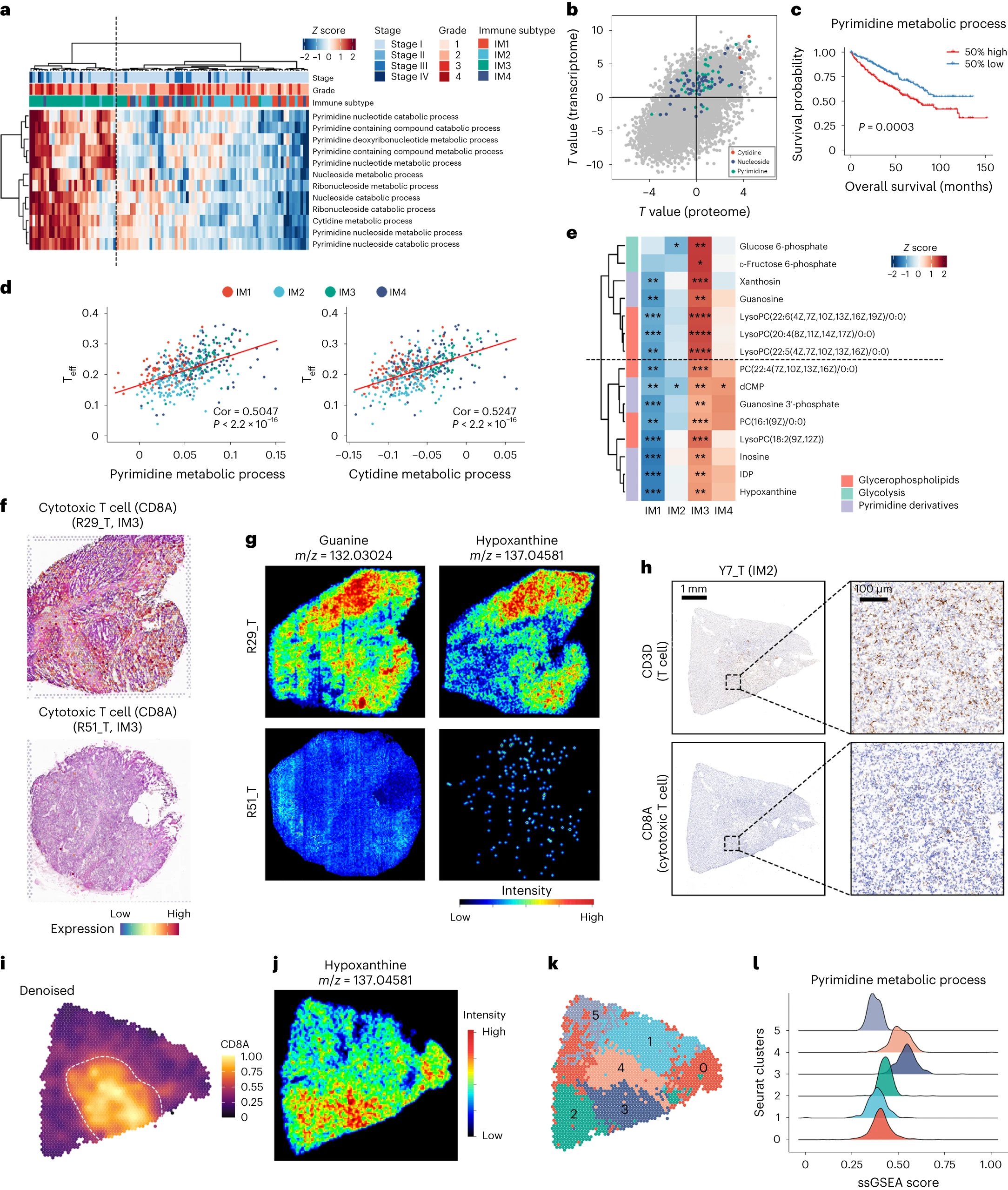
②四个簇的特点(Extended fig 5a)及不同免疫亚型(IM1-IM4)的主要簇的组成:簇1涉及胶原蛋白和蛋白多糖代谢,可能与细胞外基质重塑有关。簇2与类固醇激素代谢有关。簇1和簇2的活性主要来自间质细胞和内皮细胞。簇1和簇2均富集于IM1和IM4肿瘤中(Extended fig 5b)。簇3与脂肪酸和氨基酸代谢有关,并在IM2和IM3中富集。簇4主要与核苷代谢有关,仅凭核苷代谢就可以将IM3样本与其他亚型区分开来(Fig 3a,Extended fig 5c)。转录组和蛋白质组水平的联合分析显示,IM3样本中胞苷、嘧啶和其他核苷代谢相关通路增强(Fig3b)。随后,TCGA KIRC数据集中Teff细胞的单样本基因集富集分析 (ssGSEA) 评分与TCGA KIRC数据嘧啶和胞苷代谢活性与Teff细胞丰度之间的相关性分析表明,嘧啶/胞苷代谢活性增加与CD8+T 细胞浸润增加和预后不良相关,与本研究在TJ-RCC队列中的发现一致(Fig 3c、d)。此外,在代谢组数据中观察到IM3样品中嘧啶衍生物的增加(Fig 3e)。
③然而,尽管IM3是CD8+T细胞浸润亚群,但IM3肿瘤的预后仍优于IM4肿瘤。这些结果提示CD8+T细胞浸润可能限制ccRCC的肿瘤进展。为了证实我们的发现,我们对12个肿瘤切片(4个IM1、4个IM2、3个IM3和1个IM4)和2个NAT对照进行了空间转录组学(ST)和代谢组学分析。
在属于IM3组的CD8+ T细胞浸润样本(R29_T)中检测到高鸟嘌呤和次黄嘌呤信号(Fig 3f、g,Extended fig 5d)。相比之下, R51_T也是一个有局灶性淋巴细胞浸润的IM3样本(Extended fig 5e),在非TIL(肿瘤浸润T细胞)浸润区域仅检测到鸟嘌呤和次黄嘌呤的微弱信号(Fig 3f、g)。这些结果表明了ccRCC的瘤内异质性(ITH),以及嘧啶衍生物与TILs之间的潜在相关性。这一假设在另一个有局灶性CD8+ T细胞浸润的样本中得到了进一步的证实(Fig 3h-l)。

 6、IM4肿瘤表现出独特的代谢特征,预后较差
6、IM4肿瘤表现出独特的代谢特征,预后较差

簇3在IM4亚型中表达下调(Extended fig 5a),包括多种代谢通路,包括脂肪酸和氨基酸代谢。这些通路在ccRCC中通常被下调,表明IM4中的代谢失调增强。为了系统地研究这些差异,我们鉴定了IM4和其他肿瘤亚型之间的DEG(差异表达基因),然后再行无监督聚类。
①使用无监督聚类分析将853个DEG 聚类到四个基因模块中(Fig4a)。
②四个基因模块的具体分析(基因、通路)及其与免疫亚型(IM1-IM4)的关系:-模块1、模块2基因在IM4肿瘤中的表达高于IM1-IM3的肿瘤。NATs的模块1基因表达水平最高。对NATs的snRNA-seq数据分析显示,除近端肾小管细胞外,模块1基因在肾小管细胞中均有表达,模块2基因主要来源于集合管(Extended fig 6a-d),阐明了最近的发现:集合管特征与不良预后有关。模块3基因在正常近端肾小管中显著表达,在非IM4肿瘤中下调,在IM4肿瘤中进一步降低(Fig4a)。这些基因在脂肪酸、氨基酸和碳水化合物的代谢中富集(Fig4b),这些途径的活性降低已被描述为ccRCC的一个特征。模块4:与模块3中的基因相比,模块4中的基因在非IM4肿瘤中表达上调,而在IM4肿瘤中表达下调至低于NAT水平(Fig 4a)。ccRCC致癌基因HIF2A也包含在本模块中。这些基因(既往文献报道这些基因可导致LD在肿瘤细胞中积累 )在多种生物合成途径中富集,包括脂肪酸的生物合成途径(Fig4b)。既往研究也报道模块4中基因相关的代谢失调被描述为ccRCC的一个特征,也与肿瘤进展相关。由于这些特征在IM4肿瘤中大部分被抑制,与模块4相关的特征可能对ccRCC有双重作用。
③验证:通过对20个随机选择的TJ-RCC队列样本进行油红(ORO)染色验证,发现在非IM4样本中表现出“透明细胞”表型的脂滴(LD)积累,但在IM4样本中几乎没有观察到LD,与转录组特征一致(Fig4c)。
④代谢组分析进一步证实IM4肿瘤的代谢重编程:IM1-IM3肿瘤中与丙氨酸、天冬氨酸和谷氨酸代谢以及精氨酸生物合成相关的代谢物水平低于NATs。这些生物合成途径在IM4组中也被下调(尽管程度较小),与我们的转录组学发现相对应(Fig 4d、e)。有限的精氨酸生物合成表明IM4肿瘤中的尿素循环有限(Fig 4f、g)。值得注意的是,IM4肿瘤中的尿素循环功能障碍似乎并不依赖于酶失调(Fig4g),这表明机制未知。相反,GSH代谢在IM4中被激活。GSH和氧化GSH (GSSG)(既往研究:这些分子可以消耗肿瘤细胞中的活性氧(ROS),导致更高的增殖率和耐药性)在IM4肿瘤中都高度富集。与GSH高的三阴性乳腺癌不同,IM4肿瘤不显示GSH生物合成的底物水平升高(Fig4f、g,Extended fig 6e)。此外,参与GSH生物合成的大多数酶在IM4肿瘤中没有失调。只有GGT1(催化GSH谷氨酰部分转移的酶)下调(fig 4g)。尽管构成尿素循环一部分的鸟氨酸水平在IM4肿瘤中降低,但两种鸟氨酸衍生物精胺和亚精胺(两者都与癌细胞增殖有关)的水平仍然大幅升高(Fig4f、g)。
⑤鉴于代谢能量生成途径的下调和增殖速率的增加,表明IM4肿瘤可能有替代能源。编码葡萄糖转运体(SLC2A1和SLC2A3)、谷氨酰胺转运体(SLC1A5和SLC38A5)、支链氨基酸转运体(SLC7A5)和硫胺素转运体(SLC35F3)的基因表达上调(Fig4h),可能导致IM4肿瘤中营养物质摄取增加。一种新的烟酰胺单核苷酸转运体SLC12A8的水平(在IM4肿瘤中也有所增加(Fig 4h)。虽然IM4肿瘤可能摄取额外的葡萄糖,但在该组中,只有糖酵解过程增强,而糖异生受到抑制(Fig 4i)。
⑥IM4肿瘤特征总结:IM4肿瘤的特征包括营养吸收增加,活性氧(ROS)和脂滴(LDs)水平降低,代谢活性低和增殖率较高(Fig 4j)。由于ccRCC的特征是 LD 在癌细胞中的积累,我们将这一过程命名为 ccRCC 的去透明细胞分化 (DCCD)。此外,IM4肿瘤已经完成了这一转化过程,我们将其称为 DCCD-ccRCC。
⑦由于早期诊断为原发性肿瘤(I期和II期)的患者不接受术后药物治疗,我们探究早期DCCD肿瘤患者是否预后较差:值得注意的是,在局限于肾脏的 ccRCC 患者(I 期和II期)中,原发肿瘤分层为DCCD肿瘤的患者OS和PFS明显更差(Fig4k),这表明单独手术不太可能治愈这些患者。我们的数据表明,应识别局限性 DCCD-ccRCC 患者,并在手术后提供进一步治疗。


7、IM 亚型与治疗反应相关

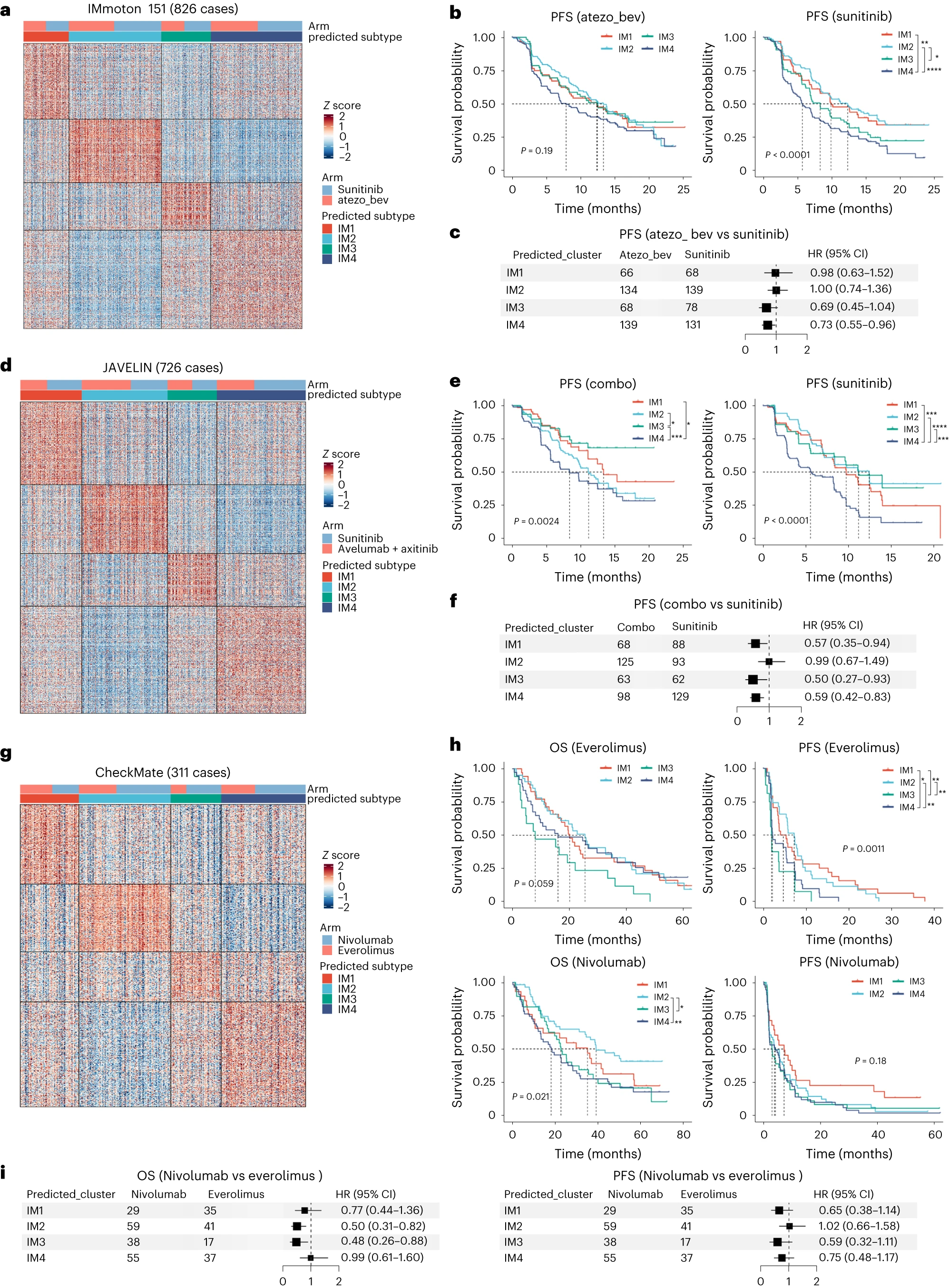
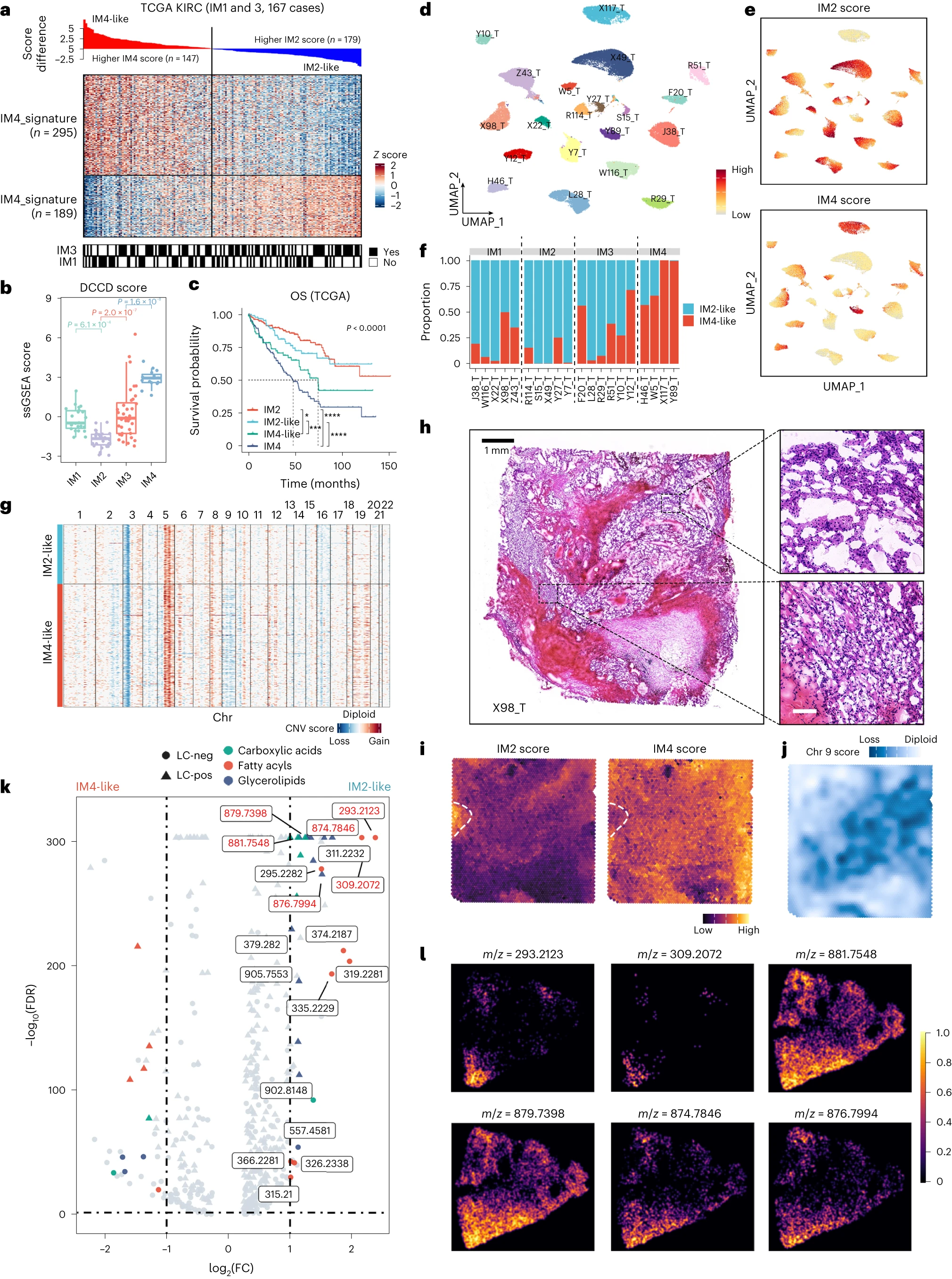
为了确定DCCD(IM4)和非DCCD(IM1-IM3)ccRCC患者的潜在治疗方案,我们分析了来自三项临床试验的Bulk RNA-seq数据。我们的目的是确定这些亚组是否与对特定治疗的反应有关。
①IMmotion151试验:与舒尼替尼(受体酪氨酸激酶抑制剂(TKI))相比,阿替利珠单抗(PD-L1抑制剂)和贝伐珠单抗(VEGF抑制剂)的组合改善了IM3和DCCD(IM4)组的预后(Fig 5a-c)。我们无法阐明患者是否从阿替利珠单抗、贝伐珠单抗或两者联合中获益。
②另一项III期临床试验JAVELIN:DCCD患者表现出最差的预后,与治疗类型无关,这与 IMmotion151试验的观察结果相同(Fig 5d、e)。与单独使用舒尼替尼相比,阿维鲁单抗(PD-L1抑制剂)和阿昔替尼(VEGFR抑制剂)联合治疗可改善IM1、IM3和IM4组的PFS(Fig 5f)。因此,IM1 组(血管生成相关基因高表达)可以从阿维鲁单抗联合阿昔替尼治疗中获益,但不能从阿替利珠单抗和贝伐珠单抗中获益(Fig5c、f)。值得注意的是,IMmotion 151和JAVELIN 都显示,抗血管生成疗法与免疫检查点阻断的组合对IM2患者没有益处。
③具有CheckMate 009、010和025的RNA-seq组合数据的meta队列:在纳武利尤单抗治疗的转移RCC(mRCC)患者中,患者分层影响OS,但不影响PFS(Fig 5g、h)。在依维莫司(雷帕霉素激酶(mTOR)抑制剂的机制靶点)治疗组中,IM3 肿瘤患者的OS和PFS最短。相比之下,在IM2和IM3患者中,与依维莫司(mTOR抑制剂)相比,纳武利尤单抗(PD-1抑制剂)治疗延长了OS时间(Fig5i)。与依维莫司相比,纳武利尤单抗可能是IM2和IM3患者二线治疗的更好选择。

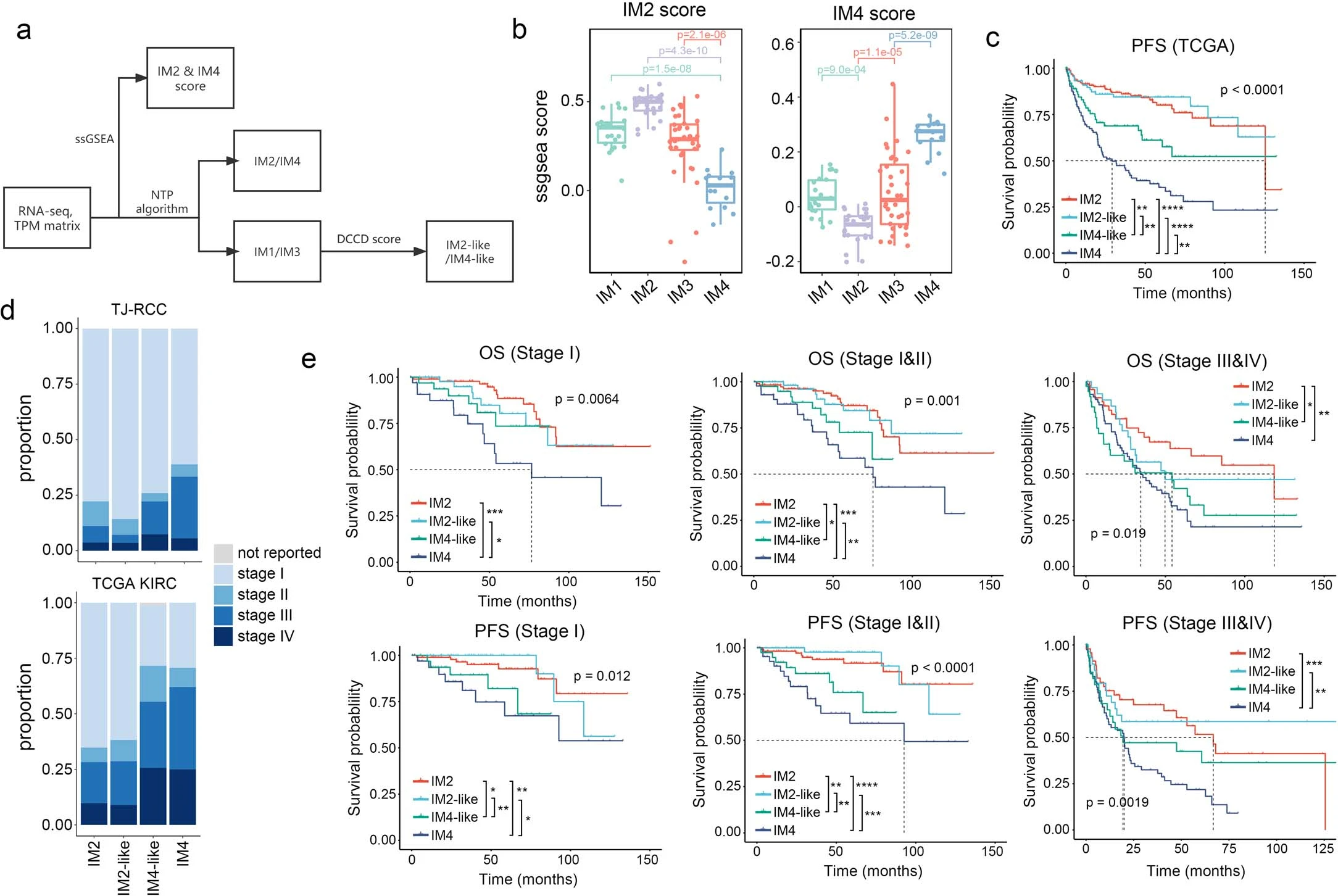
8、ccRCC中从非DCCD到DCDC的亚型水平转换

为了评估IM1和IM3样本的IM2-like或IM4-like特征,我们评估了snRNA-seq中的数据特征,并在TCGA-KIRC队列中进行验证。
①ssGSEA分析显示,IM1和IM3样本中IM2和IM4得分中等(Extended fig7a,b),在TCGA KIRC样本中进一步得到了证实:IM1和IM3样本与IM2及IM4特征呈负相关(Fig 6a),支持ccRCC中连续DCCD的假设。因此,我们根据显性基因特征将这些样本命名为IM2-like或IM4-like,并将DCCD评分定义为IM4和IM2评分的D值(Fig 6a,b)。
②IM2、IM2-like、IM4、IM4-like 肿瘤的KM分析显示:IM4-like肿瘤患者的OS和PFS优于IM4患者,但比IM2和IM2-like肿瘤患者差,IM2和IM2-like肿瘤患者结局相似(Fig 6c、Extended fig 7c)。尽管IM1和IM3肿瘤之间的TME存在显著差异(Fig2a、Extended fig 3a),但它们的结果相似(Extended fig 3d)。考虑到IM2和IM2-like组主要包含低级别、早期肿瘤(Extended fig 7d),我们分析了来自TCGA KIRC的I期病例,发现即使在这些早期病例中,较高的IM4评分也与不良预后相关(Extended fig7e),提示DCCD进展的程度可能决定ccRCC 患者的结局。
③进一步将这种调整后的分类策略扩展到临床试验数据集:在单独接受TKI治疗的患者中,该分类显示出与TCGA相似但相对较弱的预测能力(在IMmotion 和JAVELIN队列中),可能是因为这些队列仅包括转移性RCC患者(Extended fig 8a,c),并且在晚期TCGA病例中观察到类似的现象(Extended fig 7e),然而,在接受免疫检查点阻断治疗的组中,它未能提高最初IM分类的预测价值(Extended fig 8a-g),这可能是因为IM分类系统考虑了整个微环境的特征,而调整后的分类侧重于癌细胞的特征。
④随后对snRNA-seq数据的分析显示:在bulk-seq数据中观察到的IM2和IM4评分之间存在的负相关关系,同样在snRNA-seq数据中观察到(Fig. 6d,e and Extended fig 9a–d)。因此,我们根据DCCD评分将单个癌细胞分为IM2-like或IM4-like表型。有趣的是,IM2-like或IM4-like细胞的比例与bulk RNA水平的DCCD评分相关(Fig 6f和Extended fig 9e),表明DCCD过程反映了IM4-like癌细胞在肿瘤内的积累。
⑤因为DCCD-ccRCC通常比IM1-IM3肿瘤包含更多的臂水平的SCNAs(Fig 4a),我们探索了SCNAs是否驱动DCCD过程:在TJ-RCc和TCGA KIRC队列中,SCNA事件的数量表现出相同的趋势:IM4>IM4-like>IM2-like≈IM2。肿瘤进展相关的SCNA事件发生在IM4的肿瘤中发生多达75%(Extended fig 10a、b)。在snRNA-seq数据中,亚克隆SCNAs只能在两个具有部分DCCD特征的恶性细胞的肿瘤(partial DCCD)中发现(Fig 6g、Extended fig 10c)。在12个具有空间分布的ccRCC样本中,在两个样本(Y7_T、X98_T)中发现了部分 DCCD(Fig6h、i,Extended fig 10d、e)。值得注意的是,Y7_T在Bulk-seq和snRNA-seq数据中均表现出IM2特征(Fig6f),在10×visium空间转录组切片中显示亚克隆DCCD移位,反映了DCCD诱导的肿瘤异质性(ITH)。非DCCD区域表现出经典的“透明细胞”表型(Fig 6h、Extended fig 10d),与油红染色观察到的结果对应(Fig 4c)。在X98_T的DCCD区可发现9号染色体缺失,这与snRNA-seq数据一致(Fig 6g、j和Extended fig 10h)。相比之下,在Y7_T中未观察到亚克隆SCNAs(Extended fig10f、g)。综上所述,SCNA事件与DCCD事件之间没有绝对的相关性。■空间代谢组分析显示:无论是否存在亚克隆SCNAs,DCCD区域的脂肪酸,特别是长链脂肪酸较少(Fig6k、l,Extended fig 10i、j),导致这些区域的LD积累减少。
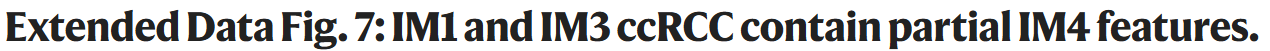



9、建立通往DCCD的轨迹
为了更深入地了解向DCCD的转化过程,使用snRNA-seq数据构建了一条轨迹。
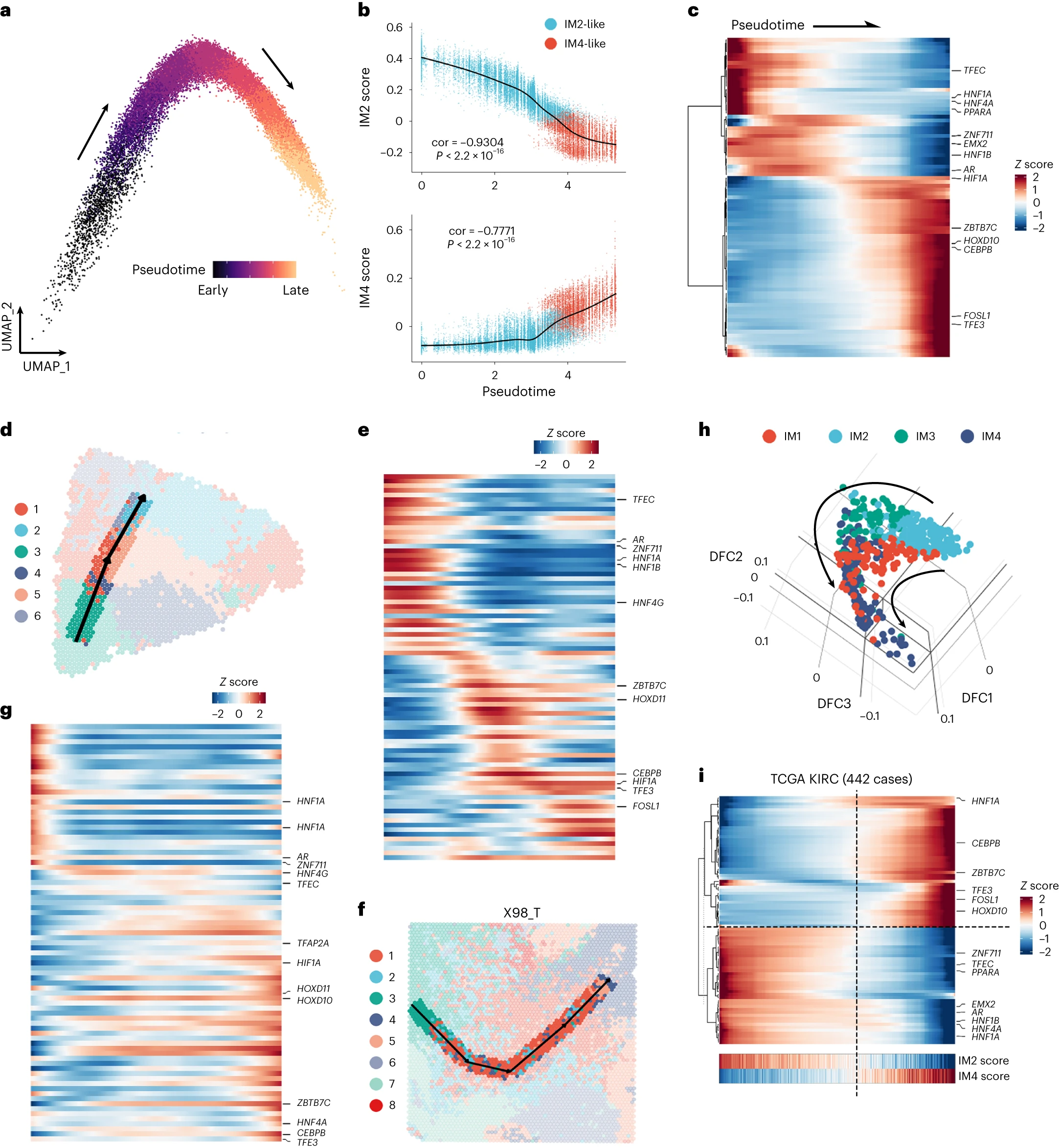
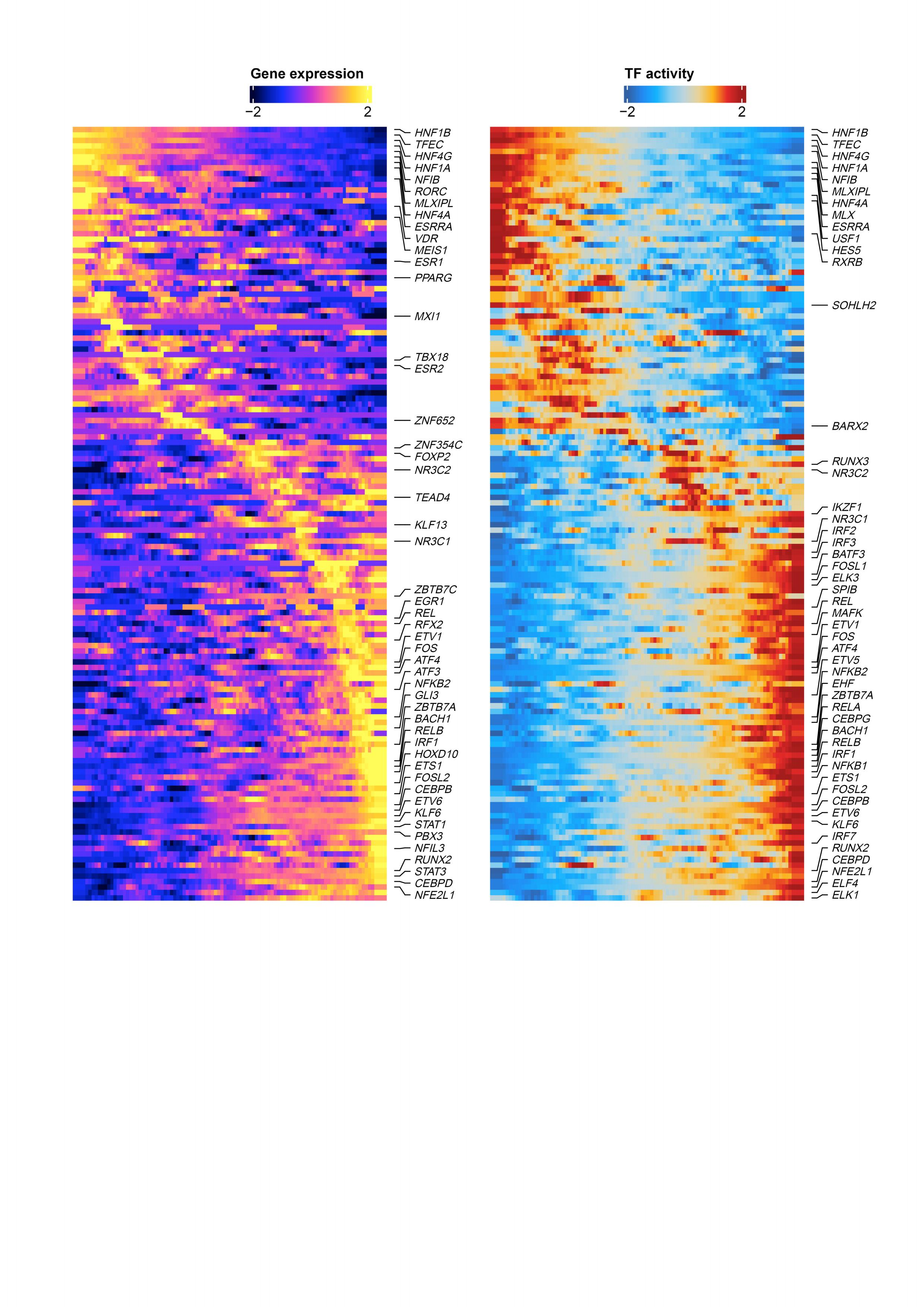
①拟时序分析: IM4-like单细胞的中心位于轨迹的末端。在整个拟时序轨迹中,观察到IM4评分增加和IM2评分下降(Fig7a,b)。随后,我们提取了Bulk-RNA差异表达的转录因子(通过比较bulk RNA-seq中IM4-like和IM2-like恶性细胞,IM4和IM4-like,IM2和IM2-like样本差异表达的转录因子)再在snRNA-seq数据中对这些转录因子行拟时序分析:将83个差异表达的转录因子分为两个簇(Fig 7c)。HNF1A、HNF1B(肾小管发育所必需且与ccRCC发生相关)和HNF4A(HNF1A的调节因子)以及 PPARA(维持正常肾近端小管代谢特征的主要转录因子)都参与其中,它们沿轨迹的下调可能与DCCD肿瘤中近端肾小管特异性代谢特征的抑制有关(Fig 4a)。雄激素受体(既往研究:其在ccRCC中的丢失与较高的淋巴结转移率有关)在IM4-like单细胞中也被下调。HIF1A(既往研究报道HIF1A是RCC的常规肿瘤抑制因子,HIF1A的上调与mRCC的药物应答率降低有关)在分化的后期显著升高。两个样本(Y7_T及X98_T)的空间轨迹与snRNA-seq数据的结果一致。(Fig 7d-g)。由于partial-DCCD样本是IM2-Like细胞和IM2-Like细胞的混合,所以我们推测可以基于DCCD特征分数,利用Bulk-RNA数据建立轨迹。因此,我们使用Monocle 2利用DCCD特征分数生成拟时序轨迹。参与DCCD的关键转录因子的连续变化在Bulk-seq和snRNA-seq数据之间高度一致(Fig 7h、i),表明DCCD在ccRCC中是一个广泛的、连续的生物学过程。
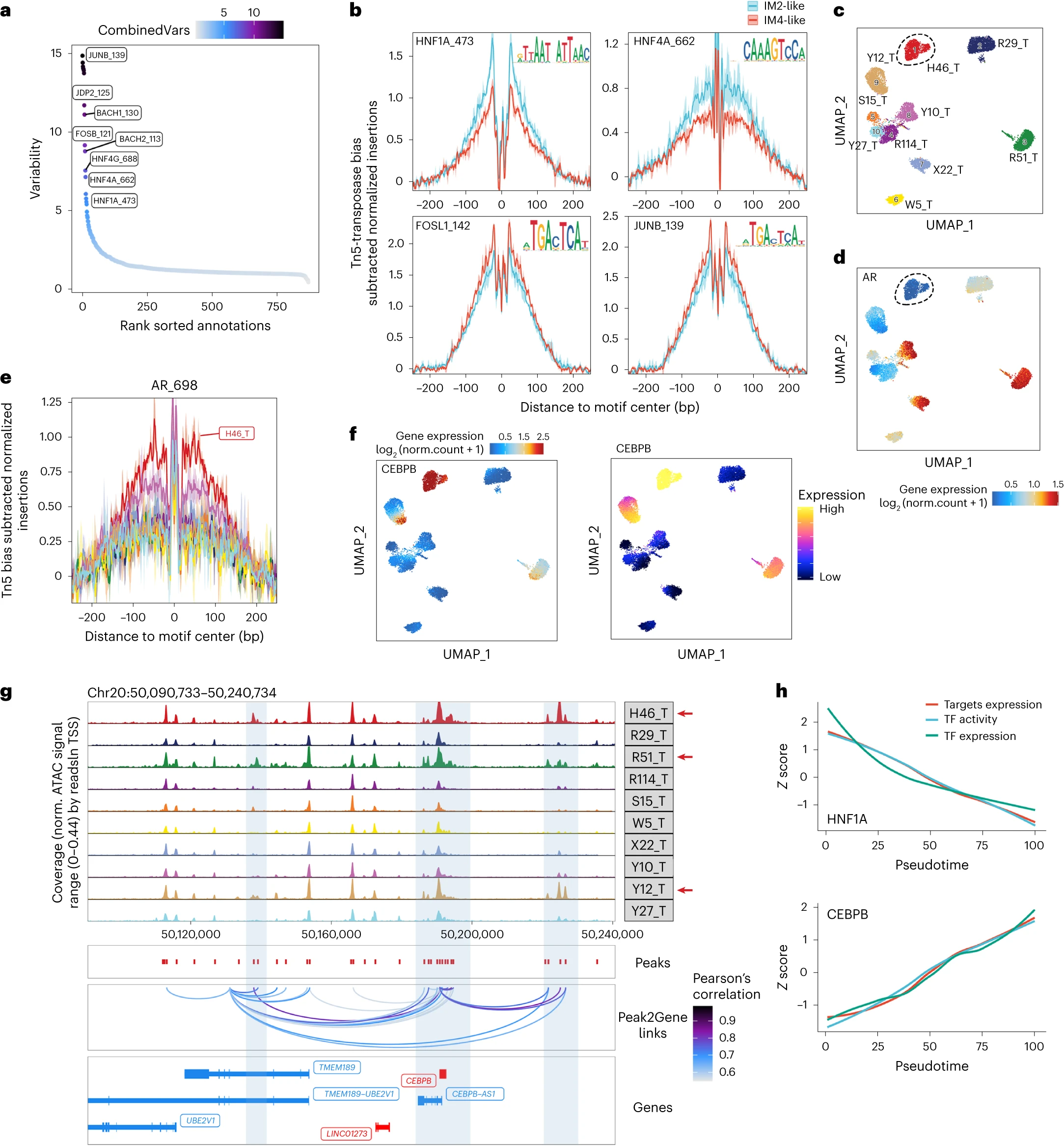
②snATAC-seq数据的ChromVAR偏差分析揭示了DCCD和非DCCD群体之间差异最大的激活转录因子:如Fig8a所示,AP-1转录因子亚基排在第一位,其次是BACH1、BACH2和肝细胞核因子家族成员。这些发现通过snATAC-seq的基序足迹分析证实(Fig 8b)。综合的多组学数据也揭示了转录组和染色质可及性之间的异步现象。例如,根据bulk-seq 和 snRNA-seq数据,H46_T是一种雄激素受体低表达(ARlow)的肿瘤。然而,基序足迹分析显示,H46_T的雄激素受体结合位点在所有样本中具有最高的可及性(Fig8c-e)。
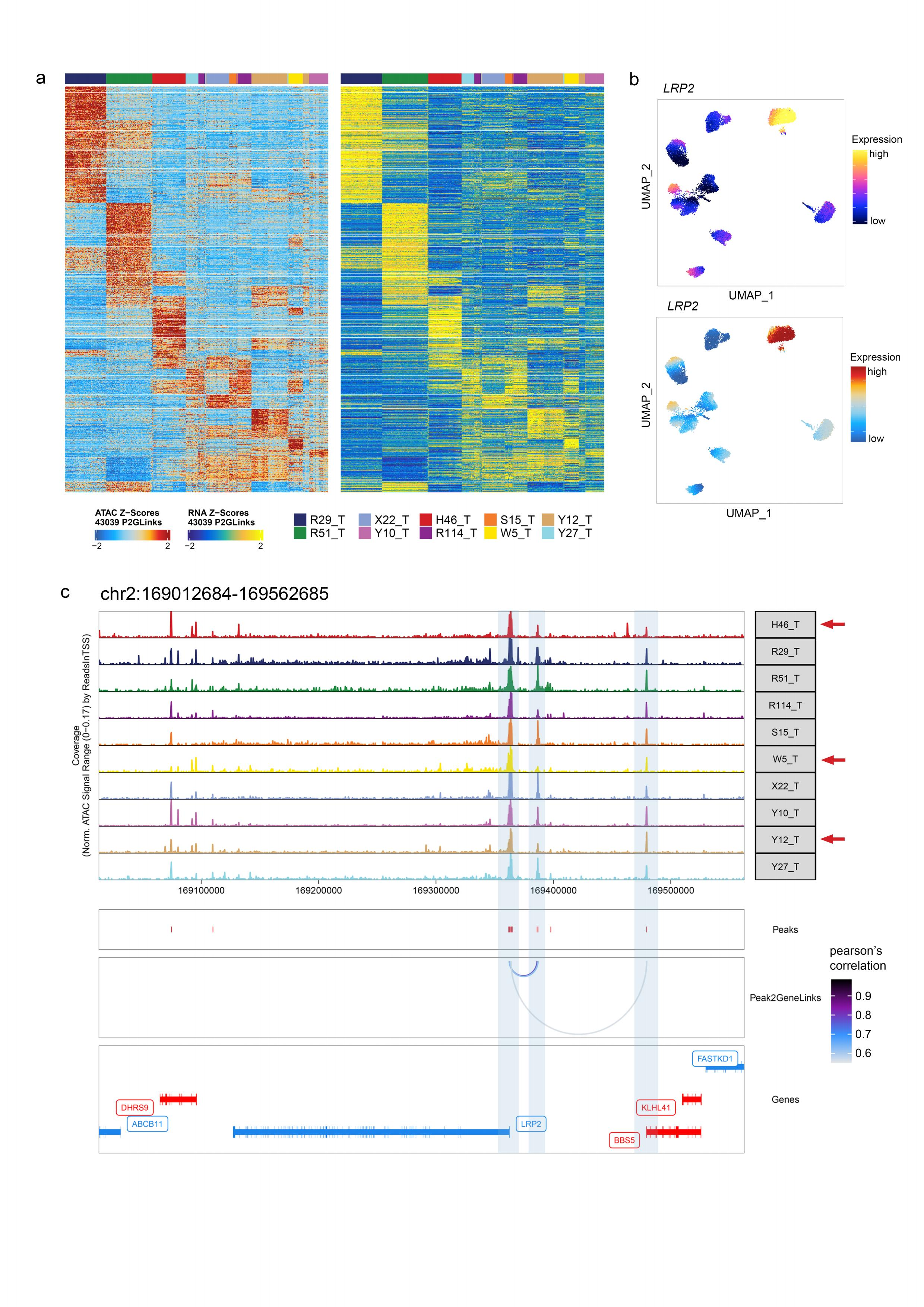
③peak-to-gene连锁性分析:尽管peak-to-gene连锁特征具有样本特异性(Supplementary Fig 3a)但在多个样本中观察到几个特征。我们发现在LRP2启动子上游约30k处有一个峰,该峰与LRP2的表达呈正相关(Supplementary Fig 3b、c)。我们还发现了几个与癌细胞中CEBPB表达相关的峰,它们可能是促进CEBPB表达的增强子(Fig 8f、g)。
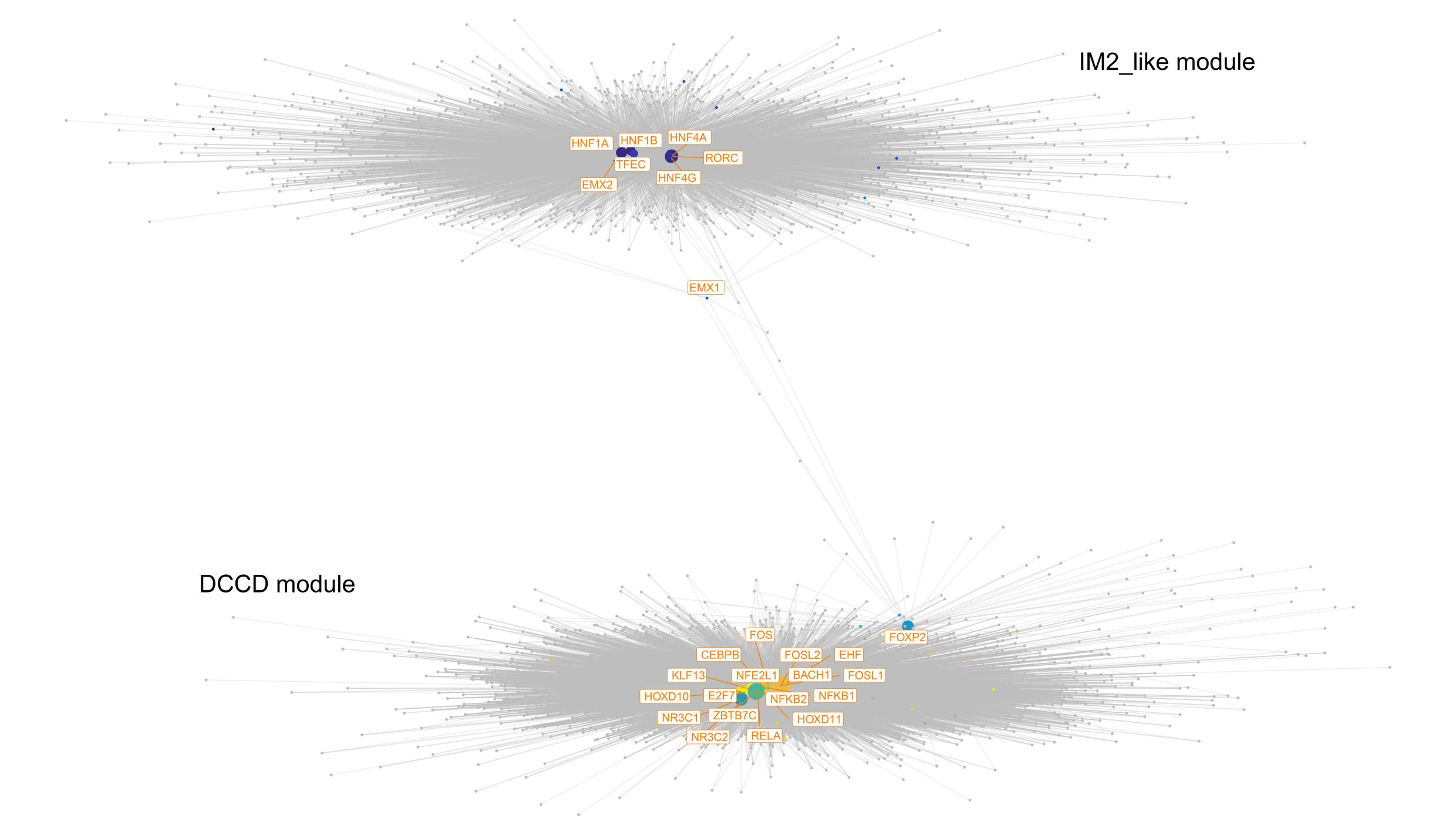
④最后,通过scMEGA分析,我们可以分别构建DCCD和非DCCD癌细胞的基因调控网络(Fig8h和Supplementary Fig 4、5)。
综上所述,这些数据为深入了解参与ccRCC进展的转录因子调控网络提供了见解。





讨论
多组学数据的整合对ccRCC的多水平ITH进行了分类,揭示了基因组、转录组和代谢调控之间的相互作用。在这项工作中,我们确定了一个独特的亚组,DCCD-ccRCC。我们还进行了空间代谢组学分析,揭示了部分代谢重编程有助于 ccRCC的ITH,为难治性RCC患者提供了新的治疗机会。

汇报人:李朔
导师:任建君
审核:邱轲、庞文都、任建君



