精读分享│【Nature Genetics】:针对东亚人群和跨种族基因组范围荟萃分析为消化性溃疡疾病提供了机制方面的见解
英文题目:East Asian-specific and cross-ancestry genome-wide meta-analyses provide mechanistic insights into peptic ulcer disease
中文题目:东亚特异性和跨种族全基因组荟萃分析提供了对消化性溃疡疾病的机制见解
期刊:Nature Genetics(IF: 31.7)
作者单位:
1.日本,东京大学,前沿科学研究生院,复杂性状基因组学实验室
2.日本,岩手医科大学,岩手东北医疗巨型生物库组织
3.加拿大魁北克,蒙特利尔,麦吉尔大学,维克托·菲利普·达达利基因组医学研究所与人类遗传学系
4.日本,东京大学,医学研究所,分子病理学科
5.日本,东京大学,前沿科学研究生院,临床基因组测序实验室
6.日本,东京大学,医学研究所,公共政策学系
发表时间:2023年12月


摘要:
消化性溃疡病(Peptic Ulcer Disease, PUD)是指酸诱导的消化道损伤,主要发生在胃(胃溃疡,Gastric Ulcer, GU)或十二指肠(十二指肠溃疡,Duodenal Ulcer, DU)。该研究结合了日本和欧洲的研究数据(包括52,032个病例和905,344个对照),进行了大规模的跨种族PUD全基因组关联研究荟萃分析,发现了25个新位点,这些位点在不同种族中高度一致。对GU和DU的遗传结构分析表明,GU与DU共享相同的风险位点,但GU的遗传效应较小且多基因性较高,表明GU的异质性更高。幽门螺杆菌(Helicobacter pylori, HP)分层分析发现了一个与HP相关的宿主遗传位点。通过使用整体和单细胞转录组数据进行综合分析,研究强调了PUD的遗传因素主要在胃组织中高度表达的基因中富集,特别是在分泌生长抑素的D细胞中。研究的结果从遗传学角度证明,胃肠细胞分化和激素调节在PUD的发病机理中至关重要。
关键词:
全基因组关联研究,消化性溃疡
前言:
PUD是由胃酸引起的消化道损伤,主要发生在胃(GU)或十二指肠近端(DU),主要并发症包括出血、穿孔或胃出口梗阻。PUD是最常见的胃肠道疾病之一,在普通人群中的终身患病率约为5-10%。据报道,东亚人群的PUD患病率显著高于欧洲人群,其中日本人群中GU比DU更常见,而在欧洲人群中DU更常见。
HP感染和非甾体抗炎药(NSAIDs)的使用是GU和DU的两个主要原因,但遗传因素也在PUD的发展中也起着关键作用。之前的全基因组关联研究(GWAS)在欧洲人群中鉴定了多个主要与HP相关的位点。鉴于东亚人群中PUD和HP感染的患病率相对较高,以及在东亚人群中发现的风险位点数量有限,需要更大样本规模的东亚人群GWAS来增强人们对PUD遗传病因的理解。由于GU和DU在多方面存在差异,如与HP感染相关的溃疡比例不同,PUD亚型的遗传差异及其病因中的关键细胞类型需要进一步研究。流行病学研究表明,DU是胃癌的保护因素。然而,PUD和胃癌的遗传因素是否一致,能否解释流行病学发现仍不清楚。因此,大规模的PUD遗传研究不仅可以扩展人们对PUD生物学的理解,还能提供关于与HP相互作用或导致PUD或胃癌不同结果的遗传因素的见解,从而有可能在临床环境中更准确地预测个体风险。
为了解决这些问题,研究对东亚特定人群及跨种族的PUD和PUD亚型进行了大规模全基因组分析,结合了四个日本队列和两个欧洲队列,总计52,032例PUD病例和905,344例对照。
结果:
研究对PUD及其亚型进行了三阶段全基因组分析。东亚人群的PUD病例通过结合两大主要亚型(DU和GU)的个体获得,并根据溃疡发生的解剖部位分类。将患有GU和DU共病的个体归类为BU(同时患有GU和DU)病例。
1、PUD及其亚型的关联分析:
首先,在BioBank Japan第一队列的180K数据集(BBJ1-180K)的发现阶段对PUD及其亚型(DU、GU、BU)进行GWAS分析。该数据集包括19,713例东亚裔PUD患者和153,178名对照组,采用1000基因组计划第3阶段(1KG Phase 3)参考面板进行基因填补。总共测试了13,846,852个变异(次等位基因计数(MAC)>20且R2>0.3),采用SAIGE方法的广义线性混合模型进行关联分析,以控制病例对照失衡(BBJ1-180K中病例对照比为1:7.7至1:82)。对于PUD,识别出了10个全基因组显著位点(P<5.0×10-8),其中5个为新发现的全基因组显著位点。此外,DU识别出了14个显著位点,包括7个新位点(其中3个与新PUD位点重叠)。GU和BU识别出一个已报道的PSCA2位点。总共15个非重叠遗传位点达到了PUD或其亚型的显著阈值,其中9个为新位点。X染色体分析中识别出一个已知的GUCY2F位点,与PUD、DU和GU相关。性别分层分析中识别出13个非重叠的显著位点(男性13个,女性1个)。
在三个独立研究中进行复制验证,分别为BBJ1-12K(1,001例)、BBJ2-42K(3,637例)和TMM-50K(5,388例)。采用1KG Phase 3面板对复制数据集进行基因填补,并采用与发现阶段相同的设置进行自体变异关联测试。在9个新发现的与PUD或其亚型相关的主效应变异中,4个在至少两个复制数据集中与PUD或其亚型呈同向关联(P<0.05)。值得注意的是,5个新位点在TMM-50K数据集中得到验证。
接着,研究进行了东亚特异性荟萃分析,结合了发现阶段的GWAS和三个复制验证阶段的GWAS(ncase=29,739;ncontrol=240,675)。采用固定效应模型的逆方差加权(IVW)方法对PUD及其亚型进行meta分析。基因组通胀因子(λgc)和连锁不平衡(LD)评分回归(LDSC)拦截范围分别为1.03-1.08和1.01-1.02,表明无显著偏倚。在东亚特异性荟萃分析中,研究检测到25个与PUD或其亚型相关的非重叠风险位点,其中11个为新位点。
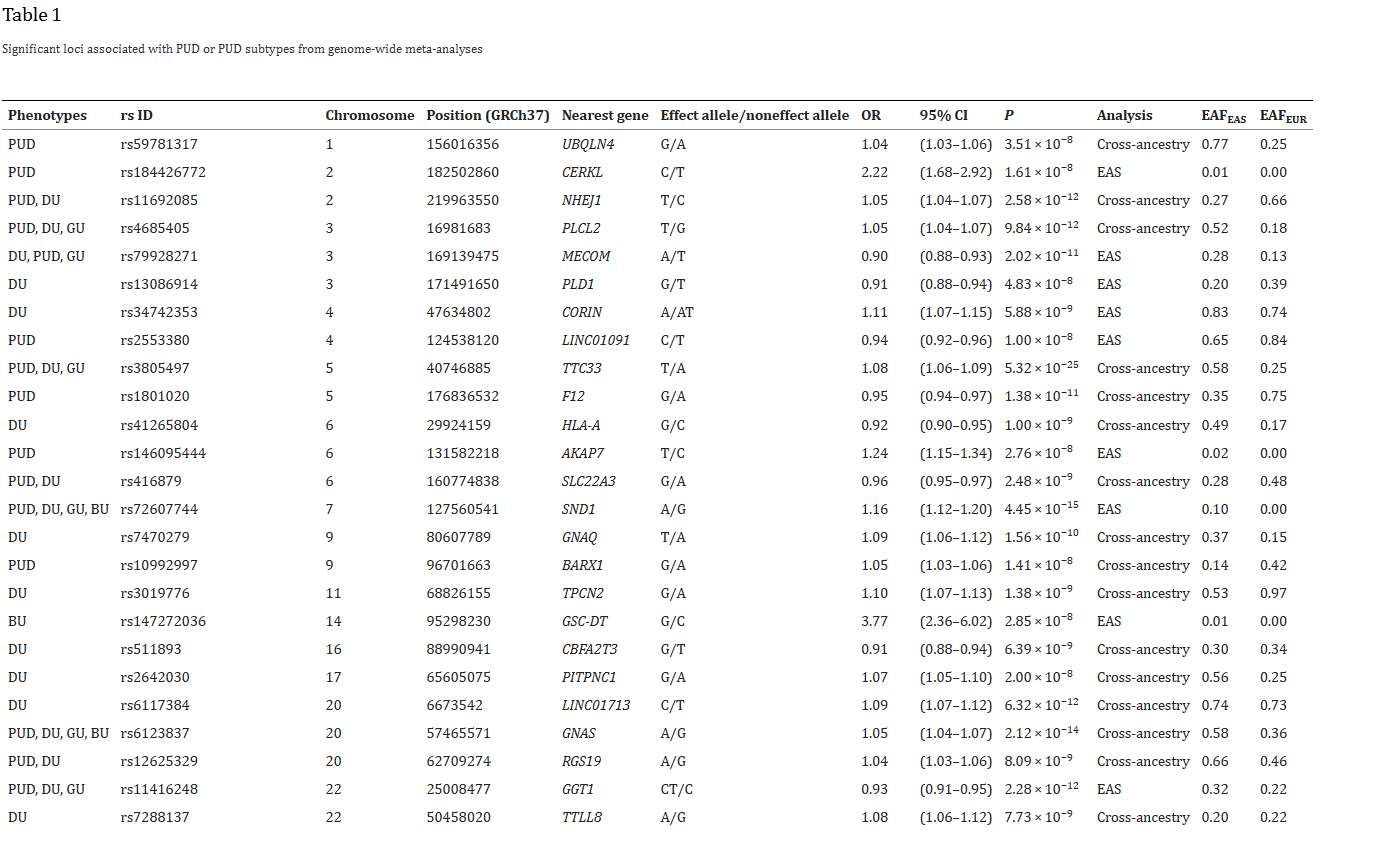
来自全基因组荟萃分析的与 PUD 或 PUD 亚型相关的重要位点
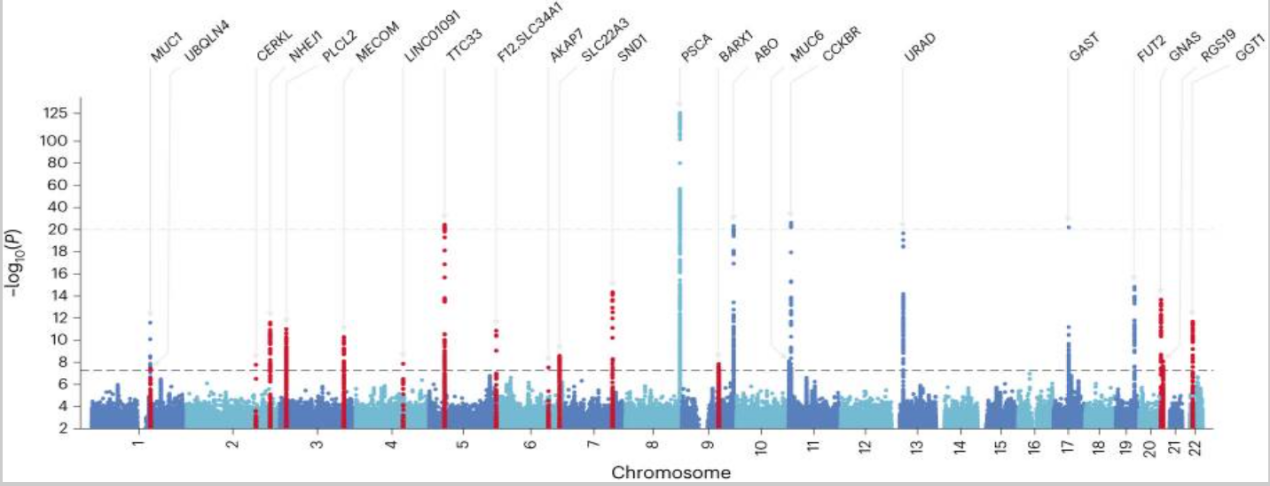
PUD 交叉血统荟萃分析的曼哈顿图
2、跨种族比较:
利用东亚群体(EAS)大规模的PUD及其亚型数据集,该研究调查了EAS和欧洲群体(EUR)中PUD的共同和独特风险位点。研究比较了在两种祖先群体中与PUD或其任何亚型相关的主要变异的每等位基因效应大小。PUD的效应大小在两个祖先群体之间显示出较高的相关性(在两个群体中次要等位基因频率(MAF)>0.01的27个变异位点,相关系数r = 0.79),尽管检测到9个变异位点的效应大小存在差异【在27个效应大小差异中有9个(对数优势比(OR)差异>0.05)】。即使在应用赢家的诅咒(WC)校正后,这种高相关性仍然存在。为了进一步研究东亚人和欧洲人之间PUD的遗传结构差异,研究使用Popcorn进行跨种族遗传相关性分析。PUD的遗传影响显著不同于1(零假设:ρgi=1),表明跨种族PUD的遗传结构存在差异。对于亚型,DU的效应大小在两种祖先群体中的相关性较高(r=0.79),而GU的效应大小相关性较低(r=0.63)。GU的遗传相关性较低(ρgi=0.45,P=7.3×10-3),而DU的遗传结构在不同祖先群体中未显示出显著差异(ρgi=0.72,P=9.6×10-2)。
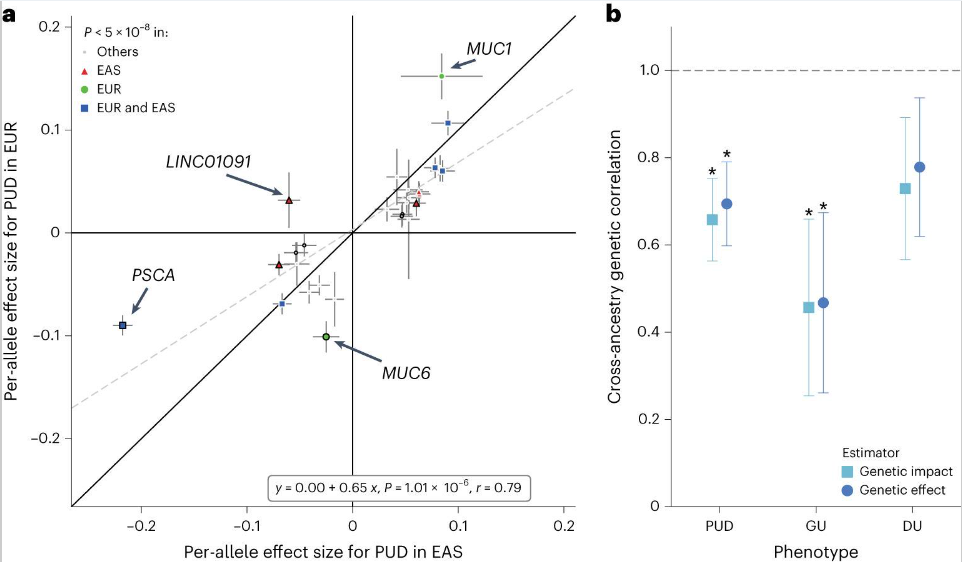
跨种族效应大小比较和遗传相关性分析
3、东亚人群中PUD相关位点的特征分析:
为探索已识别位点的次级信号,研究使用COJO方法进行了逐步条件分析,并采用东亚人群的样本内LD参考。研究检测到四个额外的独立信号达到了全基因组显著性(P<5.0×10-8)与PUD相关,以及在PSCA位点检测到的三个与DU相关的独立信号。PSCA位点拥有最多的独立关联(PUD三个,DU四个,GU和BU各两个)。在CDX2和GAST位点附近(此前在欧洲人中报道的位点),该研究分别在PDX1和JUP2位点检测到独立信号。
研究使用SuSiE进行精细定位分析,以识别可能的因果变异。在95%可信集合中搜索了非同义变异,以将疾病相关位点与蛋白质功能改变联系起来。共识别出六个非重叠位点的十个非同义变异,其中六个位于PUD及其亚型的新位点。其中,rs2233580(PAX4;p.R200H;;联合注释依赖性耗竭CADD评分=29.8)还与2型糖尿病相关。该变异在1KG EAS中很常见(MAF>0.05),但在非EAS人群中几乎为单倍型。rs4745(EFNA1;p.D159V;DU的后验包含概率PIP=0.05;CADD评分=15.2)在EAS和EUR中常见,并与胃癌相关。该变异是胃中EFNA1的主效应顺式剪接定量性状位点(sQTLs),与胃中MUC1的主效应sQTL变异rs4072037高度连锁(1KG EAS中的LD r2=0.74)。除了错义突变外,研究在可信集合中发现了rs4390169(EFNA1上游;DU的PIP=0.06;与rs4745高度连锁,1KG EAS和EUR中的LD r2=0.99)是血浆中EFNA1的顺式蛋白质QTL(pQTL)主要变异。
在此前报道与PUD相关的ABO和FUT2位点的可信变异集合中,研究识别出了rs8176719(ABO位点的主要变异)和rs1047781(FUT2位点的可信集合中的变异;PIP=0.63)。rs8176719的缺失导致了O等位基因的出现,而rs1047781(p.I140F)是EAS特有的常见变异(1KG EAS中MAF=0.439),其A等位基因决定了FUT2的分泌型状态。研究进行了逻辑回归分析,以研究ABO血型和FUT2分泌型状态与PUD的相关性。O型血(OR=1.14,P=6.0×10-14)和非分泌型状态(OR=1.17,P=2.9×10-11)PUD的风险显著增加相关,这一结果在所有PUD亚型中均保持一致。为研究O型血和非分泌型状态之间可能存在的相互作用,研究进行了包含交互项的逻辑回归分析。然而,未检测到O型血和非分泌型状态之间的显著交互作用(P<0.05/8,经Bonferroni校正)。
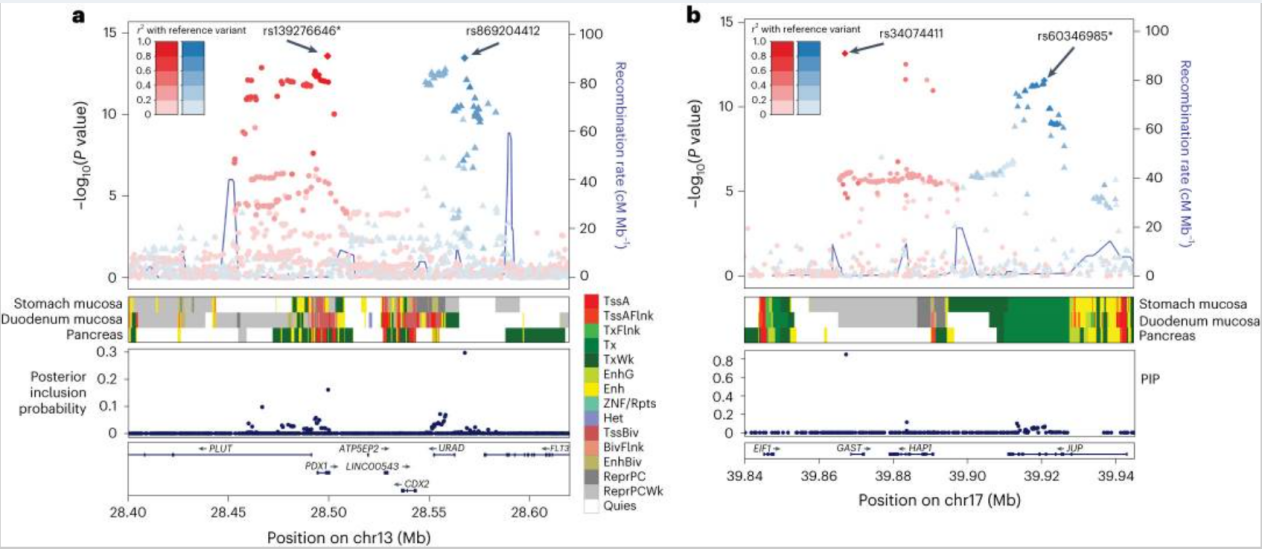
在PDX1和JUP位点上的东亚人群特异性次要信号
4、PUD风险变异与表达数量性状位点(eQTL)和蛋白质数量性状位点(pQTL)的重叠:
为了检测功能相关基因,研究在Genotype-Tissue Expression(GTEx)v.8数据集中搜索了与PUD信号或其LD代理(1KG EAS或EUR中LD r2>0.6)重叠的主要de 顺式eQTL。研究解释了每种组织类型中基因最显著的eQTL结果。研究在胃中识别出了与IHH、PLCL2、PTGER4、ZNF322、HIATL1、FAM211B和GGT1相关的eQTL重叠的新变异。
研究者查阅了来自血清或血浆的五个近期大规模pQTL数据集,用于寻找与PUD信号或其连锁不平衡代理重叠的顺式或反式pQTL。研究观察到88个独特显著pQTL关联的重叠,其中大部分(93.1%)为反式pQTL,涉及ABO位点的主要单核苷酸多态性(SNP)。与PUD风险等位基因处于LD的顺式pQTL等位基因与EFNA1和OBP2B水平增加相关,与NHEJ1、ABO和GGT1水平减少相关(上述顺式pQTL与EFNA1、OBP2B、NHEJ1和GGT1的顺式eQTL重叠)。对于与主要变异连锁的反式pQTL,研究观察到与多种蛋白质的关联,包括F8、F10、PROS1(血液凝固相关)和三叶因子家族肽(在胃肠道粘膜损伤反应中起重要作用)。
5、遗传相关性和多效性效应:
研究进行了跨性状LD评分回归分析,以评估PUD相关性状之间的遗传相关性。如预期显示,DU和GU显示出显著高的遗传相关性(rg=0.79,错误发现率(FDR)<5%)。尽管没有统计意义(FDR<5%),但GU与胃癌(GC)呈正遗传相关性(rg=0.17),而DU则呈负相关(rg =−0.14)。该研究还探索了PUD与饮食习惯和复杂性状的遗传相关性,在东亚群体中未观察到PUD与其他复杂性状之间的显著遗传相关性(FDR<5%)。
为了研究不同变异的多效性效应,研究使用日本人群中先前大规模GWAS数据进行了全表型关联研究(PheWAS)查找。在与PUD及其亚型相关的27个主效应变异中,16个达到了全基因组显著性阈值(P<5.0×10-8)。其中,12个变异在Bonferroni校正后与至少两种性状相关(P<8.6×10-6)。在Bonferroni校正后,2型糖尿病(SND1–PAX4位点两个和GAST位点一个)和胃癌(EFNA1、PTGER4和PSCA位点)分别与PUD或其亚型共享了三个显著变异(P<8.6×10-6)。
6、HP分层分析:
为了探讨HP诱导的溃疡与非HP相关的消化性溃疡之间遗传结构的差异,该研究在TMM-50K中对HP+和HP−个体的PUD进行了HP分层关联测试。在东亚人群中鉴定出的不同PUD信号(29个等位基因频率(MAF)> 0.01的变异)中,HP−和HP+状态下的PUD每等位基因效应大小高度相关。研究在CCKBR基因位点(rs12792379)中识别到一个与HP+PUD特异相关的主效应SNP(HP+PUD的OR=1.18,95%置信区间(CI)=1.05–1.34;HP−PUD的OR=1.01,95% CI=0.92–0.11),以及在ZNF169附近的一个HP−GU位点(rs12347577;Cochran's Q检验,Phet<0.05)。另一方面,PSCA位点中最显著的主效应变异在效应值上未显示显著的异质性(Phet <0.05)。共定位分析表明,HP+PUD和HP−PUD在PSCA中共享因果变异(PUD的PP4>0.8)。
7、遗传分析揭示了胃溃疡的异质性:
为了进一步探讨GU和DU之间遗传结构的相似性和差异性,研究首先比较了在东亚人群中识别出的GU和DU的不同信号的效应值(主效应变异和独立次要变异)。值得注意的是,GU的效应值与DU的效应值显示出很强的相关性(29个变异,MAF>0.01,r=0.92),这与前述高遗传相关性一致。然而,GU的效应值系统性地小于DU的效应值(截距=0.01,斜率=0.43,斜率标准误=0.03),其中19个变异(29个中的19个,占65.5%)在Cochran's Q检验中显示出显著异质性(Phet<0.05)。为了进一步验证这些发现并避免比较中的潜在偏差,该研究比较了(1)TMM-50K、FinnGen和UKB中的GWAS信号效应值,(2)在BBJ1-180K的关联测试中排除BU样本的效应值(即比较中没有共同的病例),以及(3)TMM-50K衍生统计数据与BBJ1-180K衍生统计数据(即比较中没有共同的对照)。在这些比较中,GU与DU显示出高相关性(变异MAF>0.01,r=0.75–0.90),但GU的效应值较DU小。此外,该研究利用SBasyesS估计了使用HapMap3 SNPs从东亚特定汇总统计数据中推导出的SNP遗传率和多基因性(定义为具有非零效应的SNP比例)。估计约有0.22%的变异具有非零效应。与DU相比,GU显示出适度更高的多基因性但较低的遗传率(PiGU=0.24%,PiDU=0.10%)。这些结果表明GU和DU具有很高的遗传相关性,大多数风险位点共享,并暗示GU具有更高的异质性。
最后,利用TMM-50K衍生的汇总统计数据,该研究使用包含1,029,637个变异的PRS-CS生成了多基因风险评分(PRS)模型,并在BBJ1-180K中测试了这些PRS与PUD或PUD亚型的关联性,以探讨PUD和PUD亚型之间的遗传重叠性。与HP+PRS相比,HP−PRS通常显示出与PUD或PUD亚型更强的关联性。最强的关联性是DU PRS与DU(OR=1.22,95% CI=1.20–1.25,ΔR 2=0.94%)。DU PRS(OR=1.08,95% CI=1.06–1.10,ΔR 2=0.13%)与GU的关联性比GU PRS(OR=1.04,95% CI=1.03–1.06,ΔR 2=0.05%)更强。结果进一步验证了GU与DU共享风险位点,同时比后者具有更高的异质性。
8、PUD风险变异对胃癌的多效性:
考虑到DU可能是GC的保护因素,该研究进行了双样本孟德尔随机化(MR)分析,以评估PUD及其亚型对GC的因果性。EAS中的GC汇总统计数据来自之前在BBJ1-180K进行的研究,该研究包含约6,500个病例。PUD及其亚型的汇总统计数据通过对三个重复数据集进行荟萃分析获得。虽然使用IVW方法的结果显示PUD及其亚型对GC具有显著(P< 0.05/15,Bonferroni校正)的保护效应,但MR-Egger分析表明这些工具变量存在显著的多效性。研究利用MR-PRESSO校正了水平多效性变异(每种暴露校正6到7个)。校正后的MR分析显示PUD及其亚型对GC没有显著影响。需要注意的是,样本拆分和移除异常值可能会导致统计效能的降低。
为了评估PUD风险变异对GC风险的多效性,研究比较了EAS中PUD亚型和GC的不同信号的效应值。对于存在于两个数据集中的23个变异,该研究发现DU的效应值与GC的效应值呈负相关(斜率 = −0.33,斜率标准误 = 0.10)。值得注意的是,与EFNA1(编码肝配蛋白A1,EFN家族成员)、PTGER4(编码前列腺素E2受体)和PSCA相关的主效应变异对DU和GC表现出相对强但相反的效应。这表明这些变异的等位基因增加了PUD的风险,但降低了GC的风险。在回归分析中移除这三个变异后,20个变异的效应值未显示负相关(斜率 = −0.06,斜率标准误 = 0.10),表明DU和GC之间的负相关主要受到这三个变异的影响。
9、基于基因和基因集的分析:
使用MAGMA方法进行的基因水平分析在EAS人群中检测到29个与PUD显著相关的基因(P < 6.5×10−7),45个与DU相关的基因,以及15个与GU相关的基因。总共有47个不同的基因与PUD或其亚型相关。据报道,在基因水平分析中识别出的多个基因与GC相关(如PTGER4、PRKAA1、GNAQ、GNAS、NHEJ1、IHH和JUP)。基于基因水平的统计数据,该研究进一步进行了通路富集分析,经过Bonferroni校正后识别出一个显著的基因集(nikolsky_breast_cancer_8q23_q24_amplicon,包括在乳腺肿瘤研究中鉴定的8q23-q24扩增子内的基因;P < 8.0×10−7)。
10、组织和细胞类型特异性分析:
该研究使用MAGMA方法结合GTEx v.8数据集在EAS个体中进行了组织水平的特异性分析,以探索与PUD及其亚型相关的组织类型。对于PUD,胃、胰腺、小肠和肾脏中观察到显著的遗传富集(FDR < 5%),对于DU,胃、胰腺和前列腺中观察到显著的遗传富集。
为了进一步表征胃和十二指肠组织中与PUD相关的特定细胞类型,该研究利用公开的单细胞RNA测序(scRNA-seq)数据集对人类胃和十二指肠进行了细胞特异性分析。分别在EAS和EUR个体中使用LDSC和MAGMA进行了细胞特异性分析,为了提高统计效能,该研究对每种方法的结果分别进行了固定效应荟萃分析。
对于PUD,该研究发现胃D细胞在MAGMA和LDSC分析中达到了显著阈值(FDR < 5%)。此外,十二指肠肠嗜铬细胞(EC细胞)、胃窦EC细胞和胃簇绒细胞细胞在MAGMA中也显著(FDR < 5%)与PUD相关。胃D细胞产生的生长抑素可抑制多种胃肠激素的分泌,包括由胃G细胞分泌的胃泌素,而胃泌素可刺激胃酸分泌。EC细胞分泌5-羟色胺(一种神经递质),在多种胃肠功能中发挥重要作用;而簇绒细胞(化学感受性上皮细胞)分泌白细胞介素-25,可驱动对寄生虫感染的Ⅱ型免疫反应。综上所述,这些发现表明胃肠激素调节和免疫反应在PUD发病机制中具有重要作用。
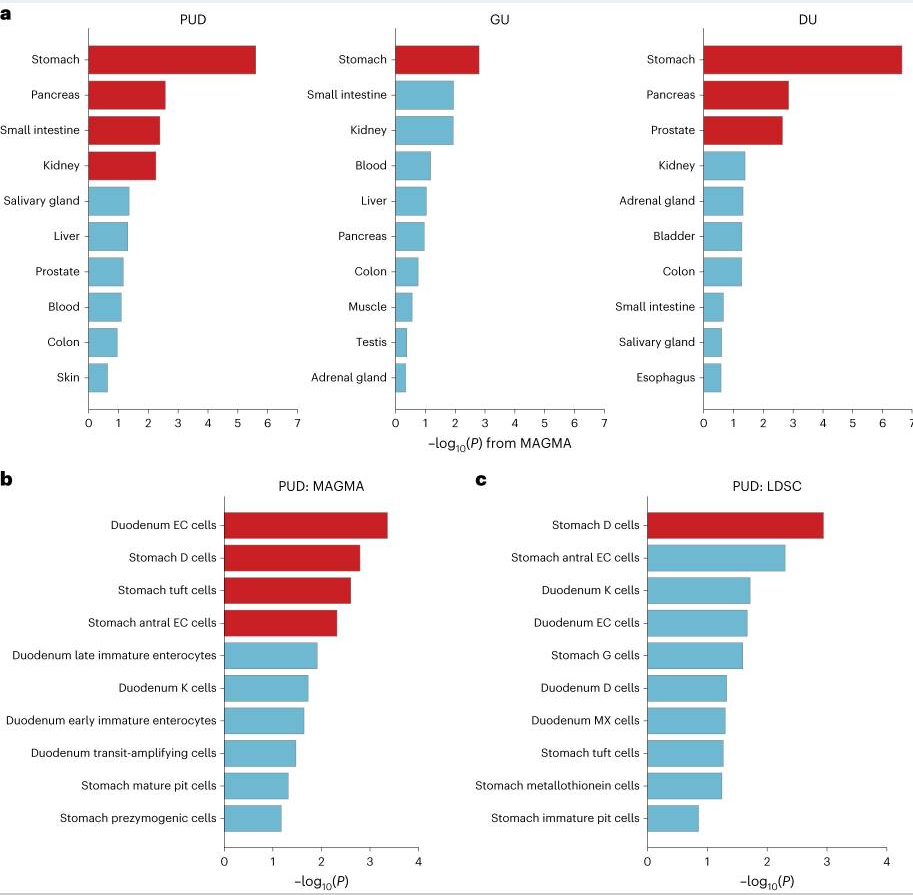
组织和细胞类型特异性分析

汇报人:黄石
导师:赵宇 教授
审核:毛敏姿、王肖宇、任建君



