精读分享│【Cancer Cell】:整合分子和空间分析揭示了原位和浸润性肢端黑色素瘤的进化动力学和肿瘤免疫相互作用
英文题目:Integrative molecular and spatial analysis reveals evolutionary dynamics and tumor-immune interplay of in situ and invasive acral melanoma
中文题目:整合分子和空间分析揭示了原位和浸润性肢端黑色素瘤的进化动力学和肿瘤免疫相互作用
期刊:Cancer Cell(IF: 50.3)
单位:北京大学-云南白药国际医学研究中心、北京大学第一医院
发表时间:2024年5月

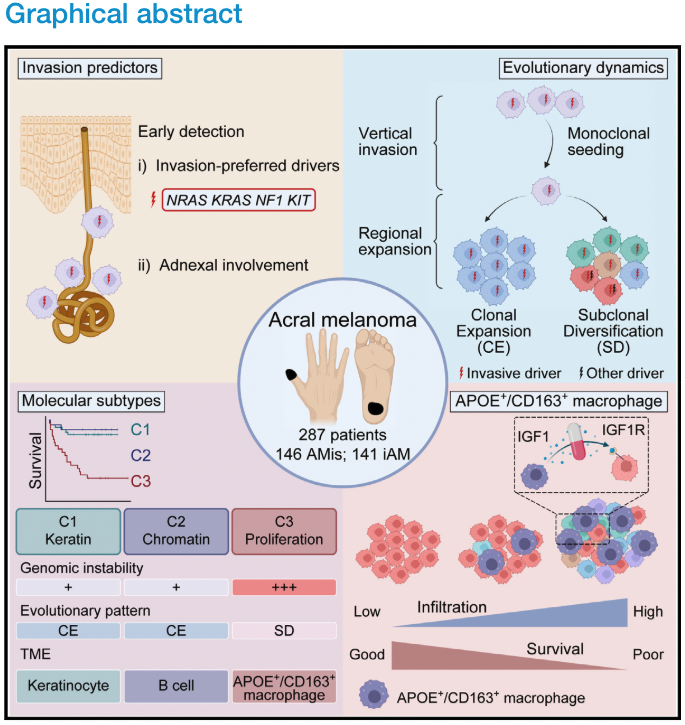
图形摘要:
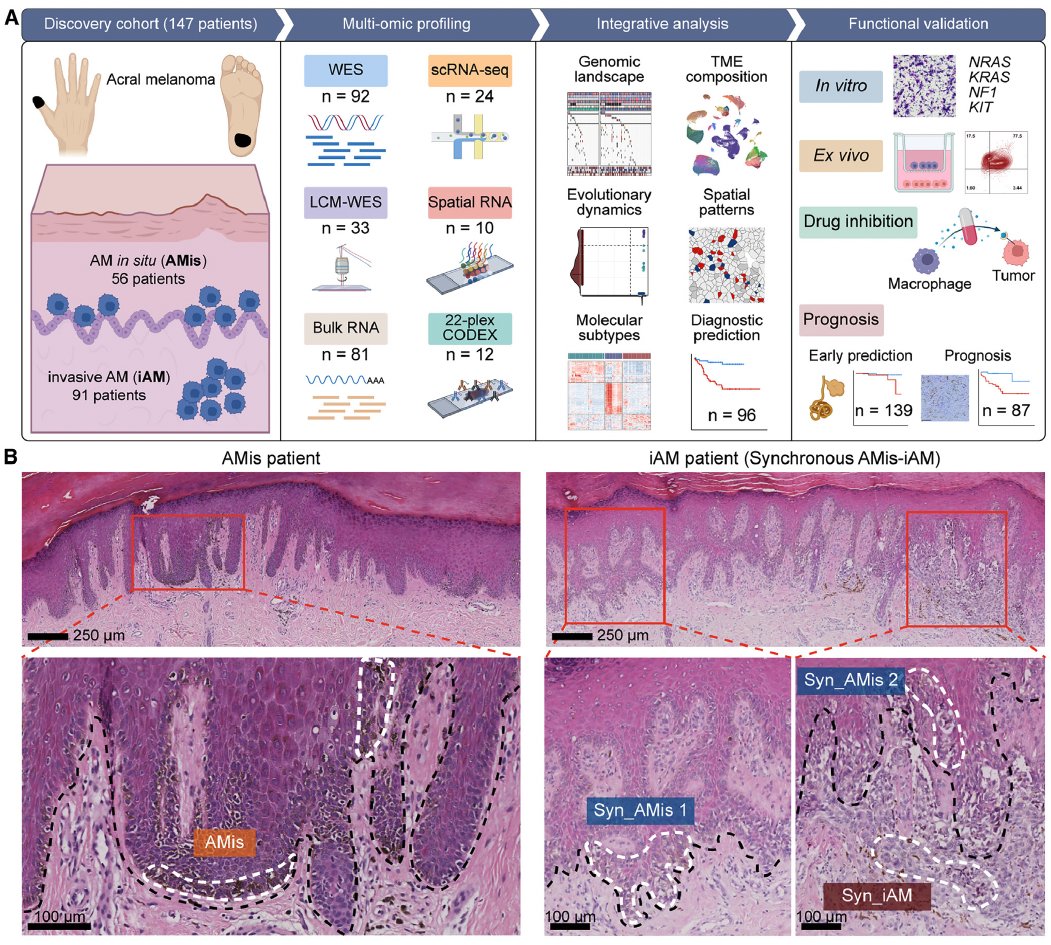
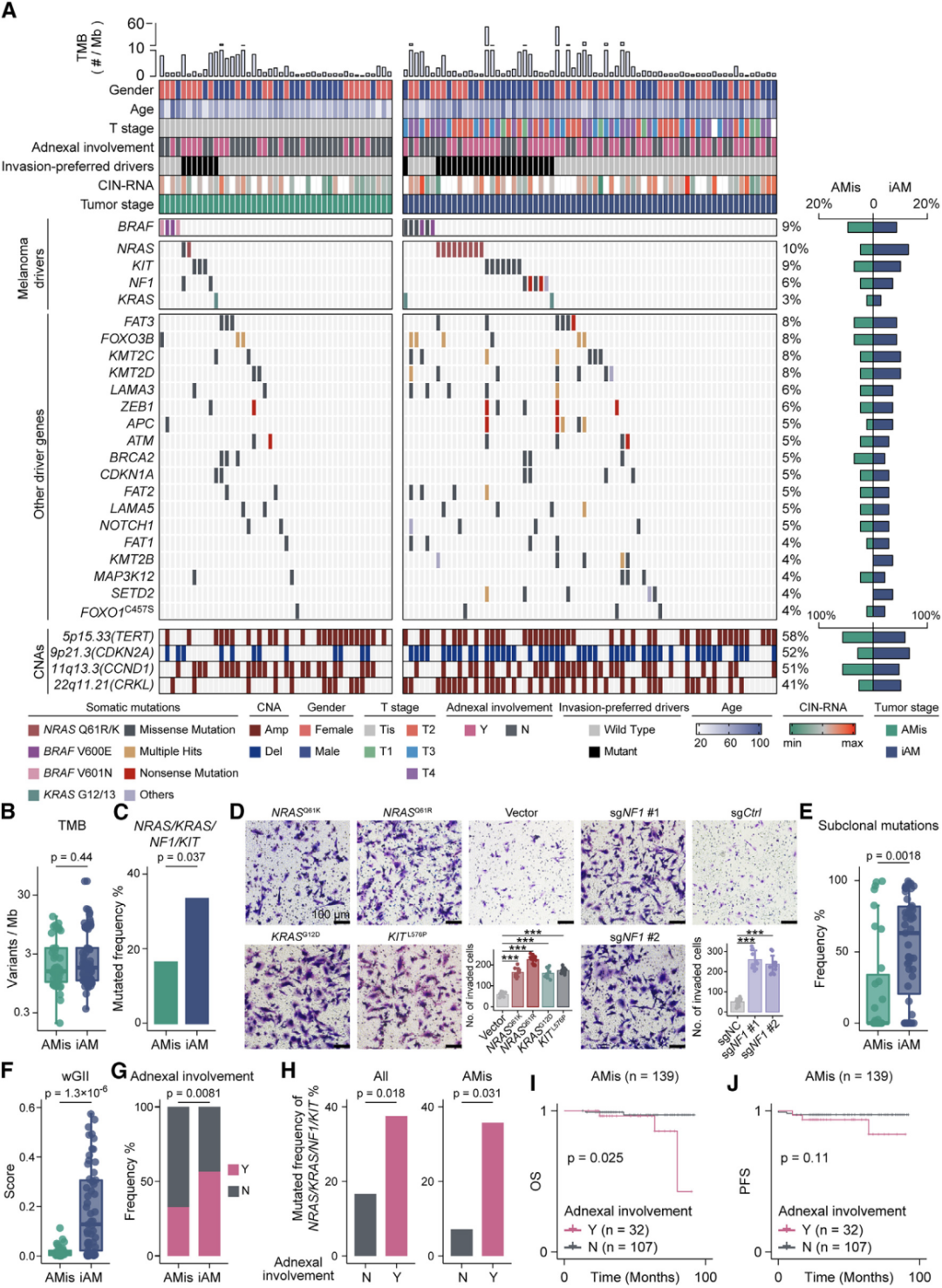
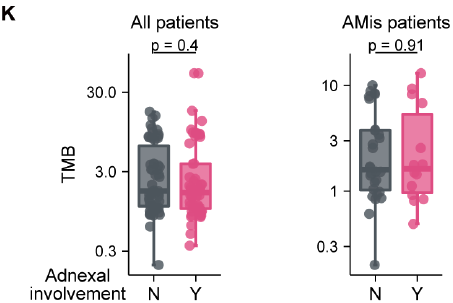
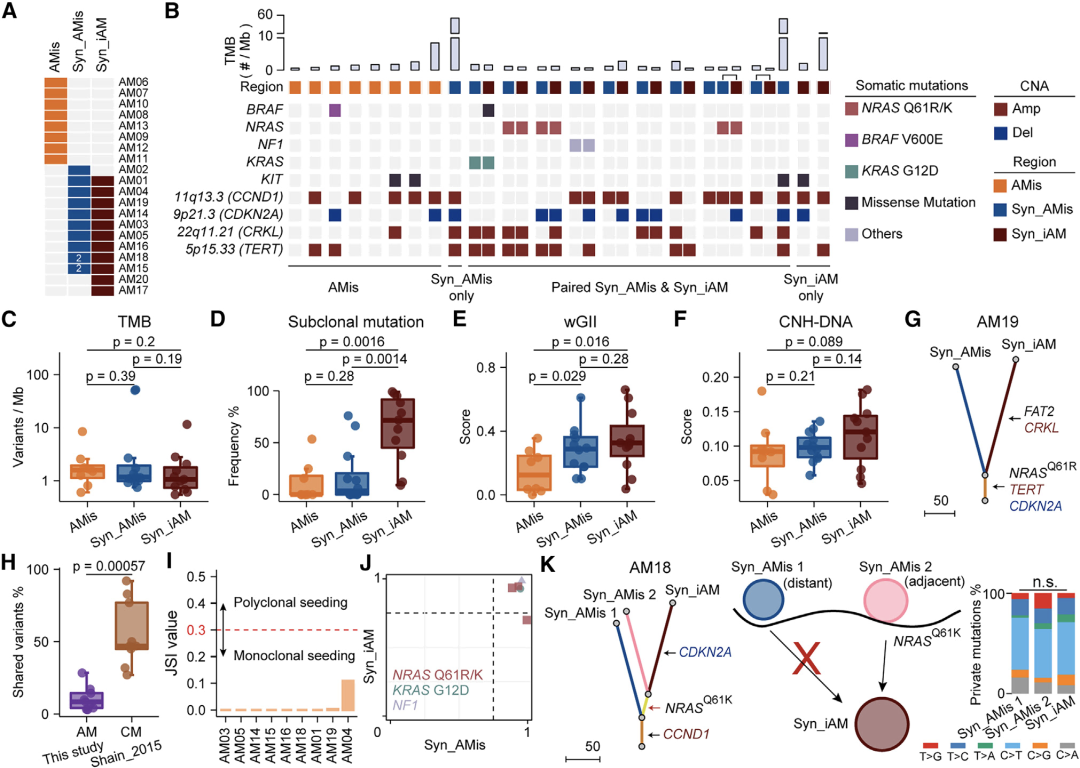
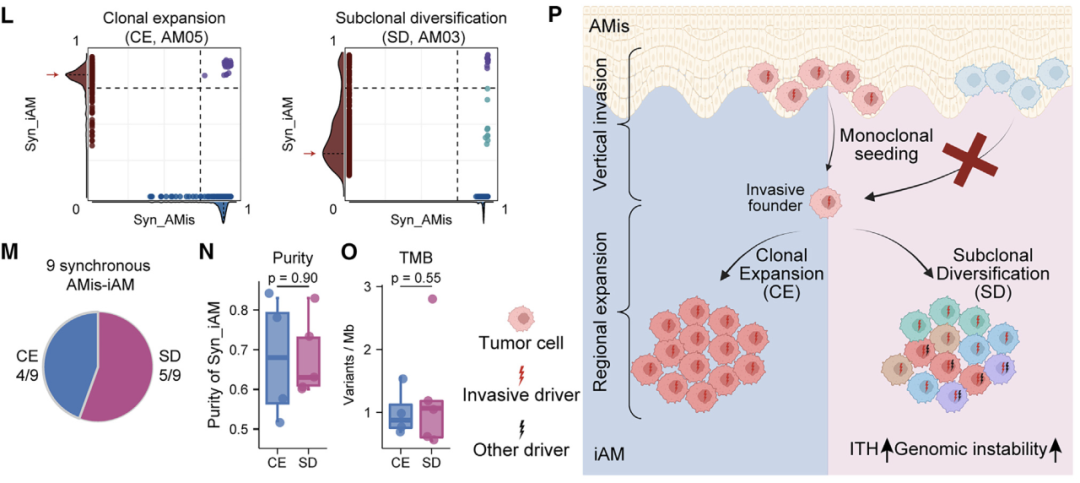
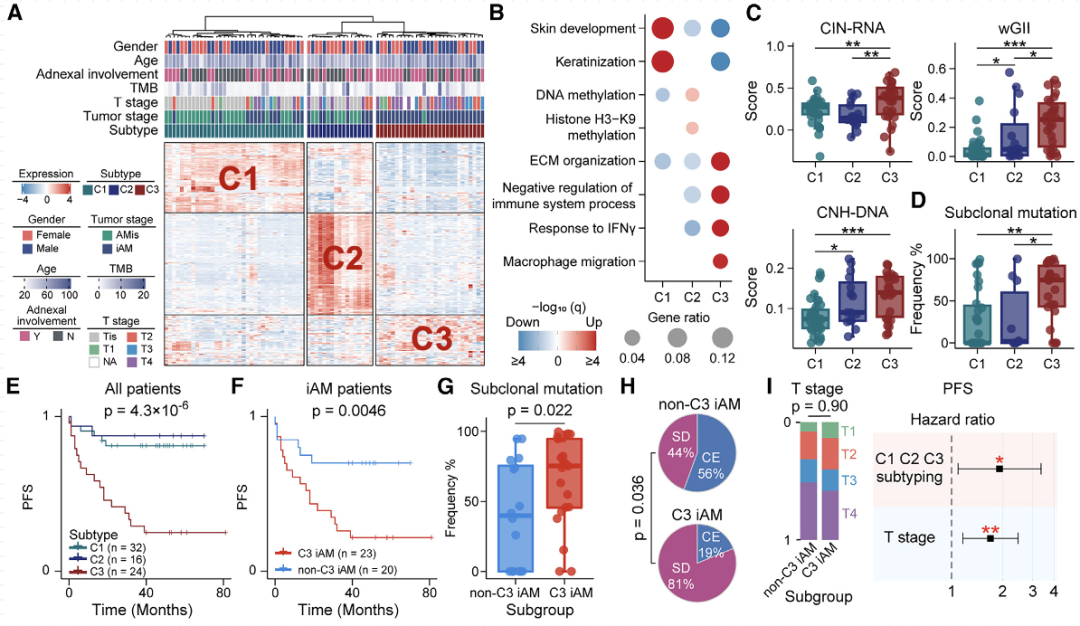
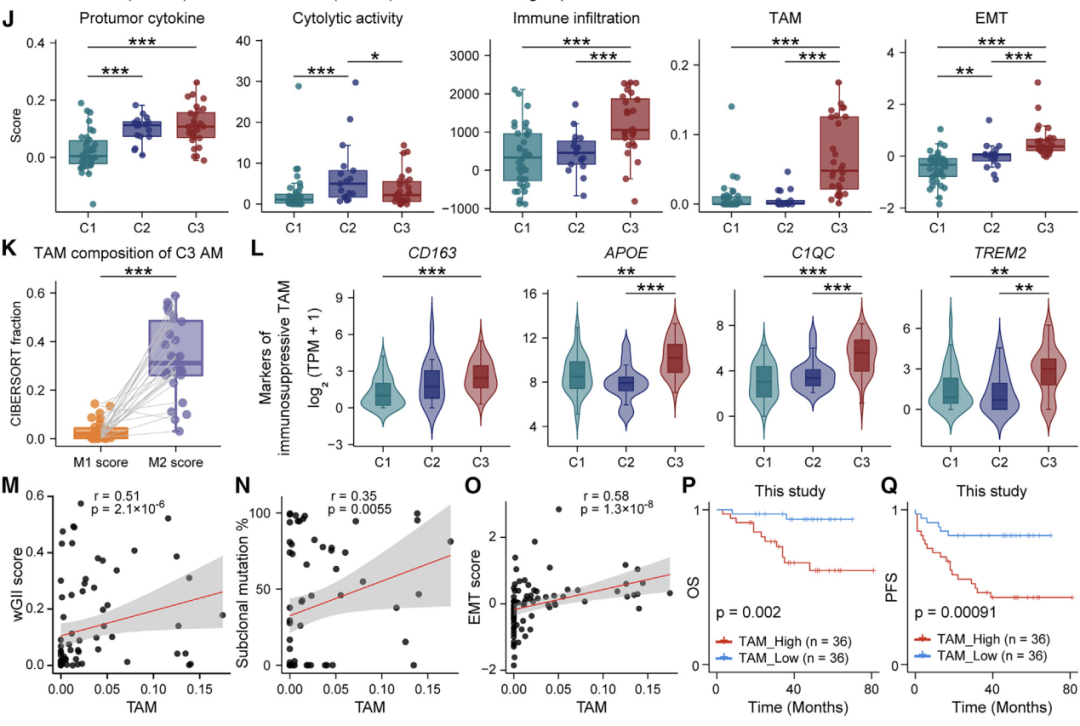
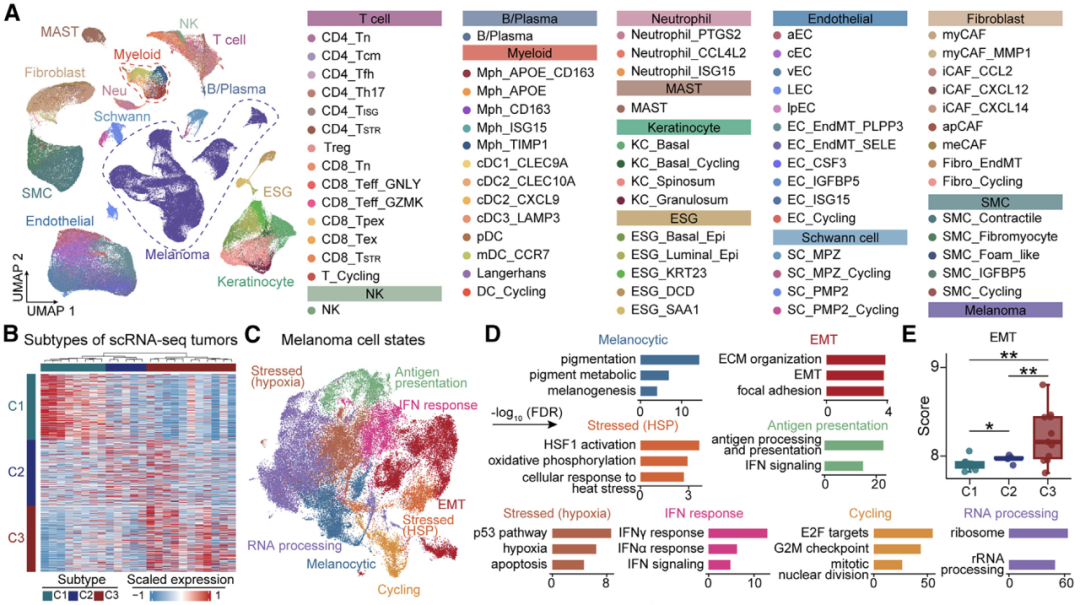
通过结合六种组学数据,研究人员剖析了早期AM(原位肢端黑色素瘤)的进化动力学和空间结构。他们证明,在表现出亚克隆多样化和预后较差的一部分iAM(浸润性性肢端黑色素瘤)患者中,APOE+/CD163+巨噬细胞通过IGF1-IGF1R相互作用促进肿瘤上皮间质转化(EMT),这提供了一个潜在的治疗靶点。 本文亮点: 1、侵袭偏好驱动因素和附件受累可预测原位肢端黑色素瘤AMis(in situ acral melanoma)的早期侵袭。 2、 亚克隆多样化加速了侵袭性肢端黑色素瘤iAM(invasive acral melanoma)的区域进展。 3、APOE+/CD163+巨噬细胞通过IGF1-IGF1R相互作用促进肿瘤EMT。 4、APOE和CD163染色是AM的预后生物标志物。 总结: 在肢端黑色素瘤(AM)中,从原位(AMis)进展到侵袭性AM (iAM)导致生存率显著降低。然而,在这个过程中的进化动力学仍然是难以捉摸的。研究人员利用基因组学、体细胞和单细胞转录组学以及空间转录组学和蛋白质组学,报告了147个AM的分子和空间综合特征。从AMis到iAM的垂直入侵显示出一种早期的单克隆播种模式。随后的区域扩张表现为克隆扩张和亚克隆多样化两种不同的模式。值得注意的是,分子亚型分析显示,侵袭性iAM亚群具有亚克隆多样化、上皮-间质转化(EMT)增加和APOE+/CD163+巨噬细胞空间富集等特点。体外和离体实验进一步证明APOE+/CD163+巨噬细胞通过IGF1-IGF1R相互作用促进肿瘤EMT。附件受累可预测具有较高侵袭潜力的AMi,而APOE和CD163可作为iAM的预后生物标志物。总之,这些研究结果为AM的早期检测和治疗提供了启示。 主要研究方案: 主要结果: 1、发现队列及基因组概览 (1)发现队列:共纳入147名患者,包括AMis(n=56)以及iAM(n=91),分别进行全外显子测序(WES)、单细胞转录组测序、空间转录组测序、转录组测序以及CODEX检测(图A) (2)病理结果显示,许多iAM肿瘤在表皮中含有恶性细胞,表现为AMis病变,这些肿瘤也可以称为同时存在AMis-iAM (3)LCM-WES:包括来自12例患者的12个Syn_AMis 以及11 个Syn_iAM区域,以及8例纯AMis患者的8个AMis区域(图B) 2、比较AMis和iAM的基因组,确定侵袭偏好驱动因素 为了确定驱动AM垂直侵袭的深层原因,我们比较了AMis和iAM样本之间的基因组图谱(图A)。结果显示,肿瘤突变负荷(TMB)相当,AMis或iAM 中没有显着富集的单一突变;但是通过基因组合筛选发现iAM样本中四个驱动基因(NRAS、KRAS、NF1 或 KIT)的突变频率显着较高(图B-C)。接下来,通过诱导热点突变(包括NRASQ61K、NRASQ61R、KRASG12D和KITL576P)以及独立敲除NF1均增强了AM细胞系LM-MEL-45的侵袭性,支持了侵袭偏好驱动因素的功能作用(图D)。同时,对比亚克隆突变的百分比,来评估肿瘤内异质性的程度 (ITH),ITH越高,其侵袭性越强(图E)。由于基因组稳定性是ITH的主要来源,接下来使用三个独立指标量化基因组不稳定性的水平,包括加权基因组完整性指数 (wGII) 得分、染色体拷贝数异质性得分 (CNH-DNA) 和染色体不稳定性得分 (CIN-RNA)。结果提示,与AMis相比,iAM表现出更高的基因组不稳定性(加权基因组完整性指数 (wGII) 得分更高(图F))。进一步,对转录组数据进行对比分析,发现iAM中高度富集细胞外基质(ECM)形成、EMT、KRAS信号、巨噬细胞迁徙及IFNγ信号通路,表明AM侵袭过程中存在TME的调控失常(图H-J)。 以上结果表明,高基因组不稳定性可能加速肿瘤发生,并促使AMis获得侵袭偏好驱动因素。此外,驱动基因突变、基因组不稳定性和TME的改变共同促进了AM的侵袭。 3、附件受累与AMis的高侵袭潜力相关 (1)为探索具有高侵袭潜力的AMis的临床预测因子,研究遍历了所有可用的临床变量。其中只有附件受累(指在小汗腺导管中存在恶性黑色素细胞)在iAM中明显富集(图G)。 (2)尽管两者的TMB相当,在所有患者或者AMis患者中,具有附件受累的AM患者,其侵袭首选驱动因素的突变频率明显更高(图H及图K),表明附件受累可作为AMis侵袭潜能的病理预测因子。 (3)为验证这一结论,回顾性分析139例AMis,发现具有附件受累的AMis患者,其OS及PFS均更低(图I-J)。 4、AMis-iAM揭示了一种早期和单克隆的垂直侵袭模式 (1)基于LCM对多区域取样测WES(图A),对比AMis、Syn_AMis、Syn_iAM以及AMis-iAM的基因组差异,8例患者中,有5例表现出侵袭驱动基因突变,表明在发生垂直侵袭前,就已经存在侵袭驱动基因改变(图B); (2)与其他区域相比,Syn_iAM具有更高的亚克隆突变、ITH及基因组不稳定性(图C-F),这进一步证实了前面的结果,即ITH及基因组不稳定性可促进AM的侵袭; (3)系统发育树(AM19患者)结果表现出一条短的主干及两条长的分支,提示AM中的高度ITH(图G);其中主干的长度表征了共有突变的比例,AM的共有突变明显低于CM,结果表明由Syn_AMis转变为Syn_iAM过程中相对较早的基因组差异,这与AM患者预后比CM更差一致(图H) (4)JCI相似性指数可区分单克隆播种和多克隆播种(图I) 5、区域扩张过程中存在两种进化模式 为了探究区域扩张的进化模式,研究人员通过癌细胞分数(CCF)分析推断克隆组成。CCF结果表明,约81.8%的Syn_AMis病变区域表现出克隆扩张峰,然而仅44.4%的Syn_iAM病变具有亚克隆多样峰(图L-M)。在Syn_iAM中,可表征出两种不同的进化模式:CE,侵袭肿瘤中仍保留克隆特征;SD,侵袭肿瘤中存在亚克隆多样性(图N-O)。考虑到高ITH可以产生亚克隆驱动因子,研究推测SD途径更有助于获得促进区域扩张的驱动因子(图P)。 6、整合分析确定了三种分子亚型 通过进一步分析81例AM患者的bulk RNA-seq数据,经过聚类及功能分析,鉴别出3种分子亚型,即C1,C2和C3(图A);其中C1型表现出角蛋白基因升高、皮肤发育和角化途径以及少许MAPK信号活化,因此把该类型定义为角化型(图B);C2型表现出染色质重塑基因的上调(KMT2A and KMT2C)、DNA和组蛋白甲基化,因此该类型定义为染色质重塑型;C3型表现出EMT相关基因上调(TWIST2 and VIM)、ECM形成、巨噬细胞浸润信号通路以及高度增殖活性,因此,该类型定义为增殖型。同时,C1、C2型中混合有AMis及iAM,而C3型中以更多的iAM为主(图A-B)。 此外,C3型中CIN-RNA、wGll以及CHN-DNA分数均较高,提示该亚型肿瘤具有高度基因组不稳定性(图C),同时该亚型的亚克隆突变比例也更高(图D),以及C3型患者的OS和PFS都更差(图E),这也提示C3亚型肿瘤组织具有更为明显的恶性特征。通过与C1和C2型的iAM患者相比,C3型iAM患者的PFS(无病进展生存)时间更短,且具有明显的恶性细胞表型及亚克隆突变,同时SD途径的占比也更高(图F-H),这进一步证实C3-iAM型患者的预后更差。尽管T分期在non-C3-iAM与C3-iAM之间没有显著差异,提示AM的浸润深度可能与其预后没有必要相关性;同时,多变量联合分析发现,AM亚型是表征预后的独立因素(图I)。此外,C3型iAM中早期肿瘤(T1,T2)均已具有高度恶性表现及迅速进展,因此,通过生物标志物尽早筛查出C3型肿瘤具有重要意义。 7、三种分子亚型的肿瘤组织具有不同的TME组成 通过功能定量分析,发现3种不同的肿瘤亚型表现出一致的TME表型:C1:Low-immune(低免疫富集),C2:Immune Activated(免疫活化), C3:Immune Suppressed (免疫抑制)(图J-K)。相关性分析发现,TAM分数与基因组不稳定评分指标具有高度相关性(图M-O),同时TAM分数越高,其预后也更差(图P-Q),这与前述C3型中CIN-RNA、wGll以及CHN-DNA分数均较高,以及其OS和PFS都更差的结果一致。这些结果共同提示TAM浸润可能促进C3亚型的肿瘤EMT和基因组不稳定性,导致预后不良。 8、scRNA-seq鉴别出APOE+/CD163+巨噬细胞亚型 为进一步解析AM的肿瘤及TME异质性,对8例AMis和16例iAM患者的肿瘤组织进行了单细胞测序。根据每个亚型的特征基因,鉴别出了前述的三种亚型(C1、C2和C3)(图A-B),并将恶性细胞分为8种细胞状态(图C-D),与bulk结果一致,C3型肿瘤同样表现出更高的EMT分数。通过对TAM细胞进行再分群,共得到5个亚群(图F)。极化分析发现Mph_APOE_CD163、 Mph_CD163和Mph_APOE均是免疫抑制性TAM,因此统一命名为APOE+/CD163+ TAM。 结果发现,APOE+/CD163+ TAM在C3型肿瘤中高度富集,且比例与EMT分数呈正相关(G-H,该结果在公开AM数据集中进一步得到验证);同时配体-受体分析发现APOE+/CD163+ TAM表现出较高的细胞间互作及自身募集信号。结果提示,APOE+/CD163+ TAM 可能通过EMT相关信号通路(TGFB1-TGFBR2, TNF-TNFRSF1B及IGF1-IGF1R)来促进肿瘤细胞的表型转变(图J-K)。 9、空间转录组学分析证实了APOE+/CD163+ TAM与EMT肿瘤细胞之间的直接接触和密切相互作用 为进一步验证APOE+/CD163+ TAM与EMThigh肿瘤细胞之间的空间分布,对10例AM肿瘤样本进行空间转录组测序(图A-B)。结果显示,在C3型肿瘤样本中,肿瘤区域由EMThigh的肿瘤细胞组成,且伴有APOE+/CD163+ TAM的浸润;相反,non-C3型肿瘤中,并不存在这两类细胞的共同浸润(图C-D);同时,在前者中,APOE+/CD163+ TAM与EMT肿瘤细胞的距离较非EMT肿瘤细胞的距离也更近(图E)。细胞间互作分析发现,C3型样本中, APOE+/CD163+ TAM无论是受体还是配体的活化程度均更高,进而证实了其细胞间的高度互作(图F)。 此外,与其他免疫细胞相比,APOE+/CD163+ TAM表现出最高水平的IGF信号通路,作为发送者(sender)和影响者细胞(influencer),这与scRNA-seq中发现IGF1-IGF1R通路可能调控APOE+/CD163+ TAM与EMT肿瘤细胞之间的互作结果一致(图G) 10、CODEX验证APOE+/CD163+ TAM与EMT肿瘤细胞之间的互作 为在蛋白组学上验证二者之间的表达情况,研究人员利用可以实现同一样本50种以上的蛋白标记物的检测及深度分析,并且可以提供单细胞水平的高分辨率图像的蛋白组学分析平台(CODEX),对12例AM样本进行多指标染色,验证APOE+/CD163+ TAM与EMT肿瘤细胞的空间分布以及互作情况(图A)。在C3型样本中,肿瘤区域仍以EMT肿瘤细胞为主;然而,non-C3型样本中主要为non-EMT肿瘤细胞(图B);样本内分析发现,APOE+/CD163+ TAMs与EMT肿瘤细胞之间存在正相关(图C)。此外,IGF1及IGF1R在C3型样本中均明显高表达(图D);在C3型样本AM138患者中,同时存在EMThigh和EMTlow区域,有利于进行患者内部比较(图E-G)。这些结果验证了在单细胞和ST水平上的观察结果,支持APOE+/CD163+ TAM可能通过IGF1-IGF1R相互作用促进肿瘤细胞的EMT。 11、体内外实验验证APOE+/CD163+ TAM通过IGF1-IGF1R相互作用促进肿瘤EMT (1)从外周血和肿瘤组织中,解离分选出巨噬细胞,其中APOE+/CD163+ TAMs 在肿瘤组织中高度富集(图A) (2)从健康供体中,分选出单核细胞与AM肿瘤细胞系(LM-MEL-45)进行共培,结果发现APOE+/CD163+ TAMs 从day 0 的1.2% 迅速扩增至day 14 的73.5%(图B) (3)bulk RNA-seq分选发现随着时间进展,与对照组相比,共培细胞系中高表达APOE+/CD163+ TAMs相关标志基因;且GSEA分析发现Day14的巨噬细胞具有APOE+/CD163+功能特征(图C-D),其基因表达情况在蛋白层面也得到了验证(图E) (4)在体外实验验证,C3型肿瘤样本中EMT+肿瘤细胞比例明显高于non-C3型肿瘤(图F) (5)通过对比APOE+/CD163+ TAMs共培的LM-MEL-45细胞与单纯肿瘤细胞,前者肿瘤细胞中间质标志基因(CDH2,TWIST1/2, SNAI1/2)明显上调,且EMT功能也显著富集(图G-H) (6)通过ELISA验证APOE+/CD163+ TAM分泌IGF1(图I-J);此外,通过应用IGF1抑制剂xentuzumab、IGF1R抑制剂linsitinib或敲除肿瘤细胞中的IGF1R来抑制这种相互作用,可以显著降低N-cadherin的表达,使肿瘤细胞恢复圆形并重新表达E-cadherin(图K-L)以上结果证实了APOE+/CD163+ TAM可通过IGF1-IGF1R来促进肿瘤细胞的EMT。 12、APOE+CD163+染色是AM不良预后的生物标志物 基于前面的结果,促使研究人员进一步探究是否可以根据检测APOE、CD163的表达来预测AM的预后。通过对前述的96例AM样本分别进行APOE和CD163染色(图M)发现,与non-APOE+CD163+巨噬细胞相比,APOE+/CD163+巨噬细胞富集的患者,其5年PFS更差(90.5%,54.7%)(图N)。此外,在87例AM患者的验证队列中,发现了同样的生存预后差异(图O)。这些结果表明APOE和CD163染色可以作为AM患者预后的一种生物标志物。 讨论: 研究从剖析原位AMis到浸润性iAM的早期鉴别出发,利用多组学分析,发现附件受累是AMis具有高度侵袭性的重要临床指标,强调规律随访这类患者术后的情况以监测疾病进展的重要性; AM的动态进化过程目前仍不清楚,acral nevi(肢端痣)是AM前驱病变的一种特殊形式,有研究发现在肢端痣中BRAF突变频率高达 86%,表明肢端痣可能不是大多数AM的前驱病变,与本研究发现的侵袭偏好驱动因素也并不包括该基因结果一致; 研究发现了早期AM垂直侵袭的两种模式(CE,SD),其中,在区域扩张期间,SD过程可能是由高度的基因组不稳定性驱动; APOE+/CD163+ TAM可通过IGF1-IGF1R相互作用促进肿瘤细胞的EMT,为AM的诊断、预后及治疗提供了临床意义。 汇报人: 饶郁芳 合作导师:赵宇 李为民 审核:张宇阳 任建君