精读分享│【Advanced Science】:耳蜗毛细胞中过氧化物酶体缺乏通过下调BK通道引起听力损失
英文题目:Peroxisome Deficiency in Cochlear Hair Cells Causes Hearing Loss by Deregulating BK Channels
中文题目:耳蜗毛细胞中过氧化物酶体缺乏通过下调BK通道引起听力损失
期刊:Advanced Science(IF: 14.3)
单位:山东第一医科大学、东南大学
发表时间:2023年07月


摘要:
过氧化物酶体是啮齿动物细胞中普遍存在的细胞器,在多种类型的细胞和组织中发挥重要作用。既往研究表明过氧化物酶体与听觉功能相关,过氧化物酶体生物发生障碍(PBDs)患者会出现听力障碍,但过氧化物酶体在听觉中的具体作用尚不清楚。本研究建立了两种过氧化物酶体缺乏小鼠模型(Atoh1-Pex5-/-和Pax2-Pex5-/-),发现过氧化物酶体主要在耳蜗毛细胞中发挥作用。此外,过氧化物酶体缺乏介导的听力损失与线粒体功能障碍和氧化损伤无关。尽管哺乳动物雷帕霉素靶蛋白1(mTORC1)的信号传导被证明是通过过氧化物酶体发挥作用的,但与野生型(WT)小鼠相比,Atoh1-Pex 5-/-小鼠中的mTORC1信号传导未观察到变化。然而,与野生型小鼠相比,Atoh1-Pex5-/-小鼠大电导、电压和Ca2+激活的K+(BK)通道的表达较少,并且给予BK通道激活剂(NS-1619和NS-11021)可恢复Pex5敲除小鼠的听觉功能。这些结果表明,过氧化物酶体通过调节BK通道在耳蜗毛细胞中发挥重要作用。因此,BK通道可能是治疗过氧化物酶体相关听力疾病(如PBDs)的靶点。
研究思路及方法:
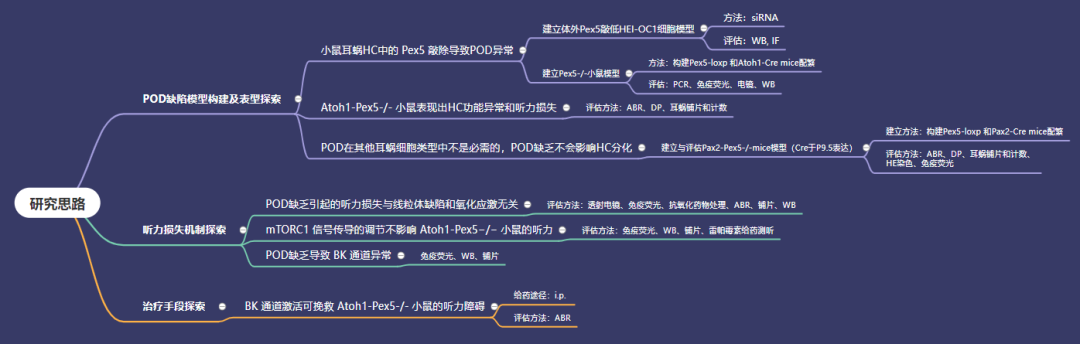
主要结果:
1、小鼠耳蜗毛细胞中Pex5 敲除导致过氧化物酶体异常
①建立体外Pex5敲低HEI-OC1细胞模型:本研究通过转染siRNA,实现了HEI-OC1细胞(一种小鼠耳蜗毛细胞系)中的Pex5的敲低。蛋白免疫印迹(WB)显示,Pex5相较于对照降低了84.7%,此外,ACOX1(过氧化物酶体关键酶/限速酶)也显著降低(图 1B,C);免疫荧光(IF)显示,同对照鼠相比,Pex5敲除小鼠出现明显的过氧化物酶体膜蛋白70(PMP70)信号的聚集(图 1D)。
②Pex5-/-小鼠模型的建立(Cre于E13.5表达):分别构建Pex5-loxp 和Atoh1-Cre 小鼠,杂交配繁,从而获得Pex5-/-小鼠模型。通过PCR鉴定小鼠基因型,从而确认模型为正确基因型(附图 1A);免疫荧光显示,Atoh1 Pex5−/−小鼠耳蜗毛细胞的免疫荧光结果与体外HEI-OC1细胞分析结果相同(图 1F);电镜结果显示敲除小鼠毛细胞中过氧化物酶体消失(图 1G);蛋白免疫印迹显示Pex5和ACOX1的水平显著降低,表明敲除小鼠过氧化物酶体出现功能受损(附图 1B-C)。
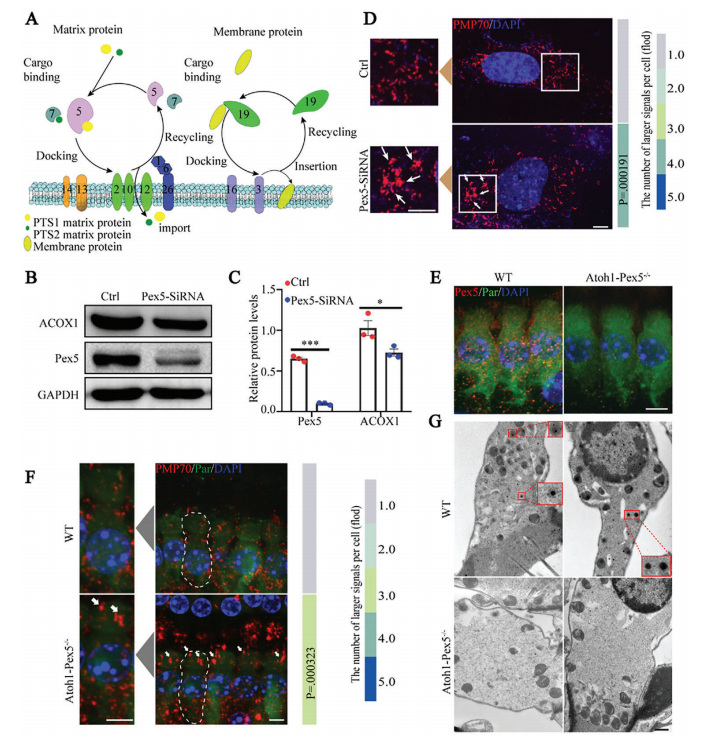
Figure 1. Pex5 knockout in mouse cochlear hair cells results in the absence of functional peroxisomes.
图1:敲除小鼠耳蜗毛细胞中的Pex5导致功能性过氧化物酶体缺失。
2、Atoh1-Pex5-/-小鼠表现出毛细胞功能异常和听力损失
①评估方法:ABR(听觉脑干诱发反应)、DPOAE(畸变产物耳声发射)、耳蜗铺片和计数。
②结果:Atoh1-Pex5-/-小鼠的ABR阈值升高、P1振幅下降、潜伏期延长,表明小鼠的内毛细胞(IHC)功能受损(图 2A-C),DPOAE阈值升高,表明外毛细胞(OHC)的功能也受损(图 2D)。
耳蜗毛细胞铺片显示Atoh1 Pex5−/−小鼠耳蜗OHC丢失(图 2E-F)
以上结果说明Pex5敲除导致的过氧化物酶体功能障碍的同时损害了IHC,OHC的功能,并导致毛细胞的丢失,从而损害听力。
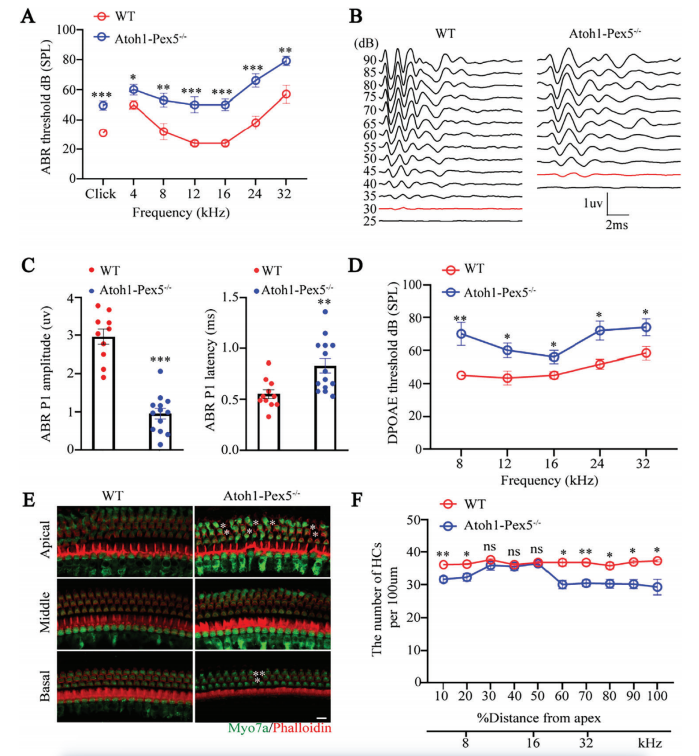
Figure 2. Abnormal hair cell function and hearing loss in Atoh1-Pex5−/− mice.
图2:Atoh1-Pex5-/-小鼠出现毛细胞功能异常和听力下降。
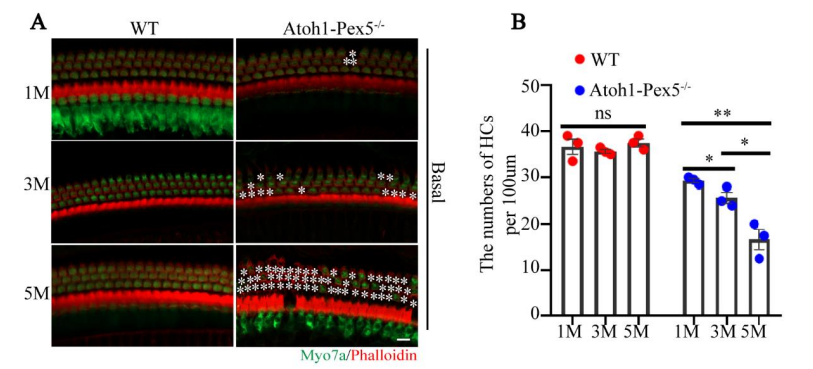
Supplemental Figure 2. Atoh1-Pex5-/- mice show increased hair cell loss with age.
附图2:Atoh1-Pex5-/-小鼠展示出毛细胞随着年龄的增长而减少。
3、过氧化物酶体缺乏不会影响毛细胞分化,且在其他耳蜗细胞类型中不是必需的——建立与评估Pax2-Pex5-/-小鼠模型(Cre于P9.5表达):
①建立方法:将 Pax2-Cre(Cre表达从E9.5开始)小鼠与 Pex5-loxp 小鼠杂交,生成 Pax2-Pex5−/−小鼠。
②评估方法:ABR、DPOAE、耳蜗铺片和计数、HE染色、免疫荧光
③结果:与野生型小鼠相比,Pax2-Pex5−/−小鼠的ABR和DPOAE阈值增加、I波振幅较低且潜伏期较长、毛细胞轻微丢失,与 Atoh1-Pex5−/−小鼠相比没有显著差异(图 3A-D;附图 3B-C)。
尽管 Pax2 和 Atoh1 分别在毛细胞分化之前和之后驱动 Cre 表达,但它们表现出相似的听力表型,说明过氧化物酶体对毛细胞分化无影响。
此外,Pax2-Cre在大多数含有过氧化物酶体的耳蜗细胞类型中驱动 Cre介导的重组,包括 SGN、StV、毛细胞和 SC(附图 3D)。
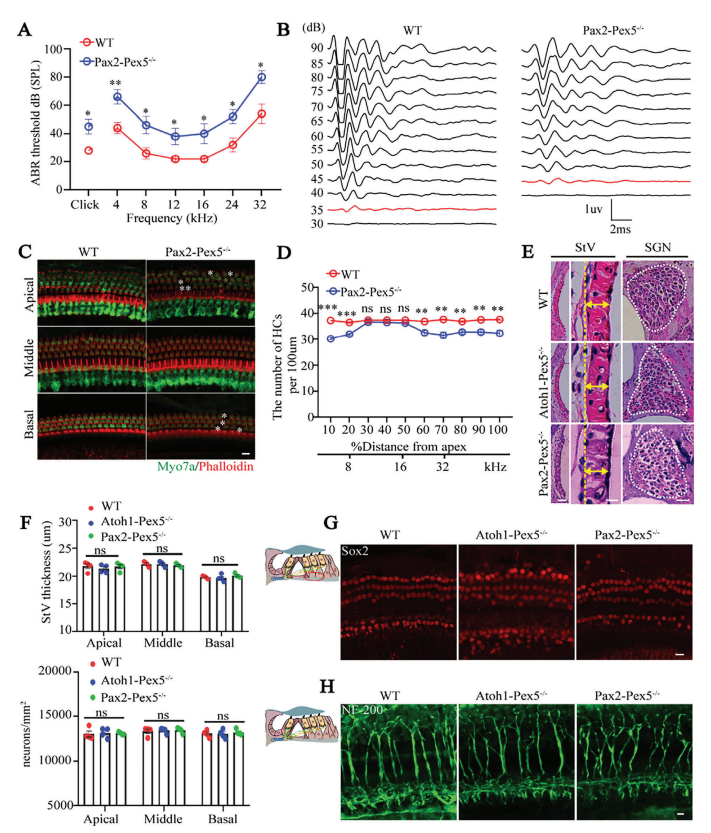
Figure 3. Peroxisomes function mainly in hair cells of the cochlea.
图3:过氧化物酶体主要在耳蜗毛细胞中发挥作用。
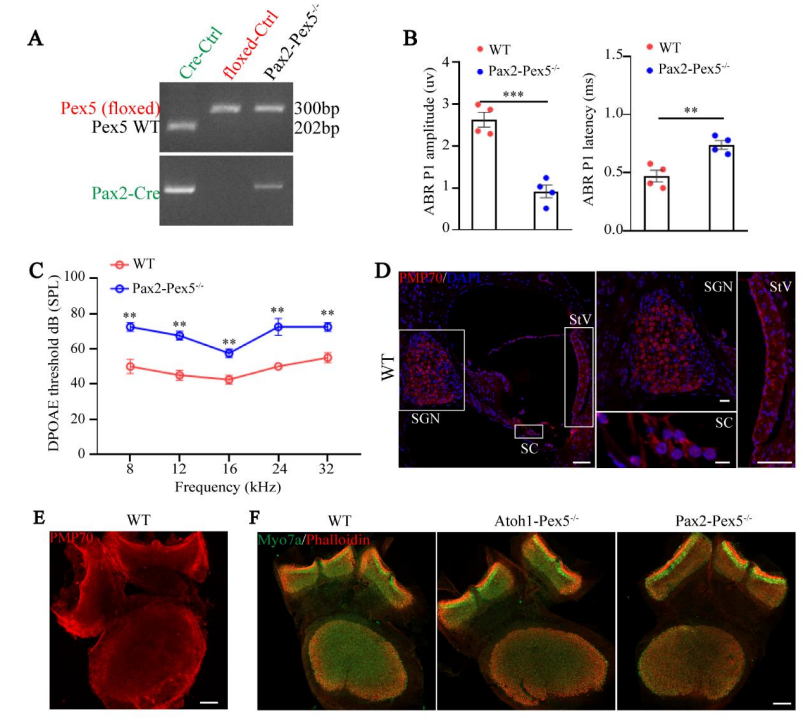
Supplemental Figure 3. The SGN, StV, and vestibule of Pax2-Pex5-/- mice are not affected.
附图3:Pax2-Pex5-/-小鼠的SGN、StV和前庭均未受到影响。
4、过氧化物酶体缺乏引起的听力损失与线粒体缺陷和氧化应激无关
①、评估方法:透射电镜、抗氧化药物N-乙酰半胱氨酸(NAC)给药前后免疫荧光对比、ABR、耳蜗细胞铺片与计数、WB
②、结果:
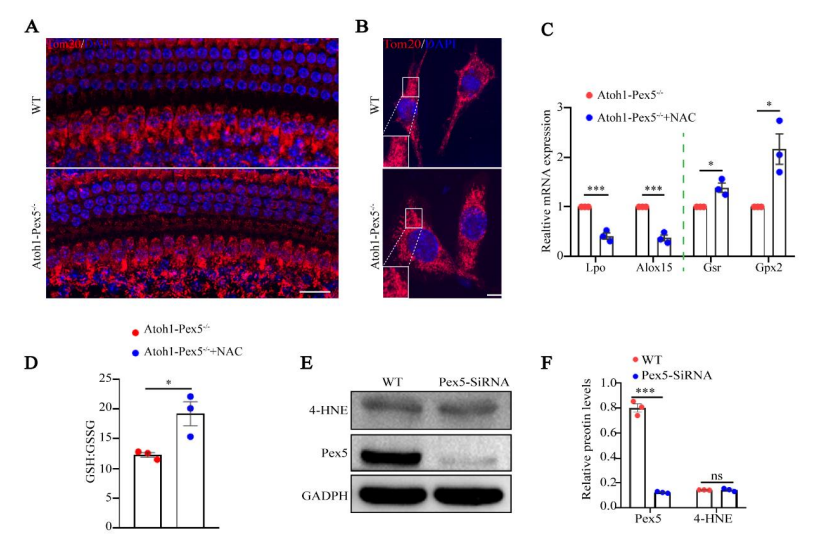
电镜和免疫荧光显示,Atoh1-Pex5−/−小鼠的线粒体形态和分布正常(附图 4A)。
透射电子显微镜 (TEM) 显示, Atoh1-Pex5−/−小鼠毛细胞中线粒体具有正常双膜和突出的嵴(图 4A)。
免疫荧光显示, Pex-/-小鼠毛细胞中4-HNE水平正常,未检测到氧化损伤(图 4B、C)
药物注射:Atoh1-Pex5-/-小鼠注射抗氧化药物NAC后,谷胱甘肽(GSH)和氧化谷胱甘肽(GSSG)的比值显著增加。抗氧化酶基因(如 Gsr 和 Gpx2)的表达量明显增加,而促氧化酶基因(如 Lpo 和 Alox15)的表达量则明显减少。这些结果表明,NAC处理增强了Atoh1-Pex5-/-小鼠耳蜗的抗氧化能力(附图 4C,D)。但是,NAC处理并不能挽救Atoh1-Pex5-/-小鼠的听觉表型(图 4D),而且NAC处理组与对照组小鼠的毛细胞数量没有明显差异(图 4E,F)。
与对照组相比,Pex5敲除 HEI-OC1 细胞的线粒体以及 Pex5 和 4-HNE 的水平也未观察到明显差异(附图 4E、F)。
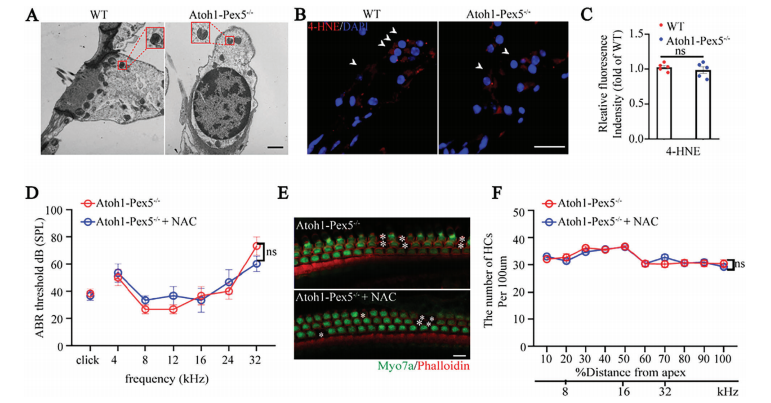
Figure 4. Hearing loss in Atoh1-Pex5−/− mice is not due to mitochondrial and oxidative damage.
图4:Atoh1-Pex5-/-小鼠的听力损失并非由线粒体和氧化损伤引起。
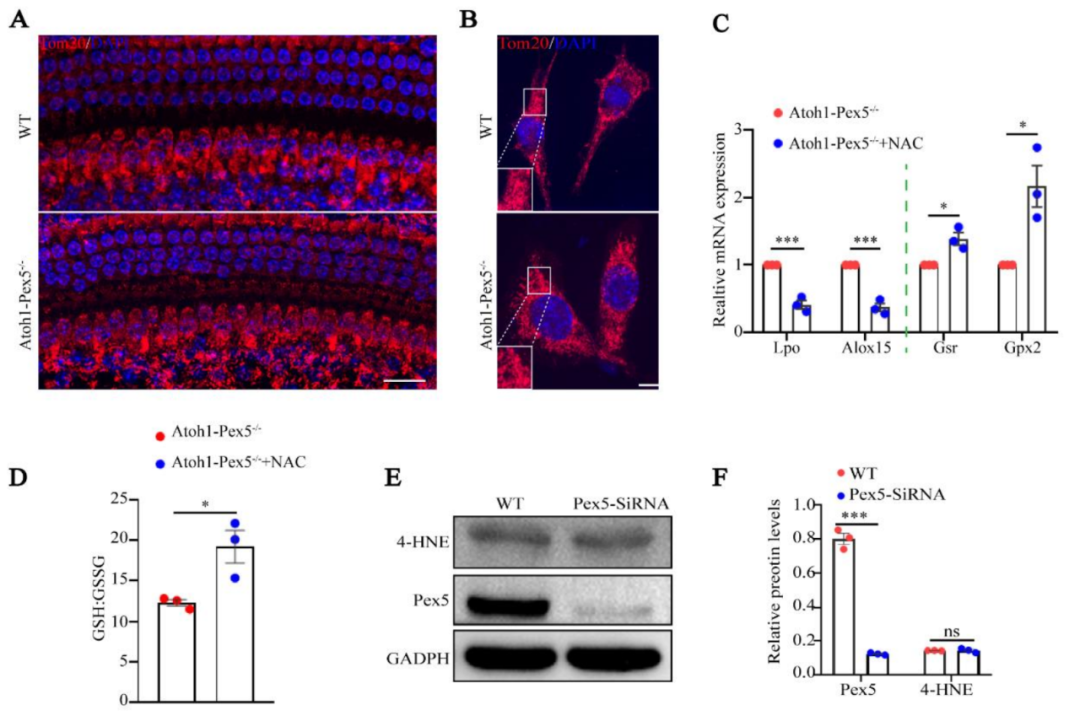
Supplemental Figure 4. Hearing loss in Atoh1-Pex5-/- mice is not related to mitochondrial and oxidative stress.
附图4:Atoh1-Pex5-/-小鼠的听力损失与线粒体和氧化应激无关。
5、mTORC1信号传导的调节不影响 Atoh1-Pex5−/−小鼠的听力
①之前表明过氧化物酶体参与听觉系统中mTORC1信号的调节,mTORC1信号的过度激活导致耳蜗毛细胞过早死亡。
②为了测试过氧化物酶体功能障碍对 mTORC1 信号传导的影响,研究者检测了235/256(P-S6)处的S6磷酸化水平(mTORC1的典型下游靶标),发现P-S6水平没有变化,表明Atoh1-Pex5−/−小鼠的听力损失可能与mTORC1信号传导无关(图 5A-B)。
③药物注射:腹腔注射雷帕霉素(1 mg/kg;一种mTORC1特异性抑制剂)治疗Atoh1-Pex5−/−小鼠时,与对照小鼠相比,观察到PS6水平降低了 89.8%,表明mTORC1显著降低Atoh1-Pex5−/−小鼠耳蜗中的水平(图 5C、D)。然而,与未治疗的Atoh1Pex5−/−小鼠相比,经过治疗的Atoh1-Pex5−/−小鼠的听力水平并未得到有效改善(图 5E),并且两组之间的毛细胞数量没有观察到显著差异(图 5F-G)
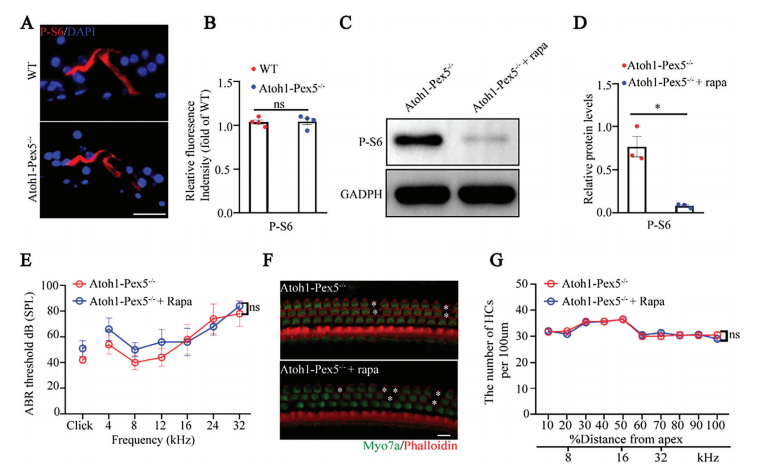
Figure 5. Hearing loss in Atoh1-Pex5−/− mice was not related to mTORC1 signaling.
图5:Atoh1-Pex5−/−小鼠的听力损失与mTORC1信号无关。
6、过氧化物酶体缺乏导致BK通道异常
①研究者分析了PMCA2、Prestin、KCNQ4几种具有毛细胞功能的经典蛋白的表达情况变化(图 6A),但在Atoh1-Pex5−/−小鼠中没有检测到这三种蛋白的表达和分布有任何变化(图6 B-D)。
②由于IHC功能受损或带状突触数量受损是ABR波I异常的最常见原因,假设这两个因素导致Atoh1-Pex5−/−小鼠的听力损伤。因此,研究者评估了 otoferlin(一种IHC胞吐标志物)、ctbp2(一种突触前带状标志物)和GluR2(一种突触后标志物),但发现这些蛋白在Atoh1-Pex5−/−小鼠的IHC中的表达和分布没有变化(附图 5A-E)。
③既往研究报道,过氧化物酶体对于缩醛磷脂的合成至关重要,而缩醛磷脂参与血管平滑肌细胞中BK通道的调节。值得注意的是,BK通道在耳蜗IHC信号转导过程中发挥着至关重要的作用,并且研究表明BK通道表达减少会导致ABR波I异常和DPOAE阈值升高;这些表型与Atoh1Pex5−/−小鼠的听觉表型相似。因此,研究者检查了Atoh1-Pex5−/−小鼠IHC中BK通道的表达,发现与对照小鼠(9.84 ± 1.72,n=270,来自三只小鼠的 IHC)相比,每个IHC中BK通道的a亚基在Atoh1-Pex5−/−小鼠中较低(2.85 ± 0.08,n=270,来自三只小鼠的IHC),(图 6G,H)。
总的来说,这些数据表明毛细胞中的过氧化物酶体缺陷导致BK通道表达减少,表明BK通道失调可能是Atoh1-Pex5−/−小鼠听力功能障碍的主要原因。
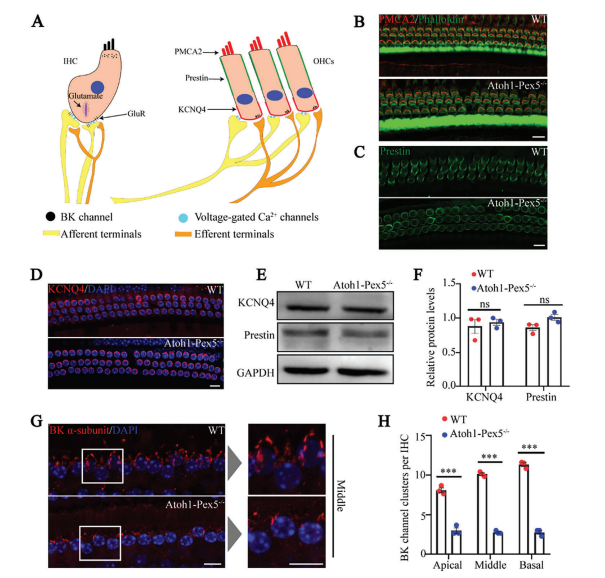
Figure 6. BK channel expression is decreased in cochlear hair cells of Atoh1-Pex5−/− mice.
图6:Atoh1-Pex5−/−小鼠耳蜗毛细胞中BK通道表达降低。
Supplemental Figure 5. The otoferlin expression pattern and the number of ribbon synapses are not affected in Atoh1-Pex5-/- mice.
附图5:Atoh1-Pex5-/-小鼠的otoferlin蛋白表达模式和带状突触数量不受影响。
7、激活BK通道可挽救Atoh1-Pex5-/- 小鼠的听力障碍
①用NS-1619(一种常见的BK通道激活剂)(图 7A)以无毒剂量(4 mg/kg)对Atoh1-Pex5-/-小鼠进行腹腔注射(图 7B),发现24小时后小鼠的ABR阈值显著降低,尤其是高频(24和32kHz)听力功能的恢复最为显著;与治疗前相比,NS-1619治疗后ABR 阈值降低了21.8±0.9 dB(图 7C)。这意味着 BK通道可能对哺乳动物的高频听力影响更大。
此外,Atoh1-Pex5-/-小鼠中ABR 波I的振幅和潜伏期在治疗后也恢复到正常水平(p<0.05,每组n= 5-13)(图 7E)。
②为了进一步确认听力损失确实是由BK通道失调引起的,以无毒浓度(0.5 mg/kg;附图 6A)的另一种常见BK通道激活剂NS-11021治疗Atoh1-Pex5−/−小鼠,发现该药也有效地挽救了小鼠的听力损失(图 7D-F)。
③与NS-1619(短声刺激和4−32 kHz时的ABR阈值)相比,NS-11021(短声刺激和4−32 kHz时的ABR阈值分别降低了15.3 dB和17.2±9.2 dB)在听力方面表现出更好的挽救潜力,其治疗后32 kHz 分别降低了7.4 dB和13.3 ± 5.2 dB),这可能归因于NS-11021更好的特异性和效用。
④BK激活剂对Atoh1-Pex5-/-小鼠听觉功能的恢复不是永久性的,有效时间约为4天(附图 6B)。
总之,过氧化物酶体缺乏引起的听力损失是由于BK通道失调所致,可以通过BK通道激活剂来改善。
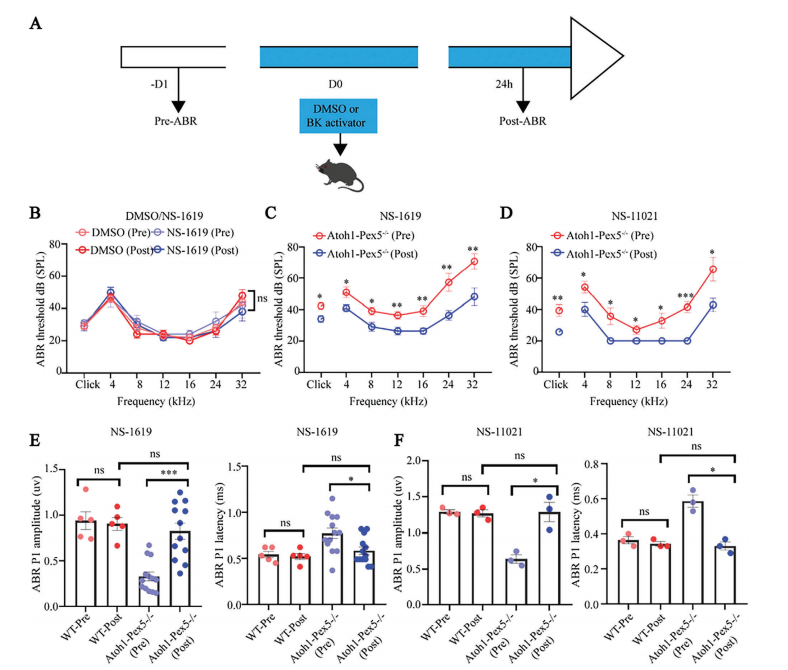
Figure 7. Activation of BK channels rescues hearing in Atoh1-Pex5−/− mice.
图7:激活BK通道可挽救Atoh1-Pex5-/-小鼠的听力障碍。
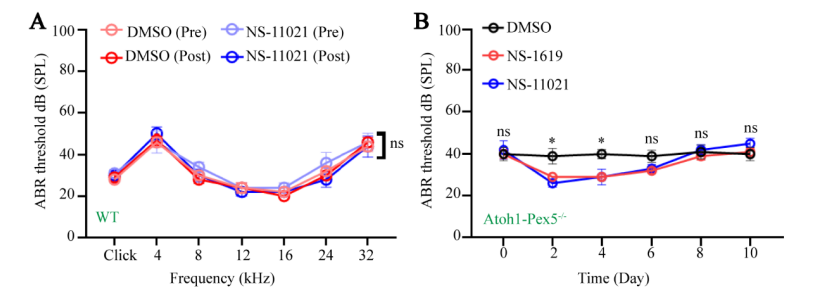
Supplemental Figure 6. Determination of BK activator drug duration in Atoh1-Pex5-/-mice.
附图6:Atoh1-Pex5-/-小鼠中BK激活剂药物持续时间的测定。
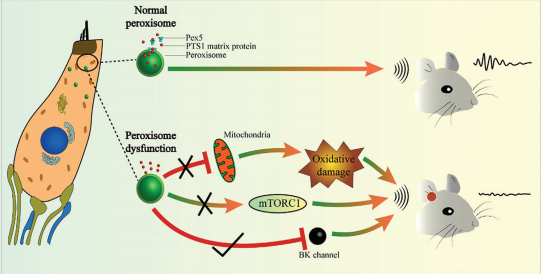
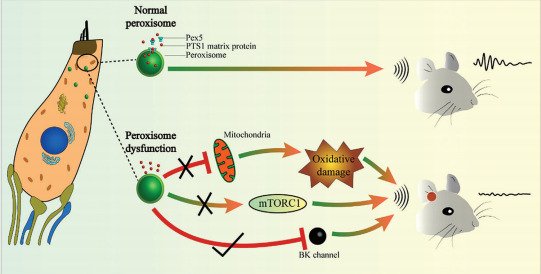
Figure 8. Model of peroxisome dysfunction in cochlear hair cells that leads to hearing loss. Hearing loss caused by peroxisome dysfunction in cochlear hair cells is not dependent on mitochondrial and oxidative stress pathways but on the down-regulation of BK channel expression. Activation of BK channels rescues hearing in mice containing hair cells with dysfunctional peroxisomes.
图8:导致耳聋的耳蜗毛细胞过氧化物酶功能障碍模型。由耳蜗毛细胞过氧化物酶体功能障碍引起的听力损失并不依赖于线粒体和氧化应激途径,而是依赖于BK通道表达的下调。激活BK通道能够挽救含有功能失调的过氧化物酶体毛细胞的小鼠的听力。

汇报人: 谢尔杰
导师:唐玥玓
审核:任建君 毛敏姿



