精读分享│【ADVANCED SCIENCE】:读写障碍相关性听力损失主要是通过螺旋神经节神经元的异常自发电活动引起的
英文题目:Dyslexia-Related Hearing Loss Occurs Mainly through the Abnormal Spontaneous Electrical Activity of Spiral Ganglion Neurons
中文题目:读写障碍相关性听力损失主要是通过螺旋神经节神经元的异常自发电活动引起的
期刊:ADVANCED SIENCE(IF:15.1)
单位:东南大学生物电子学国家重点实验室,中大医院耳鼻咽喉头颈外科,生命科学与技术学院生命健康高等研究院,江苏省生物医药高技术研究重点实验室;山东第一医科大学医学科学技术创新中心,山东省医学科学院
发表时间:2023年4月

摘要
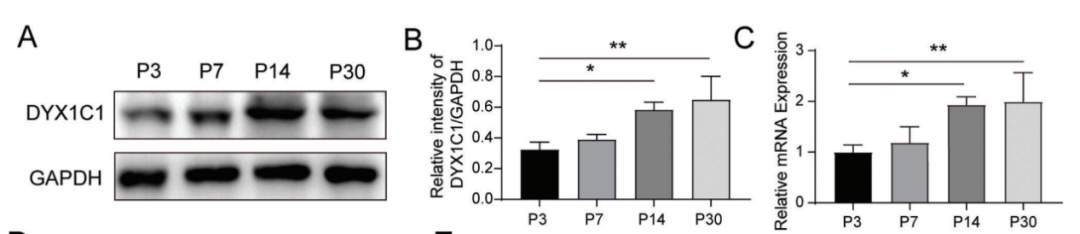
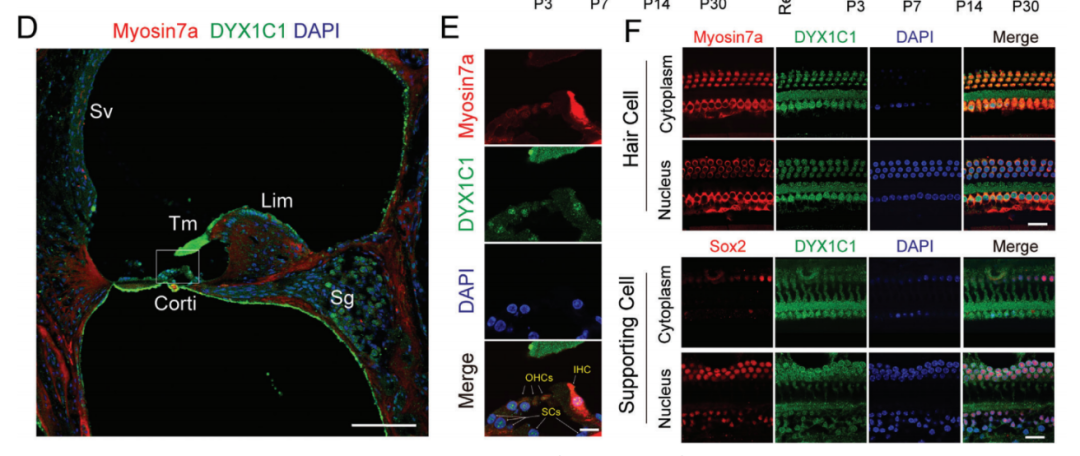
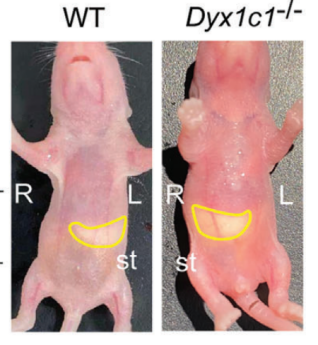
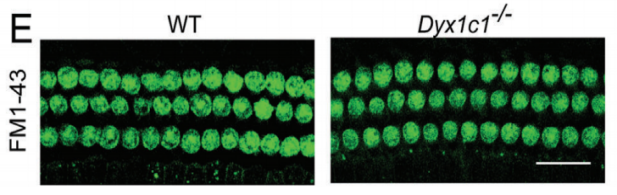
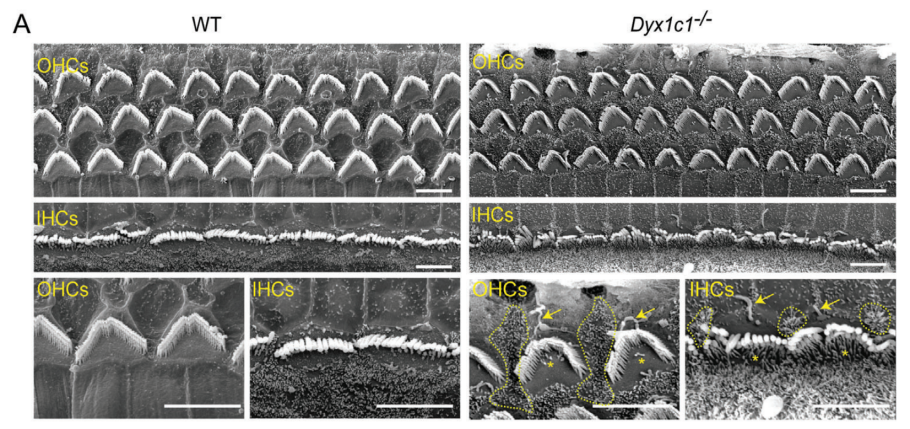
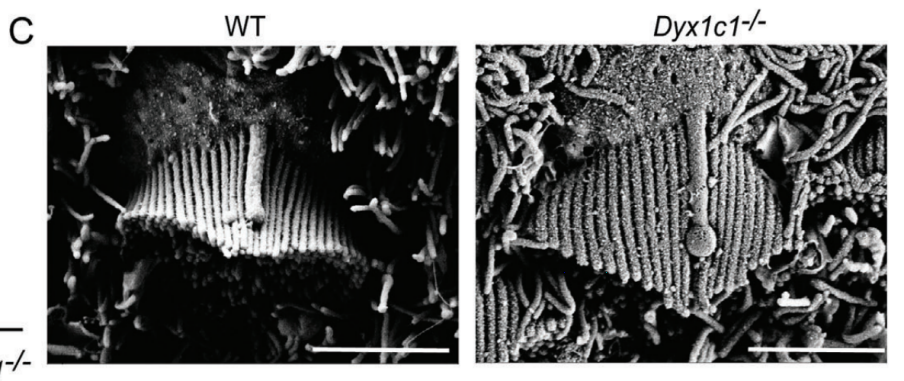
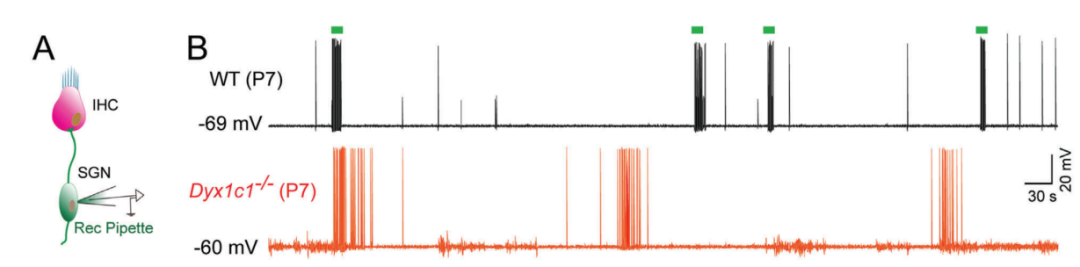
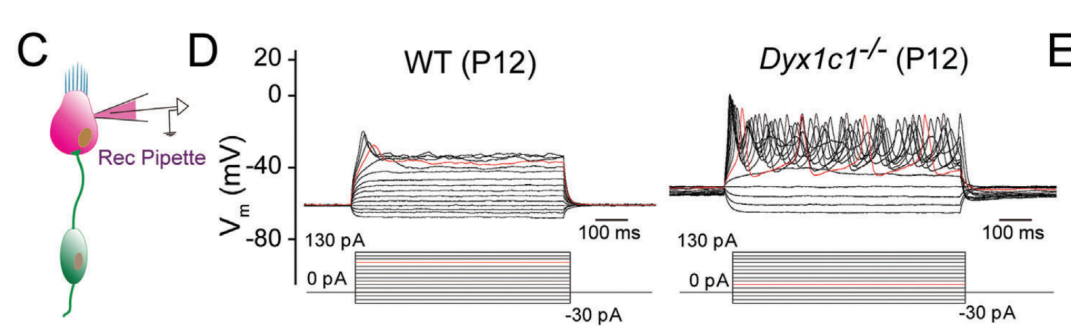
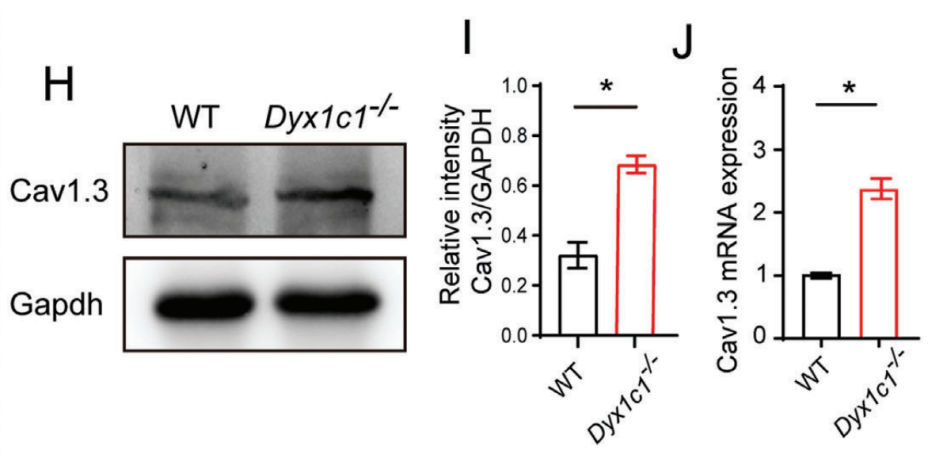
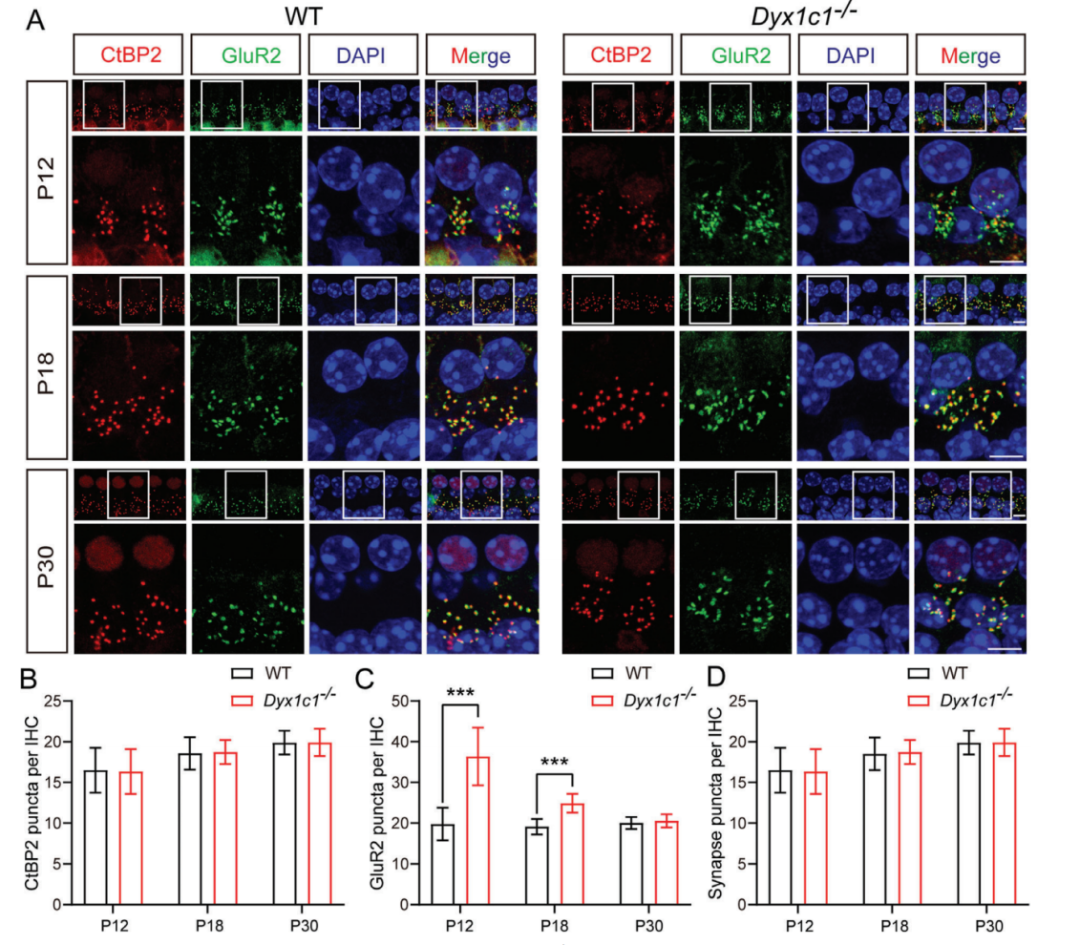
读写障碍是一种由于神经发育异常导致的阅读和拼写障碍,偶尔也会伴有听力损失,但相关听力损失的原因仍不清楚。本研究发现,在小鼠体内敲除研究读写障碍的最佳候选基因--读写障碍易感性 1 候选 1 基因(Dyx1c1-/-)会导致严重的听力损失,因此是研究读写障碍相关听力损失(DRHL)机制的良好模型。这项研究发现,Dyx1c1基因在小鼠耳蜗中高度表达,Dyx1c1-/-小鼠耳蜗中内毛细胞和I型螺旋神经节神经元的自发电活动发生了改变。此外,Dyx1c1-/-小鼠还出现了原发性睫状肌运动障碍相关表型,如坐位倒错和睫状肌结构紊乱。总之,这项研究为详细了解DRHL的发病机制提供了新的视角,并表明Dyx1c1可能是临床诊断DRHL的潜在靶点。 背景 耳聋是一个复杂的疾病,由许多因素引起,如遗传、机械损伤、年龄、噪音和耳毒性药物。全球聋人数量已达到4.66亿,而且还将继续增加。预计到2050年,这一数字将达到9亿。耳蜗毛细胞(HCs)是听觉系统中重要的机械感受器,能将机械声信号转换成电信号,然后由螺旋神经节神经元(SGNs)传输到听觉皮层进行信息处理。在任何一个步骤出现缺陷都可能导致严重的听力丧失。目前,确定各种人类疾病所致耳聋的发病机制仍然是一个严峻的挑战。 读写障碍是一种常见的学习障碍,其特征是听觉/语音缺陷。尽管患者具有正常的智力和教育机会,但他们在阅读和语音理解方面仍不及正常发育的儿童。读写障碍不能简单地用遗传疾病来解释。目前认为读写障碍是由环境和遗传的相互作用引起的,遗传因素可占疾病的60%。大约有5%–18%的全球人口患有不同程度的读写障碍,因此,对读写障碍特征的全面分析对于治疗患者至关重要。读写障碍的临床症状主要包括言语处理缺陷、短期工作记忆和快速自动化命名,这为读写障碍的发病机制提供了理论基础。根据先前的报告,人类ROBO1基因广泛区域的一个新的内含子单核苷酸变异(SNV)和三个新的基因间单核苷酸变异(SNV)引起读写障碍,ROBO1突变患者显示出语音意识、短期记忆和听觉处理方面的缺陷。随后发现,DCDC2基因在负责流利阅读的脑区中表达,并且DCDC2基因突变会破坏神经发育并导致一系列的读写障碍症状。此外,在KIAA0319基因中的18个SNP中,有四个与读写障碍显著相关。综合这些研究结果表明,读写障碍是与多种病理情况相关的复杂临床综合征,包括神经发育障碍。 读写障碍患者可能表现出异常的听觉脑干反应(ABR)。先前的研究记录了五名读写障碍患者500 Hz短纯音的早期诱发ABR,结果显示读写障碍患者表现出异常的早期诱发响应波形。这些读写障碍患者甚至在70 dB的强刺激条件下也无法检测到ABR波形,表明存在严重的听力损失。然而,一些研究人员检查了24名完全无法阅读和书写的读写障碍患者的ABR阈值,却没有发现任何听觉脑干功能异常的证据。这些不同的结论似乎可以通过遗传异质性来解释,因此读写障碍相关听力损失(DRHL)的病因需要进一步探讨。研究人员对20名读写障碍儿童进行了声学刺激实验,测试主体是否对声音信号做出正确反应。当声音刺激以较慢的速率给出时,患者与正常受试者之间没有差异,但是当连续刺激之间的间隔缩短时,读写障碍患者显示出更多的错误反应,表明读写障碍患者在快速听觉处理方面存在缺陷。随后,对10名成年读写障碍患者和20名对照受试者使用短点击间隔进行了快速听觉处理的检查,发现读写障碍成年患者在快速听觉处理方面存在缺陷。到目前为止,读写障碍相关听力损失是否与读写障碍相关的异常快速听觉处理有关尚不清楚。虽然人们长期以来一直关注读写障碍与听力之间的关系,但对读写障碍患者中DRHL的特征和机制尚无报告,因此迫切需要探索读写障碍患者的听力损失机制。 第一个读写障碍易感基因Dyx1c1位于染色体15q21的Dyx1位点附近,t(2;15)(q11;q21)易位同时与读写障碍分离。目前,Dyx1c1−/−小鼠是读写障碍的理想模型,被广泛用于研究与读写障碍相关的缺陷的发病机制。在大鼠胚胎中敲除Dyx1c1导致新皮层神经元失去迁移至正确位置的能力,表明Dyx1c1对神经系统发育至关重要。进一步的研究表明,小鼠前脑中的Dyx1c1敲除导致学习和记忆的损害,表明Dyx1c1对大脑学习和记忆的发展很重要。另一项研究发现,在Dyx1c1缺陷后,神经元未能迁移,进而导致听觉处理受到干扰。此外,Dyx1c1缺乏还会导致原发性纤毛运动障碍(PCD)。Dyx1c1在呼吸上皮细胞的细胞质中表达,并参与纤毛动力蛋白的组装,Dyx1c1−/−小鼠表现出类似于PCD的纤毛不动和逆位座位等表型,这表明Dyx1c1是一种新型轴突动力蛋白组装因子。巧合的是,患有PCD的患者经常伴有听觉功能障碍。有趣的是,读写障碍易感基因ROBO1、DCDC2和KIAA0319都与纤毛功能有关。在这项研究中,我们发现敲除Dyx1c1导致小鼠严重的耳聋,因此,作为读写障碍的关键易感基因,Dyx1c1似乎是联系听力损伤与读写障碍的关键因素。 本研究建立了Dyx1c1−/−小鼠,以探索DRHL的机制。研究发现Dyx1c1在小鼠的耳蜗中强烈表达,并且Dyx1c1−/−小鼠表现出严重的耳聋。进一步的实验表明,Dyx1c1−/−小鼠的耳蜗中的基磷酸纤毛结构和发育型I SGNs的结构异常,导致严重的听力丧失。这些发现将帮助我们更好地理解Dyx1c1功能缺陷在听力丧失中的特征和作用,并为DRHL的病因学和治疗提供新的见解。 结果 Dyx1c1在小鼠耳蜗中高表达 (1)免疫印迹实验+ qPCR:Dyx1c1的表达在小鼠出生后逐渐增加(出生后第3、7、14、30天) (2)该基因在耳蜗螺旋神经节神经元、盖膜、Corti器、螺旋缘中都有表达。 2.Dyx1c1−/−小鼠不仅患有与读写障碍相关的缺陷,还患有严重的听力损失 (1)研究者在构建模型时,采用CRISPR-Cas9使Dyx1c1基因失活,并用qPCR、WB、免疫荧光等方法确认了基因编辑的有效性。 (2)观察到Dyx1c1−/−小鼠出现了内脏反位的表现。 (3)听力学测试(ABR + DPOAE)显示:Dyx1c1基因敲除导致小鼠出现了严重的听力损失 3.在Dyx1c1-/-小鼠中未观察到耳蜗结构的显著变化。 (1)与野生型(WT)小鼠相比,Dyx1c1缺陷型小鼠的毛细胞数量和形态没有显着改变。 (2)Dyx1c1-/-小鼠毛细胞中功能性机械电转换(MET)通道正常。 (3)Dyx1c1敲除不会改变小鼠毛细胞的MET功能以及毛细胞中核心功能蛋白的表达。 4.Dyx1c1−/−小鼠的耳蜗毛细胞动纤毛和微绒毛的退化出现异常。 为探究Dyx1c1-/-基因缺失是否破坏了耳蜗内毛束的结构,研究者进行了扫描电子显微镜(SEM)检查,发现: (1)与出生后18天的WT小鼠相比,Dys1c1-/-小鼠的耳蜗中存在大量畸形的动纤毛,这些纤毛并未完全退化。然而,正常情况下,这些动纤毛在哺乳动物听觉毛细胞发育后期就应该完全退化。 (2)Dys1c1-/-小鼠的耳蜗毛细胞和支持细胞上存在大量异常的微绒毛(见图A)。 (3)Dys1c1-/-小鼠出生后第四天时的动纤毛末端扩大并呈现为球状,且许多动纤毛的方向偏离了毛束。 (4)此外,我们已知动纤毛的破坏会减少其与纤毛束之间的连接、影响毛细胞平面细胞极性(PCP)从而导致严重听力损失。而毛细胞的PCP依赖于出生后的早期分化和重新定位,所有纤毛束的顶点都被统一对齐,指向耳蜗螺旋的外侧/侧面/非神经边缘,从而保持正确的方向以响应沿神经-非神经轴的机械力。因此,本研究的研究者关注的一个问题的是Dys1c1-/-小鼠的PCP有没有被破坏。结果显示: 尽管刚出生的Dys1c1-/-小鼠的纤毛束方向偏离,但出生后第4天,方向/PCP缺陷就被纠正。不过,这种自我修复的机制有待探索。 5.Dyx1c1−/−小鼠耳蜗中动纤毛的纤毛内转运通路异常。 前面提到,在本研究中发现Dyx1c1−/−小鼠的耳蜗毛细胞动纤毛退化出现异常。而之前的研究结果表明:纤毛退化需要IFT(纤毛内转运)通路的参与,但Dyx1c1-/-小鼠中,超过60%的动纤毛只有近端和远端才有IFT88(IFT通路中的核心亚单位之一),中间位置极少。 本研究中,WB结果表明,在小鼠出生后第3天,基因敲除小鼠的IFT88蛋白水平比WT小鼠高。这些结果说明Dyx1c1的缺陷会影响IFT通路并导致动纤毛的退化失败。 6.Dyx1c1−/−小鼠内毛细胞和螺旋神经节神经元的自发活动异常。 (1)在本研究中,研究者使用膜片钳技术记录了出生后第七天的WT和Dyx1c1−/−小鼠SGNs(螺旋神经节神经元)的自发活动,并用免疫荧光检测了被测试的SGNs的形态特征。发现Dyx1c1−/−小鼠的SGNs中有效离散动作电位的数量比WT小鼠少,并且自发活动的强度显著降低;此外,形态观察显示SGNs具有冗余未修剪的分支。 (2)之前的研究结果表明小鼠出生后两周期间,内耳毛细胞和SGNs之间的持续电信号有助于进一步精化SGNs并巩固内毛细胞与SGN的连接。于是研究者使用膜片钳技术记录了出生后12天的WT和Dyx1c1−/−小鼠内毛细胞的自发活动。结果,与WT小鼠相比,Dyx1c1−/−小鼠的IHCs产生了更多的动作电位。 (3)Cav1.3是一种电压门控的钙离子通道,在内耳的各种细胞功能中起着重要作用,但主要介导持续的Ca2+通量,并在毛细胞的发育中发挥作用。于是研究者比较了WT和Dyx1c1−/−小鼠出生后12天时,内耳中Cav1.3的表达水平,结果显示Dyx1c1−/−小鼠的Cav1.3蛋白和mRNA水平显著增加。这与IHC的自发电活动增强一致。 综上,Dyx1c1的敲除扰乱了内毛细胞和SGN之间的电信号传导,从而降低了两者之间连接的稳定性。内耳中这种异常的自发电活动可能是导致听觉系统发育障碍以及DRHL的关键因素之一。 7.Dyx1c1-/-小鼠的内毛细胞带状突触结构分析 在出生后12天,Dyx1c1−/−小鼠内毛细胞带状突触后受体的数量显著多于WT小鼠,但这一数量在出生后18天开始减少,并在第30天时与WT小鼠相似。从P12到P30,突触前受体数量与WT小鼠保持一致。这些结果表明,Dyx1c1缺陷导致内耳SGN发育受损,尽管在P30时完成了SGN分支修剪,但听力仍未恢复。 讨论: 迄今为止,已确定了与读写障碍相关的各种病理缺陷,如受损的语音处理、内脏器官反位、短期记忆障碍以及快速听觉处理困难。读写障碍患者有时会伴发听力损失,但其机制尚不明确。Dyx1c1是首个被报道的读写障碍候选基因,Dyx1c1-/-小鼠已成为读写障碍研究的良好模型。此外,Dyx1c1缺陷还与神经元迁移和纤毛组装等生物学过程相关。本研究发现Dyx1c1在小鼠耳蜗中广泛表达,并构建了患严重听力损失的Dyx1c1-/-小鼠模型。Dyx1c1-/-小鼠的耳蜗中,动纤毛结构改变,毛细胞束的PCP被破坏,同时,实验显示Dyx1c1-/-小鼠的耳蜗中I型SGNs和IHCs(内毛细胞)的早期自发电活动发生改变,这暗示了可能的听力损失机制。这些结果表明,Dyx1c1基因缺失导致读写障碍相关的耳缺陷,并且Dyx1c1-/-小鼠的听力损失可能是由于毛细胞和SGNs功能紊乱引起的。Dyx1c1在盖膜、螺旋嵴等处表达水平较高,但在本研究中,这些结构并未表现出明显缺陷,但无法肯定地说Dyx1c1缺陷一定不会改变这些元素的生物学功能。此外,Dyx1c1参与维持耳蜗中动纤毛和毛束结构。研究者还发现,Dyx1c1-/-小鼠表现出内脏器官反位和纤毛功能异常,这与之前的研究结果一致。Dyx1c1-/-小鼠的听力损失严重,但与耳蜗中轻微的动纤毛结构和PCP改变不同,其预测可能有其他机制导致严重的听力损失。此外,研究者还发现Dyx1c1高度表达于SGNs中,表明SGN功能障碍可能是导致听力损失的另一个重要因素。总的来说,该研究提供了新的线索,表明Dyx1c1与读写障碍相关的听力损失密切相关,这为临床诊断和治疗提供了新的思路。 汇报人:刘敏 导师:郑芸 审核:任建君 邱轲