精读分享│【Nature】: 上皮细胞膜穿孔诱导过敏性气道炎症
英文题目:Epithelial cell membrane perforation induces allergic airway inflammation
中文题目:上皮细胞膜穿孔诱导过敏性气道炎症
期刊:Nature(IF: 48.5)
单位:北京生命科学研究所、清华大学生物医学交叉研究院、中科院生物物理所
发表时间:2025年7月
PMID: 40739348
DOI: 10.1038/s41586-025-09331-1


摘要:
诱发过敏性气道炎症的过敏原种类繁多,但它们普遍激活2型免疫应答。气道上皮细胞在识别过敏原中发挥关键作用。然而,目前尚不清楚这些结构迥异的过敏原触发相似先天反应的共性特征,以及上皮细胞如何感知它们。该研究发现,成孔蛋白是引发过敏性气道炎症的共同刺激因子之一,并阐明了其激活免疫的机制。以常见霉菌过敏原链格孢菌(Alternaria alternata)为模型,作者建立了体外系统研究2型先天免疫感知。通过六步生化分级分离,鉴定出Aeg-S和Aeg-L为核心免疫活性成分。生化重构与冷冻电镜显示,这两种蛋白可组装成16–20聚体的跨膜孔道复合体,其协同穿孔作用充当真正的2型免疫佐剂,支持抗原特异性Th2和IgE应答。基因敲除成孔活性的链格孢菌株无法在小鼠中诱发过敏反应。此外,来自不同物种的成孔蛋白,尽管结构与膜靶点各异,均足以触发呼吸道过敏。气道上皮细胞被穿孔后,通过两条途径启动过敏反应:一是促使IL-33释放,二是引发Ca²⁺内流,激活MAPK信号及2型炎症基因表达。这些发现揭示了2型免疫如何识别结构多样刺激所引起的共同扰动,针对上皮穿孔下游信号的干预有望为呼吸道过敏治疗开辟新途径。
研究背景:
2型免疫反应以嗜酸性粒细胞、肥大细胞和TH2的活化以及IgE水平升高为特征,对抵御寄生虫和毒素至关重要。然而,该免疫反应的过度激活会诱发过敏性气道炎症等过敏性疾病。尽管2型免疫反应十分重要,但其先天性感知机制仍不甚明确,这主要源于激发该反应的刺激物具有高度多样性。花粉、屋尘螨和霉菌孢子等不同过敏原均可引发过敏性气道炎症,但它们几乎不存在结构或生物学上的相似性。与依赖模式识别受体检测病原体保守分子特征的1型和3型免疫不同,2型免疫反应被认为能够感知由结构无关刺激物引起的共同组织扰动。因此,识别这些共同扰动并理解不同过敏原如何诱导它们至关重要。气道上皮细胞作为第一道防线,可通过TLR4(识别屋尘螨)、PAR2(识别丝氨酸蛋白酶)及P2RY2(识别受损细胞释放的ATP)等受体检测过敏原。然而,这些细胞如何识别缺乏这些特定特征的多种过敏原,其机制仍不明确。
成孔蛋白包括病原细菌和真菌产生的外源性成孔毒素,以及参与调节性细胞死亡的内源性成孔蛋白。这类蛋白可调节免疫反应,因为细胞膜穿孔会导致细胞因子和趋化因子表达,并释放IL-1家族细胞因子等炎症介质及引发细胞死亡。大多数成孔蛋白参与介导1型和3型免疫反应,如针对细菌或病毒感染的免疫及肿瘤免疫。在屏障上皮细胞中表达的两个内源性成孔蛋白—GSDMB与GSDMC,被发现与2型免疫反应相关。全基因组关联研究显示GSDMB与过敏性疾病有关,而GSDMC则通过促进IL-33释放参与抗寄生虫免疫。然而,多种外源性成孔毒素能否通过靶向上皮细胞特异性触发2型免疫反应尚不清楚。
链格孢菌是一种常见环境霉菌,已知可诱发呼吸道过敏性疾病。全球范围内对该霉菌的致敏率存在差异,某些地区可达过敏人群的20%。由于该菌具有较强的致敏性,它常被用于研究气道2型免疫反应的小鼠模型。链格孢菌暴露可刺激气道上皮细胞,激活Ca²⁺信号传导并释放IL-33、TL1A和ATP等炎症因子。霉菌源性丝氨酸蛋白酶可将全长IL-33快速加工为成熟形式,进而激活ILC2s、TH2细胞和嗜碱性粒细胞等下游免疫细胞。然而,上皮细胞识别链格孢菌作为过敏原的机制仍不明确。尽管链格孢菌的蛋白酶等组分被认为可驱动2型免疫,但尚缺乏直接证据证实其对致敏性的贡献。
研究方法和思路图:
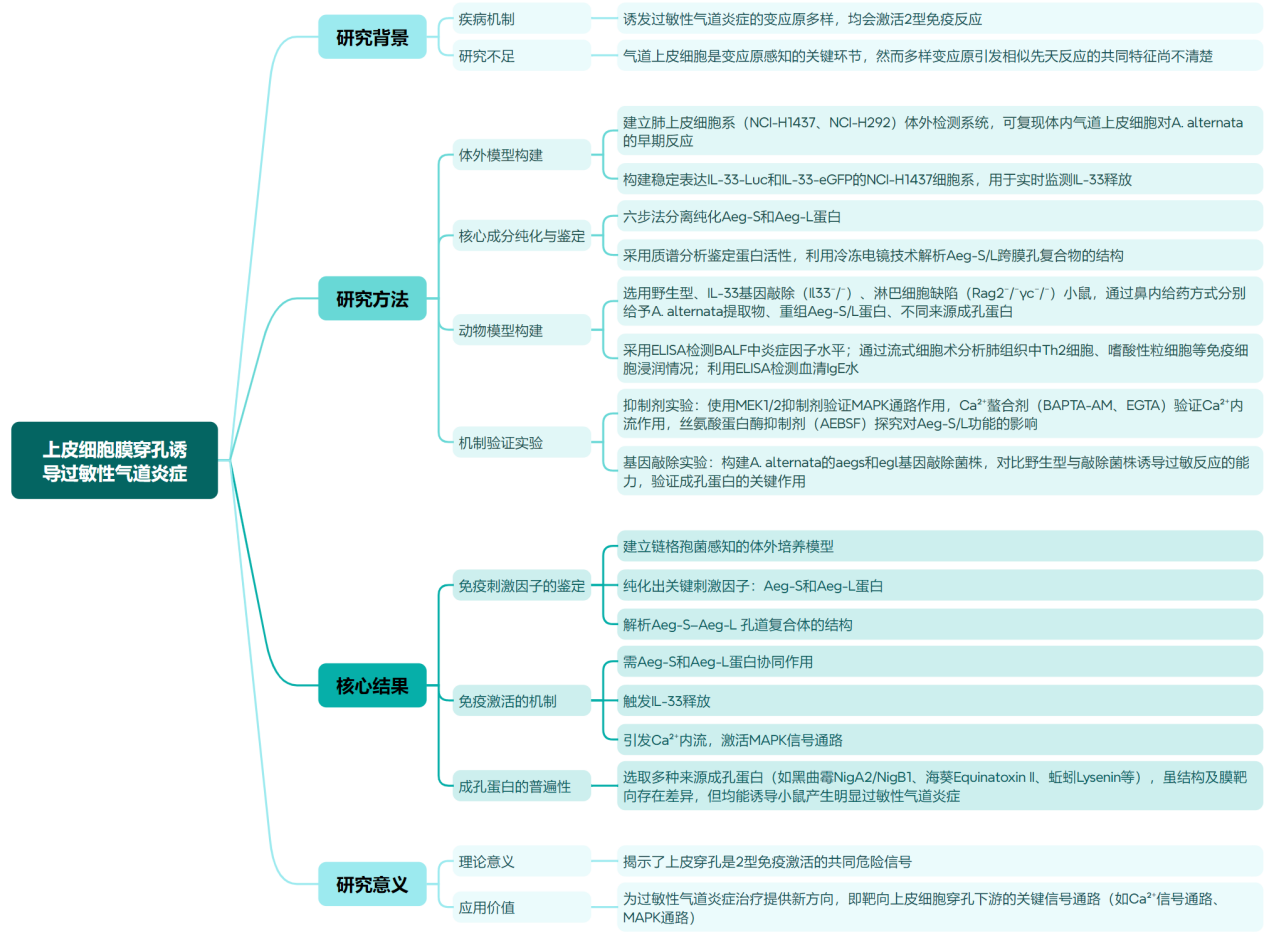
主要结果:
1.链格孢菌(A.alternata)感知的体外培养模型
为了确定链格孢菌的核心过敏原成分并了解它们的先天免疫识别,设计并开发了一种基于细胞培养的检测系统,该系统重现了气道上皮细胞对链格孢菌暴露的早期体内反应。使用这些分析作为读数,将能够进行生化分离,从霉菌中分离出免疫刺激活性(Fig. 1a,b)。研究人员基于动物实验中链格孢菌诱导的气道上皮细胞的早期反应,建立了一个细胞培养的检测系统,重现了链格孢菌诱导的小鼠气道早期反应,包括IL-33释放、MAPK途径激活和下游炎症基因表达。
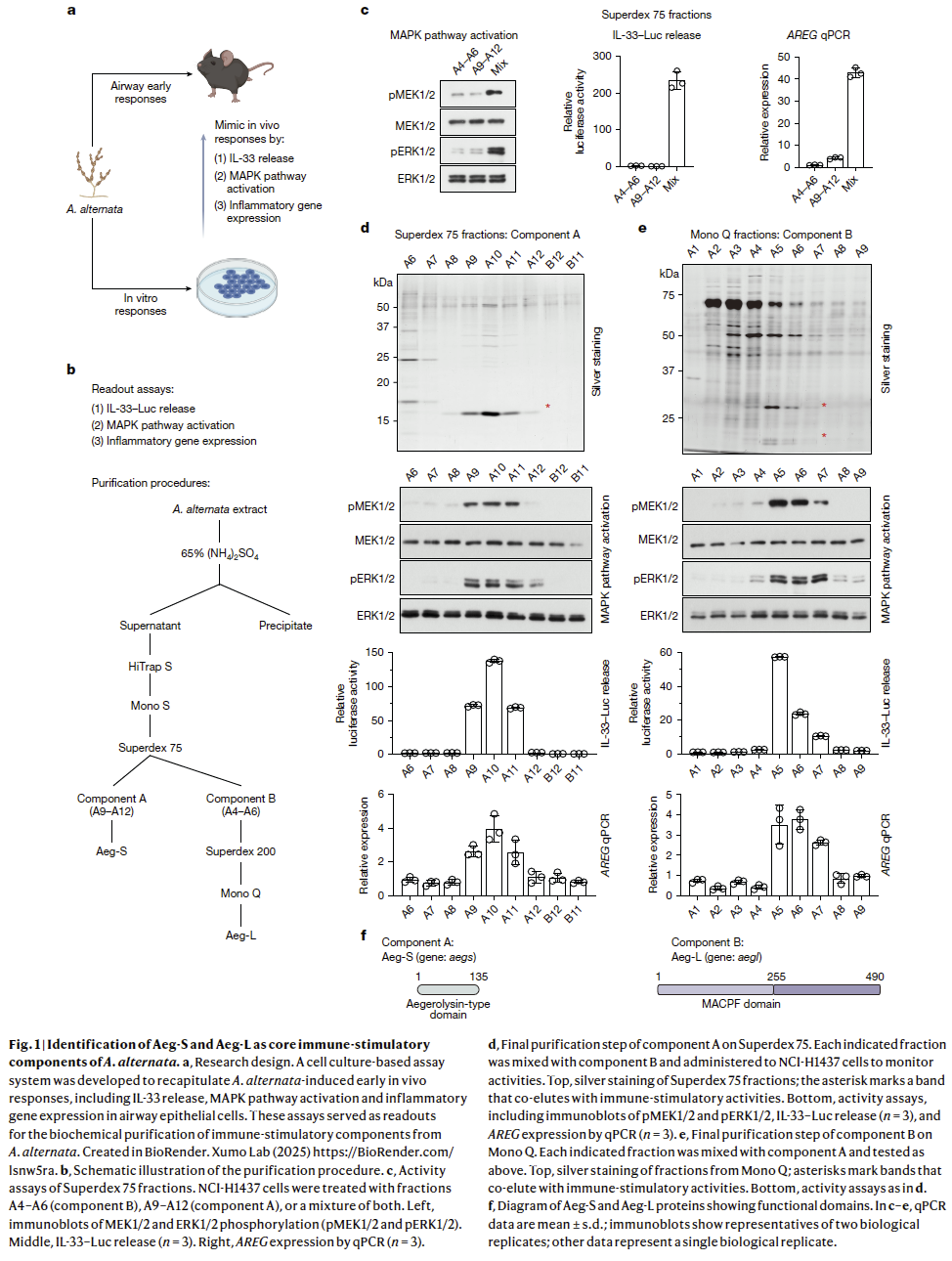
2.免疫刺激活性的纯化
纯化共六步(Fig. 1b)。第二(HiTrap S离子交换)和第三步(Mono S离子交换)中,三项活性始终共洗脱,提示由同一蛋白组分介导。第四步(Superdex 75凝胶过滤)中,单独收集的各组分均无活性,而将低分子量部分(A9–A12,组分A)与高分子量部分(A4–A6,组分B)合并后,三项活性全部恢复(Fig. 1c),说明需两种蛋白协同作用。
随后分别纯化各组分。由于A、B必须混合才显活性,策略是将其中一组分继续层析,所得级分再与另一组分混合测活。对于组分A,Superdex 75级分中银染SDS–PAGE上一条16.5 kDa条带与三项活性高度共纯化(Fig. 1d),质谱鉴定为aegerolysin家族蛋白,该家族在真菌中广泛存在,可穿孔质膜(Fig. 1f)。对于组分B,再经额外的Mono Q和Superdex 200两步纯化;在Superdex 200级分中,银染胶上30 kDa和20 kDa两条带与与三种活性相关(Fig. 1e)。质谱显示二者为同一55 kDa含MACPF结构域蛋白的N端和C端片段(Fig. 1f)。真菌中,aegerolysin与MACPF蛋白可配对形成寡聚孔道复合物,裂解细胞膜。值得注意的是,编码这两个蛋白的基因在A. alternata基因组中位于同一基因座,且此类二元成孔毒素在三大霉菌过敏原属Alternaria、Aspergillus和Penicillium中普遍存在,提示其保守的致敏作用。研究人员将16.5 kDa的aegerolysin命名为Aeg-S(基因名aegs),55 kDa的MACPF蛋白命名为Aeg-L(基因名aegl)(Fig. 1f)。与曲霉同源物一致,Aeg-S和Aeg-L均无信号肽,却可通过非经典途径分泌,为自然霉菌暴露下的免疫刺激活性提供了机制基础。
3. Aeg-S–Aeg-L 孔道复合体的结构解析
为解析孔道组装的分子基础,运用冷冻电镜测定了Aeg-S–Aeg-L复合物结构,搭建了含18个Aeg-L与36个Aeg-S亚基的18重对称孔道模型(Fig. 2a,b)。
组装后的孔道呈巨大环形结构,外径约232 Å,中央通道内径约92 Å(Fig. 2a)。Aeg-L由三域组成:N端域既参与顶端冠部又构成跨膜通道;C端呈三叶草状,沿外缘径向伸展,将Aeg-L锚定在Aeg-S骨架上;中间域为螺旋束,桥接N端与C端(Fig. 2c)。Aeg-S形成膜附着二聚体,通过C端域招募Aeg-L,建立三角骨架以稳定各亚基。界面分析显示,Aeg-S二聚化掩埋约769 Ų表面积;Aeg-L C端域分别与Aeg-S-1、Aeg-S-2再掩埋约395 Ų与668 Ų表面积(Fig. 2c)。这种多重相互作用有望增强径向对称并促进寡聚体稳定性。
为探究成孔过程中的构象转变,利用AlphaFold 2预测Aeg-L单体静息态结构。与成孔态结构叠合发现,两条插入脂膜的β-发夹(HP1与HP2)原本隐藏在延伸域ED1与ED2中(Fig. 2d)。这与pleurotolysin成孔机制一致,支持“N端域局部解折叠-再折叠驱动膜插入”的保守模型。
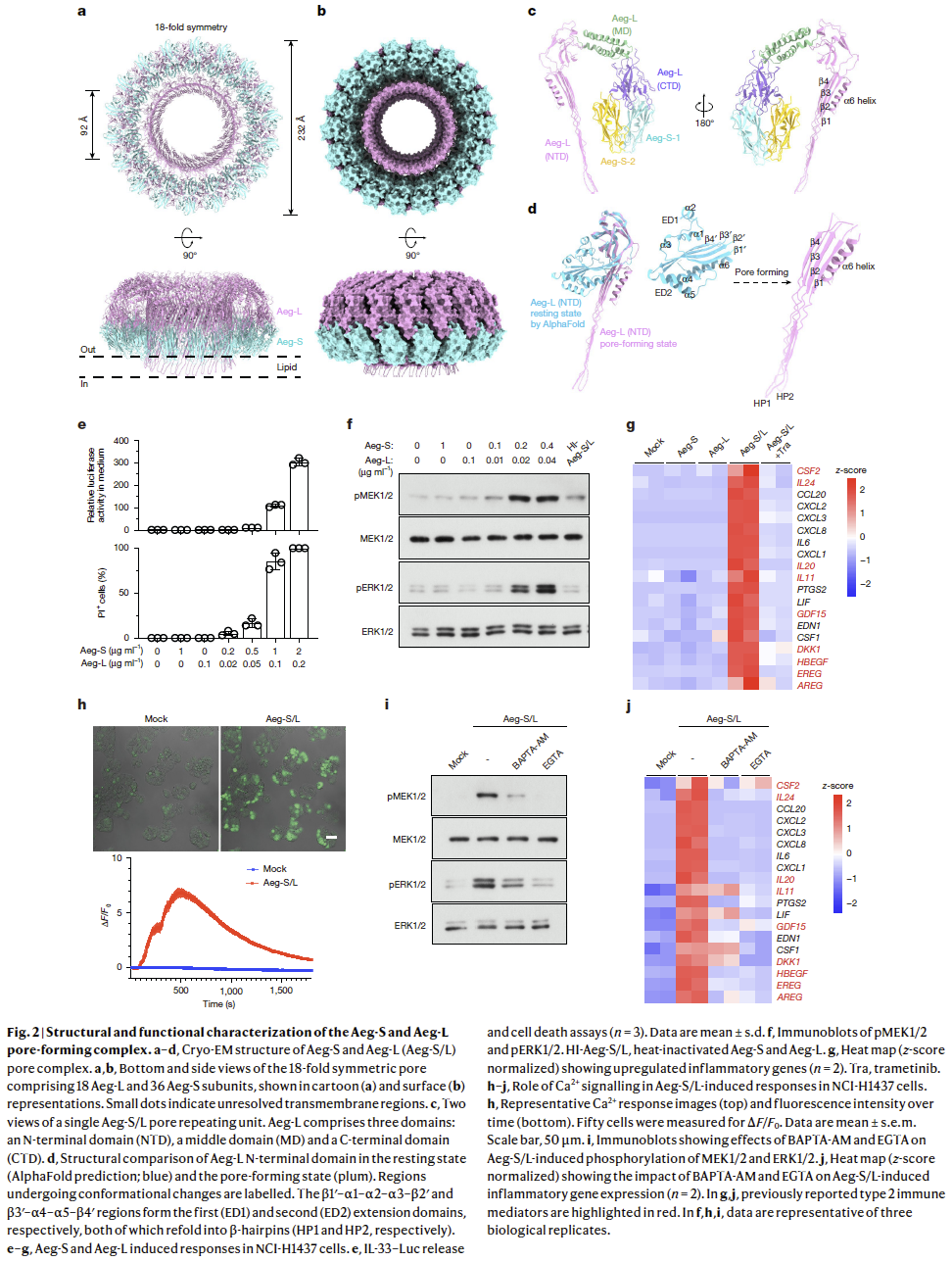
4.免疫激活的机制
为探究Aeg-S与Aeg-L的体外免疫刺激作用,使用重组蛋白处理肺上皮细胞系。在NCI-H1437细胞中,同时加入Aeg-S和Aeg-L可诱导IL-33释放、细胞死亡及MEK1/2与ERK1/2磷酸化,表型与链格孢菌提取物处理一致(Fig. 2e,f)。不同效应所需剂量不同:较低浓度即可磷酸化MEK1/2和ERK1/2,但需更高浓度才能检出IL-33释放和细胞死亡(Fig. 2e,f)。亚裂解水平下,Aeg-S+Aeg-L诱导的炎症基因谱与链格孢菌提取物高度相似,且MEK1/2抑制剂trametinib可阻断该诱导,证实其依赖MAPK信号通路(Fig. 2g)。单独使用Aeg-S或Aeg-L均无效,强调二者协同成孔的必要性(Fig. 2e-g)。综上,Aeg-S与Aeg-L联用可在培养细胞中完全重现链格孢菌的免疫刺激效应。
既往研究显示链格孢菌刺激可升高上皮细胞内Ca²⁺,于是探究Aeg-S/Aeg-L诱导的细胞膜穿孔是否激活Ca²⁺信号。Cal-520染色共聚焦成像显示,亚裂解剂量下,胞内Ca²⁺显著升高,约500 s达峰后缓慢下降(Fig. 2h)。使用Ca²⁺螯合剂进一步验证:膜通透型BAPTA-AM(同时螯合胞内外Ca²⁺)及膜不通透型EGTA(仅螯合胞外Ca²⁺)均能抑制Aeg-S+Aeg-L诱导的MEK/ERK磷酸化及炎症基因表达(Fig. 2i,j)。因此,膜穿孔导致的胞外Ca²⁺内流是激活下游MAPK通路和炎症基因表达的关键步骤。
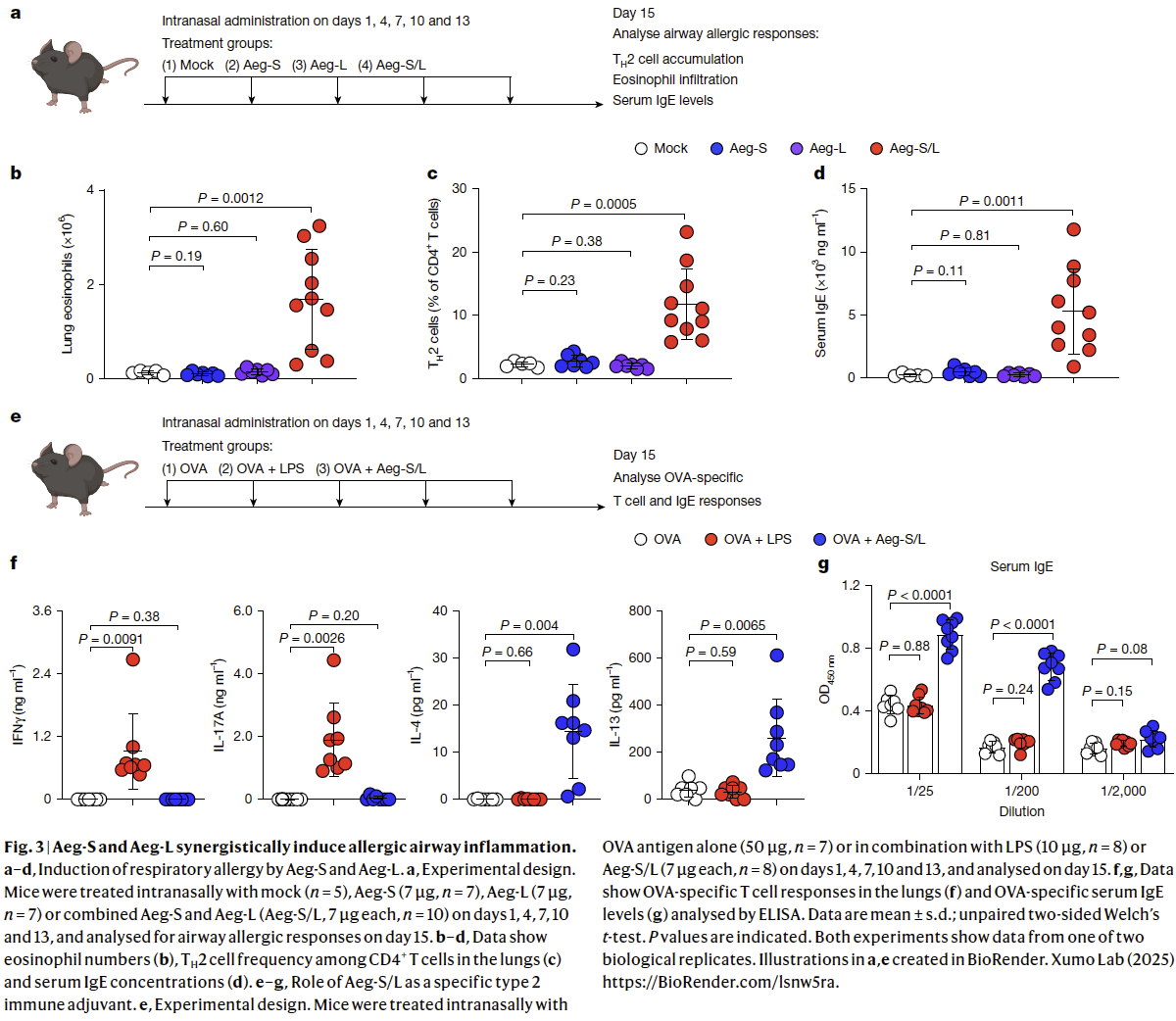
5. Aeg-S/L 协同驱动气道过敏
为验证Aeg-S与Aeg-L能否在体内诱发过敏性气道炎症,研究人员经鼻滴注重组蛋白。联合给予Aeg-S+Aeg-L(而非单用任一蛋白)6小时后,即可观察到早期气道反应:上皮细胞MAPK通路激活、BALF中IL-33及其他炎症介质释放,证实Aeg-S/Aeg-L可在体内启动先天免疫。随后,每隔3天给药,持续2周,观察过敏性气道炎症发展(Fig. 3a)。Aeg-S+Aeg-L联合处理组的肺内TH2细胞及嗜酸性粒细胞显著浸润,血清IgE升高,提示呼吸道过敏形成;而单用Aeg-S或Aeg-L无此效应,再次强调协同成孔的必要性(Fig. 3b-d)。综上,Aeg-S与Aeg-L联用足以在小鼠诱发与链格孢菌一致的过敏性气道炎症,确认二者为该霉菌主要免疫活性成分。
为了进一步评估 Aeg-S 和 Aeg-L 的免疫佐剂作用,将这两种蛋白与卵清蛋白(OVA)或链格孢菌主要抗原 Alt a 1 联合经鼻滴注小鼠,持续两周,随后检测肺内抗原特异性 T 细胞应答及血清 IgE 水平(Fig. 3e)。对照组包括单独给予 OVA 或 Alt a 1,以及将 OVA 或 Alt a 1与经典 1/3 型佐剂 LPS 联合给药(Fig. 3e)。结果显示,无佐剂时 OVA 或 Alt a 1 均未能诱导可检出的气道 T 细胞或血清 IgE 应答;而 LPS 强烈诱导肺内 IFN-γ⁺ TH1 和 IL-17A⁺ TH17 细胞,却不促进 IL-4/IL-13⁺ TH2 细胞或升高抗原特异性 IgE,符合其 1/3 型佐剂特性(Fig. 3f,g)。相反,Aeg-S+Aeg-L 组显著支持抗原特异性 TH2 细胞及 IgE 应答,但不诱导 TH1 或 TH17 反应(Fig. 3f,g),表明 Aeg-S/Aeg-L 介导的膜穿孔是气道内真正的 2 型免疫佐剂。
6. 穿孔是致敏性的关键
为明确 Aeg-S 与 Aeg-L 在链格孢菌诱发过敏性气道炎症中的贡献,研究人员构建了 aegs 和 aegl 基因敲除菌株。持续两周反复给药后(Fig. 4a),野生型组出现显著过敏性气道炎症,而aegs- 和 aegl-敲除菌株提取物均未能诱导肺内 TH2 细胞与嗜酸性粒细胞浸润,也未升高血清 IgE(Fig. 4b-g)。值得注意的是,补加重组 Aeg-S 或 Aeg-L 可恢复突变提取物的致敏性,使其重新诱导 TH2、嗜酸粒细胞及 IgE 应答(Fig. 4b-g)。这些结果证明,Aeg-S 与 Aeg-L 是链格孢菌体内诱发 2 型免疫反应不可或缺的组分,其成孔活性为该霉菌首要致敏因素。
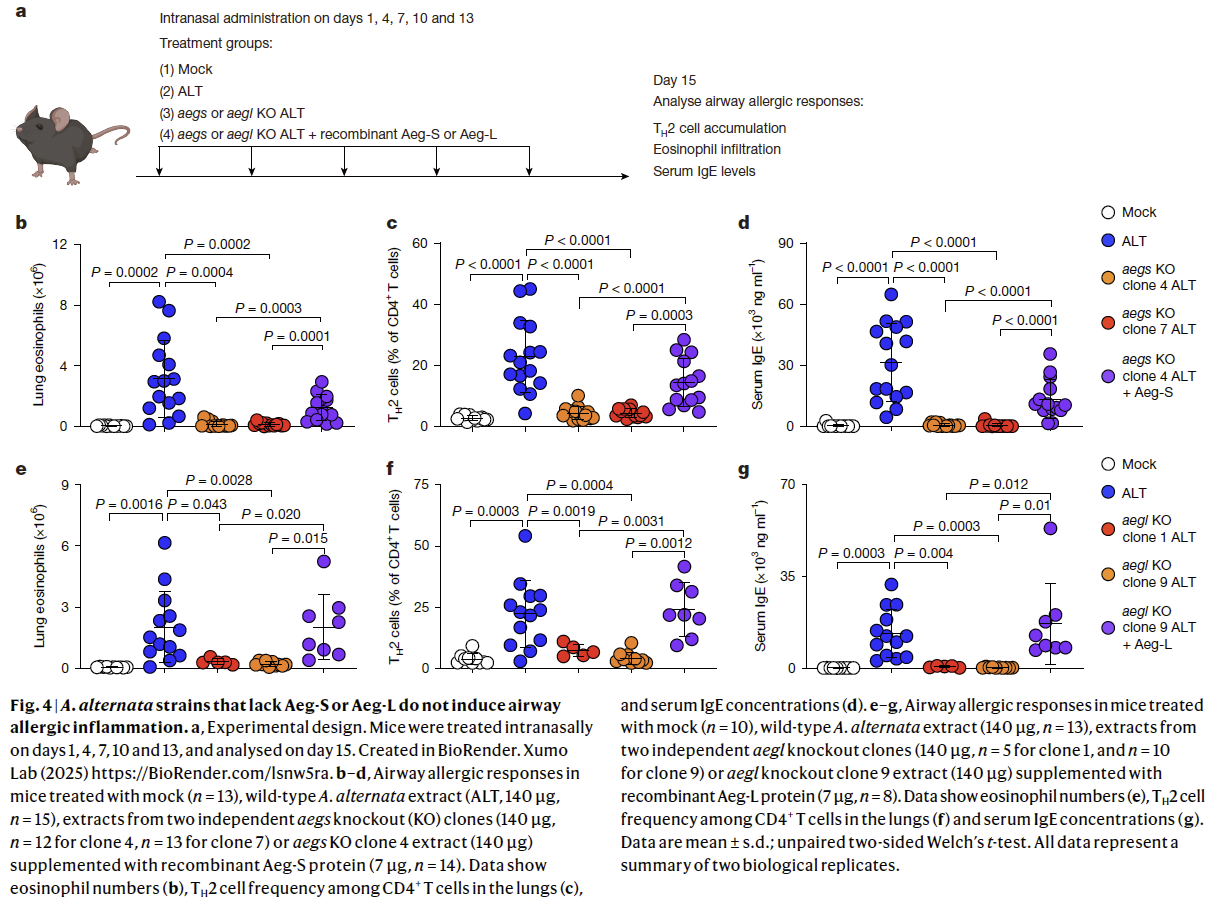
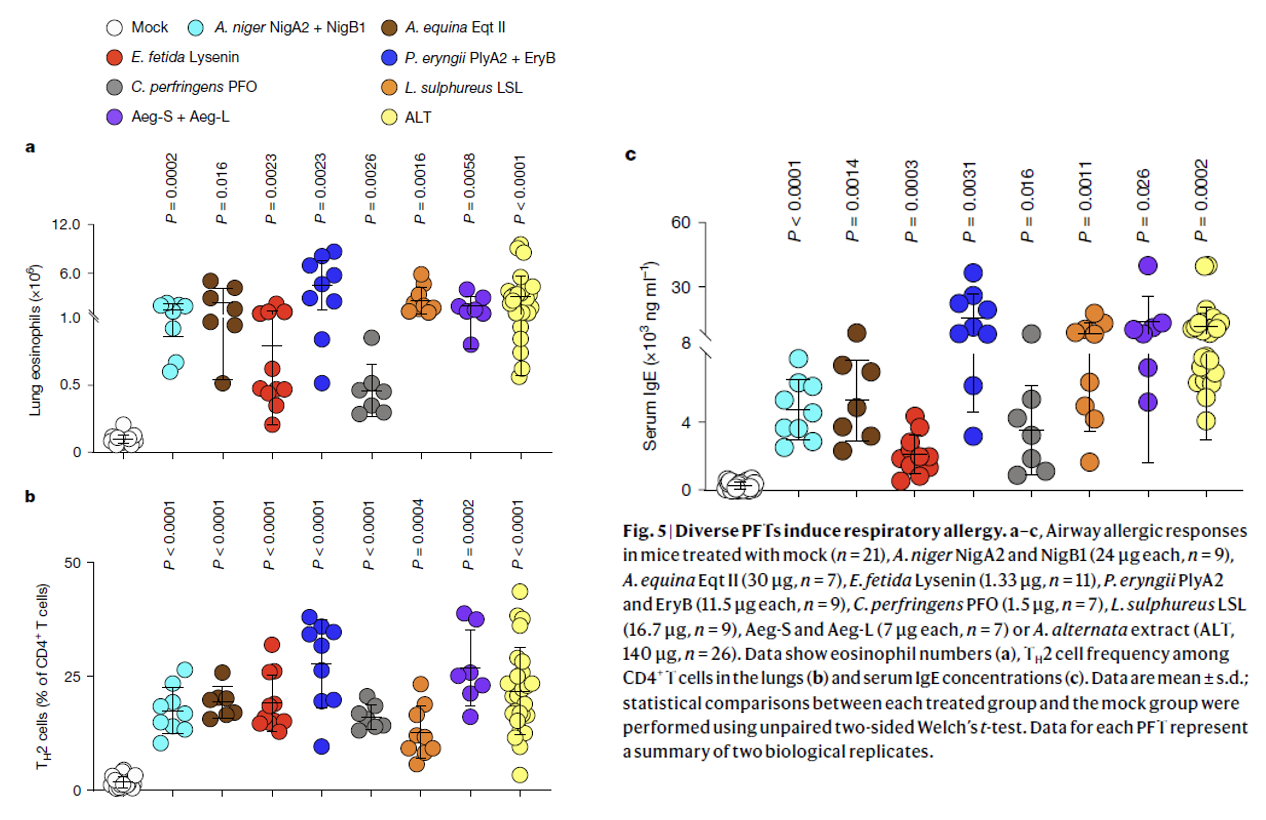
7. 多种穿孔毒素(PFTs)均可诱发呼吸道过敏
Aeg-S 与 Aeg-L 依赖其成孔活性激活免疫系统,因此推测:尽管结构各异,其他成孔毒素(PFT)也可能在气道诱导 2 型免疫应答。为此,研究人员表达了多种重组 PFT,并每隔 3 天经鼻滴注小鼠,持续两周。所选毒素包括:空气传播霉菌过敏原黑曲霉的 NigA2和NigB1、海葵溶液中的Eqt II、蚯蚓的 lysenin、刺芹菇的 PlyA2与 EryB、产气荚膜梭菌的 perfringolysin O(PFO)和硫磺孔菌凝集素 LSL。尽管结构及穿孔机制迥异,这 6 种 PFT 均显著诱发过敏性气道炎症:肺内 TH2 细胞与嗜酸性粒细胞大量浸润,血清 IgE 水平升高(Fig. 5a-c)。综上,研究阐明含 PFT 的多种刺激均可触发 2 型免疫应答,并强调先天免疫系统把气道上皮膜穿孔视为启动 2 型免疫的共同危险信号。
结论:
该研究发现,Aeg-S 与 Aeg-L 是常见霉菌过敏原链格孢菌(A. alternata)诱发过敏性炎症的关键因子,并阐明了其免疫激活机制:二者在气道上皮细胞形成跨膜孔道,穿孔既触发 IL-33 等警报素释放,又引起 Ca²⁺内流、MAPK 通路激活及炎症细胞因子/趋化因子表达,进而招募并激活免疫细胞,为过敏反应奠定基础。此外,揭示了2型先天免疫激活的普遍机制:气道上皮可将结构各异的成孔毒素(PFT)视为统一致敏刺激,并启动相似早期反应,支持“2 型免疫感知共同扰动而非共有分子特征”的理论。

汇报人:周菁
导师:何璇
审核:夏轶君、任建君



