精读分享│【Circulation Research】:针对成纤维细胞活化蛋白的疫苗通过抑制肌成纤维细胞的积累改善小鼠心脏纤维化
英文题目:A Vaccine Against Fibroblast Activation Protein Improves Murine Cardiac Fibrosis by Preventing the Accumulation of Myofibroblasts
中文题目:针对成纤维细胞活化蛋白的疫苗通过抑制肌成纤维细胞的积累改善小鼠心脏纤维化
期刊:Circulation Research(IF=16.2)
单位:大阪大学大学院医学系研究科健康发育与医学部门
发表时间:2025年1月

Abstract
Background:
Myofibroblasts are primary cells involved in chronic response-induced cardiac fibrosis. Fibroblast activation protein (FAP) is a relatively specific marker of activated myofibroblasts and a potential target molecule. This study aimed to clarify whether a vaccine targeting FAP could eliminate myofibroblasts in chronic cardiac stress model mice and reduce cardiac fibrosis.
Methods:
We coadministered a FAP peptide vaccine with a cytosine-phosphate-guanine (CpG) K3 oligonucleotide adjuvant to male C57/BL6J mice and confirmed an elevation in the anti-FAP antibody titer. After continuous angiotensin II and phenylephrine administration for 28 days, we evaluated the degree of cardiac fibrosis and the number of myofibroblasts in cardiac tissues.
Results:
We found that cardiac fibrosis was significantly decreased in the FAP-vaccinated mice compared with the angiotensin II and phenylephrine control mice (3.45±1.11% versus 8.62±4.79%; P=4.59×10-3) and that the accumulation of FAP-positive cells was also significantly decreased, as indicated by FAP immunohistochemical staining (4077±1746 versus 7327±1741 cells/mm2; FAP vaccine versus angiotensin II and phenylephrine control; P=6.67×10-3). No systemic or organ-specific inflammation due to antibody-dependent cell cytotoxicity induced by the FAP vaccine was observed. Although the transient activation of myofibroblasts has an important role in maintaining the structural robustness in the process of tissue repair, the FAP vaccine showed no adverse effects in myocardial infarction and skin injury models.
Conclusions:
Our study demonstrates the FAP vaccine can be a therapeutic tool for cardiac fibrosis.
摘要
背景:
肌成纤维细胞是参与慢性应激反应所致心脏纤维化的主要细胞。成纤维细胞活化蛋白(FAP)是活化肌成纤维细胞的相对特异性标志物,也是一个潜在的治疗靶点。本研究旨在明确,靶向FAP的疫苗是否能够在慢性心脏应激小鼠模型中清除肌成纤维细胞并减少心脏纤维化。
方法:
将FAP肽疫苗与胞嘧啶-磷酸-鸟嘌呤(CpG)K3寡核苷酸佐剂联合应用于雄性C57/BL6J小鼠,确认其体内抗FAP抗体滴度升高。在连续给予血管紧张素II(AngII)和去甲肾上腺素(PE)28天后,评估小鼠心脏组织的纤维化程度及肌成纤维细胞的数量。
结果:
与AngII/PE对照组相比,FAP疫苗接种组小鼠的心脏纤维化显著减少(3.45±1.11% vs. 8.62±4.79%;P=4.59×10−3),FAP免疫组化染色显示FAP阳性细胞的积累同样显著降低(4077±1746 vs. 7327±1741 个细胞/mm²;P=6.67×10−3)。未观察到因FAP疫苗诱导的抗体依赖性细胞毒作用而导致的全身性或器官特异性炎症。尽管肌成纤维细胞的短暂活化在组织修复过程中具有重要作用,但在心肌梗死和皮肤损伤模型中,FAP疫苗未显示不良影响。
结论:
本研究表明,FAP疫苗能够作为一种潜在的治疗手段减轻心脏纤维化。
研究背景:
心脏纤维化是多种心脏疾病(如高血压、心肌梗死)的共同病理特征,其发生主要归因于慢性应激引起成纤维细胞(fibroblasts)持续过度活化,转化为肌成纤维细胞(myofibroblasts)并分泌大量细胞外基质(ECM)。根据纤维沉积的机制,心脏纤维化可分为两类:一类为替代性纤维化(replacement fibrosis),表现为胶原沉积填充心肌梗死后丢失细胞的区域,属于修复性过程;另一类为反应性纤维化(reactive fibrosis),多见于高血压等慢性应激状态,表现为心肌细胞间的异常胶原沉积,而并无细胞丢失,具有显著病理性。
成纤维细胞活化蛋白(fibroblast activation protein,FAP)是肌成纤维细胞的相对特异性标志物,在正常组织中表达水平极低,而在纤维化心脏组织中显著上调。先前研究显示,CAR-T细胞靶向FAP能够有效减轻纤维化程度,但其高昂成本、操作复杂性及严重副作用均限制了临床转化。
基于此,本研究提出一种替代策略,即通过疫苗手段靶向FAP。该疫苗可诱导机体产生针对FAP的抗体,并通过抗体依赖的细胞介导细胞毒作用(ADCC)与补体依赖性细胞毒作用(CDC)清除FAP+肌成纤维细胞,从而改善心脏纤维化。与CAR-T方法相比,疫苗策略具有操作简便、成本较低及潜在安全性更佳的优势,为慢性心脏纤维化治疗提供新的思路。
研究方法和思路:
研究结果:
(1)疫苗构建 & 免疫原性验证
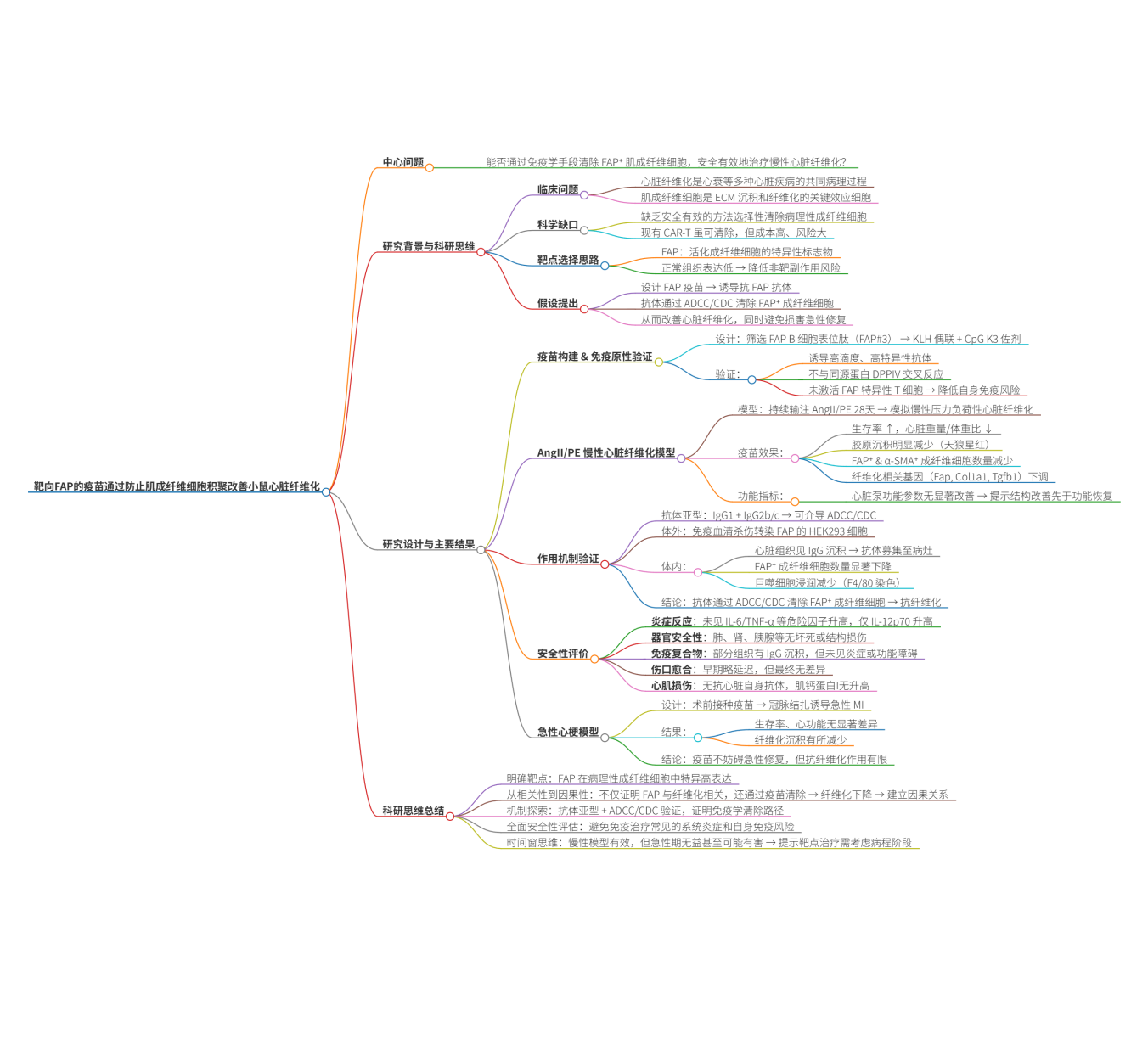
研究者基于FAP蛋白的三维结构进行表位预测的抗原性分析后,从中筛选出了三个潜在的B细胞表位肽段(FAP蛋白中可能被免疫系统识别的部分),作为疫苗的候选成分(图1A)。为了增强这些短肽的免疫原性,将候选肽段化学偶联到载体蛋白钥孔血蓝蛋白(KLH) 上,同时配合CpG佐剂使用。KLH作为大分子载体,可以帮助短肽被免疫系统识别,而CpG则促进Th1型免疫反应,有助于诱导具有效应功能的IgG2a/c等抗体。
每只雄性C57BL/6J小鼠在10周龄和12周龄时各免疫一次,每次30微克,共两次,从而建立并加强免疫记忆。通过这一设计,动物体内能够产生高滴度的抗FAP抗体。
在免疫效果上,研究者用 ELISA检测了小鼠血清中针对 FAP-BSA 的抗体滴度。结果显示,三种候选疫苗都能诱导抗体产生,并且在第4周时所有组滴度成功升高并维持至首次免疫后12周(图1B)。其中,FAP#2和FAP#3诱导的抗体能够与重组小鼠FAP蛋白发生特异性结合,尽管两者无显著差异,但FAP#3表现出稍强的趋势,因此被选为最终候选肽用于后续研究(图1C)。通过WB验证抗体的特异性,结果显示,FAP#3 疫苗诱导的抗体能够识别重组小鼠FAP蛋白,但不识别与其氨基酸同源性高达51%的DPPIV蛋白(图1D),即FAP疫苗诱导的抗体对靶点的特异性较高,不会产生明显的交叉反应。
由于该研究中FAP疫苗是基于B细胞表位设计的,而不是基于T细胞表位,如果诱导出了强烈的FAP特异性T细胞反应(如Th细胞反应或细胞毒性T细胞反应),可能会攻击正常组织,引发严重副作用。因此研究者进一步验证了该疫苗是否会意外激活FAP特异性的T细胞反应。为此,研究者检测了接种疫苗后小鼠的T细胞活化情况,采用酶联免疫斑点法,测定了接种FAP疫苗小鼠的脾细胞在不同刺激下产生的细胞因子IFN-γ(Th1型免疫反应)和IL-4(Th2型免疫反应)。结果显示,当脾细胞受到KLH刺激时,确实能诱导IFN-γ和IL-4的产生;但是当脾细胞受到 FAP 肽段刺激时,并没有观察到IFN-γ或IL-4的产生(图1E)。这说明疫苗诱导的免疫应答主要局限于B细胞表位,并不会引发T细胞对FAP的特异性反应。
即疫苗的设计既保证了它的靶向性,同时也避免了可能由T细胞介导的自身免疫损伤。
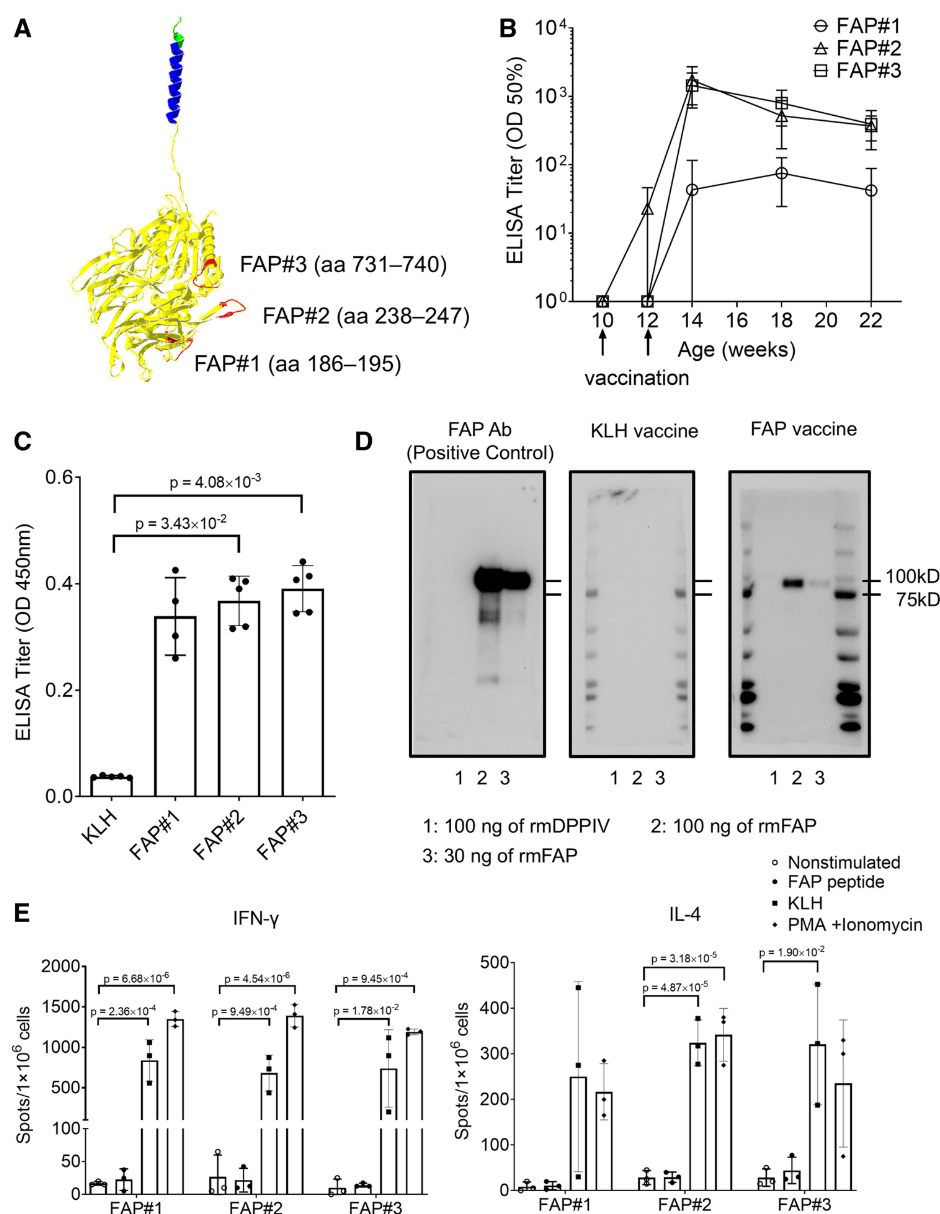
图1:FAP疫苗诱导的抗体产生评估
(2)AngII/PE 慢性纤维化模型
研究者选择了AngII/PE持续输注的小鼠模型,AngII/PE持续28天输注,会在小鼠心脏中形成类似慢性压力负荷的环境,从而诱导心脏纤维化。具体实验方案为:8周龄的雄性C57BL/6J小鼠首先接受三次FAP疫苗免疫,然后皮下植入一个含有AngII/PE的微型渗透泵,持续28天给药诱导心脏纤维化(图2A)。在28天给药期间,FAP疫苗组的小鼠生存率显著优于AngII/PE对照组和 KLH 疫苗组(图2B),这表明疫苗在慢性应激模型中具有保护作用。三组小鼠在体重变化上没有差异(图2C),虽然AngII/PE处理后体重都有下降,但随着时间推移逐渐恢复,各组间无显著差异,说明疫苗不会引起额外的全身性毒性反应。FAP疫苗组的心脏重量/体重比值显著降低(图2D),提示病理性心脏肥厚得到了改善。即FAP疫苗在纤维化模型中显著提高了存活率,并改善了心脏肥厚,但并未影响体重变化,显示出良好的耐受性。
研究者进一步就疫苗在心脏损伤和系统代谢方面的影响进行了评估。首先,由于疫苗可能诱导产生自身抗体,从而攻击心脏组织,因此对血清中抗心肌细胞抗体的水平进行了检测,结果显示,各组之间没有差异(图2E),说明疫苗没有引发自身免疫反应;对心脏损伤的标志物——心脏肌钙蛋白 I进行测量,结果同样没有差异(图2F),说明疫苗并未额外损伤心肌细胞。同时进行了一些血清学指标检测:在 AngII/PE 给药之前,FAP疫苗组小鼠的血清FAP水平显著升高;但在持续28天给药后,各组之间的血清FAP浓度未见明显差异(图S3A),此外,疫苗接种成功诱导了持续的高滴度抗体(图S3E),即抗体高滴度,但血清FAP没有长期差异,提示抗体的主要作用对象并非循环里的游离FAP,而是组织中的FAP+ 细胞。NT-proANP在AngII/PE组有升高趋势,说明纤维化和心脏压力负荷确实可导致心功能应激(图S3B) 。在血压、血糖、血脂上三组之间未见显著差异(图S3C/D),说明疫苗的作用并非通过改变血流动力学或代谢来实现。疫苗接种成功维持了高滴度的抗FAP抗体,并且持续时间较长,显示了良好的免疫持久性(图S3E)。即FAP疫苗具有靶向性,它作用于组织内的FAP+ 成纤维细胞,且不会引起心脏自身免疫或系统性代谢异常。
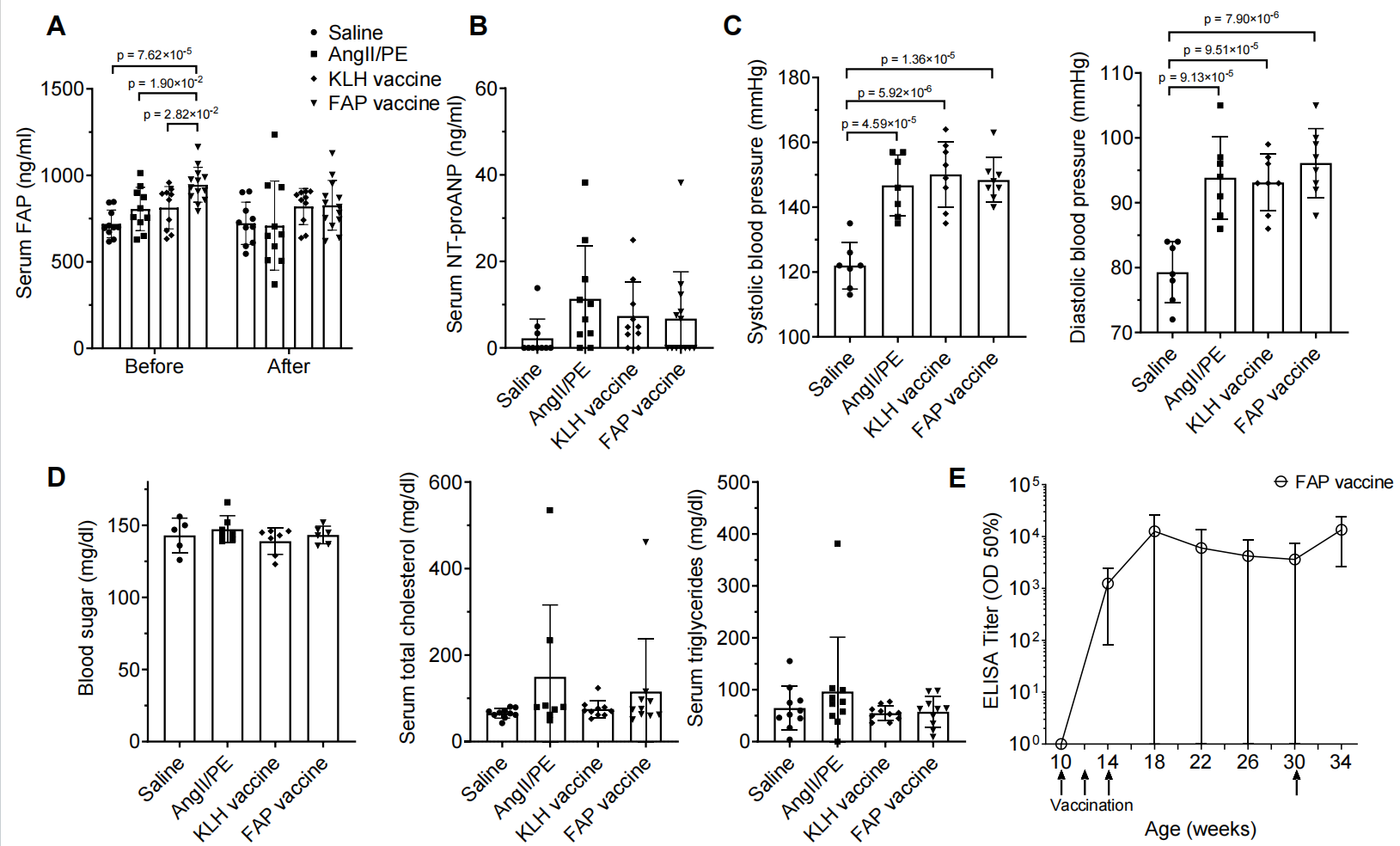
图S3:FAP疫苗在AngII/PE输注小鼠模型中的生理与生化效应评估
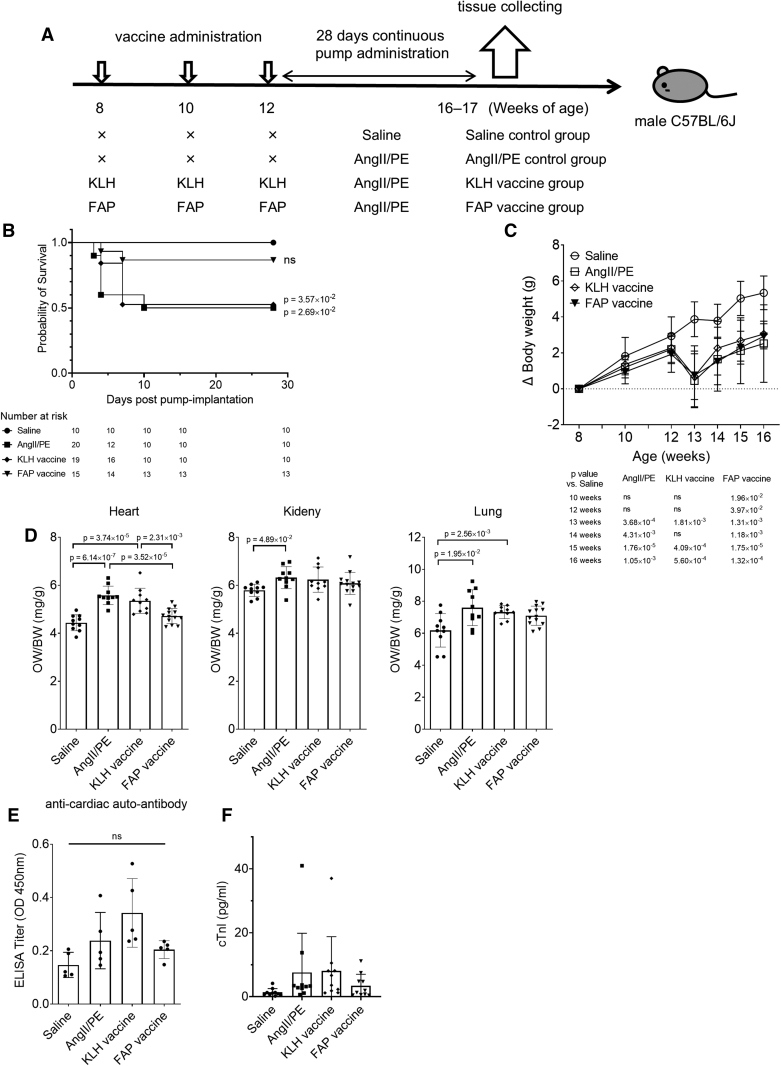
图2:FAP疫苗对AngII/PE输注模型小鼠的影响
接下来作者直接评估了小鼠的心脏纤维化和心功能。天狼星红染色显示,FAP 疫苗组的小鼠心脏纤维化显著减少(图3A),纤维沉积面积大幅下降(图3B)。但超声心动图的结果显示,收缩末期和舒张末期的内径,以及射血分数等参数,在各组之间没有显著差异(图3C),说明虽然疫苗显著改善了纤维化,但28天的观察时间不足以转化为泵血功能的恢复。
由于AngII可引起肾脏纤维化,研究者进一步评估了肾脏纤维化的程度,结果显示,AngII/PE虽能诱导肾脏纤维化,但免疫组化结果示各组间差异不大(S5A-C)。在功能指标上,尿蛋白在 FAP 疫苗组有下降趋势,说明它可能对肾脏有部分保护作用,但差异未达统计学显著(S5D)。即FAP疫苗能够显著减少心脏纤维化,改善结构性指标,但在短期内无法改善心脏功能。它对肾脏作用有限,显示出一定的组织特异性。
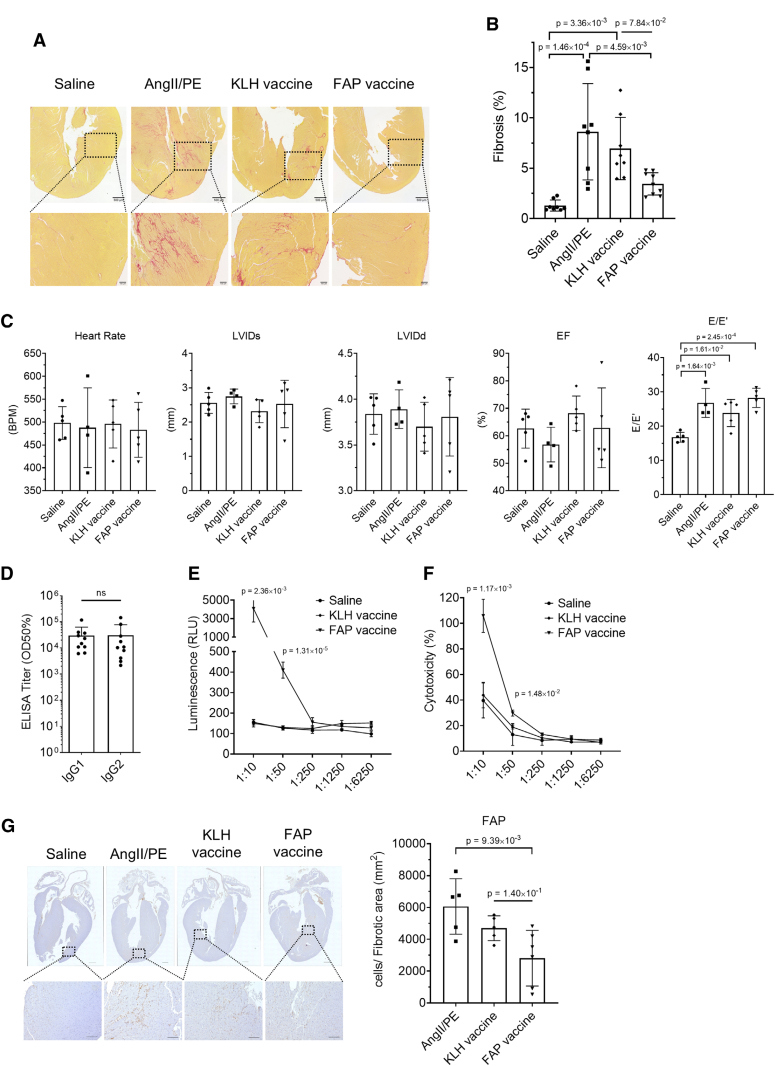
图3:FAP疫苗可改善心脏纤维化
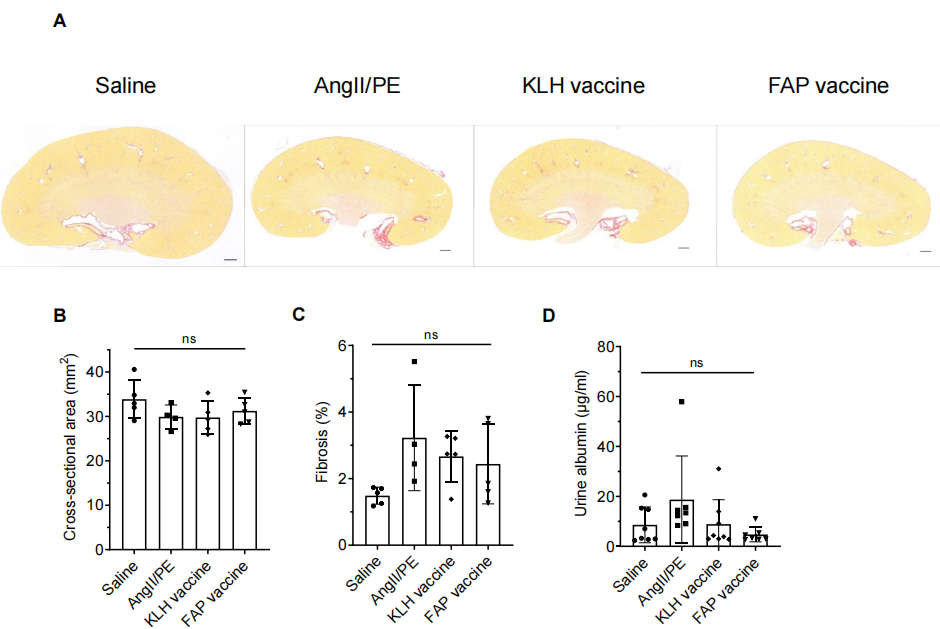
图S5:FAP疫苗在AngII/PE模型小鼠中28天时对肾脏纤维化的影响
(3)作用机制验证
研究者首先探讨了FAP疫苗在纤维化早期阶段的作用,在连续AngII/PE输注7天时收集小鼠器官进行分析(图S6A),结果显示:在第7天时,心脏纤维化已经开始出现,心脏重量与体重比值也显著增加,说明病理过程已经启动(图S6B/C)。对 FAP +成纤维细胞面积进行定量,结果显示 FAP 疫苗组有下降趋势,但尚未达到统计学显著性(图S6D)。FAP 疫苗在早期(7 天)尚未完全生效,但已经显示出减少 FAP+成纤维细胞的趋势,说明其抗纤维化效果需要更长时间才能显现。
为探究抗体是否真的能清除 FAP +的成纤维细胞,研究者假设:抗体不仅结合FAP,还可通过效应机制(ADCC或CDC)直接杀伤细胞,从而发挥抗纤维化作用。研究者首先选用高表达FAP的人胚胎肾(HEK)293细胞作为靶细胞,将其与来自疫苗免疫小鼠的血清混合进行体外验证,检测是否发生ADCC或CDC。IgG亚类分析结果表明,疫苗诱导了IgG1和IgG2的产生(图3D),IgG1可介导ADCC,IgG2b/c可介导ADCC和CDC,说明抗体具有效应功能。ADCC实验结果示FAP疫苗组血清(1:10和1:50稀释)能够显著诱导细胞死亡,而生理盐水组和KLH疫苗组不能(图3E)。CDC实验显示出同样的结果,FAP疫苗组血清可诱导补体依赖的细胞毒性,效果随稀释度增加而降低(图3F)。小鼠的心脏组织切片结果显示,在AngII/PE组和KLH组,FAP+细胞在心脏组织中大量存在;而在FAP疫苗组,FAP+细胞显著减少,纤维沉积也随之下降(图3G),说明疫苗诱导的抗体在体内确实清除了FAP+成纤维细胞,减轻了心脏纤维化。即FAP疫苗诱导的抗体通过 ADCC 和 CDC 机制有效清除了 FAP+成纤维细胞,从而减轻心脏纤维化。
此外,F4/80染色结果显示巨噬细胞浸润减少(图4A),IgG染色结果显示疫苗诱导的抗体沉积在心脏纤维化区域(图4B),提示抗体确实到达了靶点并发挥作用。这些结果进一步支持了机制:抗体被招募到疾病部位(IgG沉积),通过ADCC/CDC杀伤靶细胞,可能随之减少了继发的炎症细胞(巨噬细胞)浸润。
进一步验证分子水平的机制,研究者探讨了FAP疫苗是否能够在基因表达水平上抑制FAP在心脏组织中的表达。对心脏组织中FAP的蛋白和基因表达进行检测,结果表明:在FAP疫苗组中,FAP的mRNA和蛋白水平均显著下降,和AngII/PE对照组相比差异明显(图4C-E)。同时,纤维化相关基因也被下调,包括胶原基因Col1a1和TGF-β1等关键纤维化驱动因子显著减少;其他肌成纤维细胞标志物(Acta2/α-SMA, Clip, Postn)的表达也呈现下降趋势(图4E)。相关性分析结果显示,FAP表达水平和这些纤维化标志物的表达呈正相关。即疫苗通过减少FAP+成纤维细胞,不仅降低了FAP表达本身,还抑制了下游纤维化基因的表达,进一步支持了“清除FAP+细胞 → 抑制纤维化进程”的机制路径。
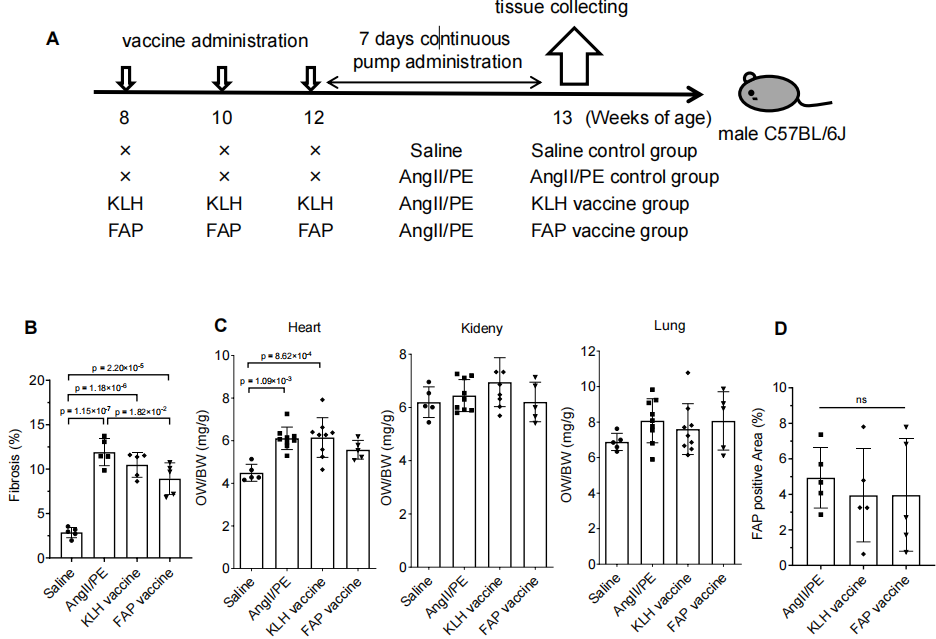
图S6:FAP 疫苗在心脏纤维化早期(给药 7 天)的作用
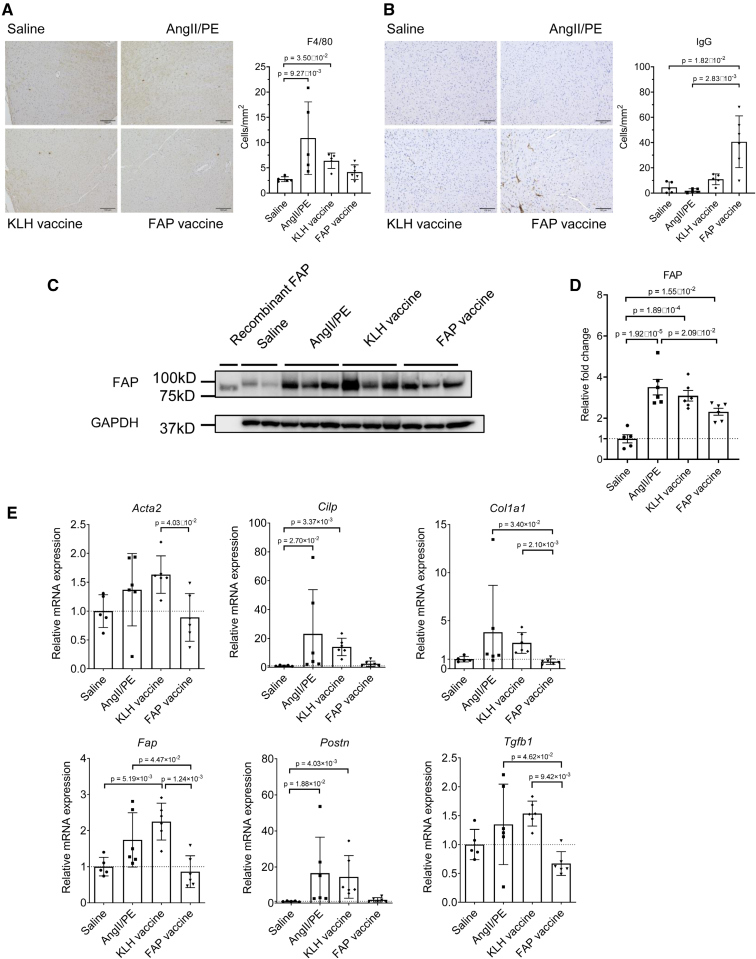
图4:FAP疫苗在心脏组织中的作用效果
(4)安全性评价
由于疫苗通过ADCC/CDC清除FAP+细胞,理论上可能导致细胞裂解,释放炎性因子,从而诱发全身性炎症甚至细胞因子风暴,因此研究者检测了血液中关键炎症细胞因子的水平以探讨FAP疫苗是否会引起全身性炎症反应。结果显示,FAP 疫苗接种后,血清IL-12p70水平升高,但其他促炎细胞因子(IL-6、MCP-1、TNFα)均未升高(图5A),提示疫苗确实激活了Th1型免疫反应,但未引发全身性炎症反应。为评估胰腺毒性,研究者检测了血清淀粉酶水平,结果显示,FAP疫苗接种并未引起血清淀粉酶升高(图5B),说明疫苗接种未引起胰腺炎症或损伤。
由于疫苗诱导抗体沉积在组织中,可能会形成免疫复合物并导致组织损伤,因此研究者探讨了形成抗体免疫复合物的风险。在心、肺、肾等组织中检测IgG沉积情况。在KLH对照组和FAP疫苗组中,均观察到肺泡壁和肾小球中IgG沉积,说明免疫应答后抗体沉积是普遍现象,而非FAP疫苗特有(图5C),尽管FAP疫苗组心脏组织中存在IgG沉积,但并未出现明显的心肌坏死或炎症细胞浸润(图5D)。肺组织H&E染色显示:肺组织中炎症细胞的浸润没有明显差异(图5D),未引起免疫复合物性肺炎等。FAP疫苗组的肺泡壁厚度显著低于AngII/PE对照组和KLH组,FAP疫苗可能还改善了肺组织纤维化或炎症相关的增厚现象,说明它的作用不局限于心脏(图S9A/B)。肺组织中FAP+细胞数量无显著差异,但在疫苗组中有减少趋势(图S9C)。在其他低水平表达FAP的组织(胰腺、皮肤、肌肉等)中,H&E染色未发现坏死或明显损伤(图S10)。即虽然FAP疫苗在心、肺、肾等组织中均可见IgG沉积,但未造成组织损伤或炎症反应;反而在肺组织中有潜在改善作用,整体来看,疫苗在免疫复合物相关风险方面是安全的。
由于皮肤中的一些成纤维细胞表达FAP,而成纤维细胞在伤口愈合过程中具有重要作用,疫苗可能妨碍这一过程,研究者进一步探讨了FAP疫苗是否影响皮肤修复。结果显示,FAP疫苗组在第3天时伤口愈合稍有延迟,但最终与对照组相比,FAP疫苗接种组中并未观察到延迟(图5E/F)。即FAP 疫苗在皮肤修复过程中可能稍微延迟早期阶段的愈合,但不会影响最终愈合结果,整体仍然是安全的。
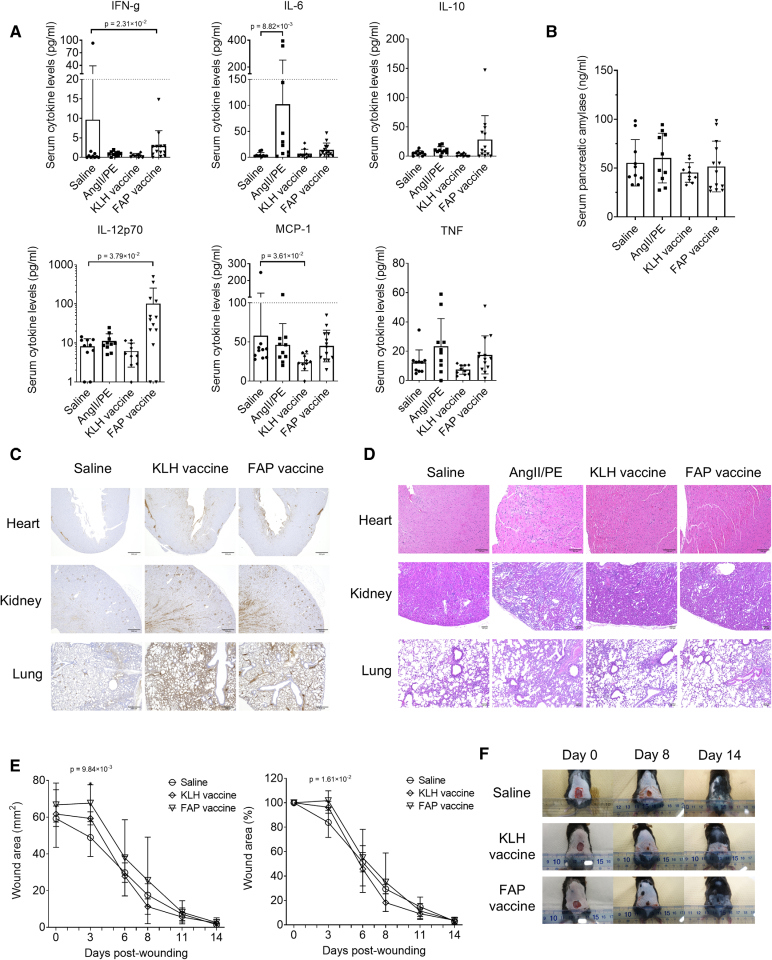
图5:FAP疫苗的安全性评估
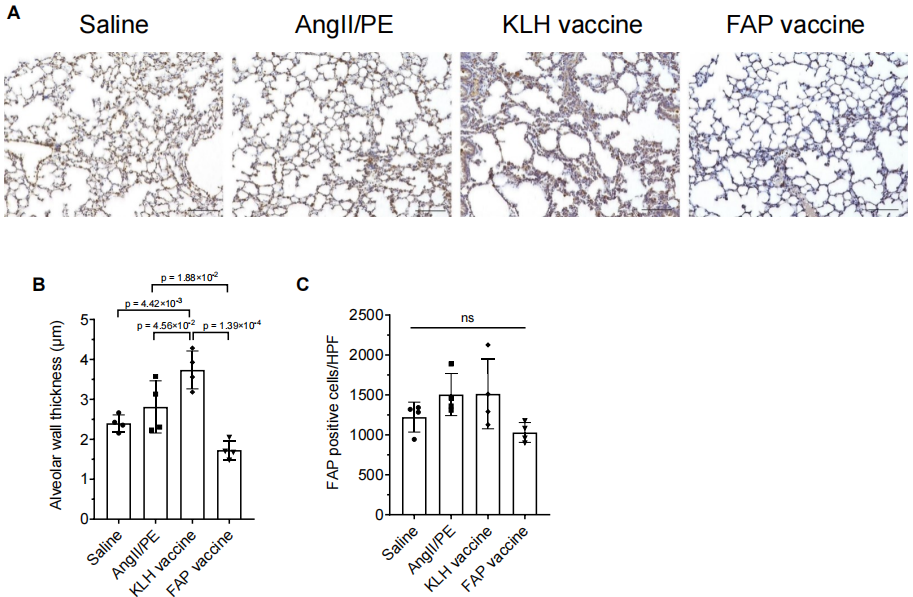
图S9:连续 AngII/PE 给药 28 天后 FAP 疫苗对肺组织的影响
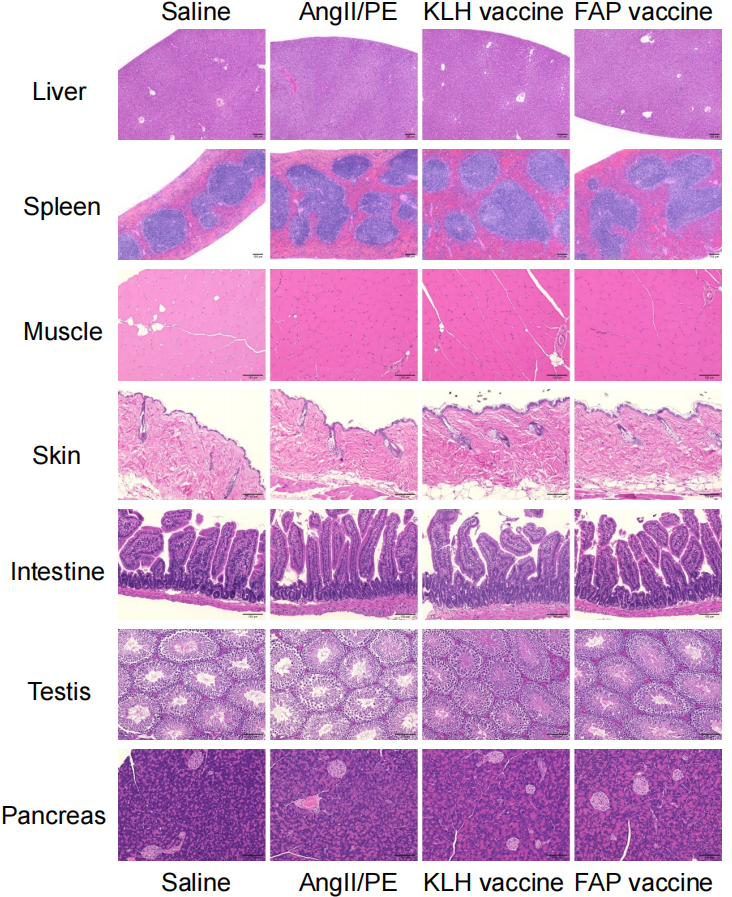
图S10:AngII/PE给药28天后FAP疫苗接种小鼠器官或组织的HE染色
在急性心肌损伤中,肌成纤维细胞的短暂活化对维持心脏的结构稳健性具有重要作用,清除这些细胞可能对心肌修复产生负面影响。因此,研究者探讨了FAP疫苗在急性心肌梗死模型中的效果与风险。8周龄小鼠先接种3次FAP疫苗,然后通过手术结扎冠状动脉诱导急性心肌梗死,模拟“先打疫苗,再突发心梗”的临床情景。存活率分析:MI对照组死亡率为45%(11只死5只),KLH组为9%(11只死1只),FAP疫苗组为33%(12只死4只)(图6A),总体来看,三组之间差异不显著,说明疫苗没有增加急性期死亡风险。通过超声心动图对心功能进行评估:在心梗后7天和28天,三组MI小鼠心功能均下降,且无组间差异(图6B/C),即FAP疫苗既未改善,也未恶化急性期的心功能恢复。免疫组化显示,和慢性模型类似,MI模型中F4/80+巨噬细胞也在纤维化区域聚集(图6D)。FAP疫苗组的心脏纤维化程度显著低于MI对照组,说明即使在急性心梗中,疫苗依然能在组织学上抑制纤维化(图6E)。各组间FAP+区域没有显著差异,但与MI对照组相比,FAP疫苗接种组呈现出减少趋势(图6F)。即在急性心肌梗死模型中,FAP疫苗没有增加死亡风险,也未影响心功能恢复;在组织学水平上仍能减少纤维沉积,但作用有限,这提示FAP疫苗主要适用于慢性纤维化模型。
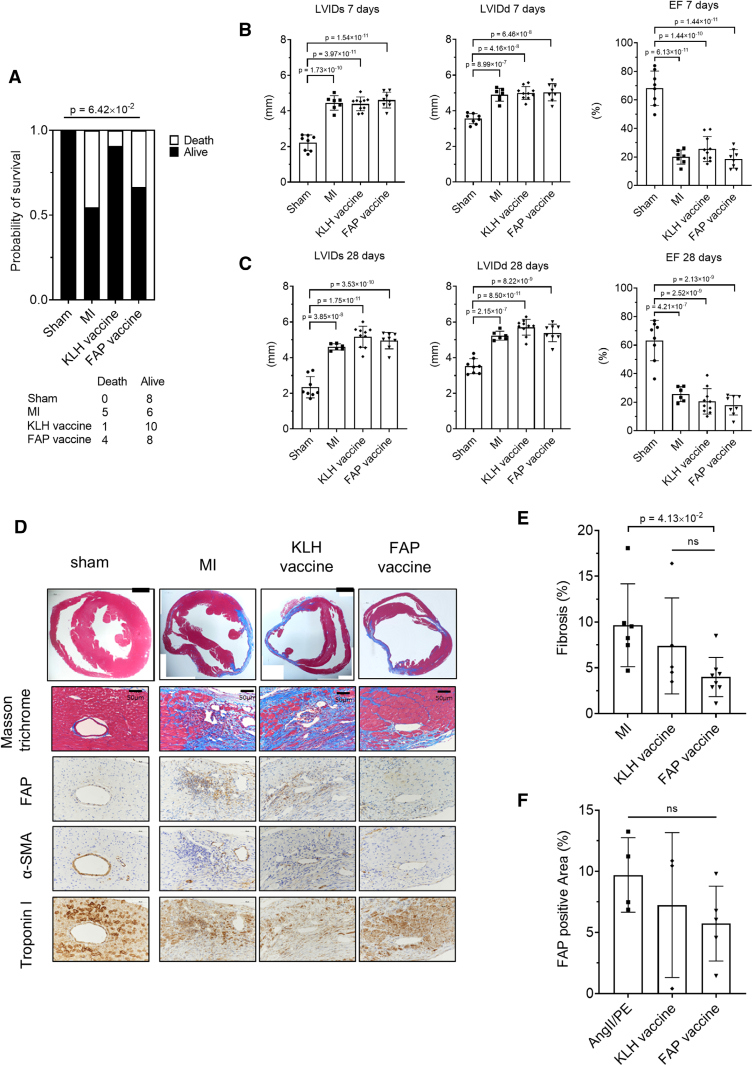
讨论:
该研究揭示了靶向活化成纤维细胞的特异性标志物成纤维细胞活化蛋白(FAP)的疫苗可通过抗体依赖性细胞毒性(ADCC)与补体依赖性细胞毒性(CDC)机制清除FAP+肌成纤维细胞,从而改善心脏纤维化。通过AngII/PE诱导的小鼠慢性心脏应激模型,研究者证实FAP疫苗能有效减少心肌中肌成纤维细胞积累与胶原沉积。与靶向FAP的CAR-T细胞疗法不同,疫苗策略并未引起系统性炎症或器官特异性毒性,且在心肌梗死和皮肤损伤模型中未干扰急性修复过程,提示其具有更优的安全性窗口。
尽管肌成纤维细胞的瞬时活化对组织修复至关重要,但本研究显示FAP疫苗在急慢性损伤模型中均未表现出不良效应,表明其作用于病理性纤维化过程时不影响生理性修复。机制上,FAP疫苗不仅降低了FAP+细胞数量,还协同下调了包括Col1a1、Tgfb1在内的多种纤维化相关基因表达,进一步强化了FAP作为纤维化关键调控分子的地位。值得注意的是,血清中可溶性FAP水平与心脏组织FAP表达无显著关联,提示其不宜作为纤维化程度的可靠生物标志物。
尽管FAP疫苗在心脏纤维化中展现出治疗潜力,其效应存在组织依赖性:研究表明,在肝纤维化中清除FAP+细胞可有效减少肝纤维化;但在特发性肺纤维化中,其效果则取决于干预机制。现有文献报道存在分歧:清除FAP+细胞(CAR-T疗法)会加剧纤维化,而抑制FAP蛋白酶活性(小分子抑制剂)则能改善病情。基于前述矛盾证据,特别是CAR-T疗法的负面结果,研究者推断,采用细胞清除机制的FAP疫苗在肺纤维化中可能具有潜在风险。此外,疫苗诱导抗体所需时间较长,限制了其在急性损伤中的应用。未来可探索FAP mRNA疫苗或联合Th2型佐剂等策略以增强免疫原性与治疗效能。
该研究不仅验证了FAP疫苗作为心脏纤维化治疗工具的可行性,更提供了一种相较于细胞疗法更具安全性、可及性的免疫干预新路径,为慢性纤维化疾病的靶向治疗提供了重要实验依据。

汇报人:厚媛
导师:赵宇
审核:夏轶君、杨柠菲、任建君



