
精读分享│:一种保留胶质瘤微环境的新型类器官模型,用于个性化药物筛选和治疗评价
英文题目:A novel organoid model retaining the glioma microenvironment for personalized drug screening and therapeutic evaluation
中文题目:一种保留胶质瘤微环境的新型类器官模型,用于个性化药物筛选和治疗评价
期刊:Bioactive Materials(IF=20.3)

Abstract
Glioma is an aggressive brain tumor with a poor prognosis. Establishing an in vitro culture model that closely replicates the cellular composition and microenvironment of the original tumor has been challenging, limiting its clinical applications. Here, we present a novel approach to generate glioma organoids with a microenvironment (GlioME) from patient-derived glioma tissue. These organoids maintain the genetic and epigenetic characteristics of the primary tumor and preserve cell-to-cell interactions within the tumor microenvironment, including resident immune cells. Bulk RNA sequencing, whole exome sequencing, and DNA methylation analysis were used to confirm the molecular similarities between the organoids and primary glioma tissues. Immunofluorescence and flow cytometry were used to assess immune cell viability, comparing GlioME with floating glioma organoids. GlioME exhibited high responsiveness to chemotherapy and targeted therapy, demonstrating its potential for therapeutic screening applications. Notably, GlioME accurately predicted patient response to the recently approved MET inhibitor, vebreltinib. Thus, this organoid model provides a reliable in vitro platform for glioma microenvironment-related research and clinical drug screening.
摘要
胶质瘤是一种侵袭性强、预后不良的脑肿瘤。建立一个能精确复制原始肿瘤细胞组成和微环境的体外培养模型一直具有挑战性,这限制了其临床应用。在此,该研究提出了一种利用患者来源的胶质瘤组织生成具有微环境的胶质瘤类器官(GlioME)的新方法。这些类器官保留了原发肿瘤的遗传和表观遗传特征,并维持了肿瘤微环境内的细胞间相互作用,包括驻留免疫细胞在内。通过批量RNA测序、全外显子测序和DNA甲基化分析,确认了类器官与原发胶质瘤组织之间的分子相似性。利用免疫荧光和流式细胞术评估了免疫细胞活性,并将GlioME与悬浮胶质瘤类器官进行了比较。GlioME对化疗和靶向治疗表现出高响应性,证明了其在治疗筛选应用中的潜力。值得注意的是,GlioME准确预测了患者对近期获批的MET抑制剂伯瑞替尼(vebreltinib)的治疗反应。因此,该类器官模型为胶质瘤微环境相关研究和临床药物筛选提供了一个可靠的体外平台。
研究背景:
胶质瘤是最常见的恶性脑肿瘤,以其侵袭性强和预后不良为特征。尽管放疗和化疗有所进展,胶质瘤患者的五年生存率仍然很低。一个重大挑战是缺乏能够准确复制人胶质瘤肿瘤微环境和细胞异质性的实验模型,这限制了对疾病机制的理解和有效疗法的开发。
当前的实验模型包括细胞系、患者来源细胞系(PDCs)和患者来源肿瘤异种移植模型(PDTX)。然而,细胞系无法代表原始肿瘤的复杂性,而PDCs则过于简化,缺乏肿瘤组织的结构和生理学特征。此外,研究显示原代培养细胞与原始肿瘤细胞之间存在差异。PDTX模型虽然有用,但建立耗时、成功率低,并且无法复制免疫系统。患者来源肿瘤类器官作为有前景的三维体外系统近年来崭露头角。这些类器官可在短时间内利用少量组织样本建立,同时保留原始肿瘤的组织病理学和基因组特征。
目前已开发出多种胶质母细胞瘤类器官模型。研究人员利用患者肿瘤组织碎片,采用悬浮培养法创建了可体外传代的患者来源胶质母细胞瘤类器官。其他方法则利用酶消化将肿瘤组织分解成单细胞,然后在基质胶(Matrigel)中培养,使肿瘤细胞自发形成类器官结构。此外,一些研究人员使用人诱导多能干细胞(iPSCs)结合CRISPR-Cas9技术敲除基因(如PTEN和TP53),生成胶质母细胞瘤样类器官。尽管取得了这些进展,复制体内肿瘤微环境仍然具有挑战性。悬浮培养的类器官会随时间推移丢失免疫细胞,而酶消化则破坏了肿瘤内复杂的细胞间相互作用。源于iPSCs的类器官缺乏非肿瘤成分。这些局限性使得这些模型无法保留原始肿瘤微环境,限制了它们在研究胶质母细胞瘤中的应用。迄今为止,尚未开发出能在类器官模型中完全保留胶质母细胞瘤微环境的方法。
为应对这些局限,该研究建立了能够保留肿瘤免疫微环境的胶质瘤类器官。通过全面的组织学、分子和遗传学分析证实,这些类器官与原始肿瘤高度相似,保留了关键生物标志物、相似的免疫细胞和基质细胞比例,以及肿瘤组织和细胞的异质性。该研究还将此方法与另一种利用患者来源肿瘤碎片(无需单细胞解离)创建胶质瘤类器官的方法进行了比较。此外,该研究探索了药物筛选应用,证明这些类器官能够实现高通量药物测试,凸显了其在维持肿瘤免疫微环境以用于治疗研究方面的重要潜力。
研究方法和思路:
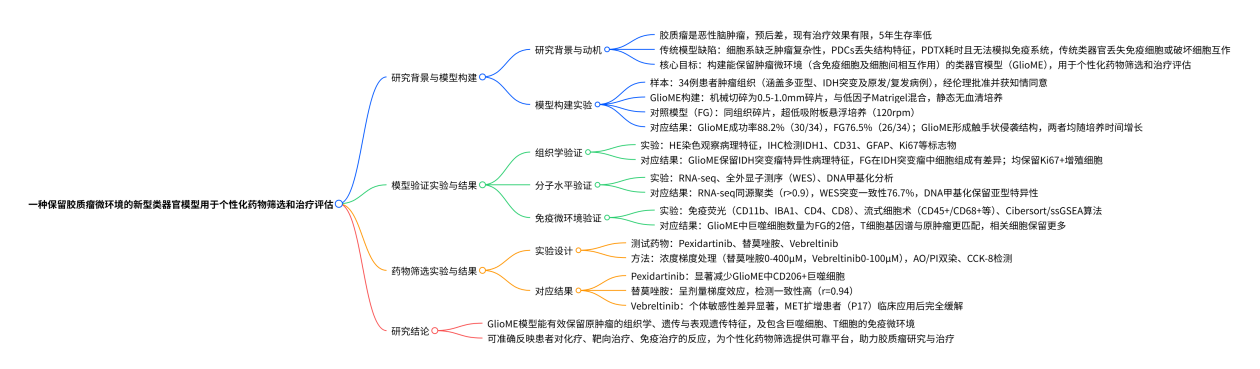
研究结果:
(1)患者源性胶质瘤类器官的培养与表征
为保留肿瘤内细胞成分及相互作用,该研究开发了新型胶质瘤类器官培养方案(GlioME),通过将机械切碎的新鲜肿瘤组织直接接种至低生长因子基质胶,并在无血清培养基(不含EGF/bFGF)中培养,成功从34例患者中建立30例类器官(88.2%),涵盖三种胶质瘤亚型、不同WHO分级及IDH突变/原发/复发样本(图1a,b)。同步建立的悬浮类器官(FGs)成功率为76.5%(26/34)。形态学分析显示:GlioME形成模拟体内侵袭的触手状结构(图1c),而FGs因摇床培养表面更光滑;两类器官均在1-2周内稳定扩增,且第0-2周体积显著增长。慢病毒GFP转染证实类器官内细胞互作优于二维培养(图1d),SEM揭示GlioME保留肿瘤相关巨噬细胞及外泌体(图1e),证实该模型有效维持肿瘤微环境。
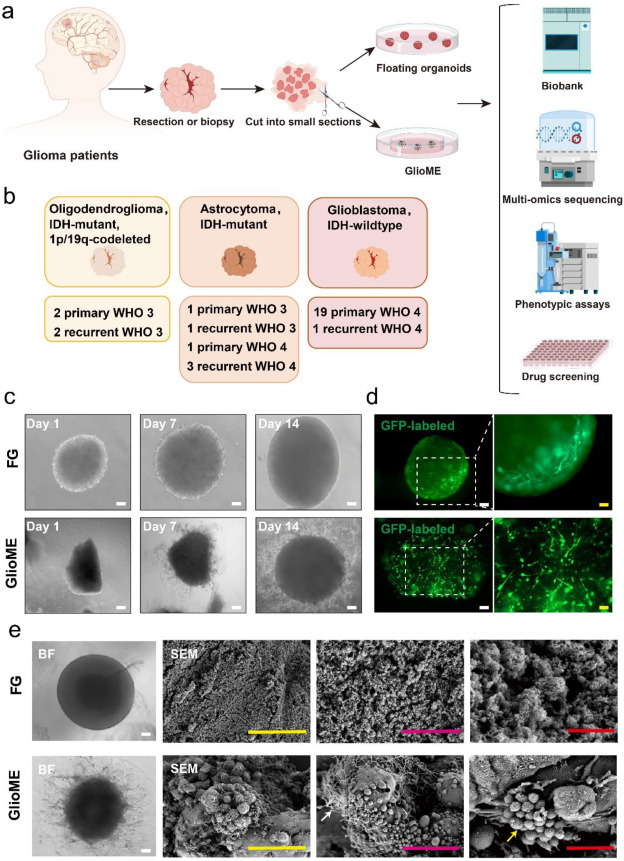
图1:微环境漂浮类器官和神经胶质瘤类器官的建立和形态学表征(GlioME)
(2)胶质瘤类器官与原肿瘤的组织学和免疫组织化学比较
所有类器官均成功复现原发瘤的组织病理学特征与分子模式(图2a)。HE染色显示:在胶质母细胞瘤中,悬浮类器官(FGs)与GlioME均保留异常核分裂、肿瘤细胞异质性及致密排列特征;而在IDH突变型星形细胞瘤中,GlioME特异性保留肥胖型星形细胞(gemistocytes)特征,FGs则因特定细胞过度增殖形成大量颗粒细胞(图2a)。该差异可能源于IDH突变细胞增殖缓慢,而悬浮培养易促进特定细胞过度扩增。关键标记物分析(图2b)证实:两类器官的IDH、GFAP表达模式与原发瘤一致,CD31标记的肿瘤浸润血管内皮细胞均被保留;KI-67染色显示两周内两类器官均维持与原发瘤相似的增殖活性。
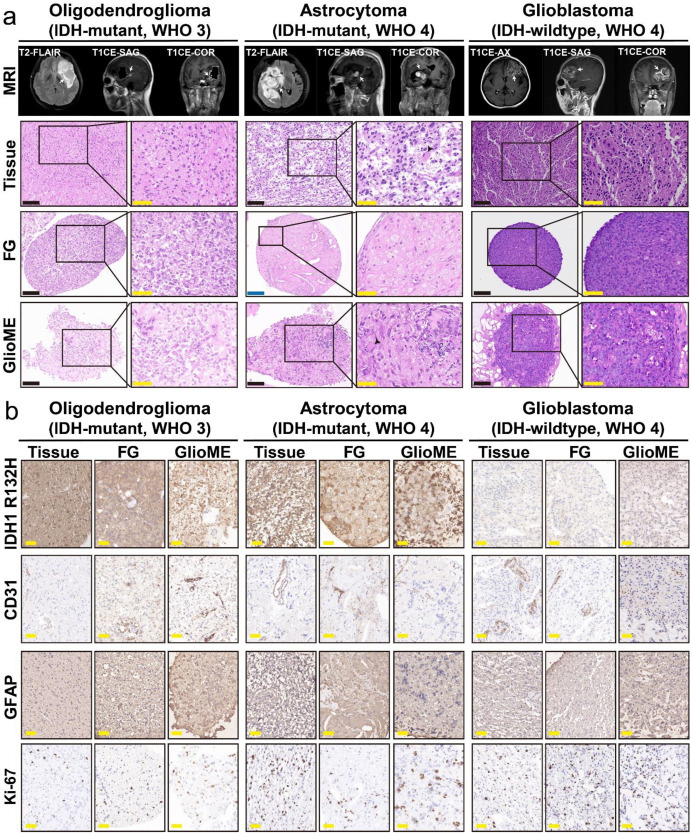
图2:微环境漂浮类器官和神经胶质瘤类器官的建立和形态学表征(GlioME)
(3)神经胶质瘤类器官的基因组分析和分子一致性
为验证类器官是否保留原发瘤遗传特征,该研究通过批量RNA测序(6例)、全外显子测序(4例)和DNA甲基化分析(5例)进行基因组一致性比对(图3a-f)。结果显示:
转录组层面:两类类器官与原始肿瘤RNA-seq高度相关(图3a);基于1421个肿瘤相关基因的无监督聚类显示同一患者样本呈特异性聚集(图3b);
基因组变异:GlioME成功保留胶质瘤常见拷贝数变异(CNVs)及单核苷酸突变(图3c),76.7%突变谱与原发瘤一致(图3d);
表观遗传:少突胶质细胞瘤的肿瘤组织与GlioME在PCA中聚类(图3e),同一患者样本的DNA甲基化模式高度相似(图3f)。
综上,GlioME在体外培养中有效保留了原发瘤的基因组、转录组及表观遗传特征。
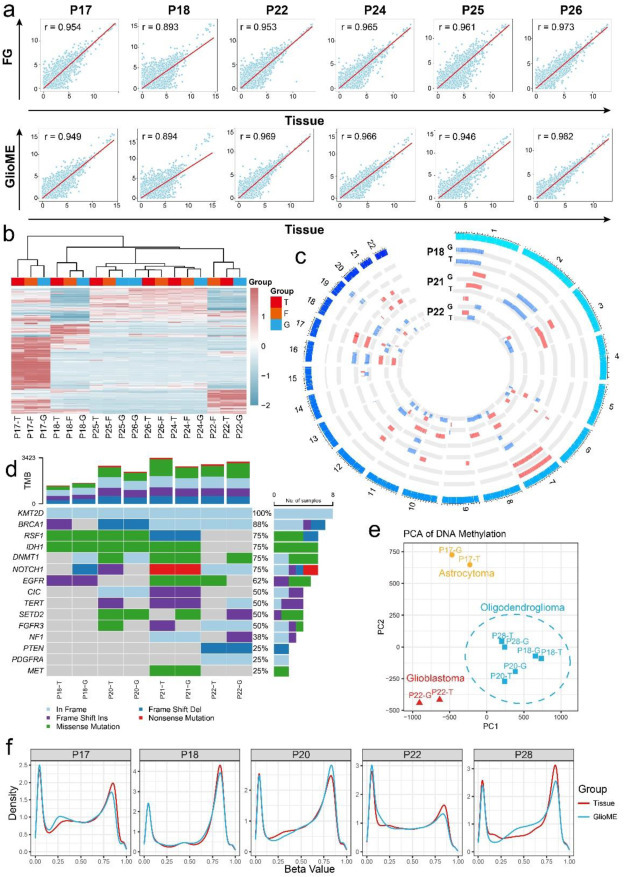 图3:神经胶质瘤类器官在转录组、甲基化和外显子突变谱水平上与原始肿瘤组织保持一致
图3:神经胶质瘤类器官在转录组、甲基化和外显子突变谱水平上与原始肿瘤组织保持一致
(4)神经胶质瘤类器官中的免疫微环境保存
为解析类器官细胞异质性,该研究通过Cibersort-ABS算法解卷积RNA测序数据(图4a),发现培养两周的GlioME较悬浮类器官(FGs)更完整保留肿瘤相关巨噬细胞(TAMs)组成。免疫荧光(CD11b+/IBA1+/TMEM119+标记,图4b)及流式细胞术(10例样本,图4c-d)证实:GlioME中巨噬细胞(CD45+/CD68+)数量约为FGs的2倍。
针对罕见浸润的T细胞,ssGSEA算法显示GlioME的T细胞相关基因表达更接近原发瘤(图5a),IFNG/FOXP3/GZMA/GZMH等标志物表达一致(图5b)。免疫荧光保留更多CD4+/CD8+ T细胞(图5c),流式证实GlioME的CD45+/CD3+ T细胞数量显著高于FGs(图5d-e)。综上所述,GlioME通过内源性保留原发瘤免疫细胞(非外源添加),有效维持肿瘤免疫微环境特征。
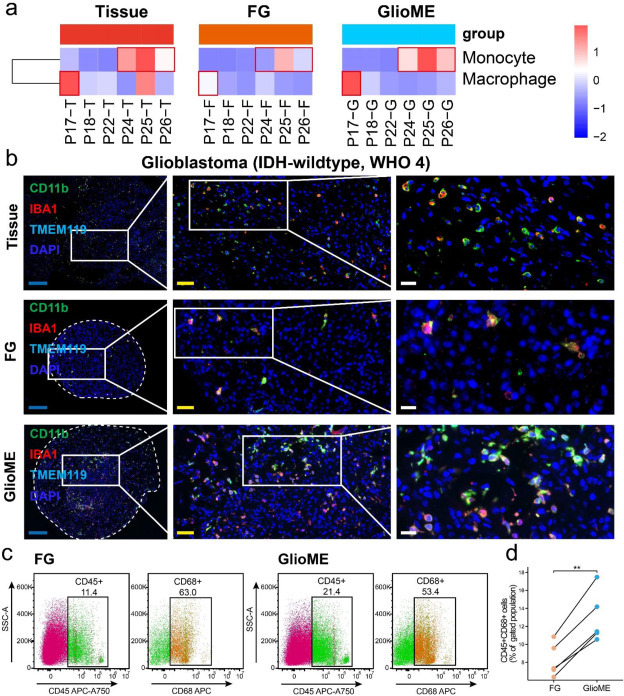
图4:与 FG 相比,GlioME 中巨噬细胞的保留增强
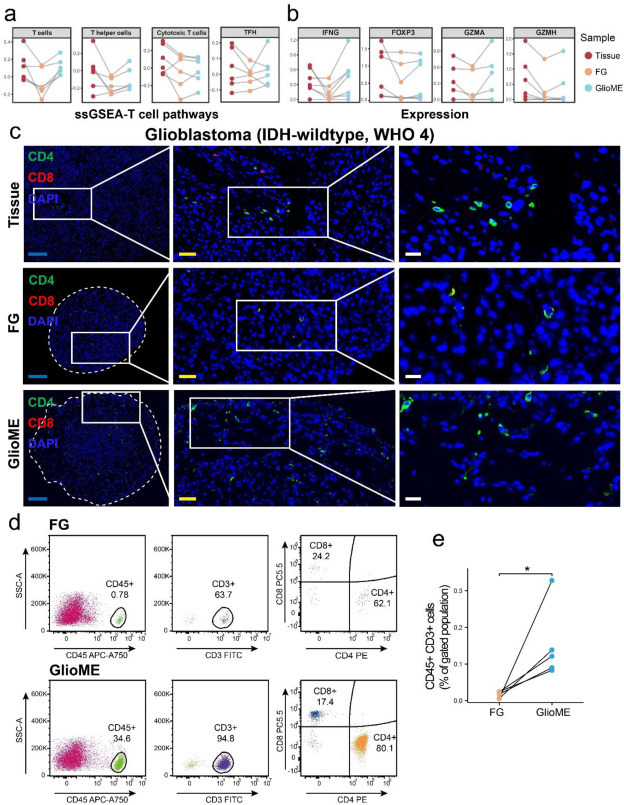
图5:与FG相比,GlioME中T细胞的保留性增强
(5)GlioME的药物筛选和临床意义
为评估GlioME对免疫治疗、化疗及靶向治疗的响应,该研究选用pexidartinib(靶向M2巨噬细胞的CSF1R抑制剂)、temozolomide(胶质瘤标准化疗药物)及vebreltinib(MET抑制剂)进行测试。免疫荧光与流式细胞术显示:1 μM pexidartinib处理6天后,GlioME中巨噬细胞数量显著减少(图6a),CD206+巨噬细胞比例下降(图6b)。针对temozolomide的测试中,AO/PI染色证实两类类器官均反映患者敏感性,并呈现明确剂量梯度效应(图6c)。采用CCK-8法评估六例患者GlioME的药敏性,结果显示不同患者对temozolomide和vebreltinib的敏感性存在差异(图6d-e)。值得注意的是,一例复发左额叶IDH突变星形细胞瘤(CNS WHO 4级)患者的GlioME模型预测其对vebreltinib敏感性高于temozolomide(图6e);临床给予vebreltinib治疗2个月后,MRI显示强化病灶消失、T2病灶缩小(图6g),症状缓解达到完全缓解(图6f),解释了药物响应机制。
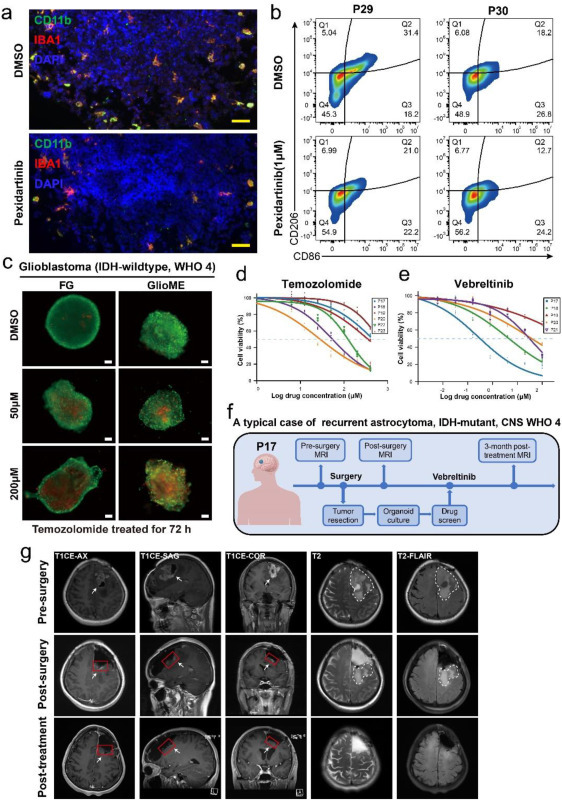
图6:GlioME 作为个性化药物筛选的强大临床前模型
讨论:
胶质瘤因其显著异质性及复杂微环境构成肿瘤学重大挑战,导致缺乏可普适于所有胶质瘤的有效治疗方案。胶质瘤微环境由肿瘤细胞、免疫细胞和基质细胞共同组成,这种复杂细胞环境引发高度异质性及耐药性问题,致使治疗效果难以统一。患者间遗传背景、肿瘤发生机制及分子特征的差异导致相同治疗方案疗效迥异,而单个患者肿瘤内部也存在显著异质性——不同区域细胞呈现表型与基因突变差异,造成药物敏感性分化。该研究开发的新型类器官培养方法成功培养出IDH突变4级星形细胞瘤及其他亚型胶质瘤类器官,为肿瘤异质性研究提供可靠体外模型。两类类器官均保留CD31标记的肿瘤浸润血管内皮细胞,但因缺乏体内血液循环,血管腔塌陷仅存内皮细胞,此为未来需攻克的技术难点。
胶质瘤微环境含大量肿瘤相关巨噬细胞、T细胞等免疫细胞,肿瘤通过重塑免疫细胞使其支持自身生长并抑制抗肿瘤免疫反应。当前多数患者来源类器官构建方法采用酶解组织获取单细胞,但此类类器官难以保留原始组织成分及微环境。保留肿瘤细胞、自体肿瘤相关免疫细胞与基质细胞对药物筛选及模拟体内情境至关重要。为应对这些挑战,该研究提出新型原发/复发胶质瘤类器官培养方案,其核心优势在于:无需组织解离为单细胞,可维持细胞间连接及免疫细胞、内皮细胞等非肿瘤成分。相较于现有模型,常用技术存在固有局限:3D生物打印依赖人工支架且缺乏自体免疫成分;免疫共培养系统引入外源免疫细胞难以重现患者特异性互作;纯肿瘤细胞的基质胶包埋模型缺失基质/免疫要素;基于组织碎片的悬浮培养无法长期维持免疫细胞活性。这些局限凸显了对复杂体内免疫微环境保真度更高的模型需求。
随着培养时间延长,成功培养的类器官与坏死组织形态差异逐渐显著:坏死组织逐渐萎缩失形,而类器官沿基质胶生长形成三维结构。培养成功率主要受肿瘤活性、取样部位及运输时间影响,其中肿瘤活性与取样部位尤为关键。MRI增强区域肿瘤密度高则存活率高,胶质母细胞瘤应避免坏死核心区取样,术者需在显微镜下精准选择肿瘤最密集区域,取样过程依赖采集者与术者的紧密配合。实验过程中避免使用外源性EGF/bFGF及血清,选用低生长因子基质胶以减少生长因子对特定细胞增殖的影响,从而维持与原发瘤相似的细胞比例。HE染色、免疫组化、全外显子测序、DNA甲基化及转录组测序结果证实,培养的类器官在组织学与分子水平均与原发瘤高度相似。区别于悬浮培养法,该方案特异性保留肿瘤浸润免疫细胞(包括巨噬细胞与T细胞),而非与外源永生化免疫细胞共培养。免疫荧光、流式细胞术及基因测序显示类器官保留与原发瘤一致的免疫微环境。GlioME类器官优于悬浮模型的免疫成分保真度可归因于:气液混合系统(Air-Liquid Mixed)的直接氧暴露增强氧敏感免疫细胞(如活化T细胞、巨噬细胞)活力;静态培养环境最小化剪切力促进组织驻留免疫细胞保留;基质胶包埋提供关键三维基质支持,维系细胞间及细胞-基质相互作用——共同构建更稳定且生理相关的微环境。
该研究结果凸显了GlioME作为创新类器官模型的独特优势:相较于传统细胞系与动物模型,其保留的免疫微环境可实现更快速精准的免疫治疗筛选(如CSF1R抑制剂pexidartinib可明确快速清除巨噬细胞)。胶质瘤组织的复杂层级结构加剧治疗难度及耐药复发风险,亟需能精准预测患者耐药风险与治疗响应的个体化平台。本研究基于新型类器官系统进行替莫唑胺与伯瑞替尼(vebreltinib)药物筛选,并将结果应用于临床治疗:GlioME准确预测MET扩增患者对伯瑞替尼的敏感性(尽管MET扩增目前非该药获批适应症),证实其可作为验证药物适应症拓展的有效平台。
综上,该研究证实GlioME可在体外保留胶质瘤原发微环境并可靠测试多种治疗药物,其培养体系至少维持两周稳定性,为深入研究奠定基础。该技术不仅为胶质瘤基础研究提供重要工具,更有助于制定个体化治疗方案。未来研究将持续优化该技术,通过该模型深入解析肿瘤微环境动态变化、探索T细胞/巨噬细胞等免疫细胞的肿瘤杀伤作用,并评估其对不同治疗方案的响应机制。

汇报人:梁艳玲
导师:任建君
审核:谢尔杰、任建君



