
精读分享│【Molecular Therapy】:AAV介导的特异性Gjb2联合表达可恢复DFNB1小鼠模型的听力
英文题目:Combined AAV-mediated specific Gjb2 expression restores hearing in DFNB1 mouse models
中文题目:AAV介导的特异性Gjb2联合表达可恢复DFNB1小鼠模型的听力
期刊:Molecular Therapy(IF=12.1)

Abstract
Pathogenic mutations in the Gjb2 gene, encoding connexin 26, are the leading cause of autosomal recessive hereditary deafness. Gene therapy holds significant promise for treating this. Adeno-associated virus (AAV)-mediated therapeutic gene delivery has been shown to be safe and effective in restoring hearing in both animal models and human patients. However, Gjb2 gene therapy has been hindered by the limited specificity and efficiency of the available AAV vectors. In this study, we screened AAV serotypes and found that co-administration of AAV1 and AAV-ie could effectively target Gjb2-expressing cells. However, the ectopic Gjb2 expression in hair cells induced by these AAVs could cause ototoxicity, which was addressed by employing the specific promoter SCpro. Co-injection of AAV1 and AAV-ie carrying exogenous Gjb2 driven by SCpro effectively restored hearing function in Gjb2-deficient mice. Moreover, the combined AAV system can transduce the cochleae of Bama miniature pigs and AAV administration into the inner ear of cynomolgus monkeys did not impair hearing and showed negligible systemic toxicity, indicating the efficiency and safety of this gene therapy in large animals. Thus, this study provides a strategy for Gjb2 gene therapy and lays a foundation for future clinical applications.
摘要
编码连接蛋白26(Cx26)的Gjb2基因的致病性突变是常染色体隐性遗传性耳聋的主要病因。基因治疗为该类遗传性耳聋提供了突破性解决方案,其中腺相关病毒(AAV)介导的治疗性基因递送已被证明可安全且有效地在动物模型和人类患者中恢复听力。然而,现有AAV载体在靶向特异性及递送效率上仍具有局限性。本研究通过系统性筛选AAV血清型,发现AAV1与AAV-ie联合给药可高效靶向表达Gjb2的耳蜗细胞。然而,常规AAV递送导致的Gjb2在毛细胞中的异位表达可能引发耳毒性,为解决这一问题,研究团队采用了特异性启动子SCpro。联合注射携带了由SCpro驱动Gjb2外源性表达的AAV1与AAV-ie双载体系统,可有效恢复Gjb2缺陷小鼠的听力功能。此外,该联合AAV系统不仅能转导巴马小型猪耳蜗靶细胞,且食蟹猴内耳给药后未观察到听力损伤,并显现出可忽略的全身毒性。综上,本研究提出了一个可突破Gjb2基因治疗载体靶向性与安全性限制的新策略,并为未来的临床应用奠定了坚实基础。
研究背景
超过50%的新生儿先天性耳聋由遗传缺陷引发,其中非综合征型占比最高,而Gjb2基因是首个被证实与该类型耳聋相关的致病基因。其不同突变可导致常染色体隐性遗传性耳聋1(DFNB1),通过影响连接蛋白26(Cx26)功能引发程度不一的先天性听力损失。Cx26在耳蜗支持细胞、血管纹等组织表达,通过与Cx30形成上皮及结缔组织间隙连接网络,维持内耳高K离子平衡及毛细胞机械转导电流,对耳蜗生理功能至关重要。
尽管Gjb2突变导致约20%的儿童耳聋,但目前仍缺乏有效而安全的生物疗法。当前主要的治疗方案(如人工耳蜗)存在听觉质量恢复不全、复杂环境适应差、依赖外部设备及高成本等局限。
腺相关病毒(AAV)介导的基因治疗在遗传性耳聋领域展现突破性进展,已被成功应用于常染色体隐性耳聋9(DFNB9)小鼠模型及患者,为DFNB1(Gjb2突变相关)治疗提供了新方向。然而,现有AAV载体面临靶向性不足的挑战:通用启动子(如CAG)驱动的Gjb2表达会引发毛细胞异位毒性,导致野生型小鼠听力损伤,这凸显了特异性靶向的必要性。
本研究开发了联合AAV策略:利用AAV-ie高效转导耳蜗柯蒂氏器(OC)以及AAV1靶向耳蜗外侧壁(LW)的特点,结合特异性启动子SCpro限制Gjb2表达,避免异位毒性。实验显示,该策略成功恢复了两种Gjb2缺陷小鼠模型的Gjb2表达及听觉功能。研究者进一步在大型动物(Bama微型猪、食蟹猴)中验证了转导效率、评估了安全性。本研究为AAV-Gjb2基因疗法的临床转化奠定了关键基础。
研究方法和思路
研究结果
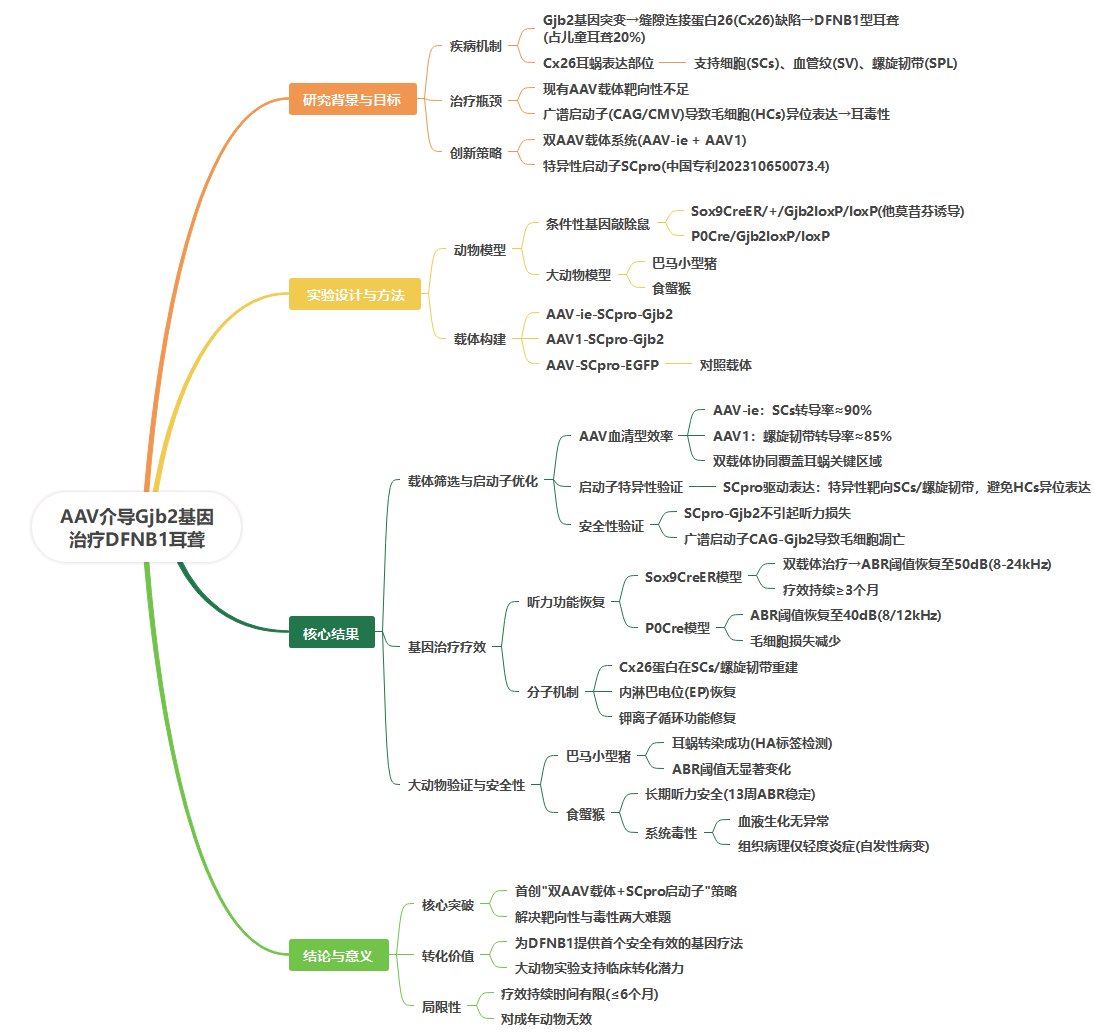
(1)Gjb2条件性敲除小鼠的产生和表征
本研究成功构建了Gjb2条件性敲除小鼠模型,为解析Gjb2基因功能及评估基因治疗效果提供了可靠工具。首先,研究者使用了基于Sox9-CreER系统(Sox9-CreER; R26R-tdTomato)的双基因敲入小鼠,通过他莫昔芬诱导实现Gjb2基因的组织特异性敲除。处理后结果显示,大多数耳蜗感觉上皮细胞及外侧壁(LW)组织(包括Gjb2原表达区域)呈现强烈的tdTomato荧光。
在此基础上,对出生后3天(P3)的Sox9-CreER; Gjb2loxP/loxP小鼠进行他莫昔芬诱导,于P30通过免疫荧光染色检测Cx26蛋白表达,结果显示耳蜗柯蒂氏器(OC)及外侧壁区域的Cx26蛋白水平较野生型(WT)小鼠显著下调。听觉功能评估(听性脑干反应,ABR)显示,他莫昔芬诱导后小鼠听力阈值显著升高,提示听力损伤。进一步分析内耳生理功能,Gjb2缺失导致内淋巴钾循环障碍,内耳电位(EP)从正常的100 mV降至40 mV,直接印证了Gjb2在维持耳蜗离子平衡中的关键作用。形态学观察显示,诱导后1个月的小鼠外毛细胞(OHC)数量轻度减少,内毛细胞(IHC)无明显丢失;但至诱导后3个月,OHC与IHC均出现严重退化。综上,Sox9-CreER; Gjb2loxP/loxP条件性敲除小鼠完整复现了Gjb2纯合突变的病理表型,是评估AAV-Gjb2基因治疗效果的理想模型。
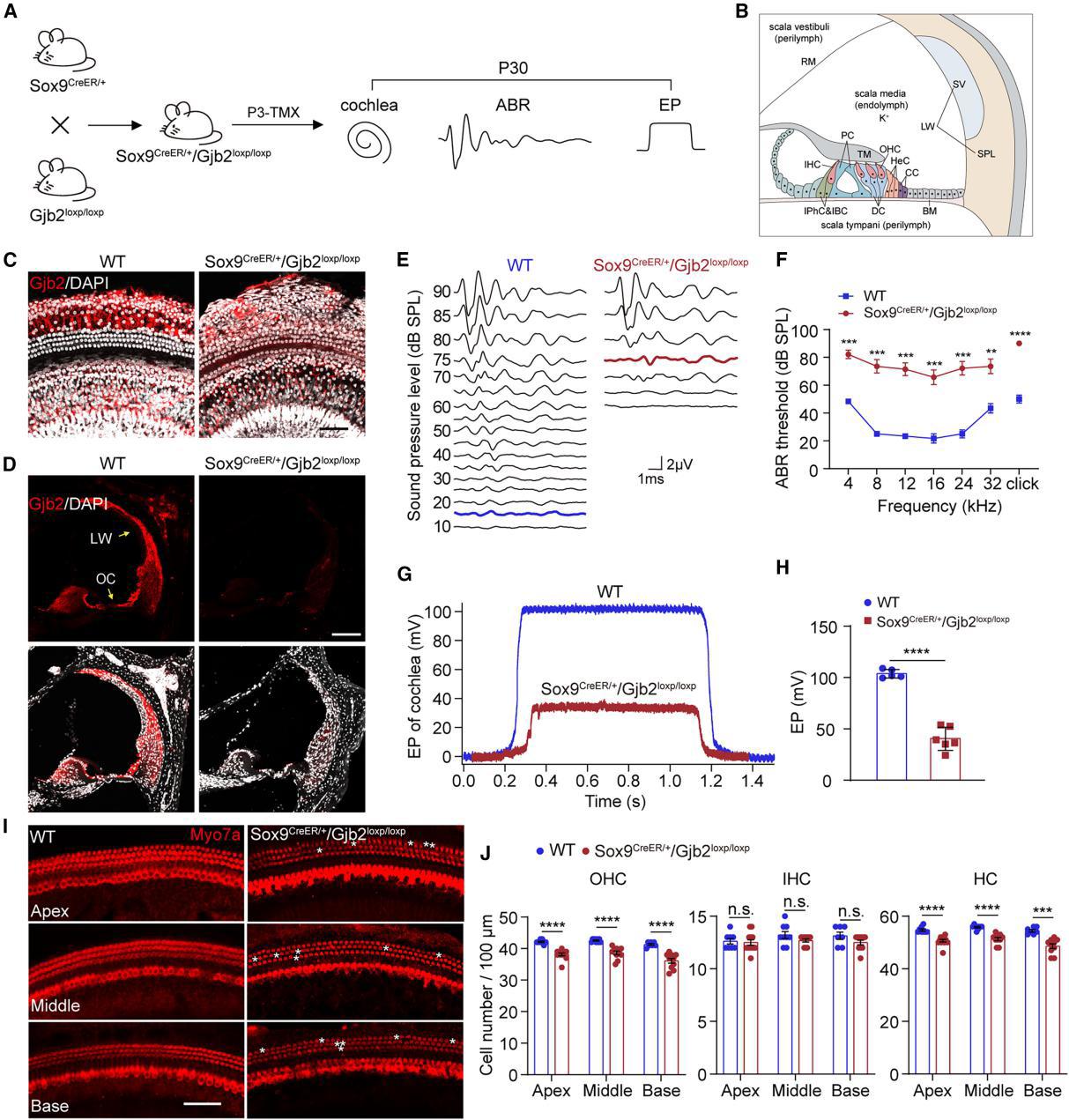
图 1. Sox9 cre/+/GJB2 loxP/loxP小 鼠
(2)用于Gjb2基因治疗的AAV血清型鉴定
为明确Gjb2基因治疗的最佳AAV血清型,本研究系统评估了AAV1、AAV-DJ和AAV-ie在耳蜗中的转导效率。AAV1作为一种广泛应用的天然血清型,已被证实可感染多种内耳细胞类型,包括毛细胞(HCs)、支持细胞(SCs)及血管纹;重组AAV-DJ血清型则具有感染内耳HCs、SCs、齿间细胞及根细胞的能力;而AAV-ie作为AAV-DJ的衍生血清型,在前期研究中被确认为靶向SCs的最有效血清型。
实验采用等剂量携带绿色荧光蛋白mNeonGreen的AAV1、AAV-DJ和AAV-ie,通过圆窗膜注射至野生型P1小鼠耳蜗,并于P7收获耳蜗以评估荧光分布及转导效率。结果显示:AAV-ie在支持细胞(包括Deiters细胞、柱细胞及内指骨细胞/内边界细胞)中具有约 90% 的转导效率;AAV-DJ对支持细胞的转导效率为70%-90%;而AAV1在IPhCs/IBCs中的转导效率约为65%,但在其他类型内耳支持细胞中仅为约8.5%。耳蜗冰冻切片分析进一步表明,AAV-ie、AAV1和AAV-DJ在外侧壁(LW)中的转导效率均约为 75%。上述结果表明,AAV-ie与AAV1联合应用可高效靶向耳蜗感觉上皮支持细胞及外侧壁区域的细胞。
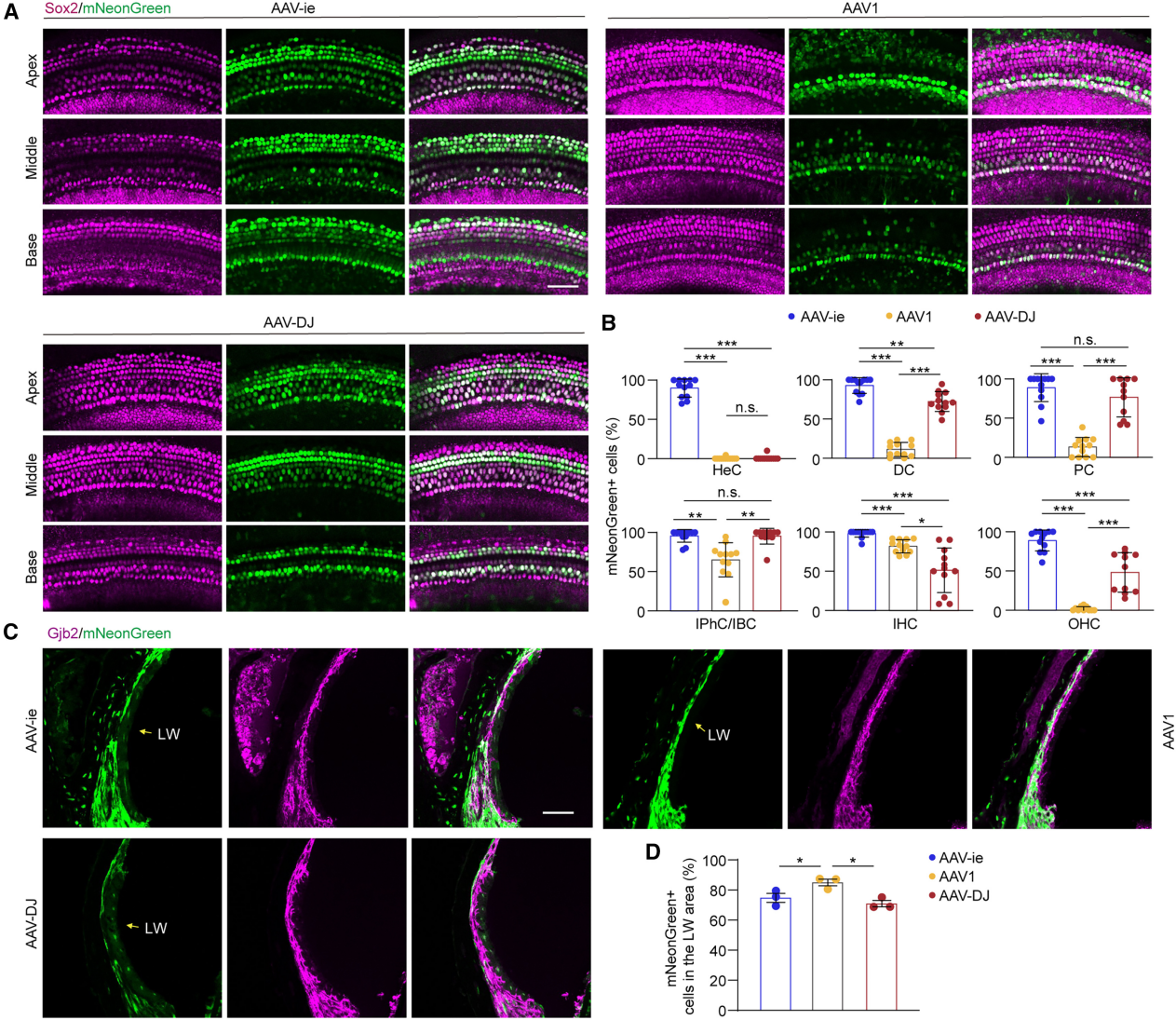
图 2 AAV 血清型筛查
(3)特异性启动子驱动小鼠耳蜗中Gjb2的安全且特异性表达
CAG、 CMV和CBA等普遍存在的启动子通常用于人工耳蜗基因治疗中的转基因递送。然而,HC中通用CAG启动子驱动的Gjb2异位表达会导致细胞和听觉损伤。为了确认异位Gjb2表达的毒性,研究者将CAG驱动的Gjb2注射到WT新生小鼠体内。正如预期的那样,小鼠表现出听力损失。免疫荧光结果表明,CAG启动子诱导了HCs中Gjb2的异位表达,小鼠在耳蜗的顶端和中转区域中显示出HCs的数量显著减少。随后,评估了Gjb2在HEI-OC1细胞中的毒性。活细胞成像显示,与对照组相比,Gjb2过表达后HEI-OC1细胞数量减少,TUNEL染色表明Gjb2过表达可诱导HEI-OC1细胞凋亡。这些结果表明,由通用启动子驱动的异位Gjb2表达会导致HCs损伤和听力损失。因此,将外源性Gjb2递送到内耳需要使用特定的启动子,以最大限度地减少脱靶效应。
研究团队之前构建了一种耳蜗特异性启动子SCpro(中国专利号 202310650073.4)。为了评估SCpro在整个耳蜗中的表达范围,研究者在SCpro的控制下将携带mNeonGreen的AAV-ie载体注射到WT新生小鼠的耳蜗中。携带SCpro的AAV在SC中实现了较高的转导效率。重要的是,在HCs中未观察到mNeonGreen表达,从而证明了耳蜗内SCpro活性的特异性。鉴于Gjb2在LW中的高表达,团队还评估了SCpro在耳蜗LW组织中的活性。携带SCpro的AAV-ie和AAV1血清型均诱导LW细胞中的mNeonGreen表达。值得注意的是,与AAV-ie相比,携带SCpro的AAV1表现出更好的转导效率,这与对携带CAG启动子的 AAV 的观察结果一致。
接下来研究评估了SCpro驱动的Gjb2表达的安全性。将AAV-ie-SCpro-Gjb2和对照AAV(AAV-ie-SCpro-EGFP)以及相同剂量的AAV-ie-CAG-Gjb2注射到WT新生小鼠体内,并在注射后1-2个月进行ABR试验。正如预期的那样,SCpro两组之间没有显着差异,而CAG组表现出听力损失。免疫荧光分析也显示HC计数没有显著变化。这些结果表明,在小鼠耳蜗中由SCpro驱动的Gjb2过表达不会损害听觉功能。
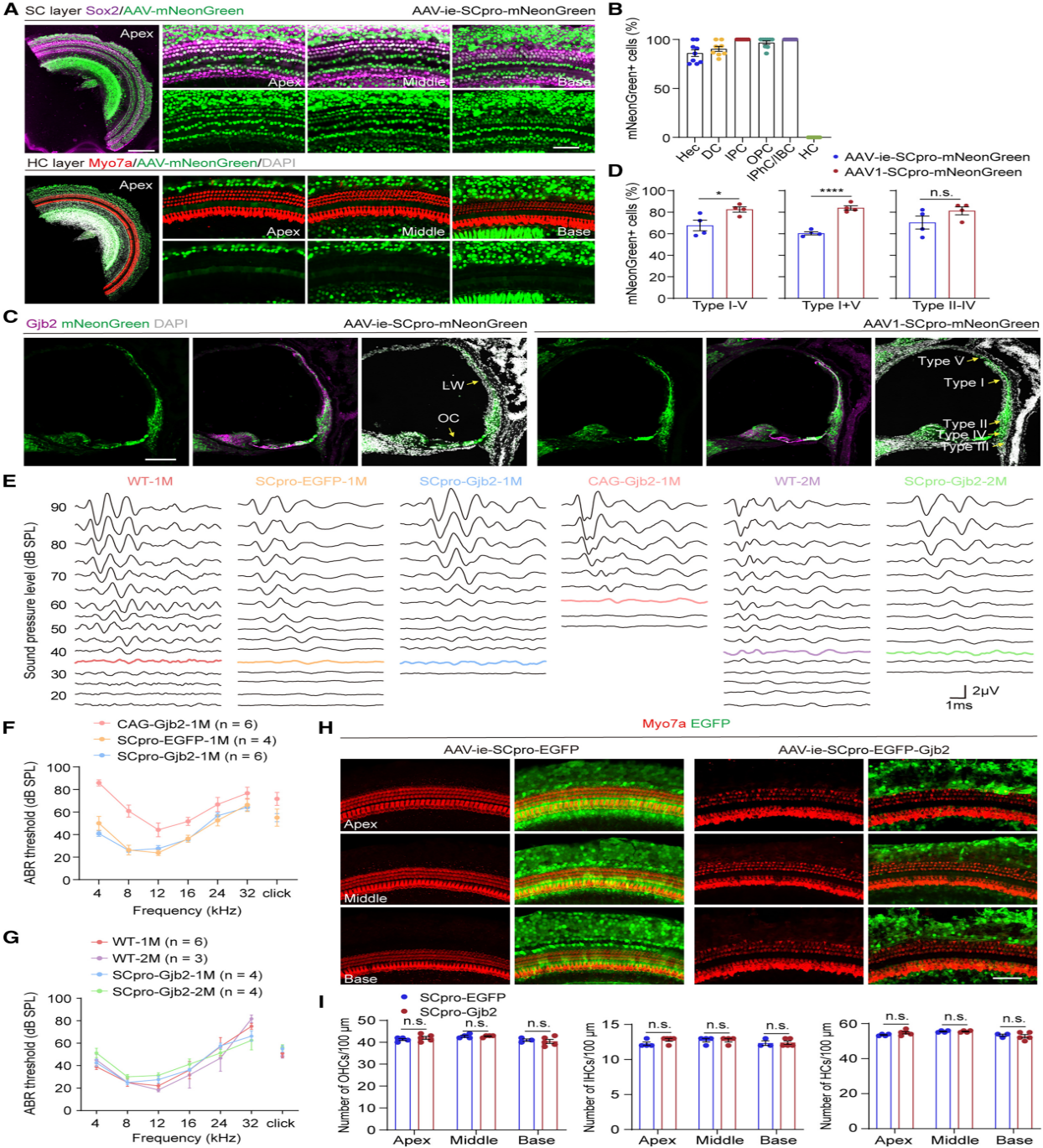
图3. 特异性启动子SCpro介导的转基因表达
(4)联合AAV介导的特异性Gjb2重表达有效恢复了Sox9 cre/+/Gjb2 loxP/loxP小 鼠听力
为实现Gjb2基因治疗的特异性和高效性,本研究采用AAV-ie-SCpro-Gjb2和AAV1-SCpro-Gjb2病毒单独或联合(1:1比例)通过圆窗注射至Sox9CreER/+/Gjb2loxP/loxP新生小鼠耳蜗,并于P3时给予他莫昔芬诱导。术后1个月的评估显示,双AAV联合治疗组在不同频率(特别是8-24kHz)的听力得到明显恢复,该频率区间平均听阈恢复至约50dB。虽然单载体治疗(AAV-ie或AAV1)也能实现部分听力改善,但其效果显著低于联合治疗组。值得注意的是,联合治疗组的听力恢复效果可持续至少3个月,但6个月后疗效消失。进一步的时效性研究表明,P14给药可实现听力恢复,而P30给药则无效。
免疫荧光分析显示,与未注射的耳朵相比,注射耳朵的OC和LW区域的Gjb2表达显著恢复。此外,EP测试显示注射耳蜗中的EP显著改善。OHC计数和扫描电子显微镜(SEM)显示,Gjb2的重新表达减轻了HC丢失,并可能预防注射耳蜗中回合底回处的HC静纤毛紊乱。
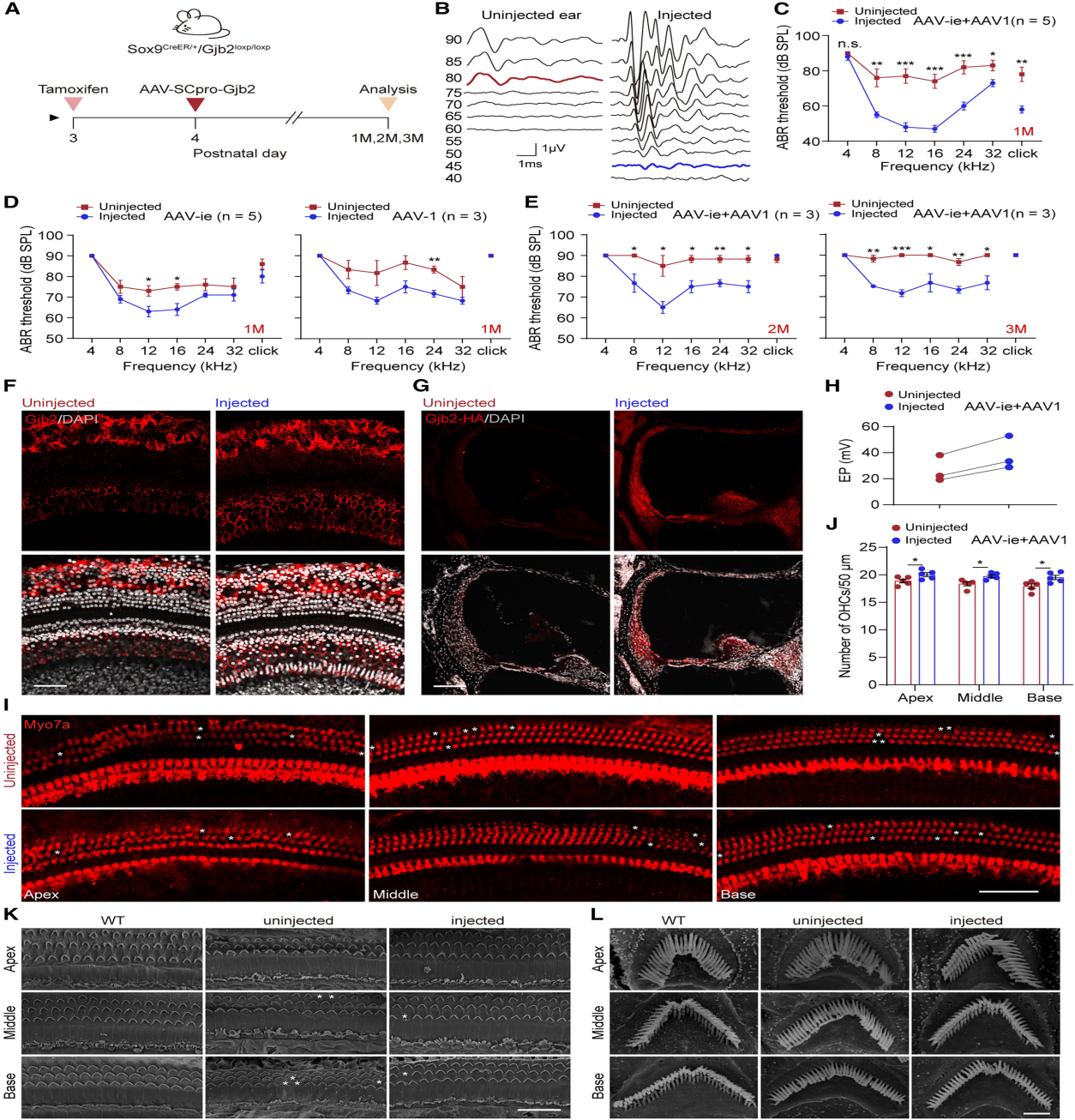
图4. 通过组合 AAV 系统恢复 Sox9cre/+/GJB2loxP/loxP小鼠听力
(5)AAV介导的特异性Gjb2重表达联合有效恢复了P0Cre/Gjb2loxP/loxP小鼠听力
为验证研究结果的普适性,研究者在P0Cre/Gjb2loxP/loxP小鼠模型中进行了实验。将AAV-ie-SCpro-Gjb2和AAV1-SCpro-Gjb2病毒(1:1比例)通过圆窗注射至新生小鼠耳蜗,1个月后的ABR检测显示所有测试频率的听力均得到恢复,其中8-12kHz频率的听阈改善最为显著,恢复至约40dB。长期随访显示,治疗效果部分可维持至3个月。值得注意的是,在P14小鼠中进行的相同治疗未能产生治疗效果。在新生小鼠治疗一个月后,EP测试显示注射的耳蜗有明显改善。免疫荧光分析显示,相对于未注射的耳朵,注射耳朵的OC和LW区域的Gjb2表达显着恢复。OHC计数和SEM显示,Gjb2的再表达明显减轻了HC丢失,并可能预防注射耳蜗中转和底转的HC静纤毛降解。这些结果共同证明,这种基因治疗方法可以在两种Gjb2缺陷小鼠模型中部分实现听力恢复。
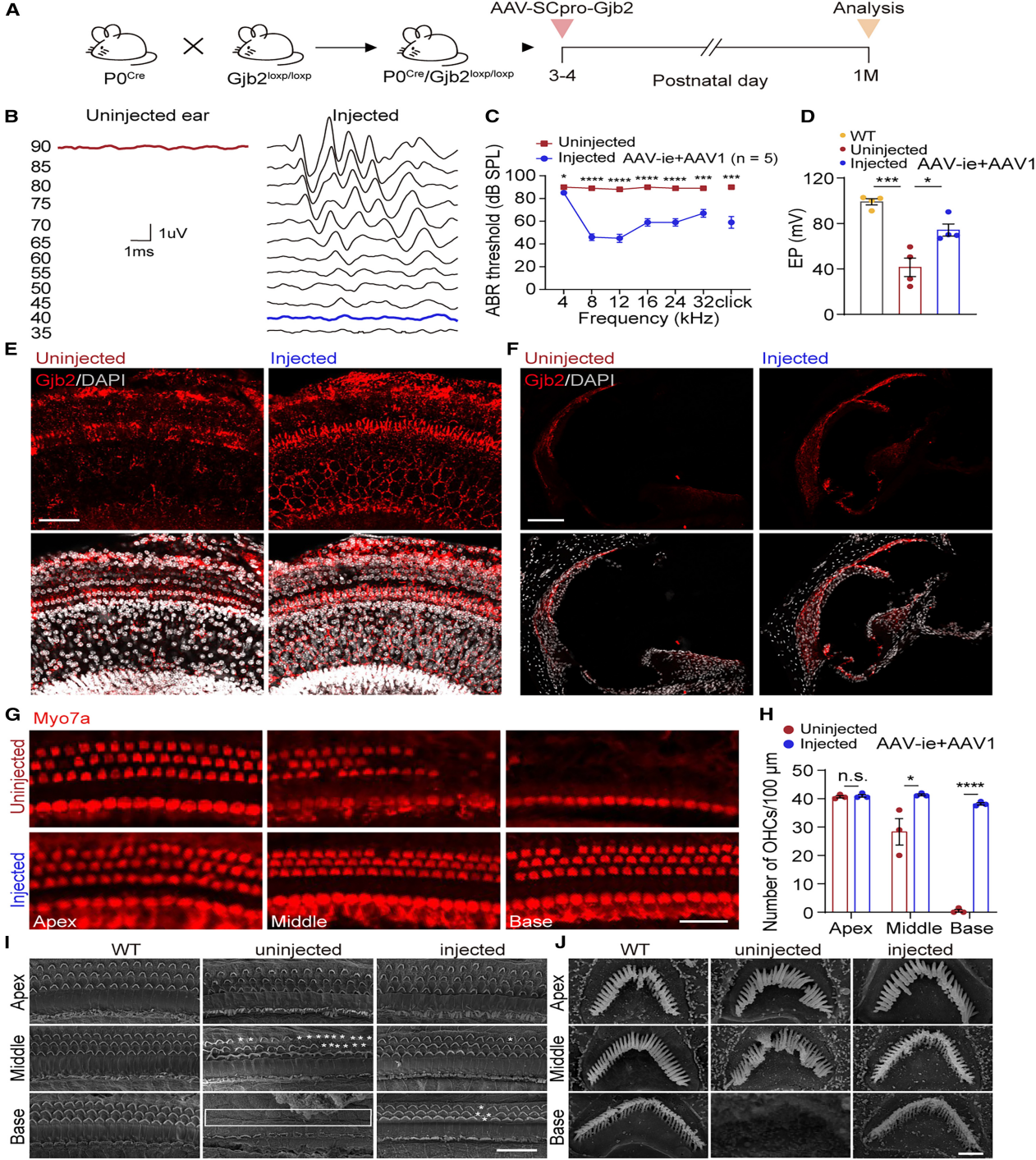
图5. 使用组合AAV系统恢复P0Cre/GJB2loxP/loxP的小鼠听力
(6)AAV-Gjb2基因治疗在大型动物中的转导及安全性评价
为推进Gjb2基因治疗的临床转化,本研究在大型动物模型中系统评估了AAV载体的转导效率与安全性。在巴马小型猪中,研究者通过圆窗膜将组合 AAV 注射到耳蜗中,并在手术前和注射后10天进行ABR 测量。结果表明,与术前听力水平相比,注射后10天所有测试频率的ABR阈值差异不显著。为了可视化外源性Gjb2表达,研究将血凝素(HA)标签添加到Gjb2的C末端。使用HA标签抗体的免疫荧光结果显示,外源性Gjb2在注射耳的OC和LW区域部分表达。
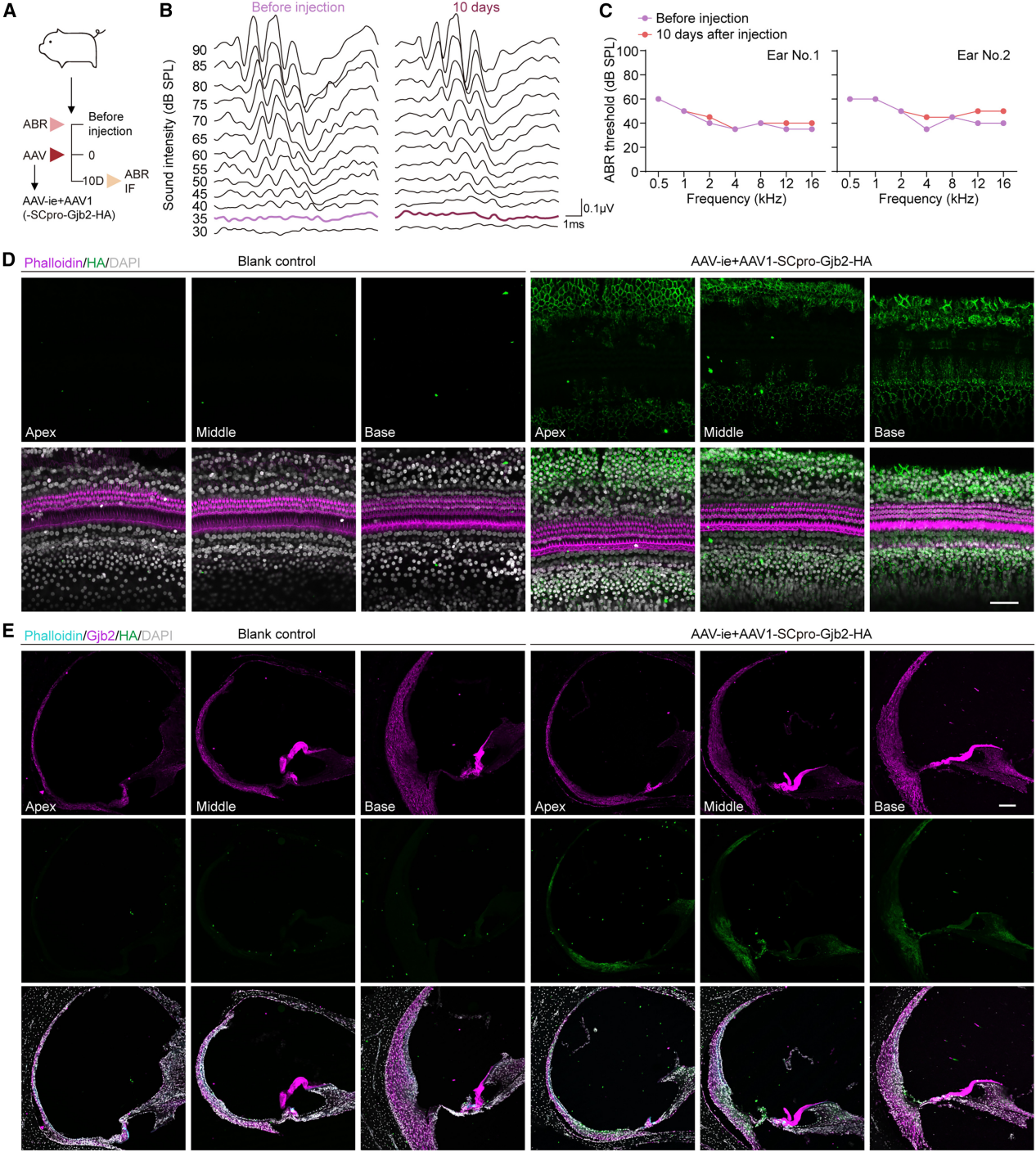
图6. 联合AAV在巴马小型猪耳蜗中的转导效率评价
接下来,在食蟹猴的长期听觉安全性和全身毒性评估中,研究者将AAV-ie-SCpro-Gjb2和AAV1-SCpro-Gjb2混合物局部递送至内耳后,在手术后的不同时间进行ABR测量。与术前听力水平相比,在注射后2、4、8和13周,所有测试频率的ABR阈值没有统计学上的显著差异。这些发现表明,联合注射AAV不会对食蟹猴的正常或长期听觉功能产生不利影响,从而证实了其听觉安全性。
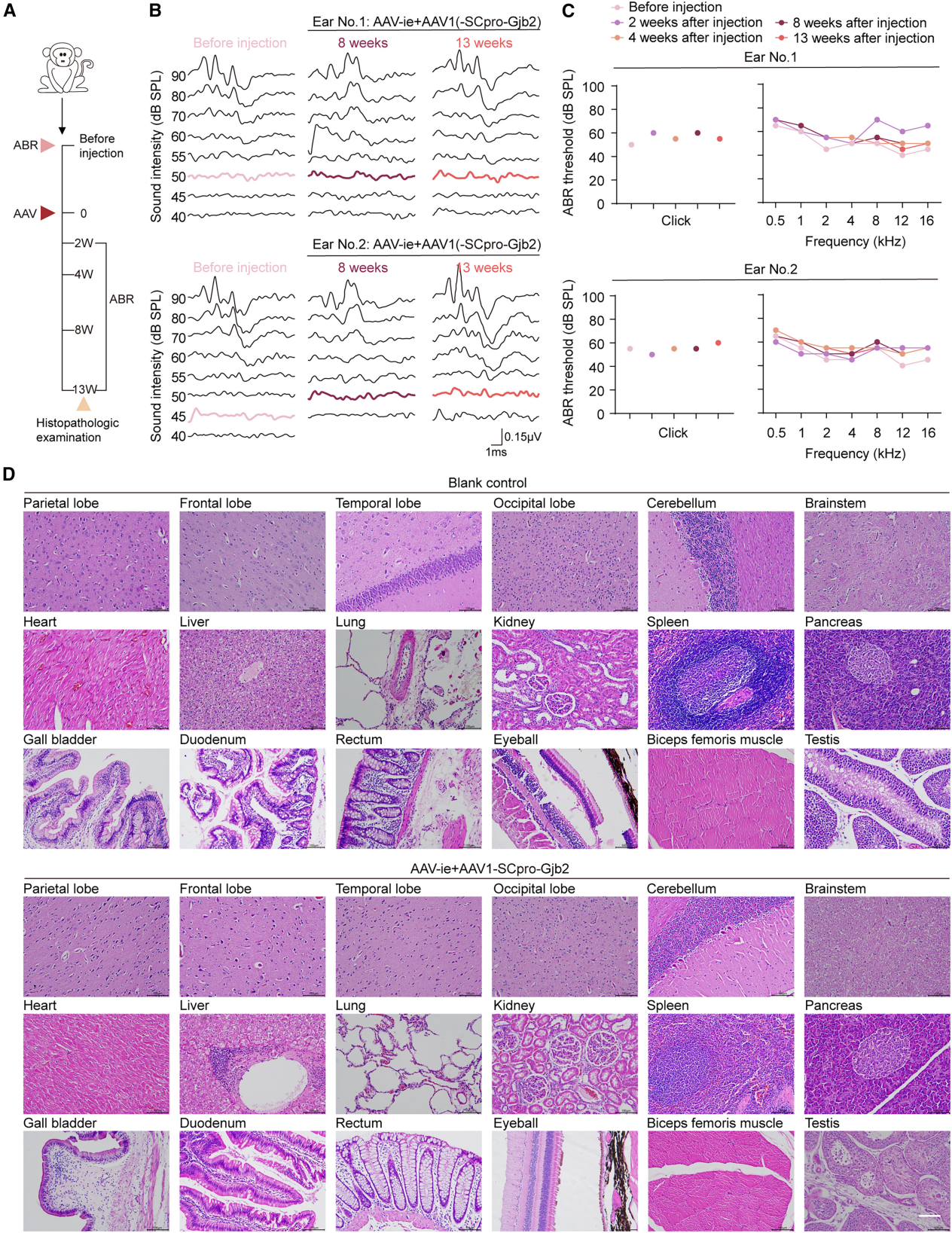
图7. Gjb2过表达不会诱导食蟹猴的听力损失或组织病变
在第13周进行ABR检测后,收集血样用于常规血液学和生化分析。与对照血样相比,未观察到明显异常。随后评估各器官的炎症反应和病理变化,结果表明肝脏和胆囊有轻度炎症细胞聚集和浸润。考虑到背景病变在非人类灵长类动物中很常见,这些发现表明这些病变是自发的,不能归因于病毒注射。总之,研究结果证实了该基因治疗方法治疗Gjb2相关听力损失的临床适用性。
讨论
既往研究表明,在多种Gjb2缺陷小鼠模型中采用AAV介导的基因治疗仅能实现有限的听力恢复。本研究推测这些不理想的结果可能源于AAV载体选择不当和启动子效率不足。基于Gjb2在耳蜗中的广泛表达模式及其在毛细胞(HCs)中异位表达导致的毒性效应,本研究系统性筛选了高效的AAV血清型并评估了特异性启动子的适用性。结果表明,携带特异性启动子的双AAV载体系统可实现内耳Gjb2的高效精准表达,显著改善Gjb2缺陷小鼠的听觉功能。
Gjb2缺失会破坏胚胎营养物质转运,导致发育缺陷,因此纯合突变体无法存活。现有条件性敲除小鼠模型(如Cx26 Sox10 Cre、Foxg1-c Cx26 KO等)均未能实现Gjb2的完全敲除。近期Li等通过四倍体胚胎互补技术构建了一种Gjb2纯合突变小鼠,但该方法成本高昂且耗时。本研究利用Sox9在内耳发育中的广泛表达特性,通过Sox9CreER/+与Cx26loxP/loxP小鼠杂交,成功构建了特异性靶向耳蜗上皮支持细胞和外侧壁的Gjb2条件敲除模型。他莫昔芬诱导的Cre重组酶激活导致ABR阈值升高、EP降低及HC丢失,为Gjb2基因治疗研究提供了可靠模型。然而,该模型尚不能完全模拟人类Gjb2缺陷,进一步研究创建Gjb2敲除或纯合点突变小鼠模型至关重要。
早期研究采用牛AAV-CMV-Gjb2成功恢复了Gjb2表达和耳蜗外植体的间隙连接功能;后续又有研究者利用AAV1-CB7-Gjb2进行试验,但未能改善听力;而使用Anc80-CAG-Gjb2甚至导致毛细胞损伤,这可能是因为CB7启动子通过HC中的异位Gjb2表达诱导毒性;另外研究使用AAV1-CMV-Gjb2组合仅实现有限疗效。近期研究采用AAV2.7m8-gfaABC1D启动子虽取得一定效果,但仍需联用地塞米松抑制免疫反应。这些研究凸显了载体选择和启动子设计的关键作用。本研究通过联合应用AAV-ie和AAV1,配合自主研发的特异性启动子SCpro(中国专利202310650073.4),在扩大Gjb2表达范围的同时避免了毛细胞毒性,实现了稳定的听力恢复。在大型动物实验中,该策略在巴马小型猪和食蟹猴均表现出良好的安全性和转导效率,从而为Gjb2相关听力障碍的临床治疗提供了理论依据。
尽管取得重要进展,本疗法仍存在局限性:疗效持续时间不超过6个月,且对Gjb2缺陷的成年小鼠无效。这些挑战主要源于成年耳蜗转导效率不足和Gjb2表达调控的复杂性。未来需开发具有增强成年动物耳蜗转导效率的AAV血清型,优化载体设计,以推动遗传性耳聋基因治疗的临床转化。

汇报人:代一冯
导师:赵宇、任建君
审核:李俊虹、宋瑶、任建君



