
精读分享│【Advanced Science】:病毒介导的外源Connexin 26联合地塞米松对条件性 Gjb2+小鼠听力的影响
英文题目:Viral-Mediated Connexin 26 Expression Combined with Dexamethasone Rescues Hearing in a Conditional Gjb2 Null Mice Model
中文题目:靶向基因组编辑修复了由人类microRNA突变引起的成年小鼠渐进性听力损失
期刊:Advanced Science(IF: 14.1)
单位:华中科技大学同济医学院
发表时间:2024年12月

思维导图:
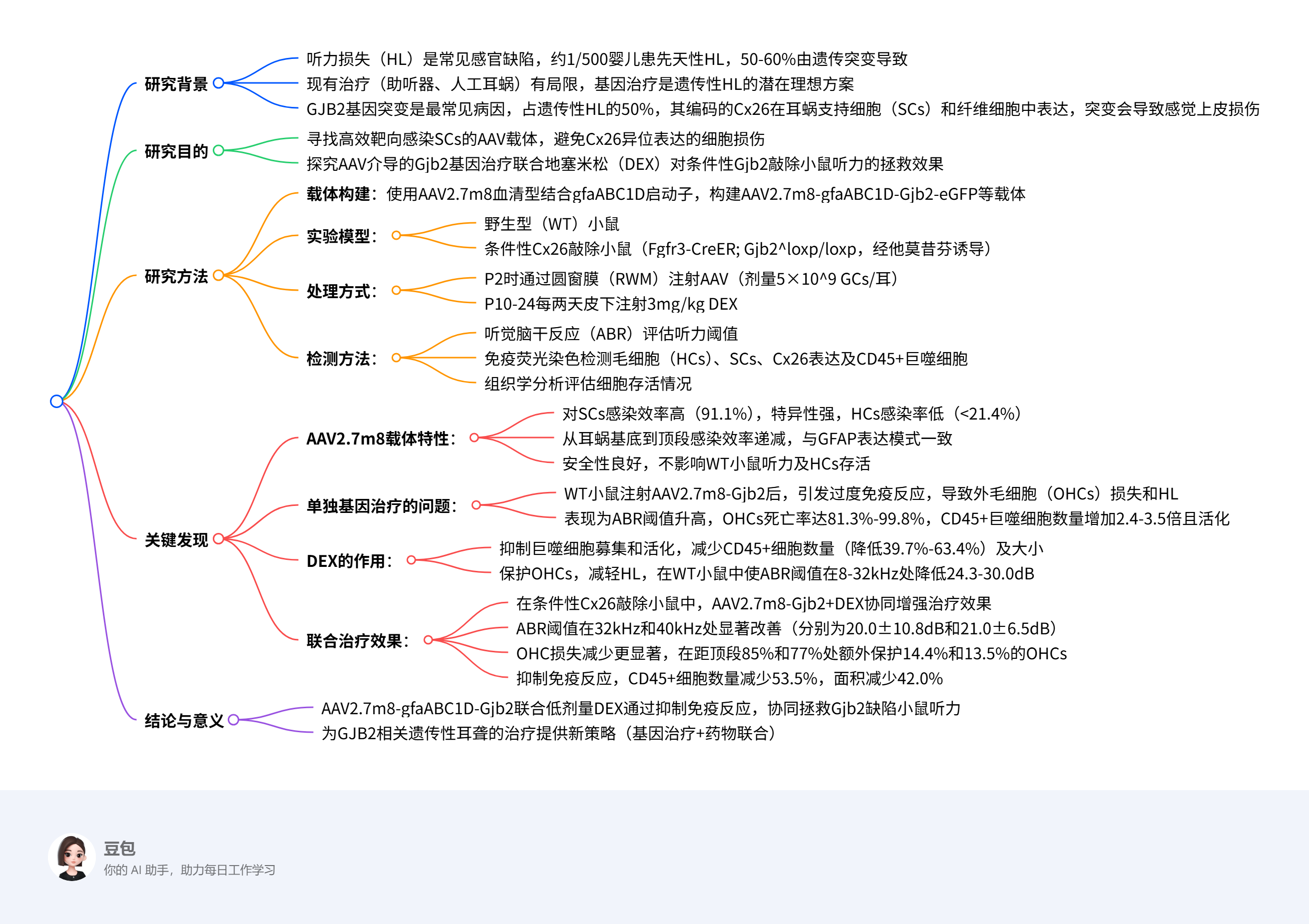
摘要
GJB2 基因编码连接蛋白26 (Cx26),是导致遗传性非综合征性耳聋最常见的突变基因。Cx26主要在哺乳动物耳蜗的支持细胞 (SCs) 和纤维细胞中表达。目前,基因治疗被认为是根除遗传性疾病最有前景的策略。然而,针对 GJB2 突变相关耳聋的基因治疗尚未取得显著效果,因为Cx26的缺失会导致感觉上皮损伤加重。本研究发现,AAV 2.7m8血清型载体结合gfaABC1D启动子可实现支持细胞特异性靶向感染。值得注意的是,在野生型小鼠中进行Gjb2基因替代治疗会引发感觉毛细胞 (HCs) 损伤、过度炎症反应和听力损失。这可能是GJB2基因替代治疗的重要难点。地塞米松 (DEX) 可有效抑制巨噬细胞募集并对毛细胞损伤发挥保护作用。进一步研究表明,在条件性Cx26敲除小鼠模型中,AAV 2.7m8-Gjb2 与 DEX 联合治疗表现出协同效应,显著增强了基因治疗效果。这些结果表明,基因治疗与药物干预相结合,将为治疗 GJB2 缺陷相关的遗传性耳聋提供新策略。
1.介绍
听力损失(Hearing loss, HL)是人类最常见的感觉缺陷之一。约1/500的婴儿被诊断为先天性听力损失,其中50-60%的病例由基因突变引起。目前,遗传性听力损失的主要干预手段是助听器和人工耳蜗植入,具体选择取决于听力损失的严重程度和类型。然而,这两种治疗方法都存在局限性:助听器仅适用于中度至重度听力损失患者,而人工耳蜗植入虽然可用于全聋患者,但要求患者保留相对正常的听觉神经功能。为了恢复更自然的听力质量,研究人员正在探索包括基因治疗和毛细胞(hair cells, HCs)再生在内的多种策略。其中,基因治疗被视为治疗遗传性听力损失最有前景的方法,其核心机制是通过将目标外源基因或基因调控元件递送至靶细胞,实现突变基因的替换或修复。
近年来,内耳基因治疗取得了重大进展。首个通过基因治疗成功恢复听力的模型源于Vglut3基因敲除小鼠中。此后,针对Tmc1、Otof、Kcne1和Gjb6等基因的遗传性耳聋基因替代疗法研究相继涌现。在人类患者中,内耳基因治疗同样展现出令人鼓舞的应用前景——近期发表的单臂临床试验结果显示,通过AAV1-hOTOF载体治疗,常染色体隐性遗传性耳聋9型(DFNB9)患儿的听力和言语感知能力均获得显著改善。然而,针对GJB2突变所致耳聋基因治疗尚未取得关键突破,而GJB2是最常见的突变基因,占遗传性听力损失的50%。
GJB2基因负责编码连接蛋白26(Connexin 26, Cx26),该蛋白主要在内耳的支持细胞(supporting cells, SCs)膜上表达。Cx26在哺乳动物内耳广泛表达,在耳蜗相邻支持细胞或纤维细胞之间形成缝隙连接(gap junctions)。通过介导离子、代谢物(≤1.5kDa)和小信号分子跨膜扩散,在细胞间通讯中发挥关键作用。GJB2基因在人类中高度保守,其致病性变异通常导致Cx26蛋白缺失部分跨膜片段或中间环结构,此为听力损失的重要分子基础。人类GJB2突变可导致重度或迟发性进行性听力损失,感觉上皮损伤是公认的耳聋病理机制。对Cx26条件性基因敲除小鼠模型的研究表明,出生后P14-P15天出现外毛细胞(outer hair cells, OHCs)和支持细胞的变性,至P30引发螺旋神经元(spiral ganglion neurons)的继发性变性。不同Cx26缺失小鼠模型的细胞死亡时间点高度一致,提示针对GJB2突变相关遗传性听力损失存在基因治疗的最佳时间窗。此外,既往研究表明Cx26的异位表达可导致感觉上皮损伤,因此,确定最佳治疗时间窗并选择高效感染靶细胞的载体,是GJB2相关听力损失的基因治疗的关键。本研究通过修饰AAV 2.7m8病毒获得支持细胞高感染效率、毛细胞低表达的改良载体,为Cx26缺失小鼠基因治疗提供了有前景的载体。
既往研究表明,腺相关病毒(AAV)可在宿主机体中引发免疫反应,这可能是影响基因治疗有效性和安全性的一个重大挑战。已证实内耳含有丰富的巨噬细胞,约占免疫细胞的80-95%。近期一项研究表明,通过后半规管向内耳注射AAV 2.7m8-tdTomato可增加内耳巨噬细胞浸润。糖皮质激素(Glucocorticoids, GCs)作为临床常用作免疫调节剂,已广泛用于内耳疾病治疗,包括突发性感音神经性听力损失(SSNHL)、噪声性听力损失(NIHL)、耳毒性药物引起的听力损失和梅尼埃病。地塞米松(Dexamethasone, DEX)是临床最常用的糖皮质激素之一,已被证明不仅对多种类型的听力损失具有明确疗效,还可用于人工耳蜗植入术中保护残余听力。该团队前期研究表明,DEX可能通过调节内耳免疫反应,在纵向Cx26缺失模型中部分挽救听觉功能并保护耳蜗感觉上皮。在本研究中,向野生型(WT)小鼠递送AAV 2.7m8-gfaABC1D-Gjb2会诱导过度免疫反应,导致OHC损失和听力损失,而给予DEX干预能够抑制免疫反应,从而预防OHC损伤并改善听力损失。此外,在条件性Cx26基因敲除小鼠模型中,内耳注射AAV 2.7m8-gfaABC1D-Gjb2后给予DEX,显著增强了基因治疗的保护效果。
2.结果
2.1.AAV 2.7m8 高效且特异性地转导支持细胞 (SCs)
首先,需筛选能够高效靶向感染 SCs 的 AAV 载体,因为 Cx26 的异位表达可能引发细胞损伤。先前报道发现,合成的 AAV2/AAV2.7m8 与 CAG(CMV 早期增强子鸡 β-肌动蛋白)启动子结合,在出生后早期注射条件下可实现毛细胞(HCs)和内柱细胞(IPCs)中 eGFP的高效表达。研究表明,胶质纤维酸性蛋白(GFAP)启动子主要局限于部分 SCs 亚群,且在出生后早期所有 SCs 中均有活性,其强度呈现从底回向顶回递减的梯度特征。AAV 9-PHP.B-Gfap-eGFP 可驱动耳蜗 SCs 中的外源基因表达。先前的研究将 2.2 kb 的 GFAP 启动子优化为681 bp的新型 GFAP 启动子 gfaABC1D,其表达模式与 gfa2 启动子基本相同,但活性提升约两倍。基于此,本研究构建了一个基因治疗载体,将 gfaABC1D 启动子、靶基因和/或增强型绿色荧光蛋白(eGFP)以及 WPRE 封装在合成的 AAV 2/AAV2.7m8 衣壳中,命名为AAV 2/AAV2.7m8-gfaABC1D-eGFP-WPRE(简称:AAV 2.7m8-eGFP)(图 1A)。
为明确在耳蜗 SCs 中病毒转导率最高的 AAV 血清型,研究者选用几种常规 AAV 包装由组成型 CMV 启动子驱动 eGFP表达 的 AAV 报告基因组。正如先前广谱启动子研究所示,AAV 2.7m8-CMV 主要感染 HCs (效率53.5%-82.1%) 及部分 SCs (效率55.3%-77.1%)。团队尝试 GFAP 和 hSyn 启动子时,两者只感染了少量 HCs(数据未显示)。因此,研究人员直接比较了 AAV 2.7m8-gfaABC1D 和AAV 2-eGFP、AAV DJ-eGFP、Anc80l65-eGFP在相同剂量(单耳5.0×109 含基因组颗粒 (GCs))下,在耳蜗外植体培养(体外)或通过圆窗膜(RWM)注射到 P2 龄 WT 小鼠内耳(体内)对 SCs 的感染效率(图 1B)。在耳蜗外植体中,Anc80l65 能高效转导 HCs(效率60.0%-76.4%),但对 SCs感染效率较低。AAV 2.7m8-eGFP 在 OHCs中转导率达69.3%,并且几乎所有 SOX2+ 的 SC 亚群中均可见表达(图 1C, E, F)。与之形成对比的是,体内感染 AAV2.7m8 时, OHCs 转导效率仅仅为 21.4%(图 1D, G)。进一步评估体内注射 AAV 的转染效率:AAV 2-eGFP 主要转导IHCs,而 SCs 转导率低至 11.7%。AAV DJ 和 Anc80L65 虽可中等效率感染 HCs,但对 SCs 的转导效率仅为 5.5% 和 33.3%。值得注意的是,AAV 2.7m8-eGFP 能够以 91.1% 的高转导效率转导多种类型的 SCs,同时仅以低于 21.4% 的效率转导少量 OHCs。
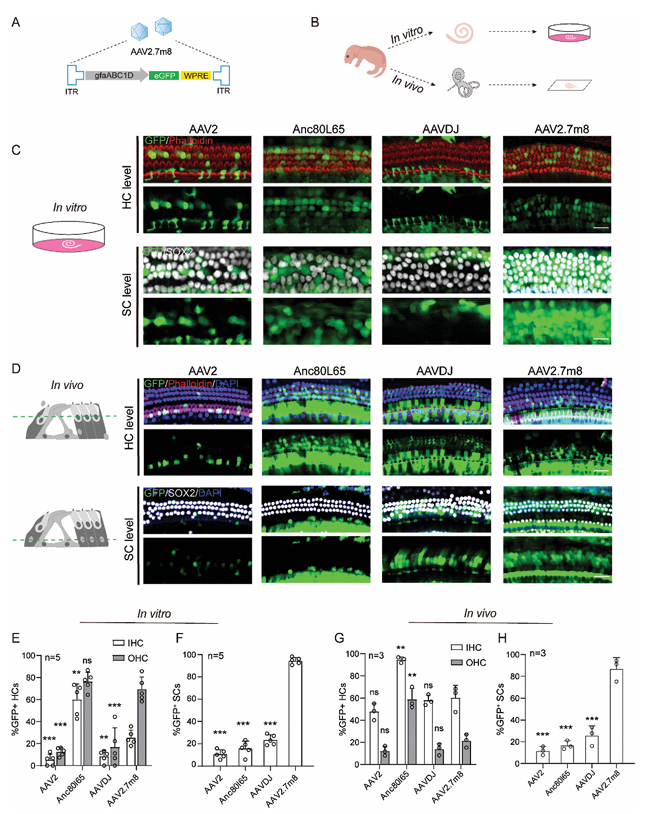

2.2. AAV 2.7m8-gfaABC1D-eGFP 在体内高效转导不同类型的 SCs
在 P2 龄小鼠单耳注射剂量为5×109 GCs,并于 P24 收获耳蜗组织进行荧光显微镜实验后,结果显示 AA V2.7m8-eGFP 可靶向感染耳蜗顶回、中回和底回 SCs (图 2A)。耳蜗 SCs 包含Hensen 细胞(HeCs)、Deiters 细胞(DCs)、柱细胞(PCs)和内指细胞(IPhCs)。在顶回、中回和底回,DCs 的靶向效率分别约为 20%、81% 和 96%(图 2B)。外柱细胞(OPCs)的靶向效率分别约为 22%、38% 和 90%(图 2C),内柱细胞(IPCs)的靶向效率分别约为 56%、82% 和 90%(图 2D)。在顶回、中回和底回,IPhCs 的靶向效率分别约为 48%、85% 和 93%(图 2E)。AAV 2.7m8-gfaABC1D-eGFP 对 SCs 的感染效率呈现出从底回向顶回依次递减的趋势,这与先前描述的内耳 GFAP 表达模式一致。简而言之, AAV 2.7m8-gfaABC1D-eGFP 能够相对特异性地感染 SCs,且在 HCs 中的表达较低。
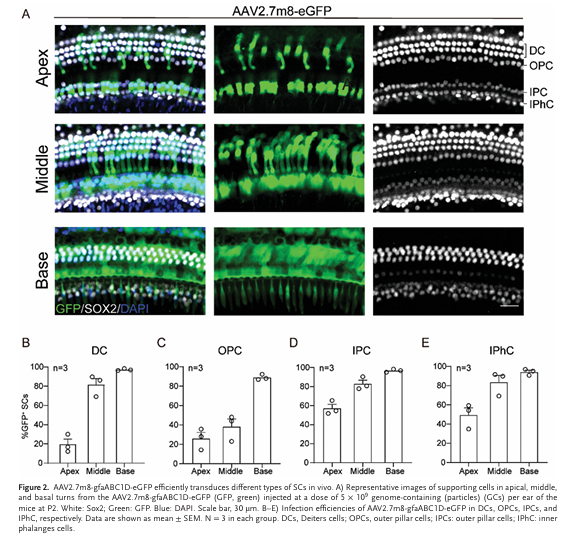

2.3. AAV 2.7m8-gfaABC1D-eGFP 对小鼠内耳是安全的
研究团队进一步评估了 AAV 2.7m8-eGFP 的内耳毒性。通过 RWM 在P2龄小鼠内耳注射 AAV 2.7m8-gfaABC1D-eGFP后,于 4 周时测试听性脑干反应(ABRs)和内耳上皮细胞活力(图 3A)。ABR 结果显示,注射耳与未注射耳在 ABR 阈值、ABR 波 I 振幅和潜伏期方面均无显著差异(图 3B–E)。免疫荧光结果显示,注射组与未注射组耳蜗顶回至底回的 OHCs 计数也无明显差异(图 3F, G)。此外,注射组支持细胞(SCs)计数与对照组相比亦未受影响(数据未显示)。上述结果表明 AAV 2.7m8-gfaABC1D-eGFP 是一种安全的基因治疗载体。

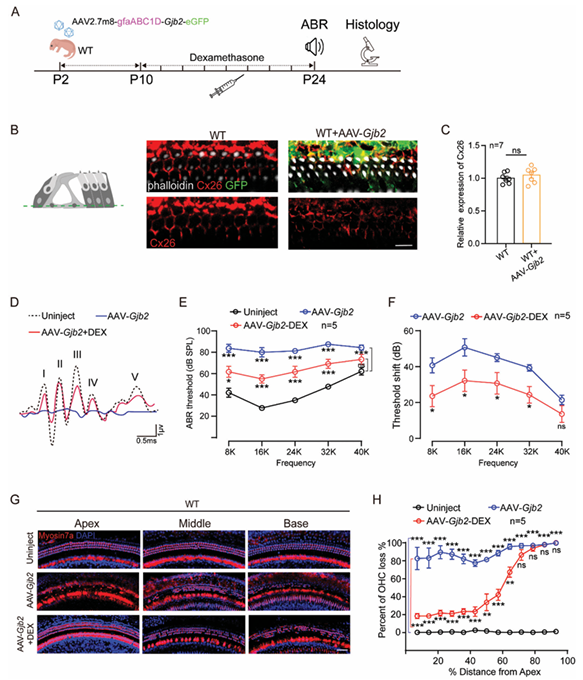
2.4. 向 WT 小鼠施用 AAV 2.7m8-Gjb2 导致毛细胞死亡和听力损失,低剂量 DEX 可预防此效应
考虑到 AAV 2.7m8 在SCs 靶向特异性和安全性的优势,研究者将小鼠源性 Gjb2 基因一同包装入病毒载体,构建为AAV 2/AAV2.7m8-gfaABC1D-Gjb2-eGFP-WPRE(简称:AAV 2.7m8-Gjb2)。首先在 HEK293 细胞中感染 AAV-Gjb2,结果显示 Cx26 能够成功表达且表达水平呈现病毒滴度依赖性。随后,在 P0-P1 龄小鼠中通过他莫昔芬(Tamoxifen)诱导 SCs 中Gjb2条件性敲低,并在 P2 龄通过 RWM 注射 AAV-Gjb2(图 4A)。3 周后的免疫荧光结果显示,Cx26 能够与 eGFP 一起在 SCs 的膜上成功共表达(图 4B, C)。
值得注意的是,与对侧未注射耳相比,注射了 AAV 2.7m8-Gjb2 的 WT 小鼠手术侧表现出 ABR 阈值升高,同时伴有显著的 HCs 死亡。先前研究表明,DEX 作为内耳手术围手术期药物可通过抑制免疫反应并可短暂增强转基因表达发挥保护作用。考虑到 DEX 的副作用较小且适合预防性给药,研究者选择从 P10 龄开始对小鼠进行定期皮下 DEX 给药。在注射了 AAV 2.7m8-Gjb2 的 WT 小鼠中,从 P10 到 P24 每两天皮下注射 3mg DEX。在 P24 时,通过 ABR 检测小鼠的听觉功能。如图 4D, F 所示,与仅注射 AAV2.7m8-Gjb2 的小鼠相比,AAV 2.7m8-Gjb2+DEX 组在 8、16、24 和 32K Hz 处的听阈偏移显著降低,降低幅度分别为 24.3、30.0、24.2 和 17.9 dB(P<0.05, n = 5)(图 4F)。然后,研究者通过 Myosin7a 免疫荧光染色标记 HCs,以检查 DEX 是否能减轻 OHCs 的损失。与听阈偏移的降低一致,DEX 治疗显著防止了顶回和中回的 OHCs 损失(图 4G)。AAV2.7m8-Gjb2组的小鼠在整个基底膜长度上表现出广泛的 OHC 死亡,OHC 死亡率为 81.3%–99.8%,而对 IHCs 几乎没有影响(图 S1F)。然而,给予 DEX 在距离顶回顶点 60% 的范围内缓解了 28.3%–67.9% 的 OHC 死亡,而底回以外的区域未显示出显著的挽救效果(图 4H)。这些结果表明,DEX 可以防止 WT 小鼠因注射 AAV 2.7m8-Gjb2 引起的 OHC 损失和听阈偏移。


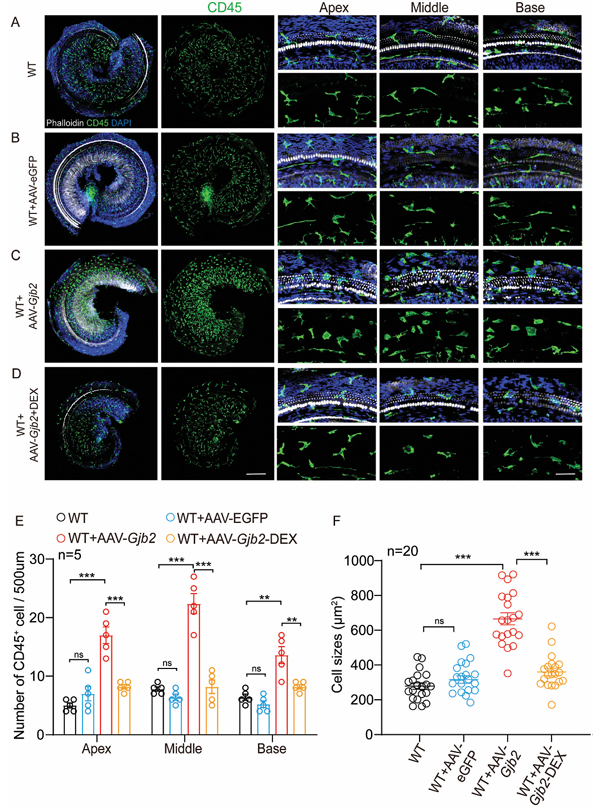
2.5. AAV 2.7m8-Gjb2 注射组的内耳呈现 CD45++ 巨噬细胞的活化和募集
据报道,宿主免疫反应在病毒介导的基因治疗的安全性和有效性中发挥关键作用。研究人员推测外源性 Cx26 可能通过诱导内耳炎症反应导致 OHC 死亡的主要原因。免疫荧光检测 CD45 的表达,清晰显示了耳蜗中巨噬细胞的形态和分布模式。在注射 AAV 2.7m8-eGFP 的内耳组中,从底回到顶回不同区域的 CD45+ 细胞数量与假手术对照组相比没有差异(图 5A, B)。然而,AAV 2.7m8-Gjb2注射组中,内耳中 CD45+ 细胞的数量似乎显著增加,比 AAV 2.7m8-eGFP 注射组高出 2.4–3.5 倍(图 5C, E)。如前所述,在给予低剂量 DEX 后,CD45+ 巨噬细胞的数量显著减少了 39.7–63.4%(图 5D, E)。
此外,研究者检查了巨噬细胞的形态,这是巨噬细胞活化的重要指标。在对照组和 AAV 2.7m8-eGFP 注射组中,CD45+ 细胞呈细长或条带状(图 5A, B)。然而,后者耳蜗损伤附近的多数 CD45+ 细胞显示出增大的细胞体和树突状突起,表明它们是活化的巨噬细胞(图 5C)。细胞大小的定量统计显示,AAV 2.7m8-Gjb2 组耳蜗中部 CD45 细胞的平均大小(655.5 ± 150.5 μm22)显著大于对照组和 AAV 2.7m8-eGFP 组(分别为 320.9 ± 95.2, 308.0 ± 83.4 μm22,图 5F)。使用低剂量 DEX 后,CD45+ 细胞的大小显著减小(360.6 ± 94.6 μm22,与 AAV 2.7m8-Gjb2 注射组相比(p<0.001),但其形态更趋向于圆形突起状(图 5D, F)。这些结果表明,炎症反应可能是基因治疗效果不佳的重要原因。

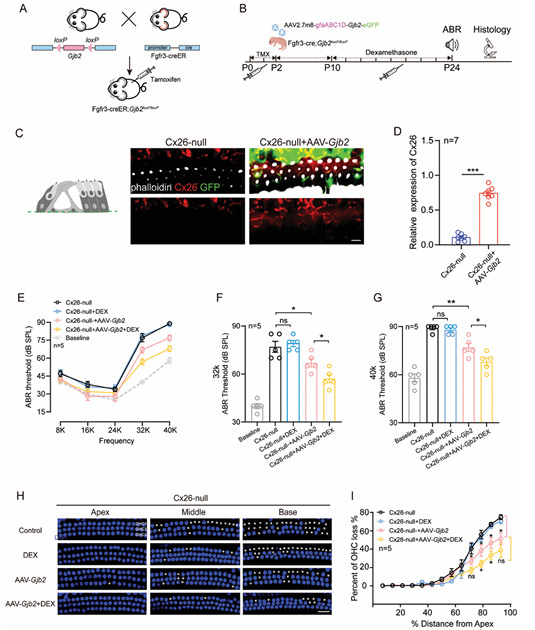
2.6. 低剂量 DEX 联合 AAV 2.7m8-Gjb2显著改善了条件性 Gjb2 缺失小鼠模型的听力
针对 GJB2 缺陷小鼠的基因治疗仍然是一个巨大的挑战。接下来,研究者重点讨论了使用 DEX 治疗对AAV 2.7m8-Gjb2 Cx26 缺失小鼠听力治疗效果是否有影响。首先,通过他莫昔芬(TMX)诱导 Cre 重组酶,在Fgfr3-CreER; Gjb2flox/flox 小鼠的 DCs 和 PCs 中靶向敲除 Gjb2(图 6A)。Fgfr3 是内耳 DCs 和 PCs 的特异性转录因子,其诱导的靶向 SCs-Gjb2 敲除小鼠表现出高频听力损失(HL),并伴有从底回到顶回的 HCs 损失。
通过 RWM 将 AAV 2.7m8-Gjb2 注射到 Cx26 缺失小鼠的耳蜗中,此后将小鼠分为两组:AAV 2.7m8-Gjb2组(仅给予 AAV 2.7m8-Gjb2)和DEX 组(在给予 AAV 2.7m8-Gjb2后,从 P10-P24 每两天给予低剂量 DEX)(图 6B)。在 P24 时,对不同组的小鼠(Cx26-null 组、Cx26-null+DEX 组、Cx26-null+AAV-Gjb2组和 Cx26-null+AAV-Gjb2+DEX 组)测量 ABR 和内耳感觉上皮细胞。ABR 基线阈值来自同龄 WT 小鼠的听力。与团队之前的结果一致,低剂量的 DEX 对Fgfr3-CreER; Gjb2flox/flox 小鼠的耳聋没有改善效果。免疫荧光染色显示,在 Cx26 缺失小鼠的 SCs 中可成功表达 Cx26,可恢复到 WT 小鼠的 72.9%(P<0.001, n = 7)(图 6C, D)。与对照组相比,仅用 AAV 2.7m8-Gjb2 治疗的小鼠的 ABR 阈值仅在 32K-40K Hz 处有轻微保留(分别为 10.0 ± 10.8 和 12.0 ± 6.5 dB)(图 6E-G)。然而,联合施用AAV 2.7m8-Gjb2 相比于对照组显著改善了 Cx26 缺失小鼠的听力(在 32K 和 40K Hz 处分别改善了 20.0 ± 10.8 dB 和 21.0 ± 6.5 dB)。
此外,对四组小鼠的 HCs 进行了免疫标记以检查形态。Cx26 缺失小鼠表现出 预期的OHC 损失(图 6H)。无论是否给予 DEX,施用 AAV 2.7m8-Gjb2都可以防止 OHC 的退化(图 6H, I)。在距离顶回顶点 92%、85%、77% 和 69% 的位置,与 Cx26-null 小鼠相比,AAV 2.7m8-Gjb2 分别减少了 23.5%、20.17%、17.6% 和 13.9% 的 OHC 损失;而 AAV 2.7m8-Gjb2 +DEX 分别减少了 35.9%、33.7%、32.0% 和 23.8% 的损失(图 6F, G)。就单独使用 DEX 对注射了 AAV8-Gjb2 的 Cx26 小鼠 HCs 的保护作用而言,在距离顶回顶点 85% 和 77% 的位置,它进一步保护了 14.4% 和 13.5% 的 OHCs(P<0.05, n = 5)。
靶向 Cx26 缺失小鼠的内耳表现出巨噬细胞的轻度活化,应用 DEX 可适度缓解。此外,与 Cx26-null 组相比,AAV 2.7m8-Gjb2 注射组的 CD45+ 巨噬细胞数量显著增多(20.2 ± 2.7),细胞面积增大(605.0 ± 132.5 μm22),而应用 DEX 使中回 CD45+细胞的募集和活化在数量上减少了 53.5%,在细胞面积上减少了 42.0%(图 7A–C)。CD45+ 细胞的活化呈现从顶回到底回逐渐增加的趋势(图 7B)。总之,上述结果表明 DEX 联合 AAV 载体可能通过抑制免疫反应起到补充基因治疗的作用,其效果将是事半功倍的。
3.结论
总之,该研究对支持使用AAV 2.7m8-gfaABC1D-Gjb2 联合地塞米松 (DEX)作为挽救Cx26缺失小鼠听力的潜在策略提供了依据,并最大限度地减轻了各自的不良反应,为遗传性听力损失的治疗提供了一种新的治疗策略。

汇报人:谢尔杰
导师:唐玥玓
审核:代一冯、庞文都、任建君



