
精读分享│【Nature】:溶酶体铁的活化激活癌症中的铁死亡
英文题目:Activation of lysosomal iron triggers ferroptosis in cancer
中文题目:溶酶体铁的活化触发癌症中的铁死亡
期刊:Nature(IF: 48.5)
单位:居里研究所,法国国家科学研究中心,法国国家健康与医学研究院,巴黎文理研究大学,巴黎,法国
发表时间:2025年6月
PMID: 40335696
DOI: 10.1038/s41586-025-08974-4


摘要:
铁催化生物膜中脂质的氧化,并促进一种称为铁死亡的细胞死亡形式。定义这种化学反应在细胞中的发生位置可以为设计在各种与疾病相关的环境中诱导或抑制铁死亡的药物提供信息。基因方法已经揭示了铁死亡的抑制因子;相比之下,小分子可以提供对工作中化学反应的时空控制。本研究展示了铁死亡抑制剂liproxstatin-1通过灭活溶酶体中的铁来发挥细胞保护作用;还展示了铁死亡诱导剂RSL3在溶酶体中启动膜脂质氧化。本研究设计了一种小分子溶酶体铁激活剂——fentomycin-1—以诱导磷脂的氧化降解并最终导致铁死亡。Fentomycin-1能够杀死富含铁的CD44high原发性肉瘤和胰腺导管腺癌细胞,这可以促进转移并增加药物耐受性。在这种细胞中,铁调节细胞适应性,同时使细胞容易受到铁死亡的影响。暴露于亚致死剂量fentomycin-1的肉瘤细胞获得了一种铁死亡抗性细胞状态,其特点是间充质标志物下调和膜损伤反应的激活。这种磷脂降解剂可以在体外消灭耐药的持久性癌细胞,并在乳腺癌转移的小鼠模型中减少淋巴结内肿瘤的生长。总之,这些结果表明,对铁反应性的控制具有治疗益处,确定溶酶体铁是一个可药物作用的靶点,并强调了靶向细胞状态的价值。
研究背景:
铁与过氧化物反应生成自由基,可引发细胞中的芬顿反应,导致氧化有机产物。生物膜中的脂质易受此影响,最终造成膜完整性丧失和细胞器功能改变,释放化学实体,诱导细胞缺陷和铁死亡结局。
铁死亡涉及多个细胞器,包括过氧化物酶体、线粒体、内质网和溶酶体,但尚不清楚是各个细胞器是通过细胞信号传导、代谢和生物合成受损,还是细胞器上的膜脂质直接氧化导致细胞死亡。
癌细胞需要正常功能的溶酶体才能发生铁死亡。药理学抑制溶酶体铁运输会促进其膜脂质氧化,表明溶酶体中的铁可触发铁死亡。内质网中积累的过氧化脂质替代物也可诱导铁死亡,显示脂质过氧化可通过此途径传播。然而,铁介导的膜脂质氧化首先在细胞中何处启动尚不明确。
研究方法与思路图:
主要结果:
1. 溶酶体铁的铁死亡机制探究:铁死亡抑制剂Liproxstatin-1验证
①实验目的:溶酶体定位验证
实验方法:点击化学标记(可点击类似物cLip-1)+ 荧光显微镜检查
关键结果:在HT-1080纤维肉瘤细胞、人胰腺导管腺癌(PDAC)的原代细胞、肺和结肠循环肿瘤细胞以及4T1小鼠乳腺癌细胞,荧光信号与溶酶体标记物(Lamp1)共定位率>80%。
研究结论:Liproxstatin-1在溶酶体中发挥抗铁死亡活性。
②实验目的:cLip-1是研究铁死亡抑制剂Lip-1的有效替代物
实验方法:GPX4(KO)诱导急性肾衰竭的小鼠+铁死亡抑制剂cLip-1
关键结果:cLip-1增加了该小鼠的存活率,在小鼠组织中的标记cLip-1显示其在肾脏中的积累,并与肾近端小管中的溶酶体标记物共定位。
研究结论:cLip-1通过在溶酶体内的作用,阻止了膜脂质的氧化,从而保护细胞免受Gpx4基因耗竭或GPX4药理抑制而引起的铁死亡。
③实验目的:Lip-1铁螯合能力验证
实验方法:氯化铁NMR滴定+循环伏安法
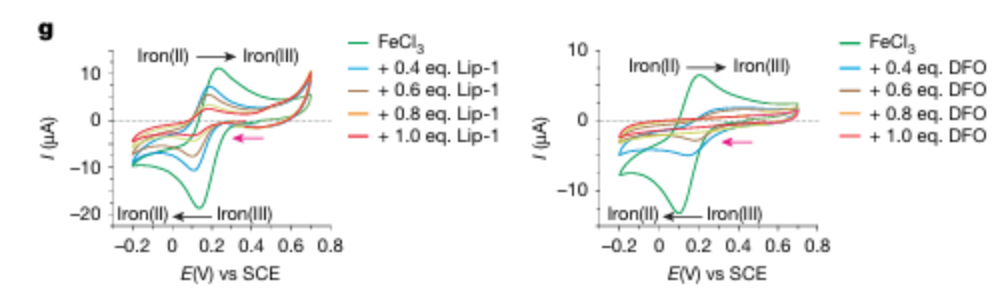
关键结果:核磁共振(NMR)光谱表明,Lip-1以1:1和2:1的化学计量与三价铁离子相互作用;导致信号展宽,以及Lip-1氮原子相邻的质子信号的下场移动,这表明路易斯酸与氮孤对发生了配位。
循环伏安法结果提示,Lip-1通过螯合Fe³⁺,降低了可被还原为Fe²⁺的自由Fe³⁺浓度(峰电流降低),同时降低了Fe³⁺的还原能力(峰电位负移),从而减少了Fe²⁺的生成。
研究结论:Liproxstatin-1通过螯合溶酶体中的Fe³⁺抑制铁死亡。
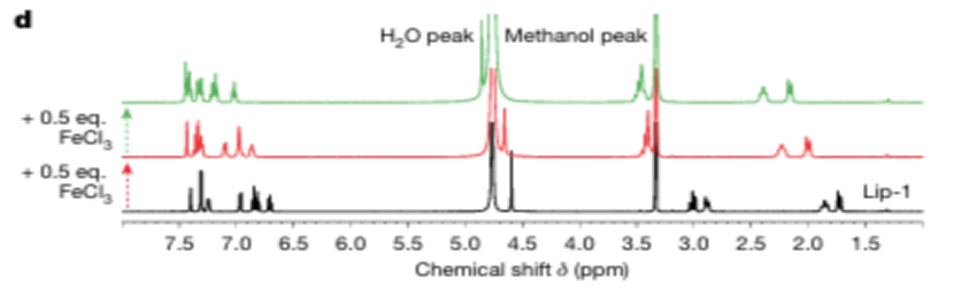
④实验目的:Lip-1在酸性环境中的铁螯合
实验方法:NMR滴定:Lip-1中添加布朗斯台德酸以及三氟乙酸。
荧光探针测量:用羟氯喹或巴弗洛霉素 A1 处理细胞,增加溶酶体 pH 值。
关键结果:核磁共振(NMR)光谱表明,向Lip-1中添加布朗斯台德酸会导致质子信号的下场移动,这表明氮原子被质子化。添加三氟乙酸(TFA)并不能完全将铁从Lip-1中置换出来,正如化学位移再现了路易斯和布朗斯特酸的影响。
荧光探针显示溶酶体 pH 值增加后,部分阻止了Fe3+从内吞载体卸载,导致可螯合的细胞Fe3+池和反应性溶酶体Fe2+减少。
研究结论:Lip-1 与铁的螯合在酸性条件下进行,如溶酶体中的条件,溶酶体环境是铁发生芬顿反应的关键。
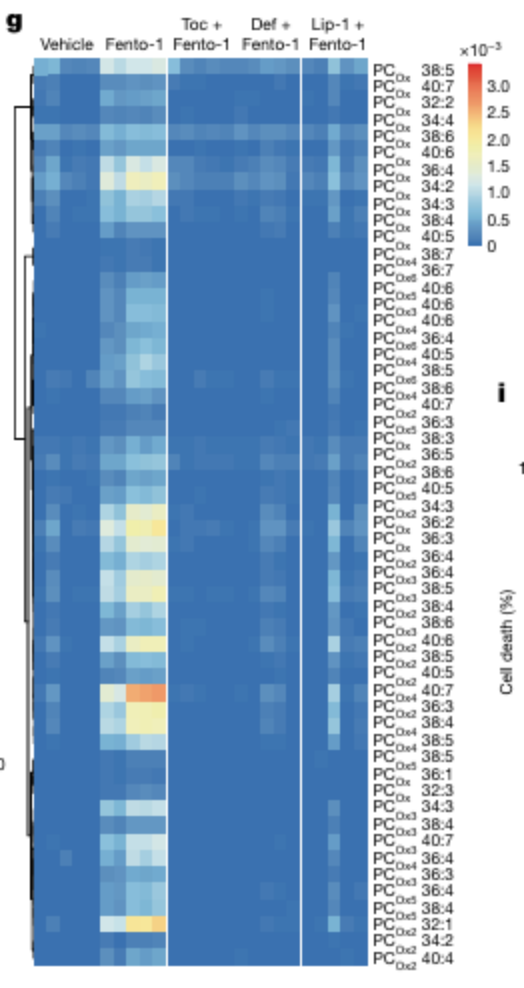
⑤实验目的:脂质过氧化的起始位点验证
实验方法:铁死亡诱导处理后,用荧光探针检测技术检测溶酶体内的脂质过氧化。
关键结果:用 RSL3处理 1 小时后,通过 Liperfluo 和 Bodipy 665/676 荧光水平评估,主要在溶酶体中检测到膜脂质的氧化。
用 RSL3 (铁死亡诱导剂)处理 1 小时后,膜脂质氧化主要在溶酶体中检测到,而处理 4 小时后,氧化脂质染色与内质网标志物共定位。数据表明,自由基链反应从溶酶体启动,传播到附近细胞器膜脂质。
为了支持这一假设,用成熟的铁凋亡诱导剂处理细胞导致谷胱甘肽的消耗和溶酶体中氧中心自由基水平的增加。
研究结论:脂质过氧化相关的自由基链反应的启动发生在溶酶体,随后扩散至其他细胞器,证明溶酶体铁在铁死亡诱导中的核心作用。
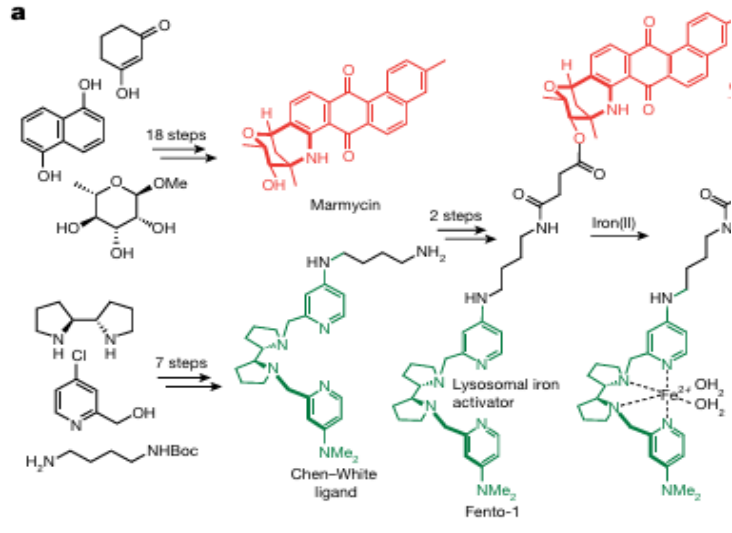
2. 铁死亡诱导剂Fento-1的设计与机制验证
靶向癌细胞:药物耐受的持久性(DTP)细胞状态,特点是高表达铁摄取蛋白CD44,这些细胞表现出铁摄取上调,导致细胞铁水平增加,更易受溶酶体铁影响而促进铁死亡。
结构组成: 荧光亲脂性天然产物marmycin:靶向质膜上的脂质;Chen-White配体:激活溶酶体铁形成脂质过氧化
设计逻辑:质膜靶向促进内吞→溶酶体定位→铁激活→脂质过氧化
设计思路:利用DTP癌细胞中大量的反应性Fe2+,这种双功能分子将在细胞中形成一种活性催化剂,促进溶酶体膜脂质的氧化降解,并最终触发铁死亡。
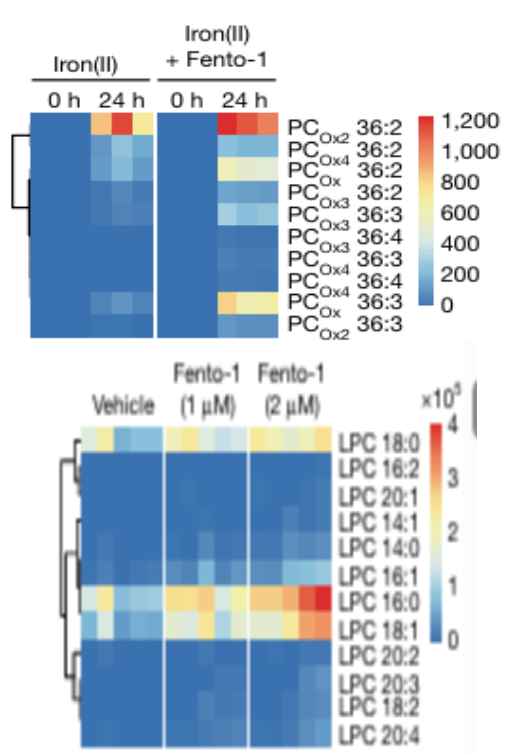
实验目的:Fento-1对脂质过氧化的诱导效果
实验方法:无细胞系统实验:在模拟溶酶体中的实验条件下(酸性 pH、过氧化氢的存在和水溶性铁盐)对其效果验证。基于质谱 (MS) 的脂质组学分析。
关键结果:Fento-1在无细胞系统,在模拟溶酶体中的实验条件下增强了铁诱导的脂质过氧化。脂质组学分析显示,Fento-1 比公认的铁死亡诱导剂在更大程度上诱导了几种细胞系中脂质氧化。
用Fento-1处理诱导了4-羟基壬烯醛(4-HNE)的产生,这表明含有多不饱和脂肪酸的磷脂的过氧化和分解。Fento-1处理还导致溶血磷脂和甘油水平升高,进一步表明氧化磷脂的降解,氧化的膜脂质触发了膜损伤反应。
研究结论:Fento-1对溶酶体内的脂质过氧化有增强效果。
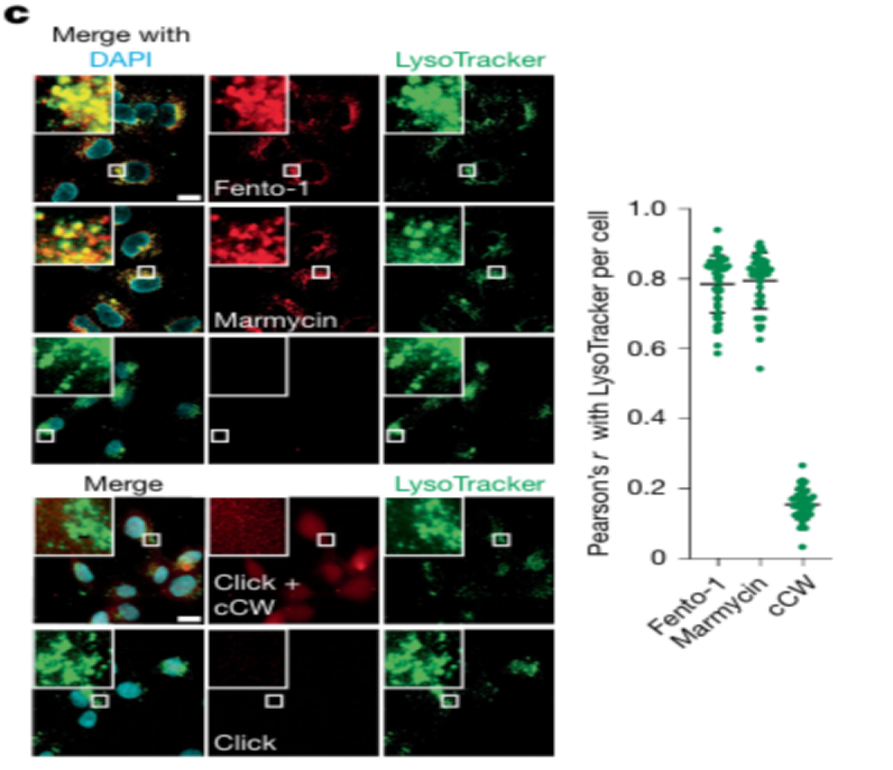
②实验目的:Fento-1的靶向定位验证
实验方法:内在荧光成像检测,可点击化学标记
关键结果:低温处理(抑制内吞时),此时Fento-1 主要定位于质膜。生理温度(允许内吞时),此时Fento-1 和 marmycin 均定位于内体溶酶体区室。Chen-White 配体,显示弱的泛细胞染色,表明未束缚的配体没有特异性地积累在内体溶酶体区室。
研究结论:Fento-1的靶向性依赖于 marmycin 部分的作用,而非单独的 Chen-White 配体。
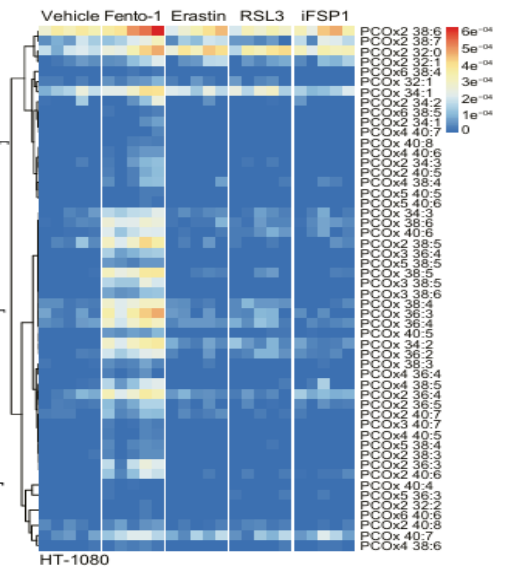
③实验目的:亚致死剂量的 Fento-1对铁死亡以及溶酶体相关蛋白的诱导
实验方法:定量蛋白质组学分析+蛋白质印迹分析
关键结果:亚致死剂量的 Fento-1 增加了 HT-1080 细胞中铁死亡抑制因子的水平。定量蛋白质组学分析显示,用亚致死剂量的 Fento-1 处理 48 小时的细胞分别促进了铁死亡和溶酶体相关蛋白的上调,包括铁死亡抑制因子和溶酶体相关膜蛋白(lamps);还表现出铁稳态相关蛋白的下调,包括铁摄取蛋白CD44和铁储存蛋白;也表现出转铁蛋白受体1(TFR1)和铁反应元件结合蛋白2(IRP2)水平的增加,这是细胞铁耗竭的特征。
研究结论:亚致死剂量Fento-1通过激活溶酶体铁诱导轻度脂质过氧化,触发细胞的适应性反应:这一过程诱导细胞启动铁死亡防御机制;铁稳态调节能力下降,细胞处于铁耗竭状态;进一步强化溶酶体功能。
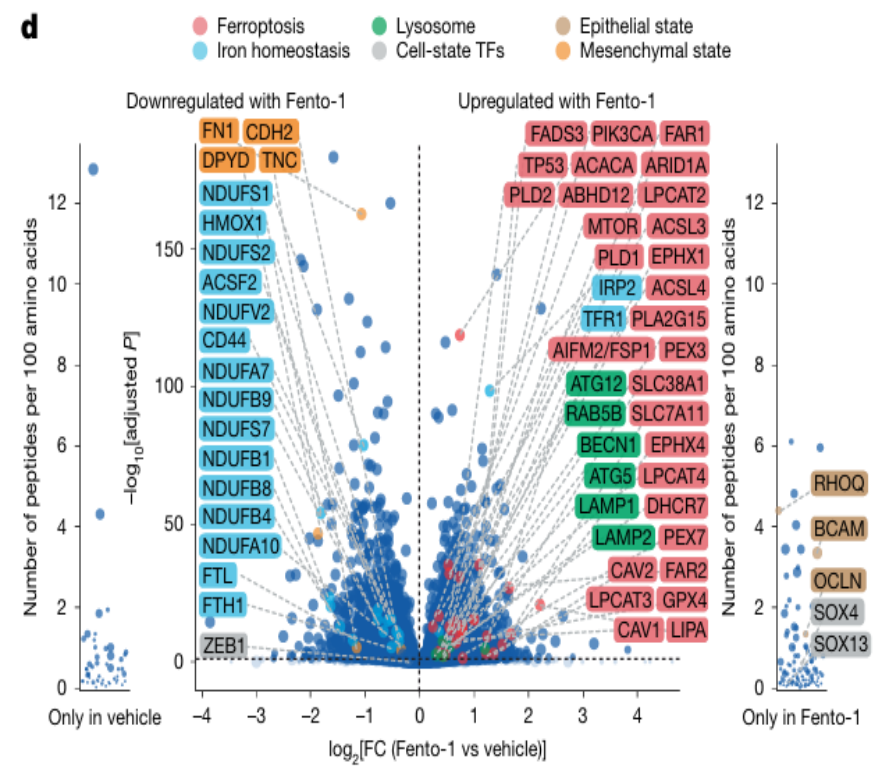
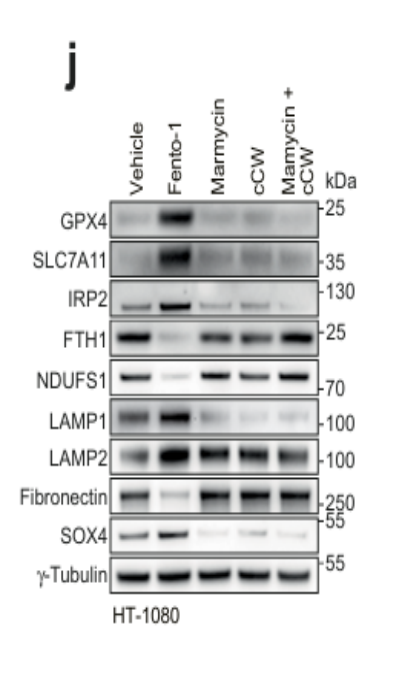
3. Fento-1的特性验证
①实验目的:耐药机制解析
实验方法:定量蛋白质组学分析+蛋白质印迹分析
关键结果:亚致死剂量的Fento-1促进了间充质标志物的下调;同时引起其他参与细胞状态调节的转录因子如SOX4和SOX13,以及上皮标志物的上调。(图同上d与j所示)
研究结论: Fento-1处理对间充质来源的HT-1080细胞的影响是来源于一种类似于对标准抗增殖治疗敏感的上皮细胞的独特细胞状态。癌细胞可以适应Fento-1的暴露,并进化出一种对铁死亡耐受的细胞状态。经低剂量Fento-1处理的细胞表现出持续的生存能力和独特的耐药性。
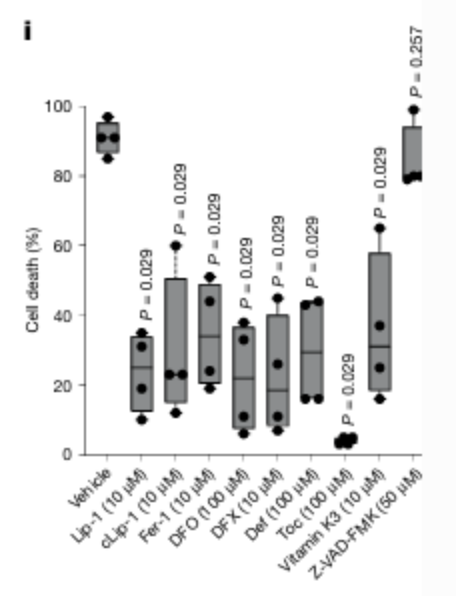
②实验目的:铁死亡特异性验证
实验方法:脂质组学分析+抑制剂实验
关键结果:Fento-1诱导的膜磷脂氧化作用被亲脂性RTA α-生育酚、铁螯合剂去铁酮和Lip-1显著减弱; Fento-1诱导的细胞死亡被公认的铁死亡抑制剂拮抗,包括铁螯合剂和RTA,但不被凋亡或坏死抑制剂拮抗。此外,Fento-1表现出铁死亡抑制剂无法完全克服的残留毒性,这反映了Fento-1的效力。
研究结论:Fento-1特异性诱导铁死亡,而不造成其他类型的细胞死亡。
4.疾病模型验证:Fento-1的转化价值
①实验目的:验证靶向肿瘤组织中的溶酶体铁含量
实验方法:人类胰腺导管腺癌(PDAC)/肉瘤组织+电感耦合等离子体质谱(ICP-MS)+ 荧光探针
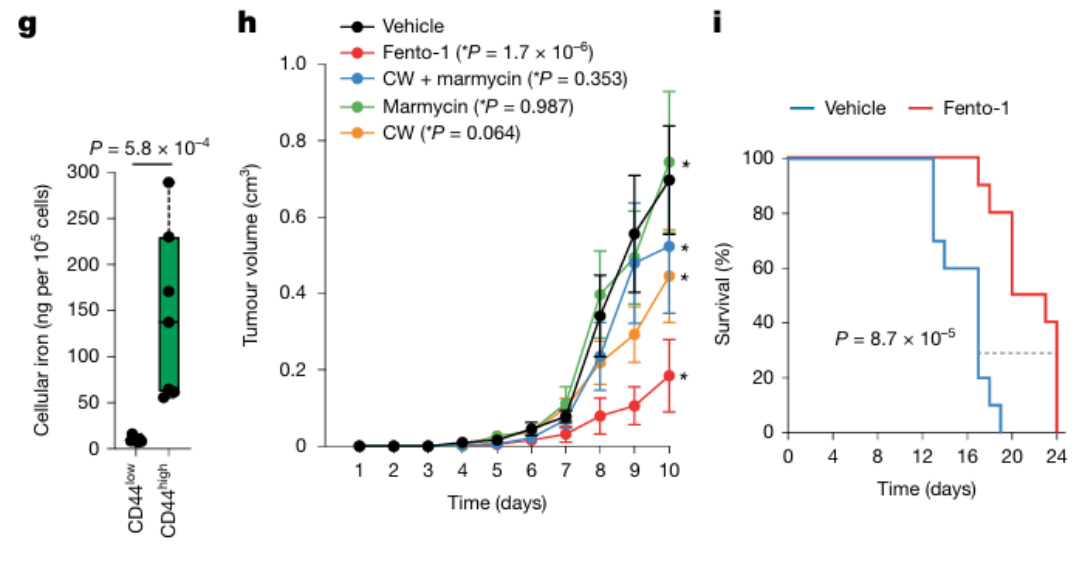
关键结果:通过电感耦合等离子体质谱(ICP-MS)测量,总铁含量在胰腺癌、未分化多形性肉瘤(UPS)、血管肉瘤、脂肪肉瘤和上皮样肉瘤的癌症组织中比相邻的非癌症组织高;由荧光探针测量,在PDAC和肉瘤组织中获得的细胞在CD44high癌症细胞亚群中显示出比CD44low对照组更高的氧化还原活性溶酶体铁的水平。
研究结论:在CD44high的癌症细胞亚群中,细胞铁负荷更高;CD44high肿瘤细胞由于铁摄取增加,导致细胞铁水平增加,所以更易被溶酶体铁影响而促进铁死亡。
②实验目的:Fento-1对肿瘤细胞的铁死亡效力
实验方法:原发性PDAC细胞,人类PDAC衍生的类器官+ Fento-1处理+ 脂质组学+集落形成试验
关键结果:脂质组学分析,从新鲜解离的人类原发性肿瘤中获得的细胞中,Fento-1诱导了膜磷脂的氧化和脂解,还减少了人源PDAC和UPS中解离的CD44high细胞的数量,但这些作用会被铁死亡抑制剂所拮抗。在集落形成试验中,Fento-1根除了对阿霉素治疗具有抗性的CD44过表达的三阴性乳腺癌SUM159细胞。同时,Fento-1对长时间低剂量阿霉素处理的HT-1080细胞的效力更强,此时其特征是CD44和铁蛋白水平升高,以及间充质标志物上调。
实验结论:Fento-1通过诱导肿瘤细胞脂质过氧化,以铁死亡的形式来杀伤肿瘤中CD44high细胞的数量。同时,暴露于阿霉素的细胞增加CD44以促进铁摄取,并呈现出更明显的间充质表型来逃避阿霉素敏感状态;但这种适应导致对铁死亡的脆弱性增加,使得其对Fento-1敏感。
③实验目的:评估Fento-1对小鼠模型的治疗效果
实验方法:4T1免疫活性小鼠模型 + Fento-1处理
关键结果:从淋巴结内4T1肿瘤分离的细胞中铁的定量分析显示,CD44high癌细胞亚群中的铁负荷高于CD44low亚群。当具有结内4T1肿瘤的小鼠用Fento-1治疗(每两天一次淋巴管内给药)时,小鼠显示肿瘤生长减少,肿瘤大小为基础的生存终点增加。
研究结论:Fento-1在体内利用CD44high癌细胞亚群中溶酶体铁的较高丰度在体内诱导铁死亡,减少肿瘤生长,有效延长肿瘤小鼠的生存期。
结论:这项研究表明,微调溶酶体铁的氧化还原活性可以控制膜脂质的氧化,从而支持溶酶体铁是铁死亡触发因素的观点。这些知识为铁死亡调节剂的设计提供了理论基础。Fento-1表现出了一种独特的化学类型来研究铁死亡,并为靶向DTP癌细胞提供了一个概念框架。

汇报人:夏轶君
导师:赵宇
审核:李朔、任建君



