
精读分享│【Cancer Research】:A Prime-Boost Vaccination Approach Induces Lung Resident Memory CD8+ T Cells Derived from Central Memory T Cells That Prevent Tumor Lung Metastasis
英文题目:A Prime-Boost Vaccination Approach Induces Lung Resident
Memory CD8+ T Cells Derived from Central Memory T Cells
That Prevent Tumor Lung Metastasis
中文题目:初免-加强疫苗接种策略诱导源自中央记忆T细胞的肺驻留记忆CD8⁺ T细胞形成以预防肿瘤肺转移
期刊:Cancer Research(IF: 16.6)
单位:香港大学李嘉诚医学院艾滋病研究所,中国香港
发表时间:2024年10月



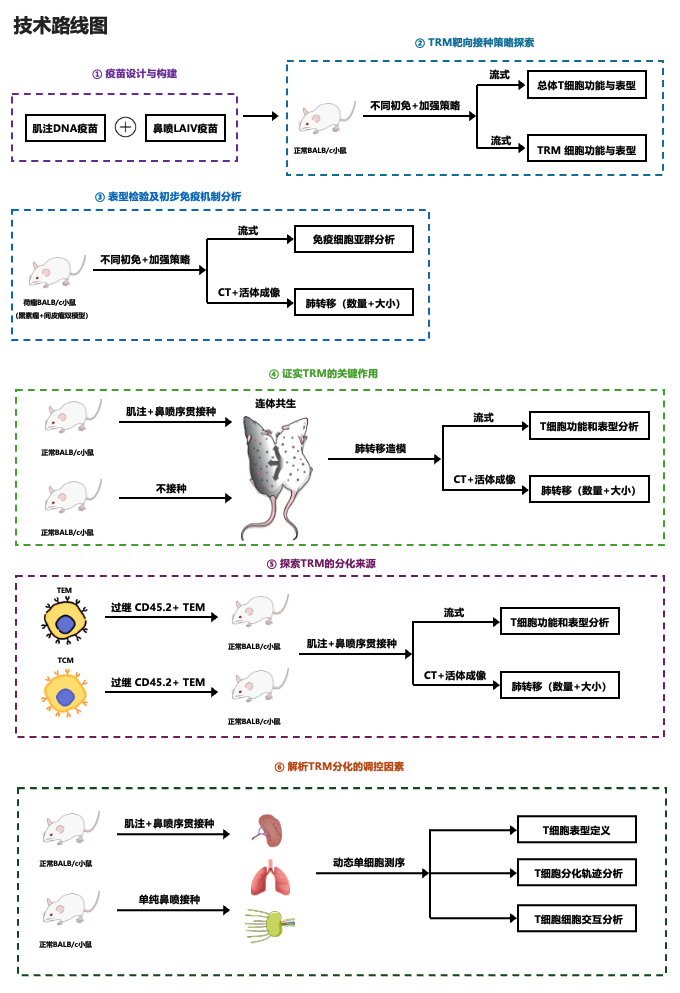
技术路线图
摘要:
记忆 T 细胞在免疫系统对抗癌症方面发挥着关键作用。已有研究表明,疫苗诱导的肺组织驻留记忆 T(TRM)细胞能够预防肺部转移。明确肺 TRM 细胞的来源有助于改进预防肿瘤转移的策略。在此,本研究发现,相较于其他疫苗接种方案,采用肌肉注射 DNA 疫苗进行初次免疫,随后通过鼻内接种减毒流感病毒载体疫苗(LAIV)进行加强免疫的方案,能诱导出更高频率的肺部 CD8+ TRM 细胞。疫苗诱导的肺部 CD8+ TRM 细胞,而非循环记忆 T 细胞,对转移性黑色素瘤和间皮瘤具有显著的保护作用。DNA 疫苗诱导的中央记忆 T(TCM)细胞是鼻内 LAIV 加强免疫后在肺部建立的 TRM 细胞的主要前体。单细胞 RNA 测序分析表明,TCM 细胞向肺部 TRM 细胞的转录重编程分化最早在 LAIV 加强免疫后第 2 天就开始了。鼻内 LAIV 改变了黏膜微环境,通过 CXCR3 依赖的趋化作用招募 TCM 细胞,并诱导了与 CD8+ TRM 相关的转录。这些结果表明,TCM 细胞是疫苗诱导的 CD8+ TRM 细胞的来源,能够预防肺部转移。意义:初免-加强免疫接种可重塑黏膜微环境,并重新编程中枢记忆 T 细胞以生成肺驻留记忆 T 细胞,从而预防肺部转移,为优化疫苗策略提供了理论和实验基础。
研究背景:
肺癌转移是癌症死亡的主因之一,传统疗法效果有限。组织驻留记忆T细胞(TRM)在肺组织中可提供长期免疫监视,但两大瓶颈制约其应用:
诱导效率低:常规疫苗难以高效生成肺TRM细胞;
来源不明:TRM前体细胞身份不清(TCM vs. TEM争议),阻碍疫苗策略优化。
主要结果:
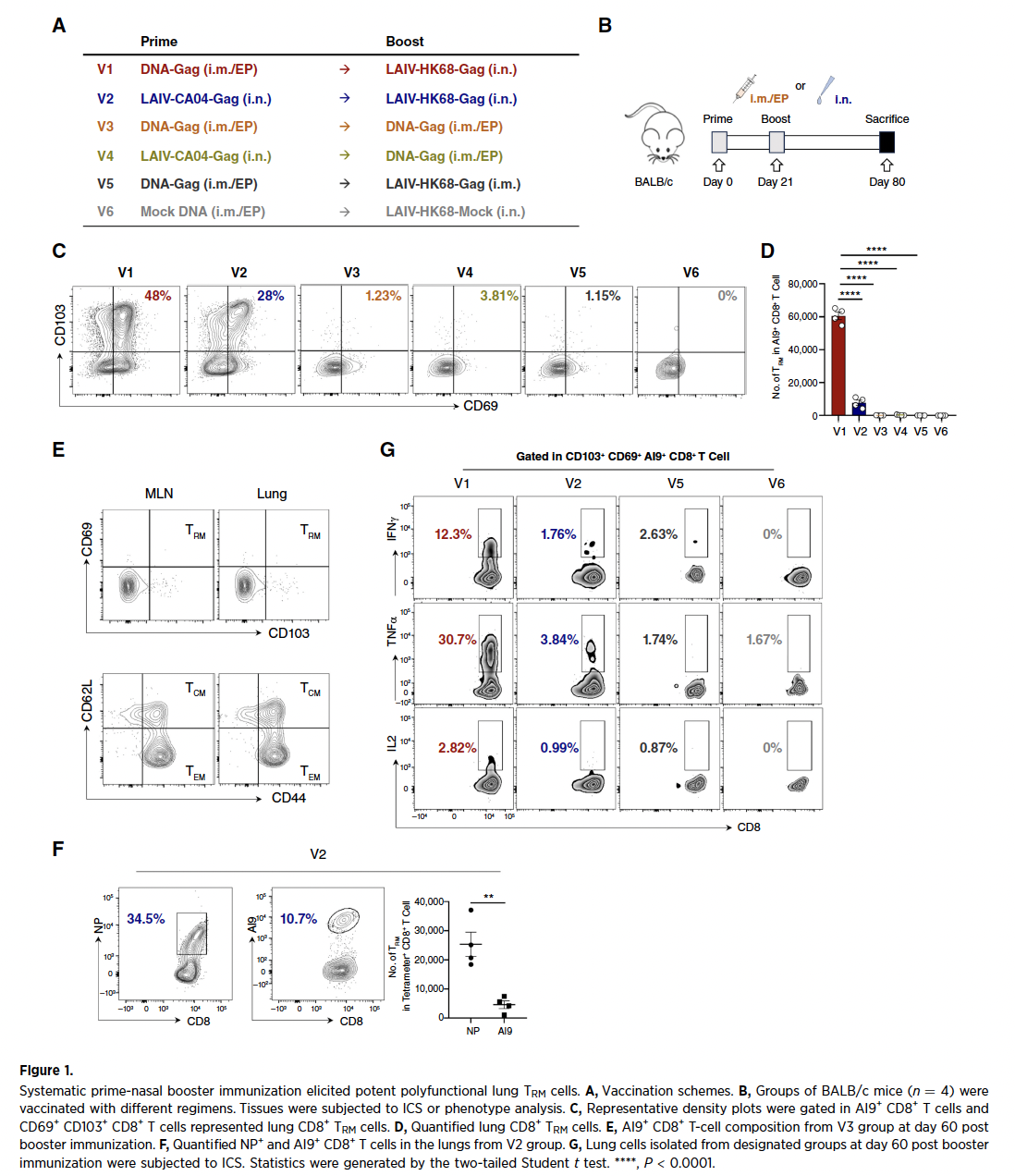
1. 系统初免-鼻内加强免疫诱导多功能肺TRM细胞
通过对比不同疫苗接种方案,研究发现采用肌肉注射DNA疫苗初免联合鼻内滴注LAIV载体疫苗加强的策略(V1组)可高效诱导肺驻留记忆CD8+ T细胞(TRM)。该方案使肺组织中TRM细胞数量显著高于单鼻内免疫组,且大多数的TRM细胞具备多因子分泌功能(IFNγ+TNFα+IL2+),其功能活性远超其他方案。异源策略还显著提升抗原特异性TRM比例,有效降低载体免疫原性干扰,为抗肿瘤免疫奠定细胞基础。
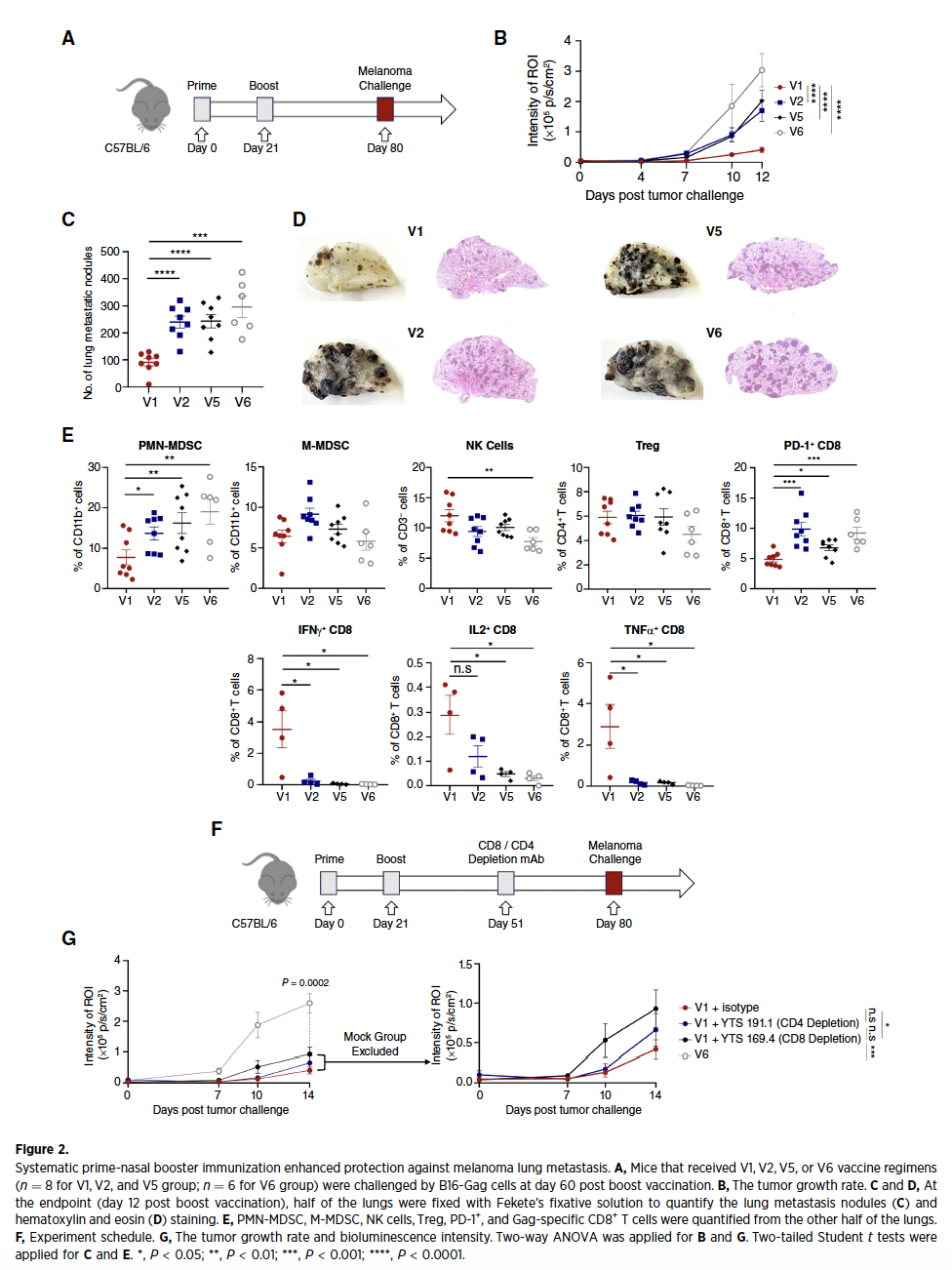
2、TRM细胞主导抗转移免疫保护
在黑色素瘤和间皮瘤肺转移模型中,V1组疫苗诱导的TRM细胞直接介导肿瘤抑制,使肺转移结节显著减少。通过CD8+ T细胞清除实验证实,清除TRM细胞后保护作用完全消失,而CD4+ T细胞清除后无显著影响。进一步分析显示,V1组疫苗通过重塑肿瘤微环境发挥作用:下调T细胞耗竭标志PD-1表达,抑制髓系来源抑制细胞PMN-MDSC活性,并协同增强NK细胞杀伤功能,形成多维度抗肿瘤屏障。
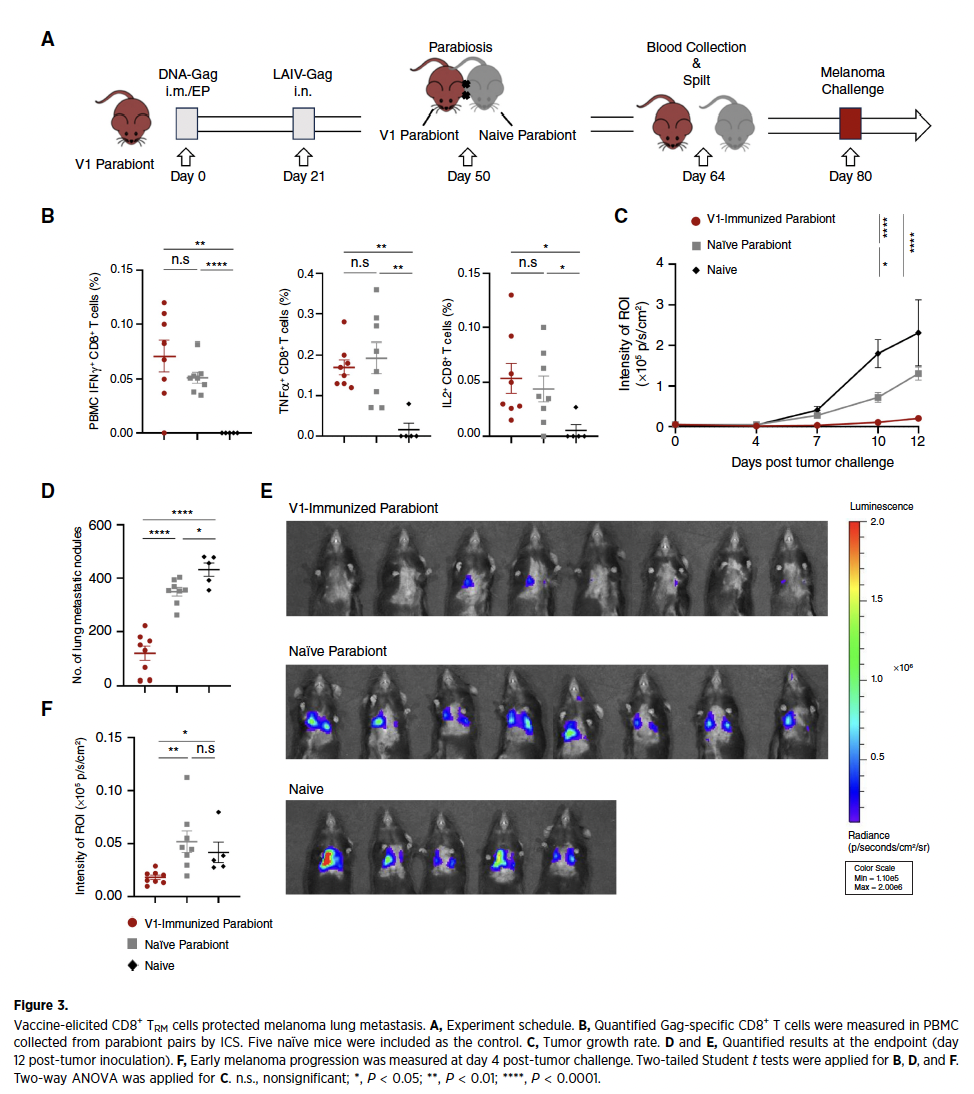
3、TCM细胞被确认为TRM核心前体
过继转移实验揭示,DNA初免诱导的中央记忆T细胞(TCM)是肺TRM的主要来源。过继至受体小鼠的TCM细胞在鼻内加强后分化为TRM的效率显著高于TEM细胞,并完成向CD69+CD103+表型的转化。机制研究表明,鼻内LAIV加强显著上调肺局部趋化因子CXCL9/CXCL10表达(qPCR与ELISA验证),通过CXCR3受体介导TCM特异性肺归巢——CXCR3基因敲除组TCM肺浸润显著减少,证实CXCL9/CXCL10-CXCR3趋化因子轴是TCM定向迁移的关键枢纽。
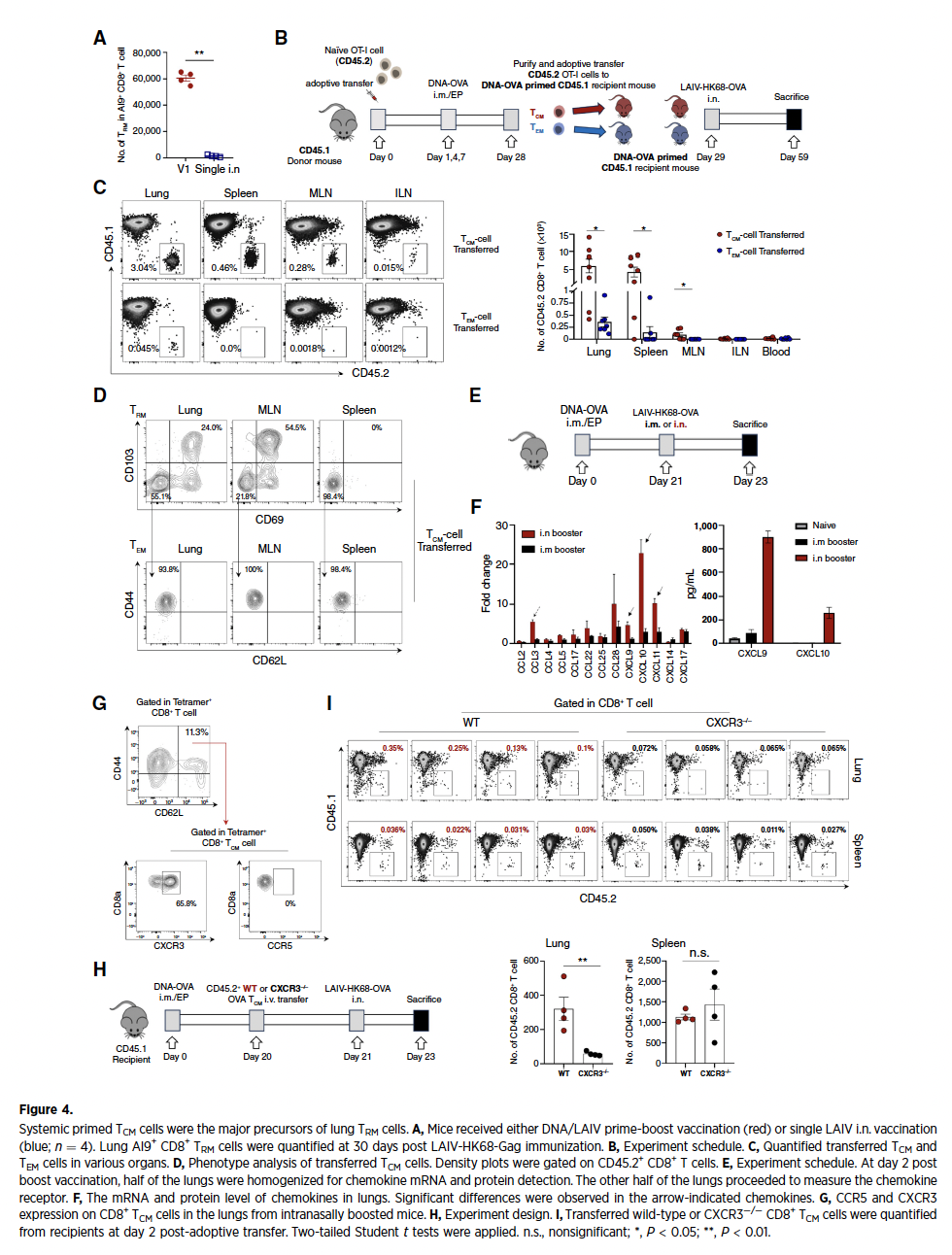
4、鼻内加强编程细胞毒性T细胞TRM特征
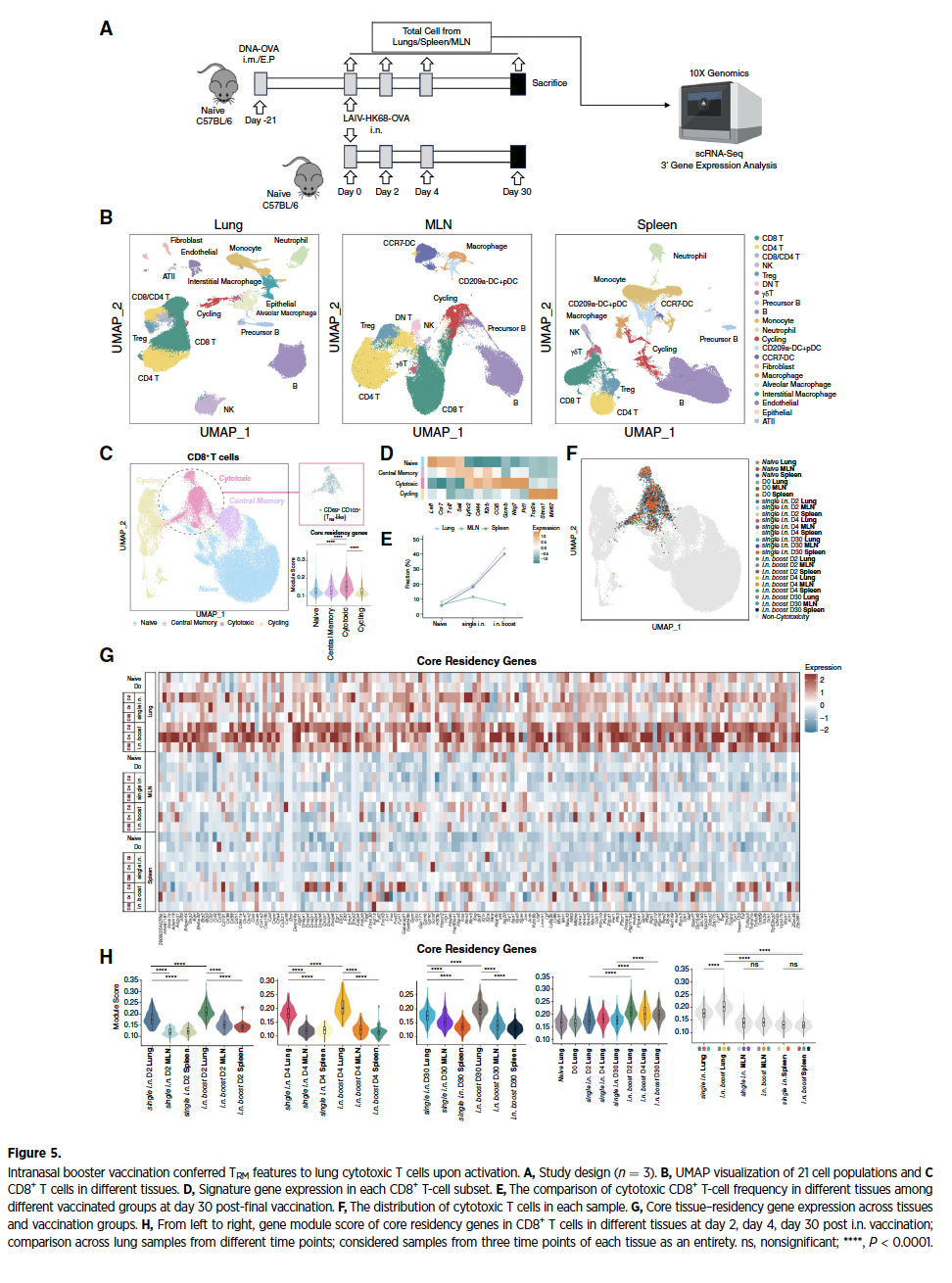
单细胞转录组分析显示,加强免疫后肺内细胞毒性CD8+ T细胞(高表达GZMB、PRF1)显著扩增,且核心驻留基因模块(如CD69、ITGAE)在该亚群特异性富集。时空动态分析发现,TRM特征在加强后第2天启动转录重编程,至第30天形成稳定驻留池,表明鼻内免疫通过早期表观遗传修饰赋予效应T细胞持久组织驻留能力,突破传统疫苗的时效局限性。
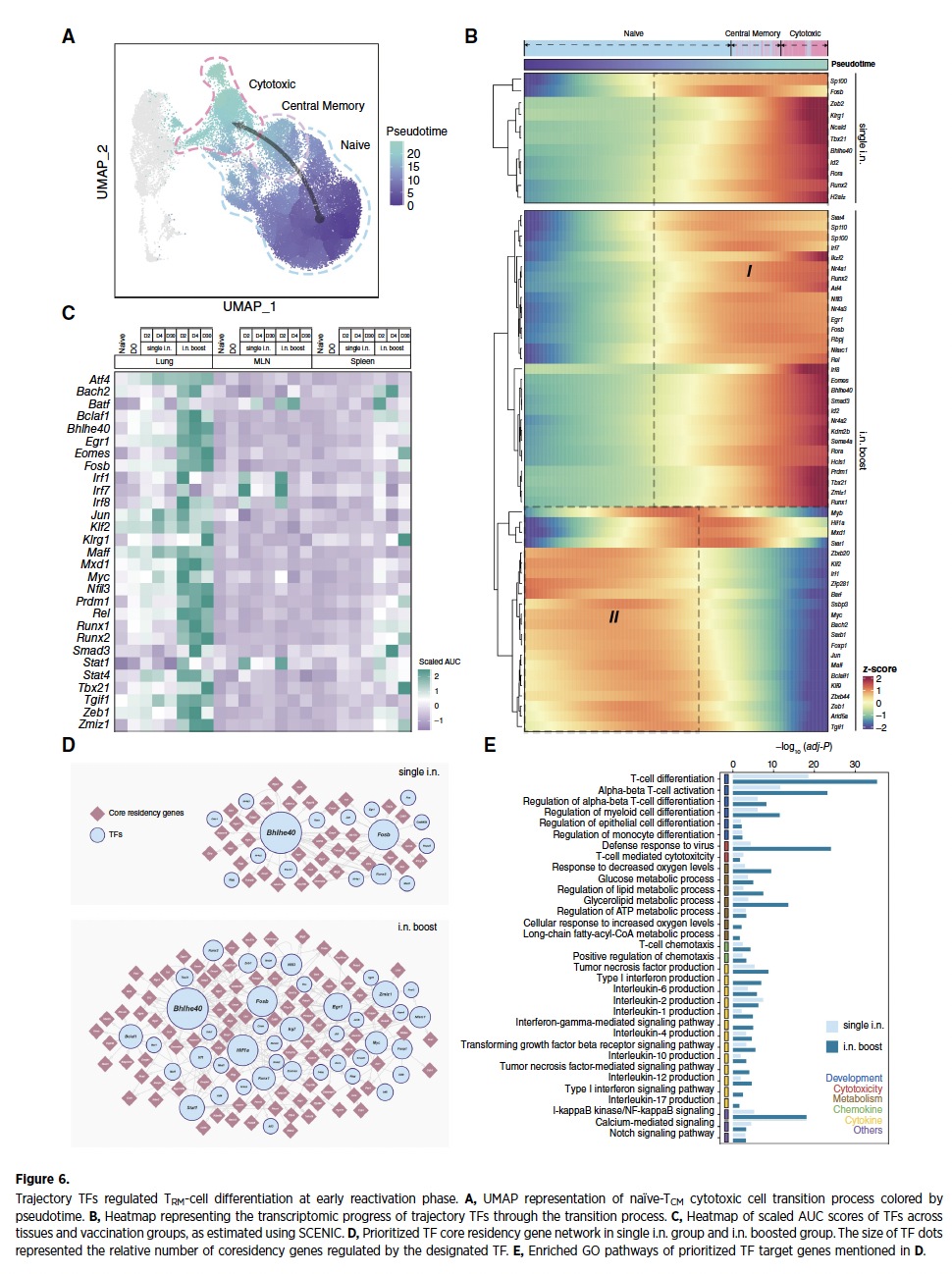
 5、TCM向TRM分化命运在再激活早期确立
5、TCM向TRM分化命运在再激活早期确立
伪时序轨迹分析描绘出TCM→TRM分化路径:初始T细胞经抗原刺激分化为TCM,最终定向转化为细胞毒性TRM。关键转录因子(NR4A1/2/3、BHLHE40、PRDM1)在加强后第2天即被激活,启动TRM特异性转录程序。调控网络分析进一步揭示TGF-β信号(SMAD3)、脂代谢通路(PPARG)与NF-κB(REL)协同驱动分化进程,为干预TRM发育提供精准靶标。
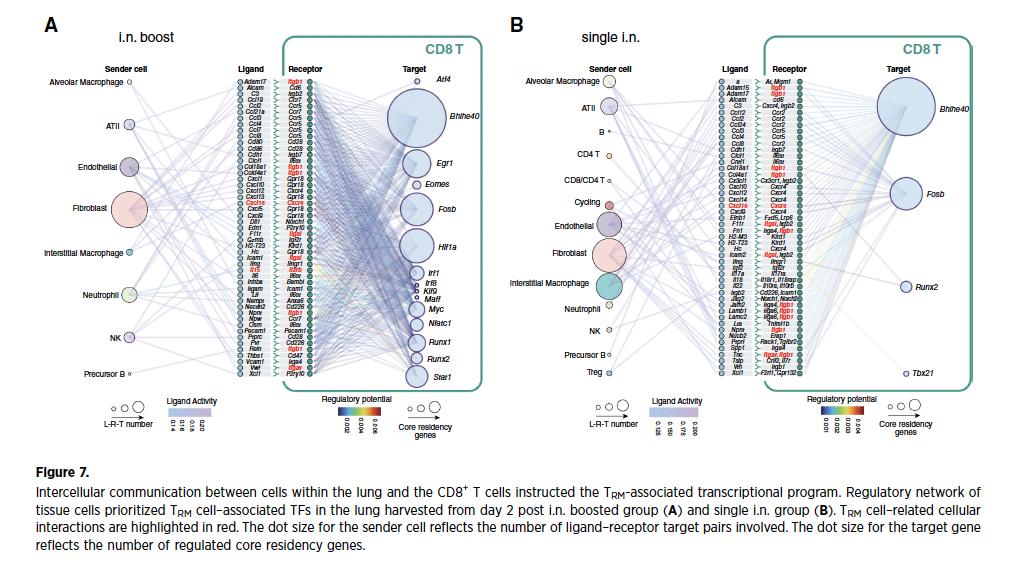
6、组织微环境指令性调控TRM转录程序
肺组织内细胞间通讯网络是TRM分化的核心指令系统。内皮细胞、成纤维细胞及巨噬细胞通过配体-受体对(如IL15-IL2RB、CXCL12-CXCR4)激活TRM相关转录因子,其调控网络密度在加强组显著高于单鼻内组。Notch信号(JAG2-NOTCH1)和细胞黏附分子(ICAM1-ITGAL)被鉴定为促进TRM驻留的核心通路,阐明微环境与T细胞互作的时空协调机制。
结论
本研究通过创新性的DNA肌注初免联合LAIV鼻内加强策略,成功实现中央记忆T细胞(TCM)向肺驻留记忆CD8+ T细胞(TRM)的高效转化,其核心机制在于
鼻内加强免疫可促进肌注激发的TCM细胞经由CXCR3-CXCL9/10趋化因子轴定向归巢至肺组织,协同肺组织微环境信号驱动其向TRM进行终末分化的进程。该策略在黑色素瘤与间皮瘤模型中均显著抑制肿瘤肺转移,并通过抑制T细胞耗竭标志PD-1表达和抑制髓系抑制细胞活性建立长效抗肿瘤屏障。这一发现为抗肿瘤肺转移免疫治疗的优化提供了理论和实验基础。

汇报人:邱轲
审核:邹雨豪、饶郁芳、任建君



