原创 冯兰 华西医院耳鼻喉科
精读分享│【Nature Communications】:协同纳米CRISPR支架通过激活肿瘤内焦亡来增强免疫疗法
英文题目:A cooperative nano-CRISPR scaffold potentiates immunotherapy via activation of tumour-intrinsic pyroptosis
中文题目:协同纳米CRISPR支架通过激活肿瘤内焦亡来增强免疫疗法
期刊:Nature Communications(IF: 14.7)
单位:四川大学华西医院生物国家重点实验室巩长旸和吴秦洁团队等
发表时间:2023年2月

思维导图:


摘要
高效的癌症免疫治疗依赖于将高生物活性的治疗剂精准递送至肿瘤部位。然而,外源性药物的递送在临床实践中常常面临诸多挑战。为此,该研究开发了一种协同纳米CRISPR支架(Nano-CD),其通过功能筛选获得特定的sgRNA,能够精准触发内源性GDSME的表达,同时释放顺铂以诱导免疫原性细胞死亡。其作用机制分为两个关键步骤:首先,裂解的细胞内物质具有佐剂特性,能够启动抗肿瘤免疫反应的级联放大;其次,GDSME表达的上调进一步强化了这一过程,引发细胞焦亡并释放肿瘤相关抗原,从而增强免疫系统的识别和攻击能力。单独使用顺铂或GSDME均无法有效抑制肿瘤生长,但两者联合作用可显著抑制原发性和复发性黑色素瘤的进展。此外,Nano-CD与免疫检查点阻断疗法联用能够诱导持久的免疫记忆和强烈的全身抗肿瘤免疫反应,从而预防疾病复发、抑制肺转移并延长黑色素瘤荷瘤小鼠的生存期。综上所述,该研究利用CRISPR技术实现了细胞内在蛋白的表达调控,并以GDSME作为原型免疫调节剂,为免疫治疗提供了新策略。这一纳米平台还可进一步拓展,用于调控其他免疫相关过程,以实现更广泛的治疗应用。
背景
蛋白质疗法在癌症治疗领域受到越来越多的关注,并展现出巨大的潜力。近年来,肿瘤新抗原、细胞因子以及焦亡(pyroptosis)相关底物(如Gasdermin家族)等多种蛋白已被广泛应用于肿瘤免疫治疗。然而,尽管这些蛋白质疗法展现出显著的治疗潜力,其直接应用仍然面临诸多挑战。其中,体内不利的生理屏障是主要限制因素,这使得外源蛋白容易在血液循环中被迅速清除或代谢,从而导致生物利用度较低,削弱了治疗效果。研究表明,增加蛋白剂量可以改善其在肿瘤部位的累积,但由于蛋白缺乏肿瘤靶向性,这种策略可能会引发免疫相关的不良反应。因此,如何提高蛋白质疗法的稳定性和生物利用度成为亟待解决的问题。
目前,增强体内蛋白稳定性和生物利用度的策略主要包括功能化修饰和递送系统的优化。已有研究表明,通过特定的修饰方法可以改善蛋白的治疗效果。此外,借助纳米载体系统,蛋白可以有效富集于肿瘤部位并被肿瘤细胞摄取,从而提高治疗效率。然而,当前主流的方法仍以外源蛋白的递送为主,不仅成本高昂,制备过程复杂,而且对蛋白的生物活性要求极高,限制了其从实验室向临床转化的进展。
相较于外源蛋白递送,利用细胞自身合成的内源性生物活性蛋白提供了一种更加安全、自然的癌症治疗策略。肿瘤细胞源自正常细胞,其基因组中仍然包含许多具有治疗潜力的蛋白编码序列。这一机制使得利用肿瘤细胞自身合成特定蛋白来实现治疗效果成为可能。由于这些蛋白直接由肿瘤细胞合成,无需考虑递送过程对蛋白质稳定性和活性的影响,因此可显著提高其生物利用度。此外,内源合成的蛋白只在肿瘤细胞内发挥作用,避免了对正常细胞的不良影响。然而,由于基因突变或表观遗传沉默等原因,许多功能性蛋白(如抑癌基因TP53及焦亡相关底物GSDME等)在肿瘤细胞中通常表达异常或水平较低。因此,尽管这一策略具有巨大的潜力,相关研究仍较为有限。如何开发一种高效、简便的方法以实现治疗蛋白在肿瘤细胞内的自主合成,仍然是一项极具挑战性的任务。
CRISPR技术的发展为这一挑战提供了新的解决方案。通过将失活的Cas9(dCas9)与转录激活因子结合,CRISPR/dCas9可精准调控肿瘤细胞基因组,从而诱导内源性治疗蛋白的表达。该研究提出了一种协同作用的纳米CRISPR载体(Nano-CD),用于介导焦亡相关蛋白GSDME在肿瘤细胞内的自主合成,并以此为基础开展免疫治疗。Nano-CD由氨基酸修饰的阳离子核心与功能化共聚物外壳共同构建,能够实现CRISPR/dCas9和顺铂(cisplatin)的共递送。这一设计使得Nano-CD在血液循环中具有良好的稳定性,并能够在肿瘤细胞内的酸性环境下按需释放顺铂和CRISPR/dCas9质粒。最终,通过肿瘤细胞自主合成的GSDME及顺铂诱导的Caspase-3活化,Nano-CD能够精准、高效地启动焦亡,进而逆转肿瘤微环境的免疫抑制状态,并通过正反馈机制增强抗肿瘤免疫反应。当Nano-CD与免疫检查点抑制剂联合使用时,可有效抑制恶性黑色素瘤的复发和转移,并诱导持久的免疫记忆效应。综上所述,该研究提供了一种基于CRISPR技术的新型癌症免疫治疗策略,通过诱导肿瘤细胞自主合成治疗蛋白,为未来免疫治疗的进一步发展提供了新的思路。
结果
协同纳米CRISPR载体(Nano-CD)的构建与表征
Nano-CD(纳米CRISPR载体)是一种能够协同递送顺铂(cisplatin)和CRISPR/dCas9质粒的纳米平台。该纳米系统的制备过程包括两个主要步骤:首先,通过静电吸附作用在氨基酸修饰的支化聚乙烯亚胺(PEIPT)核心上负载CRISPR/dCas9质粒,形成CRISPR/dCas9复合物;随后,利用共价键连接顺铂和TAT肽至聚丙烯酸聚乙二醇(PAA-PEG)骨架,形成外壳包覆该复合物,从而构建出完整的Nano-CD载体(图1,图2a)。这一设计赋予Nano-CD良好的血液循环稳定性,并使其在酸性细胞环境中实现按需释放顺铂和CRISPR/dCas9质粒。
为了验证Nano-CD在细胞内环境中的递送能力,研究者采用高效液相色谱(HPLC)测定了Nano-CD在溶酶体环境(pH5.0)下的顺铂释放情况。结果显示,在溶酶体模拟条件下,约90%的顺铂被释放,证明其能够在细胞内精准释放。此外,透射电子显微镜(TEM)成像结果证实了Nano-CD在不同pH条件下均保持均匀的球形形态(图2b)。动态光散射(DLS)测量结果显示,在pH7.4条件下,Nano-CD的平均粒径为160±11nm,而在pH5.0条件下,粒径降至116±5nm,表明PCT外壳具有去包覆作用(图2c)。与此同时,Nano-CD在pH7.4条件下的表面电位约为-5mV,而在pH5.0下则转变为+14mV,这一变化进一步验证了其对溶酶体酸性环境的响应性(图2d)。凝胶电泳实验显示,Nano-CD能够有效包裹CRISPR/dCas9质粒,并在20:5:1质量比下成功凝聚DNA,从而防止其在体内被核酸酶降解(图2e)。此外,Nano-CD在PBS、5%血清或不同pH条件(4.0-8.0)下均保持稳定。
该研究利用MTT试验评估了Nano-CD及其组成成分的细胞毒性。实验结果表明,即使在较高浓度(300μg/mL)下,PEIPT和PCT也未显示出明显的细胞毒性。为了进一步研究Nano-CD的细胞摄取行为及转染效率,研究者利用共聚焦激光扫描显微镜(CLSM)对其细胞内分布进行了观察。结果显示,与PEI25K载体相比,Nano-CD的细胞摄取效率提高了近一倍。同时,CLSM成像结果表明,在1h内,YOYO-1标记的Nano-CD(绿色)开始积聚于细胞膜,2h后进入溶酶体,并在4h内富集于溶酶体。8h后,绿色信号几乎完全重叠于细胞核(蓝色),表明Nano-CD成功逃逸出溶酶体并释放质粒。这一高效的细胞摄取与胞内递送特性,使Nano-CD在B16F10细胞中的转染效率达到约80%,显著优于PEI25K(约36%)。这一优异的转染能力为肿瘤细胞内自主合成GSDME蛋白奠定了基础。
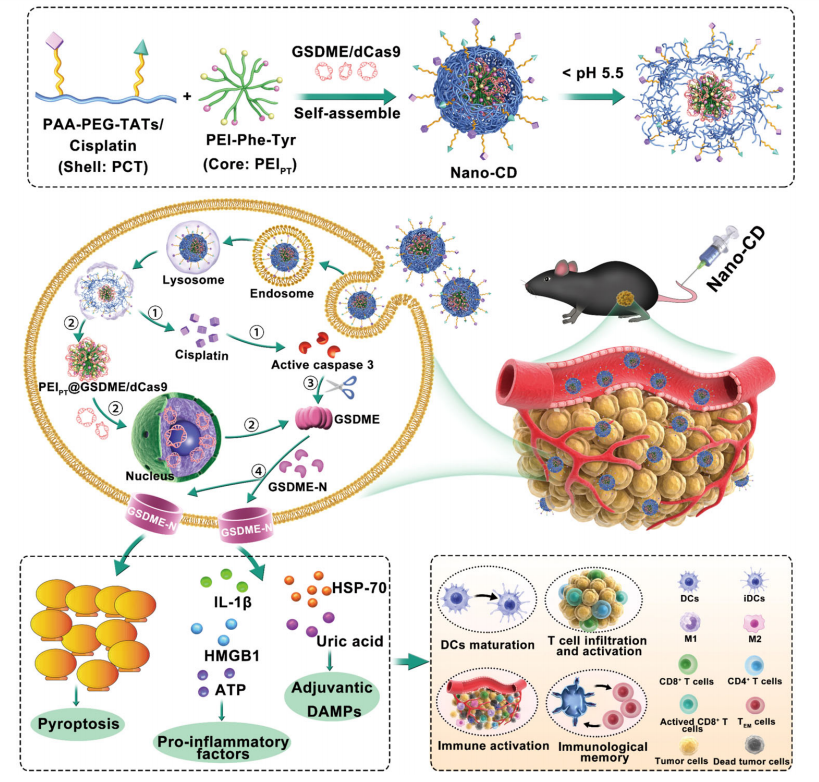
Figure 1. Workflow of cooperative Nano-CD scaffold.
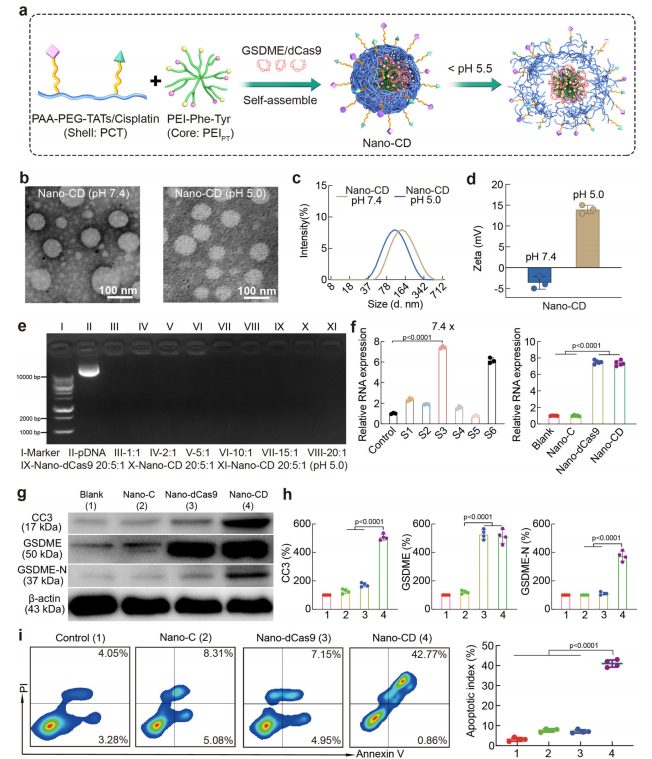
Figure 2.Characterization of Nano-CD nanoparticles.
Nano-CD介导的肿瘤细胞焦亡及其免疫原性
GSDME蛋白是焦亡过程的关键因子,能够被活化的Caspase-3裂解,释放其活性膜穿孔结构域(GSDME-N)。为了筛选最优的sgRNA以提高GSDME表达水平,研究人员设计了7种sgRNA并进行功能筛选。实验结果表明,sgRNA-3(s3)在Nano-CD载体中的调控效率最佳,使GSDME表达水平提高了7.4倍(图2f)。因此,该研究选择含有sgRNA-3的CRISPR/dCas9系统用于Nano-CD的构建。qPCR结果显示,与对照组相比,Nano-CD处理组的GSDMEmRNA表达水平提高了7.5倍(图2f)。此外,Western Blot结果进一步证实,在Nano-CD处理组中,裂解型GSDME(GSDME-N)和活化Caspase-3(CC3)的蛋白表达水平显著上调(图2g,h),表明Nano-CD成功在肿瘤细胞内诱导了GSDME介导的焦亡过程。为了评估Nano-CD的肿瘤杀伤效果,该研究进行了细胞凋亡分析。流式细胞术(FCM)检测结果显示,与对照组(Nano-C和Nano-dCas9,细胞死亡率约8%)相比,Nano-CD处理组的肿瘤细胞死亡率提高了约5倍(图2i)。这些结果表明,Nano-CD通过顺铂和CRISPR/dCas9介导的协同作用,实现了显著的肿瘤杀伤效果。此外,该研究还探讨了Nano-CD诱导的焦亡是否具有免疫原性。CLSM成像结果显示,Nano-CD处理的B16F10细胞表现出明显的细胞肿胀,并伴有细胞膜表面大量气泡形成,这是焦亡的典型形态特征(图3a)。同时,红色荧光标记的T11染料成功进入Nano-CD处理细胞的胞质,而未能渗透未受损细胞的细胞膜,进一步表明Nano-CD能够破坏肿瘤细胞膜的完整性(图3b)。焦亡过程中,细胞内容物的释放会进一步激活免疫系统。实验结果表明,与对照组相比,Nano-CD处理组的细胞外ATP、乳酸脱氢酶(LDH)及IL-1β释放量显著增加(图3c)。此外,免疫原性细胞死亡(ICD)标志物高迁移率族蛋白B1(HMGB1)和钙网蛋白(CRT)的表达也显著提高(图3d,e)。进一步的流式细胞术和ELISA检测证实,Nano-CD处理显著增强了肿瘤微环境中免疫佐剂相关分子(尿酸、Hsp-70和HMGB1)的释放(图3f-h),表明Nano-CD通过焦亡诱导了强烈的免疫激活效应。综上所述,Nano-CD能够在肿瘤细胞内自主合成GSDME并协同顺铂诱导焦亡,进而激活免疫系统,为肿瘤免疫治疗提供了新的策略。
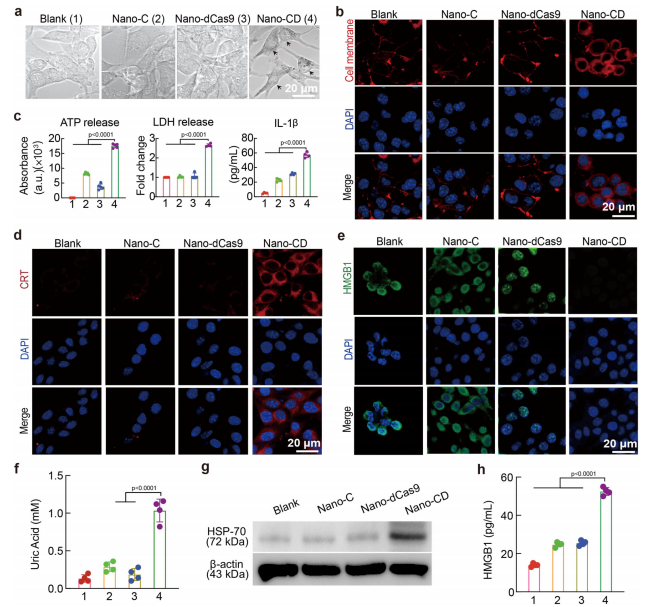
Figure 3.Representative characterization of pyroptosis.
Nano-CD诱导的树突状细胞(DC)成熟
焦亡是一种关键的程序性细胞死亡方式,通过Caspase-3激活后可释放促炎性细胞内容物,从而诱导全身性免疫反应。该研究探讨了Nano-CD诱导的肿瘤焦亡能否促进树突状细胞(DC)的成熟。将小鼠骨髓来源的树突状细胞(BMDC)与Nano-CD处理过的B16F10细胞共同培养,结果表明Nano-CD处理能够显著促进树突状细胞的成熟。流式细胞术结果显示,与对照组相比,Nano-CD处理的树突状细胞在CD83、CD40、CD80和CD86等成熟标志物的表面表达显著增加(图4d)。此外,ELISA检测结果也显示,经过Nano-CD处理后,成熟树突状细胞分泌的TNF-α、IL-12p40和IFN-γ水平比对照组显著提高(图4c)。
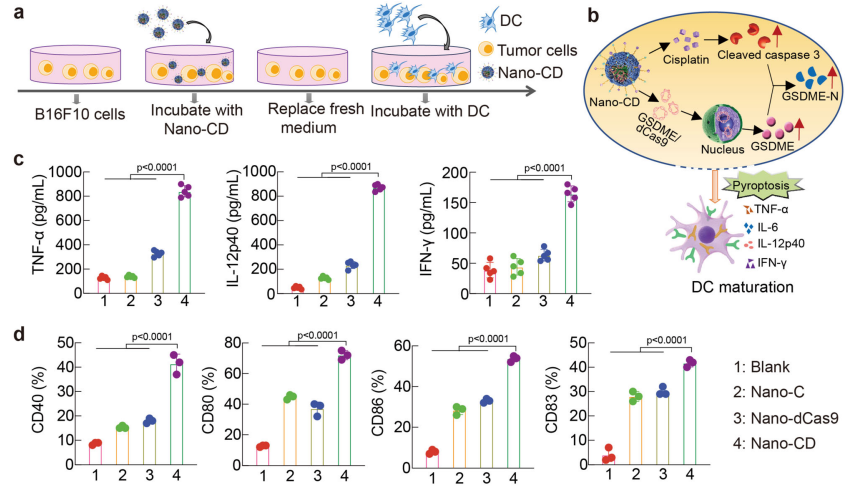
Figure 4. Immune stimulation of DC by Nano-CD in vitro.
4、Nano-CD联合PD-1阻断的抗肿瘤效果
基于Nano-CD在肿瘤中的优异靶向性和免疫激活效果,该研究进一步探讨了其与免疫检查点抑制剂PD-1抗体联合应用的抗肿瘤效能。在小鼠皮下黑色素瘤模型中实施治疗,结果显示单独使用Nano-CD组可显著抑制肿瘤生长,并有效延长小鼠的生存期(图5b,c)。更为显著的是,Nano-CD联合PD-1抗体治疗组展示了比其他治疗组更强的抗肿瘤效果,所有接受联合治疗的小鼠均实现了完全肿瘤消退,并且其生存时间较其他组延长了三倍(图5c)。
免疫分析进一步证明,Nano-CD联合PD-1阻断治疗显著增加了肿瘤中CD4+和CD8+T细胞的浸润,且这些T细胞呈现活化状态(CD69+),表明免疫治疗成功激活了特异性的抗肿瘤免疫反应(图5d,e)。与单独Nano-CD处理组相比,联合治疗组中,CD4+T细胞和CD8+T细胞的比例更高,免疫抑制性Tregs(Foxp3+T细胞)显著减少,这进一步支持了Nano-CD与免疫检查点抑制剂联合使用可显著增强抗肿瘤免疫反应的假设(图5e)。这些结果表明,Nano-CD与PD-1阻断抗体的联合治疗能够有效增强肿瘤免疫反应,抑制肿瘤复发。
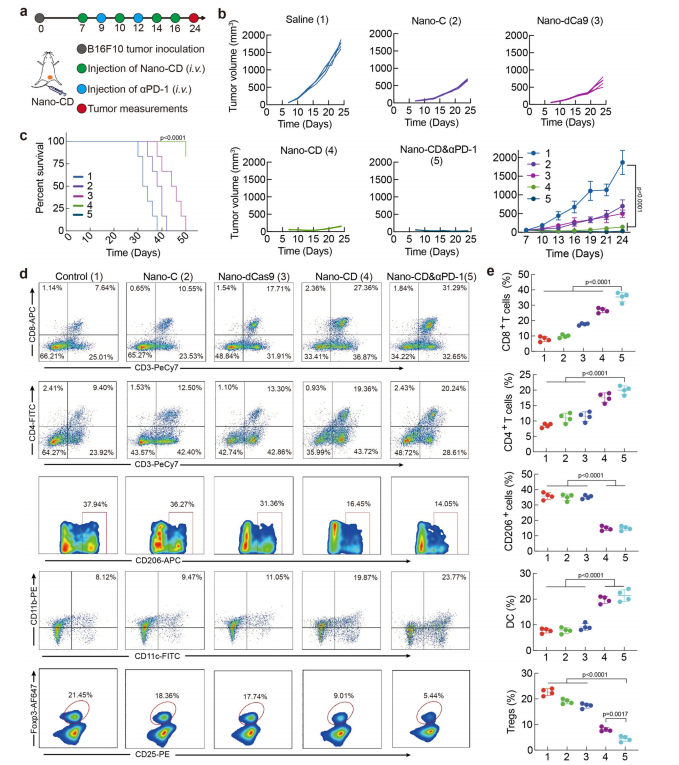
Figure 5.Anti-tumor effect of Nano-CD against primary melanoma model.
5、Nano-CD联合PD-1阻断的肿瘤复发抑制作用
肿瘤复发是癌症治疗中的主要挑战之一。为评估Nano-CD联合PD-1抗体治疗对肿瘤复发的抑制作用,研究者在小鼠中建立了肿瘤复发模型。结果表明,单独使用Saline、Nano-C或Nano-dCas9的治疗组未能有效抑制肿瘤复发,而Nano-CD联合PD-1阻断抗体的治疗则显著抑制了肿瘤复发,并且能够持续60天抑制肿瘤的恶性转化(图6b,c,d)。联合治疗组的肿瘤体积和重量显著小于其他组,且小鼠存活率大大提高(图6b,c)。
进一步的免疫分析显示,Nano-CD联合PD-1阻断治疗显著促进了CD8+T细胞和CD4+T细胞在肿瘤中的浸润,并且活化的CD8+T细胞(CD8+CD69+)比例明显增加。与其他治疗组相比,联合治疗组的肿瘤微环境中的效应记忆T细胞(TEM)显著增加,这表明该治疗可以有效激活系统性的抗肿瘤免疫反应,抑制肿瘤复发(图6e,f,g,h)。这些结果表明,Nano-CD与PD-1抗体的联合治疗为抑制肿瘤复发提供了有效手段,尤其是在黑色素瘤等复发性肿瘤中展现了强大的治疗潜力。
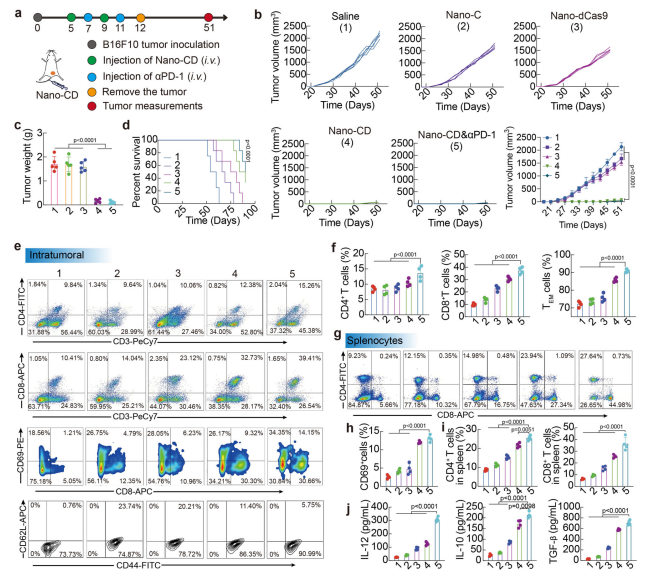
Figure6.Anti-tumoreffectofNano-CDagainstrecurrencemelanomamodel.
6、Nano-CD联合PD-1阻断治疗的肺转移抑制作用
肿瘤远处转移是临床治疗失败的主要原因,尤其是在恶性黑色素瘤等癌症中更为显著。为进一步评估Nano-CD的治疗效果,我们在小鼠肺转移模型中进行了实验。结果显示,Nano-CD联合PD-1阻断抗体治疗显著抑制了黑色素瘤的肺转移,治疗组小鼠的肺转移结节数量显著低于对照组(图7b,c)。联合治疗组小鼠的生存期较对照组延长了约1.3倍(图7c),且肺组织切片的H&E染色显示,治疗组的肺转移结节显著减少(图7d)。
免疫分析表明,Nano-CD联合PD-1阻断抗体治疗显著增加了CD8+细胞毒性T细胞和CD4+辅助T细胞的数量,并且CD8+T细胞的激活水平显著提高。此外,联合治疗还显著降低了肿瘤组织中的M2型巨噬细胞比例,这些细胞通常促进肿瘤的进展和转移(图7e,f)。这些结果表明,Nano-CD联合PD-1阻断抗体的治疗能够有效抑制肺转移,并且提供了系统性的抗肿瘤免疫反应。
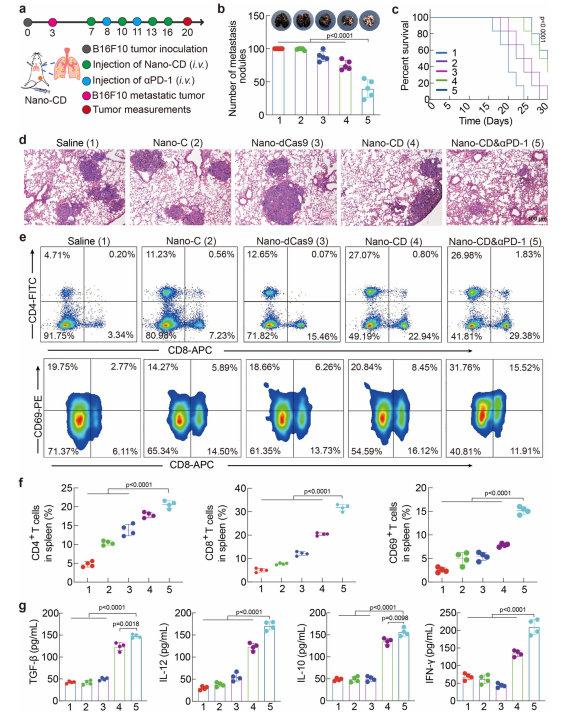
Figure7.|AssessmentoftherapeuticefficacyofNano-CDinmelanomapulmonary
metastasismodel.aSchematic.
结论
综上所述,该研究成功构建了一种协同作用的Nano-CRISPR载体(Nano-CD),它能够通过自供给GSDME蛋白启动精准的肿瘤焦亡,并通过免疫激活反应有效抑制肿瘤的生长、复发和转移。与免疫检查点抑制剂PD-1阻断抗体联合使用时,Nano-CD展现出了强大的抗肿瘤效果,并通过增强系统性抗肿瘤免疫反应和持久的免疫记忆,显著延长了小鼠的生存期。该研究为未来癌症免疫治疗提供了新的思路,并为临床转化奠定了坚实的基础。

汇报人:冯兰
导师:任建君、赵宇
审核:李俊虹、邹宇豪



