原创 张宇阳 华西医院耳鼻喉科
精读分享│【Nature Communications】:通过CEACAM6靶向抗体-药物偶联物递送BET蛋白降解剂可抑制胰腺癌模型中肿瘤生长
英文题目:Delivery of a BET protein degrader via a CEACAM6-targeted antibody-drugconjugate inhibits tumour growth inpancreatic cancer models
中文题目:通过CEACAM6靶向抗体-药物偶联物递送BET蛋白降解剂可抑制胰腺癌模型中肿瘤生长
期刊:Nature Communications(IF: 14.7)
单位:日本株式会社筑波研究实验室
发表时间:2024年3月


摘要:
胰腺导管腺癌(PDAC)是所有癌症中预后最差的一种。为了改善PDAC的治疗,本研究建立了基于类器官和共培养技术的筛选系统,并找到了抗体-药物偶联物(ADC)的有效载荷--一种名为 EBET 的溴域和末端外(BET)蛋白降解剂。本研究选择CEACAM6/CD66c作为ADC靶点,开发出一种对表达CEACAM6的正常细胞反应性最小的抗体#84.7。EBET偶联的#84.7(84-EBET)对各种PDAC类器官组织有杀伤作用,对CEACAM6阴性的PDAC细胞和癌症相关成纤维细胞有旁观者效应。在小鼠研究中,单次注射84-EBET可诱导各种PDAC患者衍生的异种移植物出现明显的肿瘤消退,同时减少基质细胞的炎症表型,且不会引起明显的体重减轻。与标准化疗或PD-1抗体联合使用可诱导更深入、更持久的肿瘤消退,且不会增加毒性。临床前证据表明,通过CEACAM6靶向的ADC向PDAC及其微环境递送BET蛋白降解剂具有潜在的疗效。
研究思路及方法:
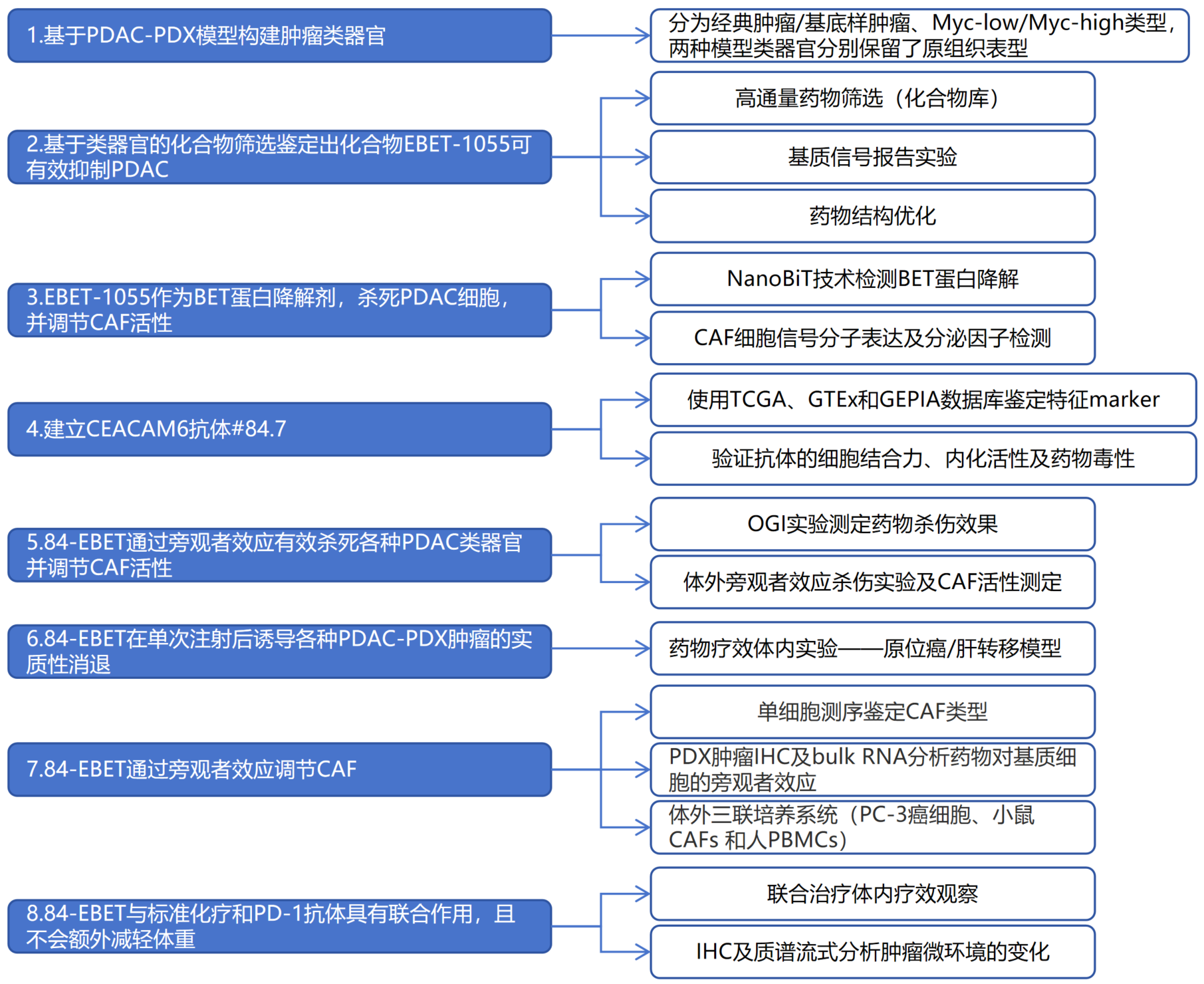
主要结果:
1.类器官培养表型与原始PDAC-PDX肿瘤相似
①根据已知预后分子亚型和RNA-seq数据,将PDAC-PDX样本分为经典肿瘤/基底样肿瘤、Myc-low/Myc-high类型,并选择了两种具有显著差异的PDAC-PDX模型。PC-3(非前列腺癌模型)的分子亚型为经典型肿瘤,Myc信号低,与PDAC患者的较好预后相关;而PC-42的分子亚型为基底样肿瘤,Myc信号高,与PDAC患者的较差预后相关。小鼠研究显示,PC-3肿瘤表现为中度分化和对GEM敏感的表型,肿瘤缩小,而PC-42肿瘤表现为分化差和对GEM抗性的表型,肿瘤不缩小(Figure S1 a-c)。
②构建PDAC-PDX肿瘤类器官模型:PC-3和PC-42肿瘤类器官在GEM敏感性和分化方面反映了原始肿瘤的表型(Figure S1 d、e)。对PDX肿瘤和类器官组织进行了免疫荧光分析。在PC-3肿瘤中,几乎所有E-cadherin+癌细胞都是BC2LCN阴性,而在PC-42肿瘤中,E-cadherin+癌细胞都是BC2LCN阳性。经GEM处理后,PC-3肿瘤中BC2LCN+癌细胞的数量增加,但PC-42肿瘤中BC2LCN+癌细胞的数量保持不变;存活的BC2LCN+癌细胞是Ki67+循环细胞。在这两种模型中,肿瘤均高度纤维化,并且富含I型胶原。同样,PC-3类器官经GEM处理后,BC2LCN+细胞丰度和I型胶原染色均有所增加。与PC-3类器官相比,无论是否经过GEM处理,PC-42类器官都显示出更高的BC2LCN+细胞丰度和I型胶原染色(Figure S2 a-b)。
综上所述,这些发现显示该类器官培养系统可以很好地模拟体内的PDAC肿瘤,有助于理解PDAC细胞和基质细胞的动态变化。
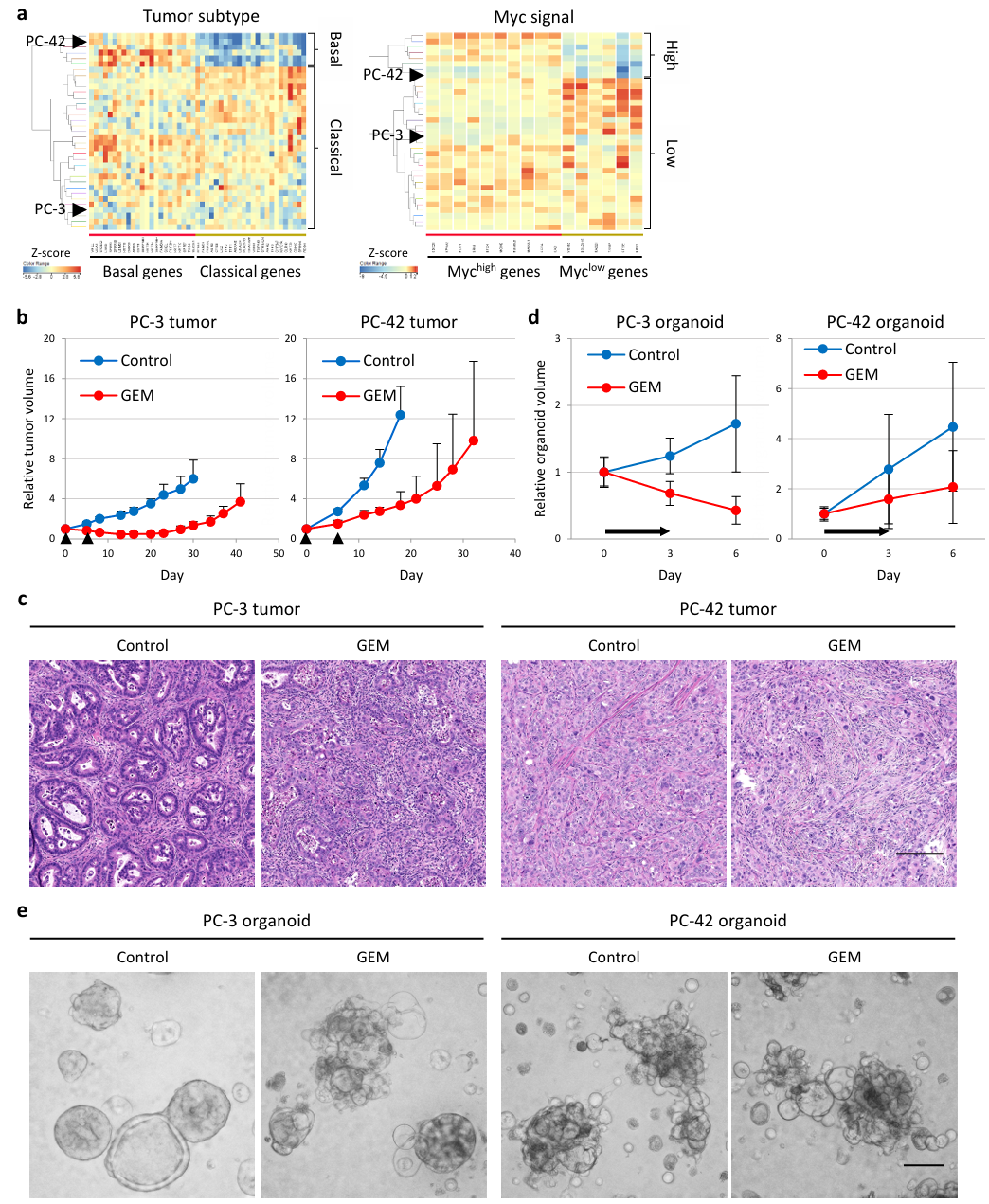
Figure S1. Characterization of PDAC-PDX tumors and organoids
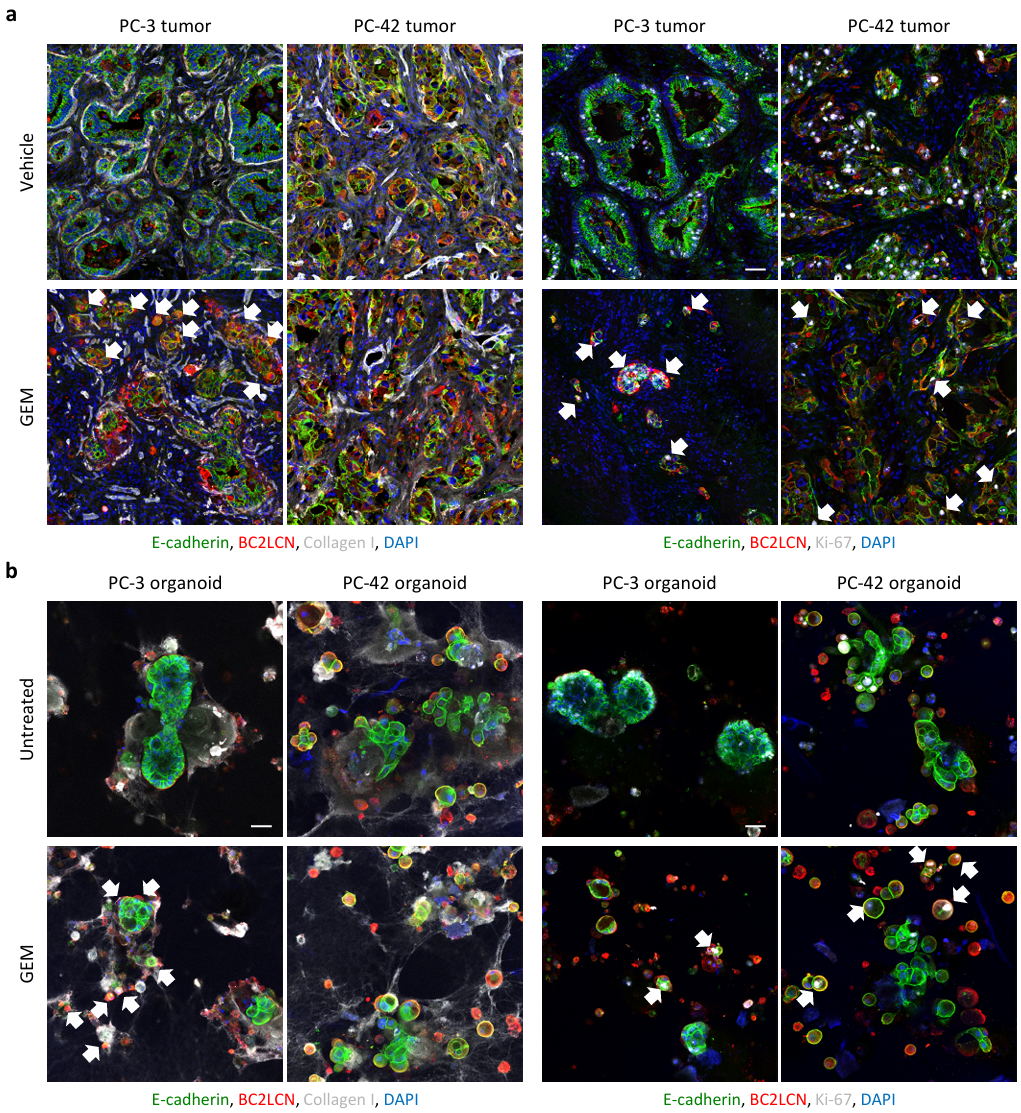
Figure S2. Organoid culture phenotypically mimics the original PDAC-PDX tumor
2.基于类器官的化合物筛选鉴定出化合物EBET-1055可有效抑制PDAC
①基于类器官系统,使用专有化合物库进行高通量药物筛选,发现BET蛋白降解剂EBET-1055是一种在PC-3和PC-42类器官中均非常有效的化合物。重要的是,PC-3类器官对标准化疗药物敏感,而PC-42类器官具有耐药性。最常用的有效载荷-- maytansine和monomethyl auristatin E(MMAE)不能完全杀死PC-3类器官,对PC-42类器官也完全无效。一些与DNA结合的有效载荷,即PNU-15968216、calicheamicin和SJG-136,对PC-42类器官有效,但半数最大抑制浓度(IC50)约为10至100nM,远高于二维培养中报道的IC50值(Figure 1 a, Figure S3 a-b)。
②选择具有高报告活性的LSCs(肝星状细胞)进行基质信号报告实验筛选并检测化合物处理对共培养的LSCs的干扰素刺激反应元件(ISRE,IL-1信号)、NF-κB(IL-1 信号)、STAT3(IL-6 信号)和SMAD2/3(TGF-β 信号)报告活性。这些基质信号对PDAC中癌症相关成纤维细胞(CAFs)的功能非常重要。与PC-3癌细胞共培养后,LSCs上的所有报告活性都比单株培养时的基础值有所提高。在类器官生长抑制(OGI)筛选出的有效化合物中,只有EBET-1055能消除共培养物中所有报告活性的上调,而GEM处理则不能。较GEM处理,BC2LCN+/Ki67+癌细胞在EBET-1055处理后明显减少(Figure 1 b-c)。
③选择EBET-1055作为种子化合物,将其作为有效载荷进行优化,最终获得了主要有效载荷EBET-1593。为了与抗体偶联,EBET-1593的羟基上通过自巯基氨基亚甲基连接了可被cathepsin-B分解的甘氨酰甘氨酰苯丙氨酰甘氨酸(GGFG)连接体(Figure S3 b)。
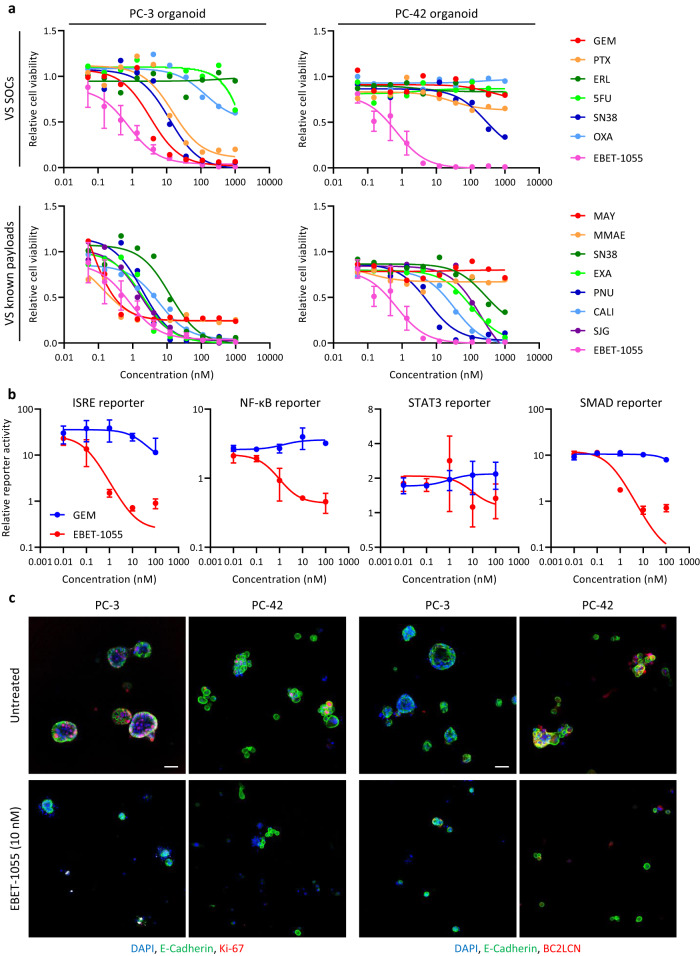
Figure 1. Compound screening with organoids identifies EBET-1055, a compound effective against PDAC.
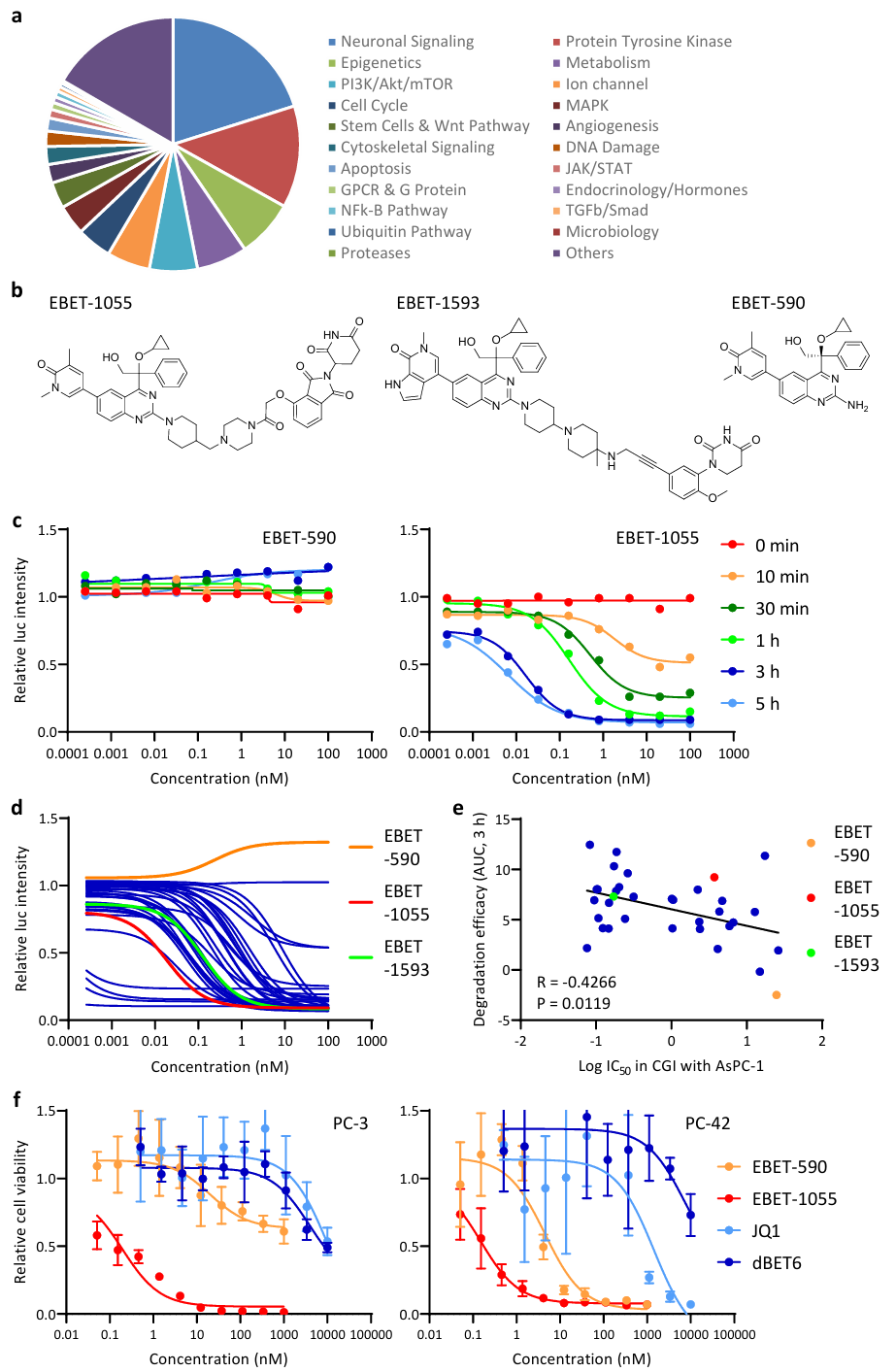
Figure S3. EBET-1055 compound works as a BET protein degrader and kills PDAC cells.
3.EBET-1055作为BET蛋白降解剂,杀死PDAC细胞,并调节CAF活性
①利用NanoBiT技术对HEK293细胞中含溴结构域蛋白4-溴结构域1(BRD4-BD1)结构域降解的活细胞监测表明,EBET-1055降解BET的作用在加入后10分钟开始,3小时后达到饱和。EBET衍生物和对照化合物在该系统中3小时的降解效果与其对AsPC-1PDAC细胞系的细胞生长抑制(CGI)效果显著相关。EBET-1055在OGI试验中的效力远高于dBET6,后者是一种众所周知的BET抑制剂 JQ1 的BET蛋白降解剂(Figure S3 c-f)。
②大量研究表明,BET抑制剂具有抗炎或抗纤维化活性。为了解其潜在机制,使用从PDX肿瘤中分离的小鼠CAFs检测了关键信号分子STAT3和SMAD2/3的状态。添加EBET-105524小时后,STAT3Y705、SMAD2S465/467和SMAD3S423/425的磷酸化水平下降。免疫共沉淀分析(co-IP)显示,BRD4与细胞中含有CDK9的转录复合物上的 STAT3 相互作用,但信号较弱,表明存在通过多分子复合物的间接相互作用。
在 PDAC 微环境中,iCAFs中的STAT3信号与IL-1、IL-6、LIF和CXCL1形成正反馈回路,并协调免疫抑制微环境。本研究中,将小鼠CAFs与PC-3或PC-42癌细胞共培养相比于单独培养CAFs,显著上调了小鼠IL-6和LIF的分泌,而EBET-1055处理可消除这种上调(Figure S4)。
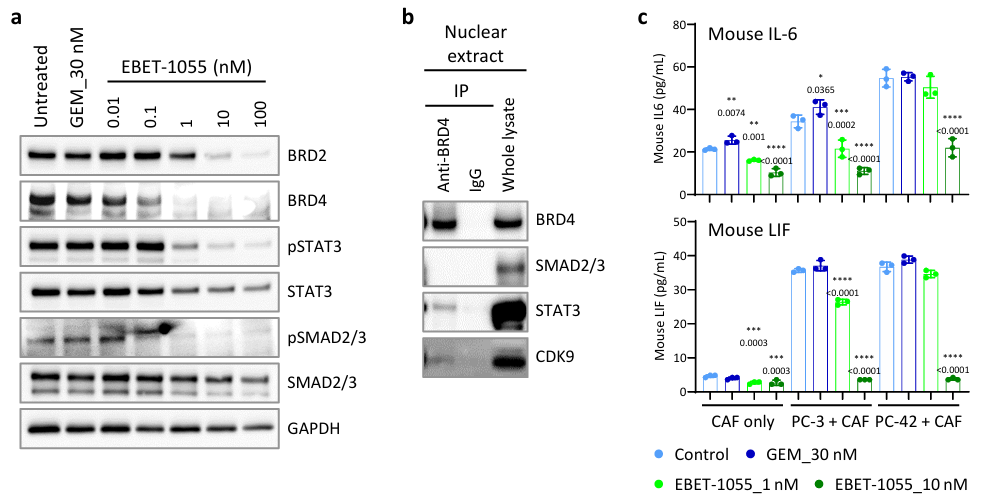
Figure S4. EBET-1055 compound modulates CAF activity.
4.构建CEACAM6抗体#84.7
①使用TCGA、GTEx和GEPIA数据库分析了胰腺癌和正常组织中的基因表达,发现与正常胰腺相比,CEACAM6 是PDAC 中编码膜蛋白的基因上调最显著。预后分析显示CEACAM6表达与较短生存期之间存在相关性;IHC染色显示CEACAM6蛋白在临床PDAC中普遍表达,并且表达仅限于癌细胞。
使用TCGA PDAC数据集检查了CEACAM6表达、PDAC分子亚型和关键分子表达之间的关系。GATA6与经典亚型生态位依赖性及PDAC的更好预后相关;PDGFRA和ACTA2分别是iCAF和myCAF的标志物。CEACAM6在经典PDAC中的表达显著高于基底样PDAC,且与GATA6表达之间存在微弱但显著的正相关。
CEACAM6 在正常肺上皮细胞和髓系祖细胞 (MPC)中同样表达(Figure 2 a-c, Figure S5)。
②从专有的人单链可变抗体片段(scFv)噬菌体展示库中开发了针对CEACAM6的抗体,并使用PDAC细胞、人MPC和人小气道上皮细胞(HSAEC)通过流式细胞术进行筛选;通过比较抗体处理的PC-42细胞在4℃和37℃培养条件下孵育后的平均荧光强度来检查细胞内化活性。与市售的CEACAM6单克隆抗体(mAb)KOR相比,克隆#84.7与PC-42细胞显示出相当的结合和更强的内化活性,与MPC的结合较少,与HSAECs的结合相同。
将药物与人肺上皮细胞进行ALI培养,ADC添加到下腔室中,检测#84.7、EGFR mAb(西妥昔单抗)、HER2 mAb(曲妥珠单抗)与PNU-159682(OGI筛选中最有效的参考有效载荷)偶联的ADC药物毒性,HEL3抗体用作非靶向对照抗体。发现#84.7对肺上皮的毒性相对较低。ALI培养物的免疫组织化学分析和猴肺免疫荧光分析表明,CEACAM6表达仅限于肺上皮的顶端,而 EGFR和HER2表达分布在整个上皮。此外,还研究了注射抗体在食蟹猴体内的分布,#84.7与在HEK293 细胞上表达的人和食蟹猴CEACAM6结合的半数最大有效浓度没有显著差异。通过用抗人IgG抗体染色对注射的mAb进行可视化,发现#84.7在支气管上皮上仅具有背景水平的分布,尽管该上皮表达CEACAM6,而EGFR mAb和HER2 mAb在支气管上皮上积累,具有靶点表达。这些抗体在肺泡上没有分布。这些结果表明#84.7没有主动分布在肺上皮的顶端侧CEACAM6,这可能是由于上皮紧密连接的屏障功能(Figure 2 d-f, Figure S6)。
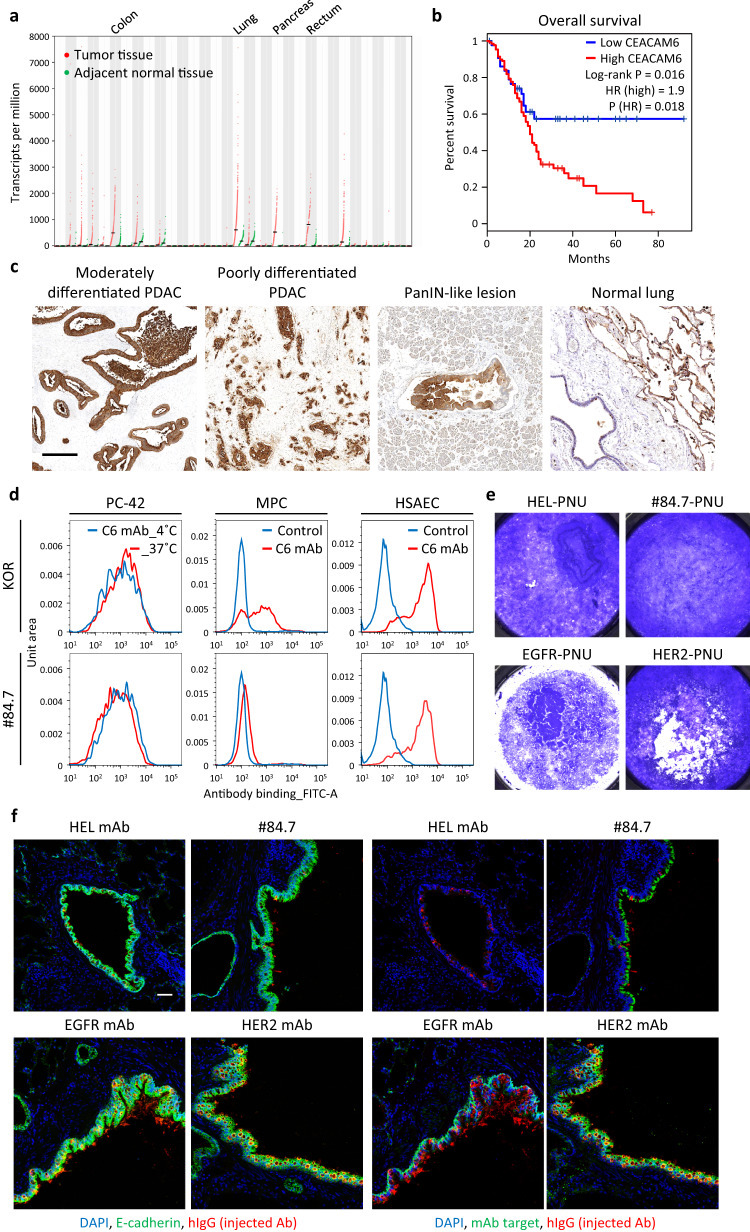
Figure 2. Establishment of CEACAM6 antibody, #84.7.
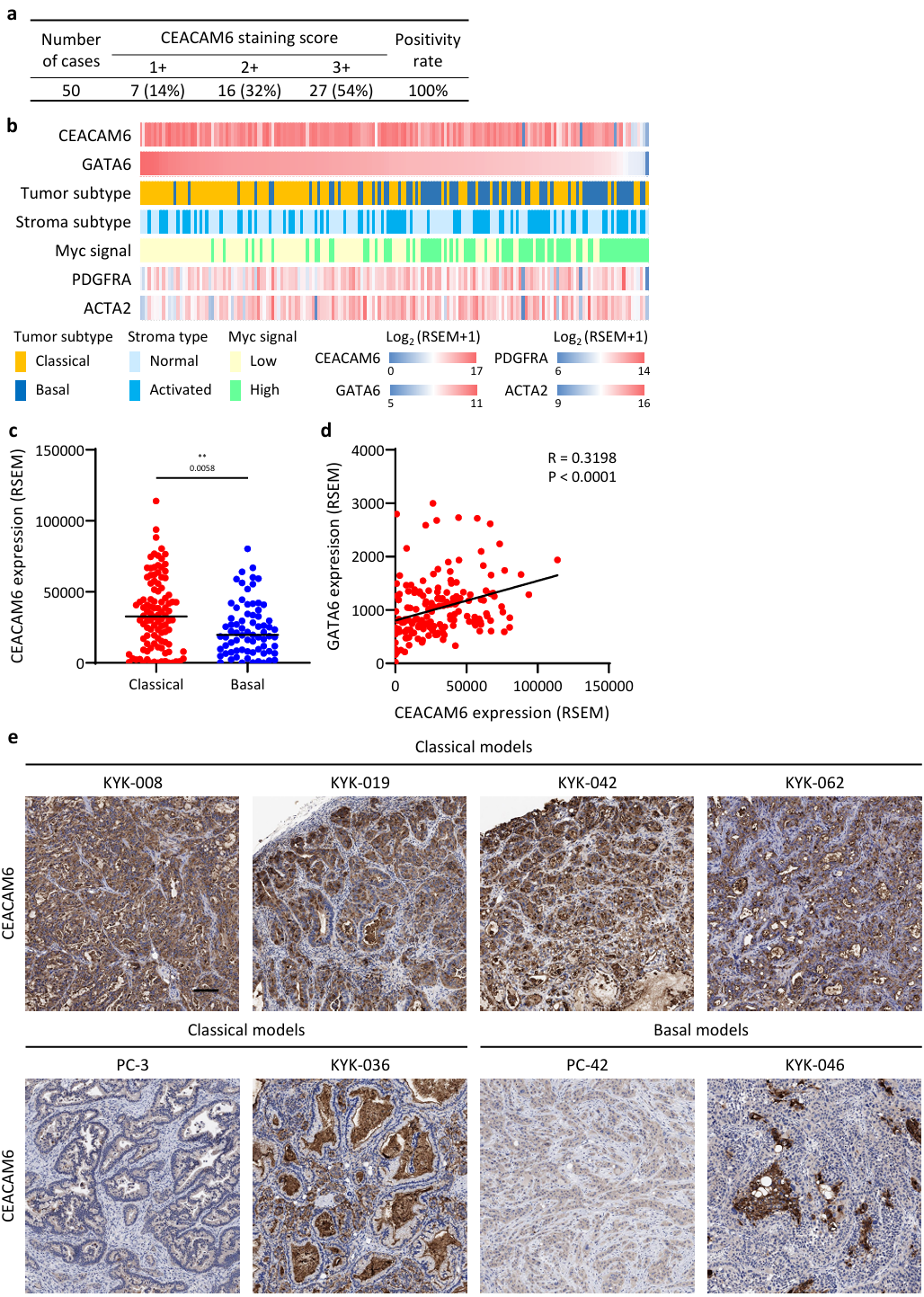
Figure S5. Expression analysis of PDAC clinical samples, TCGA-PDAC dataset, and PDAC-PDX panel.
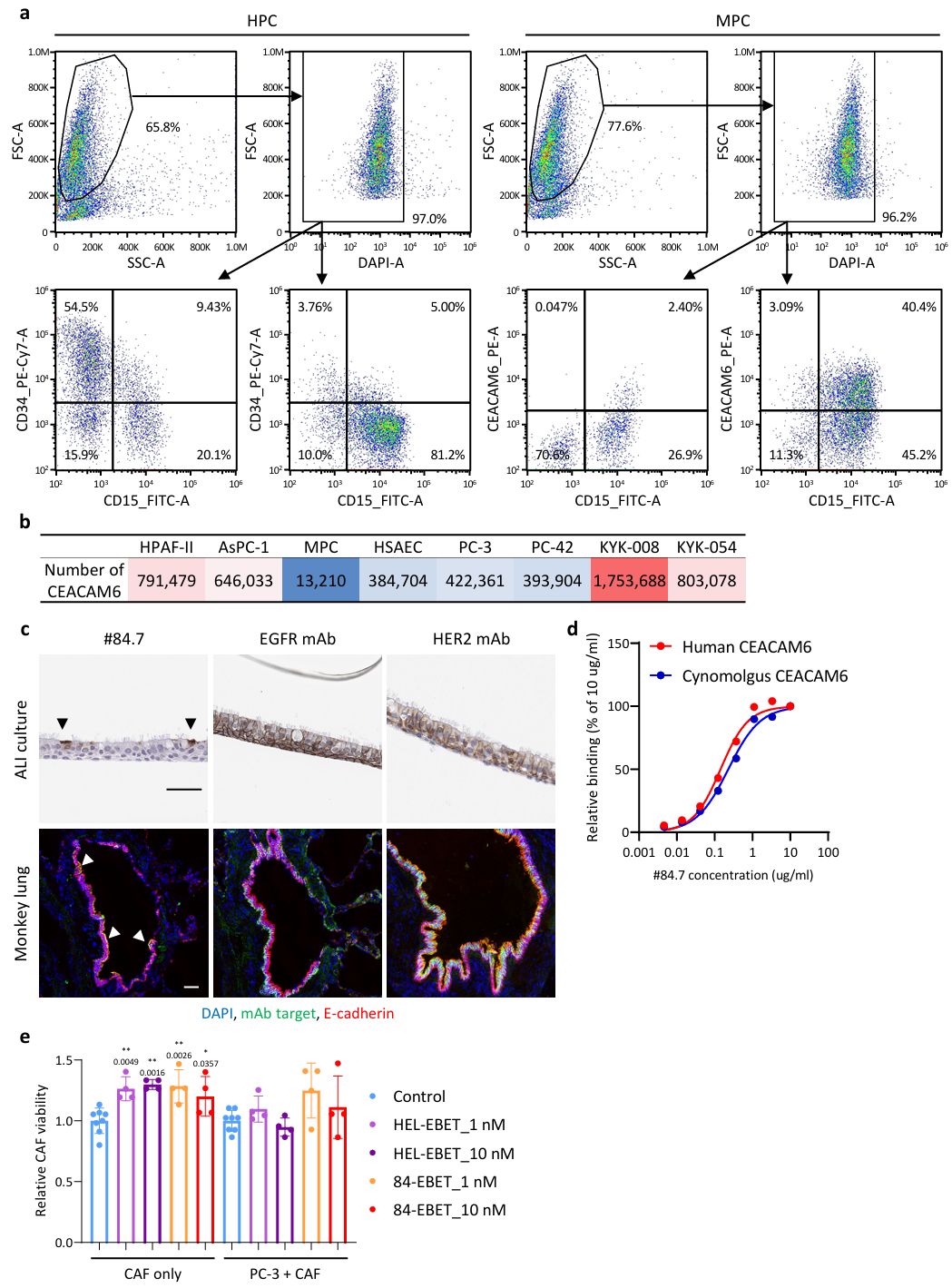
Figure S6. CEACAM6 is expressed on myeloid progenitor cells and the apical side of the lung epithelium.
5.84-EBET通过旁观者效应有效杀死各种PDAC类器官并调节CAF活性
①在源自16个PDAC-PDX模型的PDAC-OGI测定中检查了84-EBET(EBET-1593 偶联#84.7)的体外疗效,同步评估#84.7与MMAE或deruxtecan(DXd)偶联药物。84-EBET在大多数模型中都有杀伤作用,而84-MMAE和84-DXd在所有模型中都没有杀伤作用。大多数CEACAM6low/基底细胞模型对84-EBET治疗相对耐药,但其中一个KYK-048模型表现出超强敏感性。
检测了84-EBET在表达CEACAM6的PDAC细胞(靶标,HPAF-II/Cas9/Fluc) 和CEACAM6敲除PDAC细胞(旁观者,HPAF-II/CEACAM6-KO/Rluc)共培养中的体外旁观者疗效。在用具有旁观者功效的CEACAM6-ADC处理后,在靶细胞存在的情况下,旁观者细胞的活力(Rluc的活性)降低;84-EBET表现出比84-MMAE和84-DXd更强的旁观者疗效(Figure 3 a-b)。
②进一步研究84-EBET是否通过旁观者疗效调节CAF活性。在PDAC细胞和小鼠CAF的共培养试验中,84-EBET减少了小鼠CAFs分泌的IL-6和LIF,但不影响这些浓度下CAF的活力(Figure 3 c,Figure S6 e)。
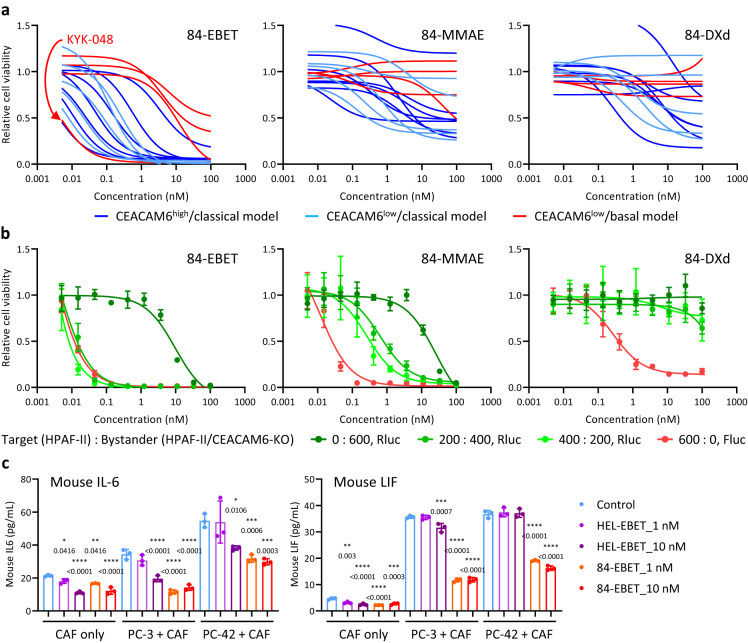
Figure 3. 84-EBET efficiently kills various PDAC organoids and modulates CAF activity via the bystander effect.
6.84-EBET在单次注射后诱导各种PDAC-PDX肿瘤的实质性消退
在16个PDAC-PDX模型中评估了84-EBET的体内疗效。同时在部分模型中同步评估了84-MMAE、84-DXd或与EBET-1593结合的滋养层细胞表面抗原2(Trop2)抗体(Trop2-EBET)。在所有经典模型中,单次注射3毫克/千克84-EBET可诱导肿瘤大量消退,且体重无明显下降;在9/16个PDX模型中,肿瘤消退至少维持了3个月。值得注意的是,在CEACAM6low/基底PC-42和KYK-046模型中,84-EBET 的疗效有限,但相同剂量的Trop2-EBET能诱导更深层次的消退,这表明只要与适当的靶向抗体一起给药,EBET是有效的。在另一种CEACAM6low/基底模型KYK-048中,84-EBET能诱导100%的肿瘤缩小;这与OGI试验中84-EBET治疗的超敏感性相一致。#84.7与新鲜分离的PDAC细胞的结合程度与最佳肿瘤反应显著相关。
使用原位癌模型和肝转移模型检验了84-EBE的体内疗效。单次注射84-EBET后,所有已形成的肿瘤在至少3个月内几乎都检测不到。与皮下PC-3模型不同,这些模型在GEM处理后仅表现出生长延迟(Figure 4,Figure S7)。
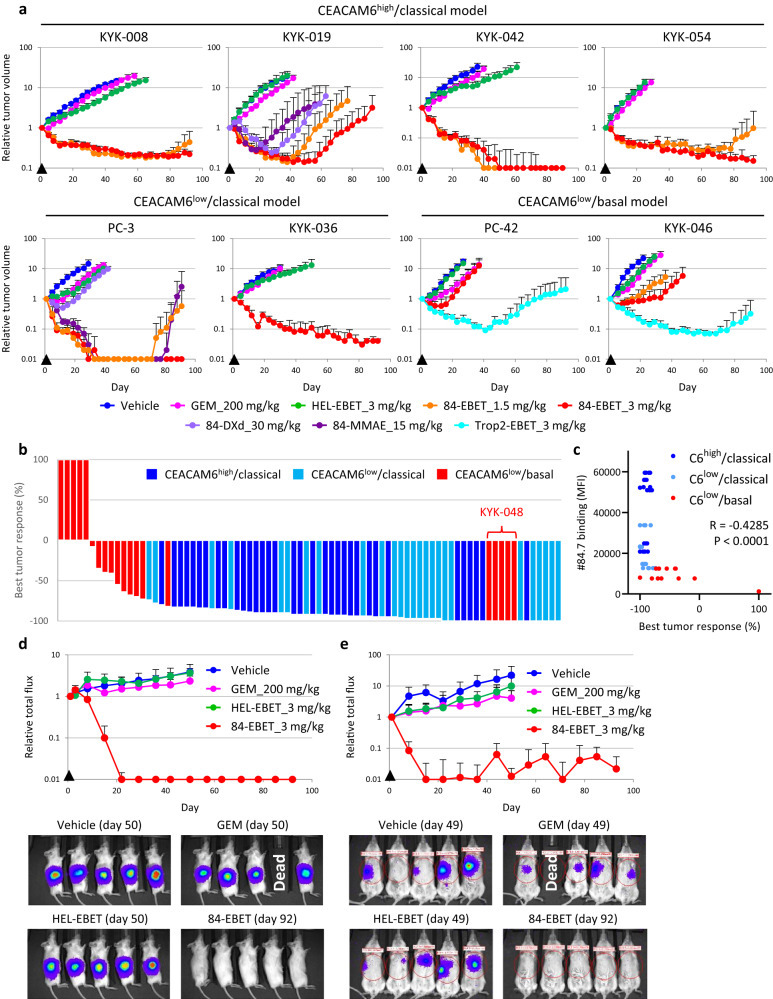
Figure 4. 84-EBET induces substantial regression of various PDAC-PDX tumors after a single injection.
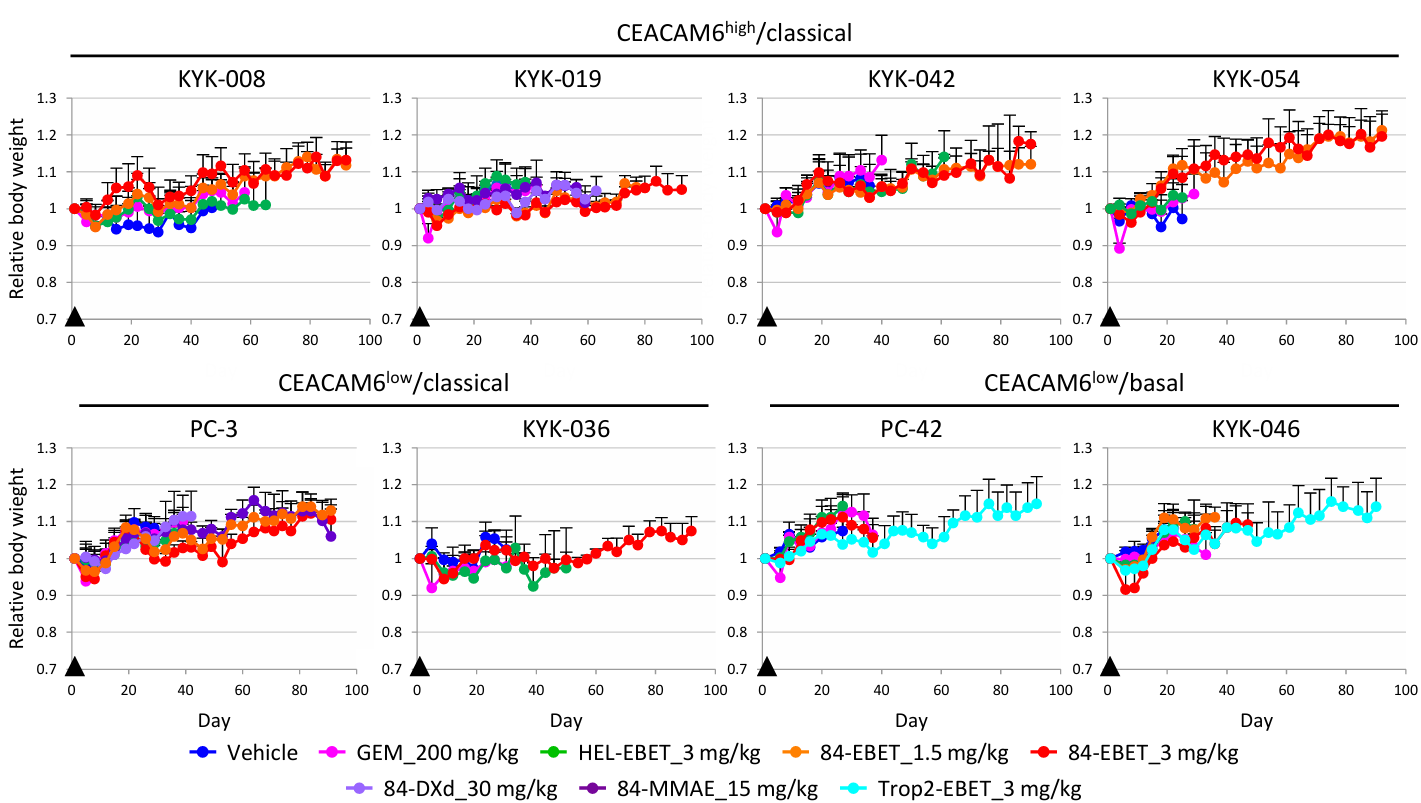
Figure S7. Effective dose of 84-EBET does not induce body weight loss in mice.
7.84-EBET通过旁观者效应调节CAF
①使用PC-3和PC-42模型研究了84-EBET药效学标记物。单细胞RNA-seq分析鉴定出相关CAF标志物,即iCAF的PDGFRA/PDGFRα;myCAF的ACTA2/α-SMA;panCAF的COL1A1/collagen I;GSEA分析显示,与B细胞群相比,A细胞群中富集了IL6-JAK-STAT3信号转导、TNFα通过NF-κB信号转导和炎症反应(Figure S8)。
②PDX 肿瘤IHC分析证实,肿瘤中的癌细胞和基质细胞上的BRD4都被 84-EBET 降解,这表明从癌细胞扩散的EBET对CEACAM6阴性的基质细胞有旁观者效应。84-EBET 处理还减少了基质中 pSTAT3Y705- 和 PDGFRα 阳性区域。在这些时间点上,pSMAD2/3和α-SMA对myCAFs标记的影响缺乏一致性(Figure 5)。
③利用PC-3和PC-42肿瘤的bulk RNA-seq数据分析了小鼠基质细胞中与CAF相关的基因表达。用 84-EBET 处理可减少两种模型基质中大多数iCAF相关基因的表达,而用 GEM 处理只能下调少数基因的表达。尤其是多种炎症细胞因子的下调支持了体外共培养试验的结果。此外,GSEA 也证实了iCAF相关基质信号的抑制作用(Figure S9)。
④为了明确84-EBET对CAFs和免疫系统影响的因果关系,建立了一个由Fluc转导的PC-3癌细胞、小鼠CAFs和人外周血单核细胞(PBMCs)组成的体外三联培养系统。在该系统中观察到PBMCs对PC-3癌细胞的杀伤作用,但与CAFs共同培养会抑制这种作用;用抗人类-PD-1mAb处理,剂量依赖性地增强了杀伤效果,但在有CAFs的情况下则没有。培养上清液中IL-2和IFN-γ的定量显示CAFs显著抑制了PBMCs中T细胞的活化。在该系统中进行ADC药物处理,发现84-EBET处理消除了CAFs对T细胞介导的杀伤的抑制(Figure S10)。
结果表明,EBET从表达CEACAM6的PDAC细胞中释放出来,扩散到邻近的CAFs并消除CAFs的免疫抑制。
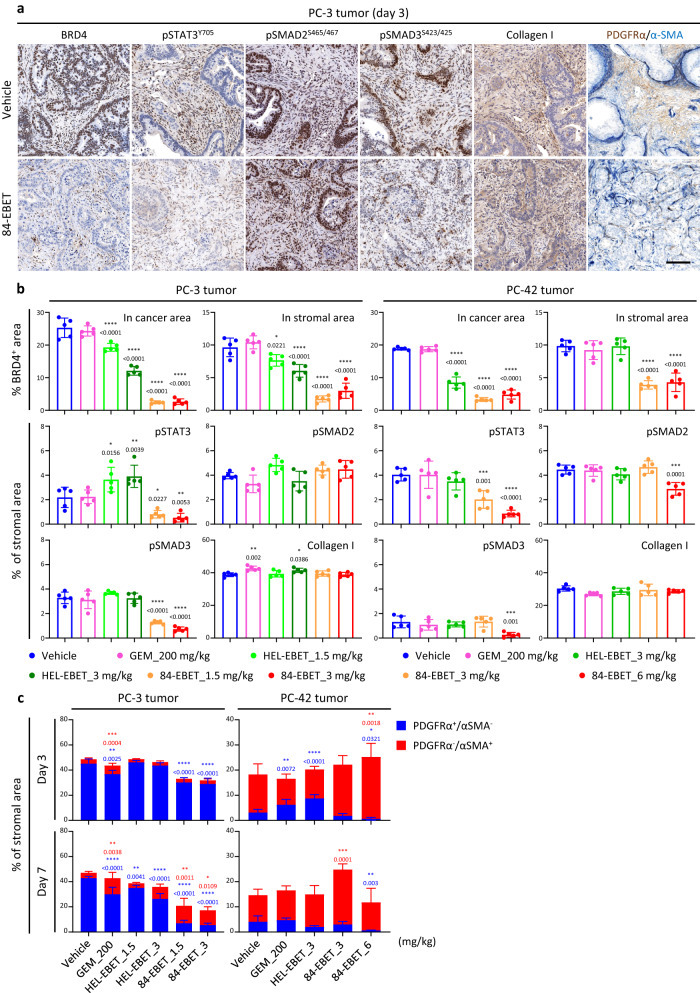
Figure 5. 84-EBET modulates CAFs via the bystander effect.
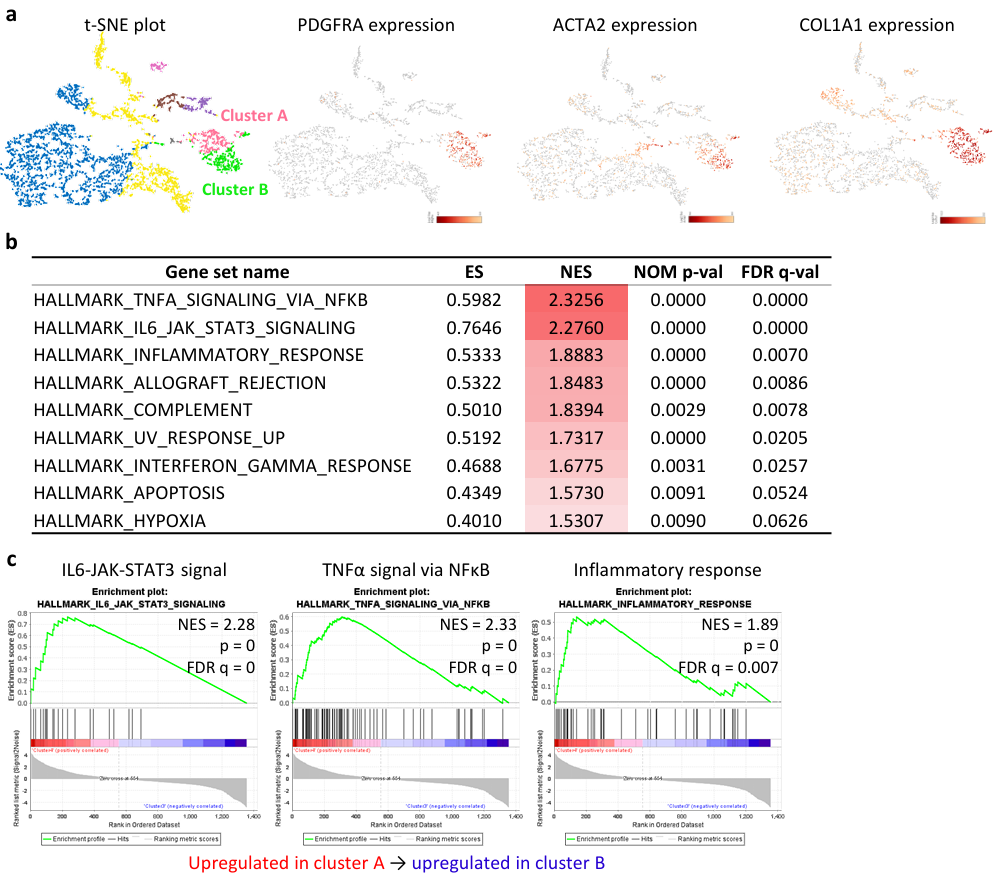
Figure S8. PDGFRα and α-SMA define inflammatory CAF and myofibroblastic CAF populations, respectively, in PDAC-PDX models.
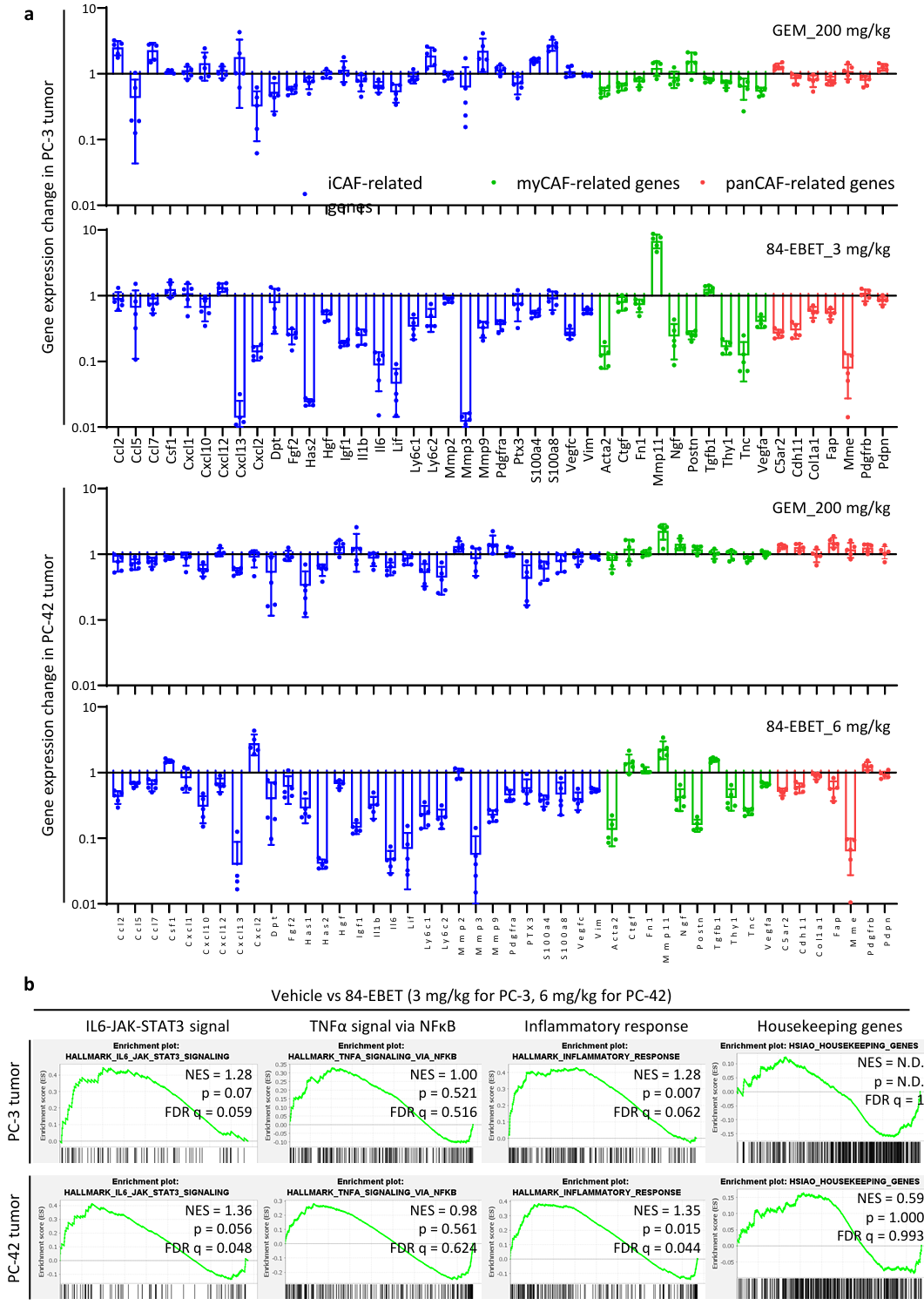
Figure S9. 84-EBET modulates stromal cells and their signaling via the bystander effect.
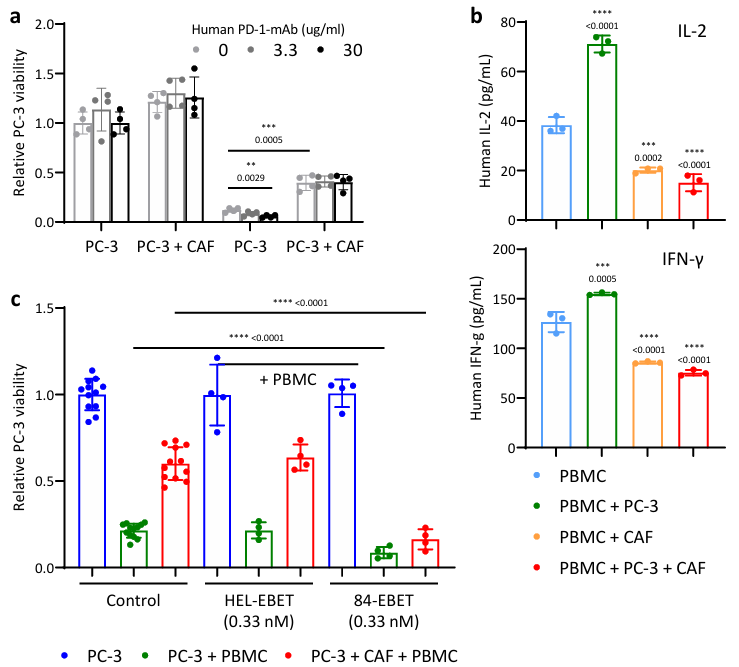
Figure S10. 84-EBET facilitates cancer-cell killing by T cells in tri-culture with CAFs.
8.84-EBET与标准化疗和PD-1抗体具有联合作用,且不会额外减轻体重
①在 CEACAM6low/基底PC-42模型中研究84-EBET与标准化疗相结合的策略。将 84-EBET(3 毫克/千克)与治疗PDAC的标准化疗(即GEM+ nab-PTX)结合使用,可诱导更深入、更持久的肿瘤消退,且无毒性增强,表现为体重无变化(Figure 6 a)。
②为了评估与ICI的组合,建立了一个表达人CEACAM6(hCEACAM6)的小鼠合成 PDAC 模型,即 Pan02/hCEACAM6。在该模型中,单独使用 PD-1 抗体只能诱导生长延迟,而使用1.5 mg/kg的84-EBET 会导致肿瘤复发。然而,84-EBET和PD-1抗体联合使用可使所有肿瘤完全消退至少3个月。Pan02 肿瘤的免疫组化分析表明,84-EBET治疗第3天减少了肿瘤中 PDGFRα阳性基质的面积,第 7 天增加了活化T细胞浸润。这与体外数据一致,表明 84-EBET抑制了 CAFs 的炎症表型,并逆转了免疫抑制性肿瘤微环境(Figure 6 b-c, Figure S11)。
③第7天利用质谱流式细胞术进行的免疫分析显示,84-EBET减少了肿瘤中的免疫抑制细胞、髓源抑制细胞(MDSCs)和肿瘤相关巨噬细胞(TAMs),增加了肿瘤中的效应细胞、T细胞和自然杀伤细胞(NK)。在肿瘤引流淋巴结中,只有联合组的成熟树突状细胞(DC)和激活的T细胞增加,这表明肿瘤中的抗原呈递增强(Figure S12)。
综上所述,本研究假设对免疫系统的影响分为两个阶段。在第一阶段,84-EBET 对 CAF的修饰可抑制炎症反应和免疫抑制细胞的浸润,吸引并激活效应细胞,发挥抗肿瘤作用。在下一阶段,癌细胞死亡,树突状细胞对抗原的吸收增强,活化的树突状细胞迁移到淋巴结,促进 T 细胞的进一步活化。
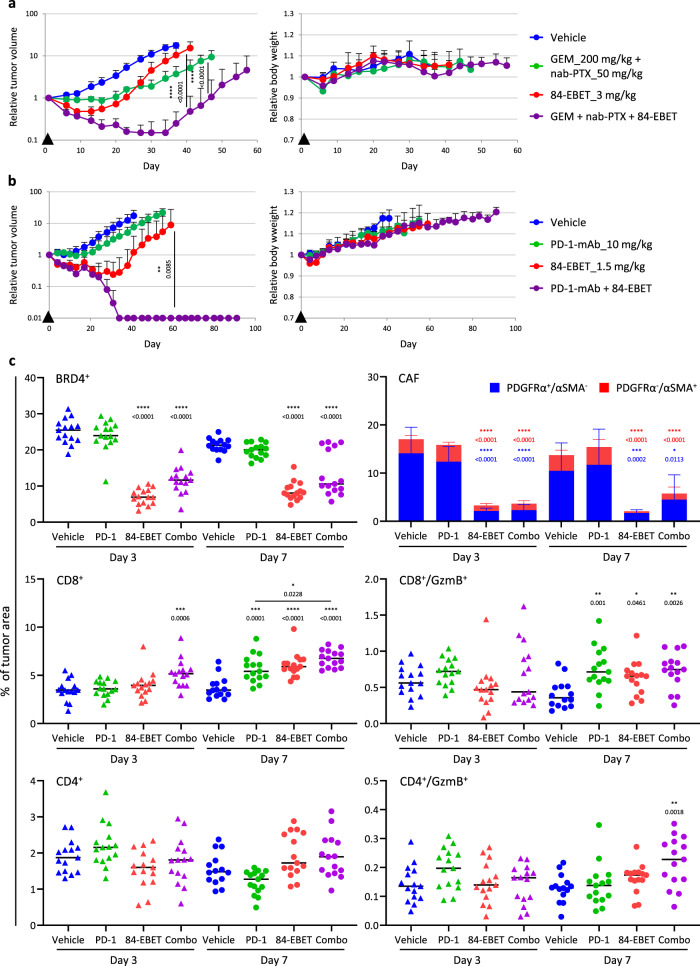
Figure 6. 84-EBET has a combinational effect with standard chemotherapy and PD−1 antibody, without toxicity enhancement.
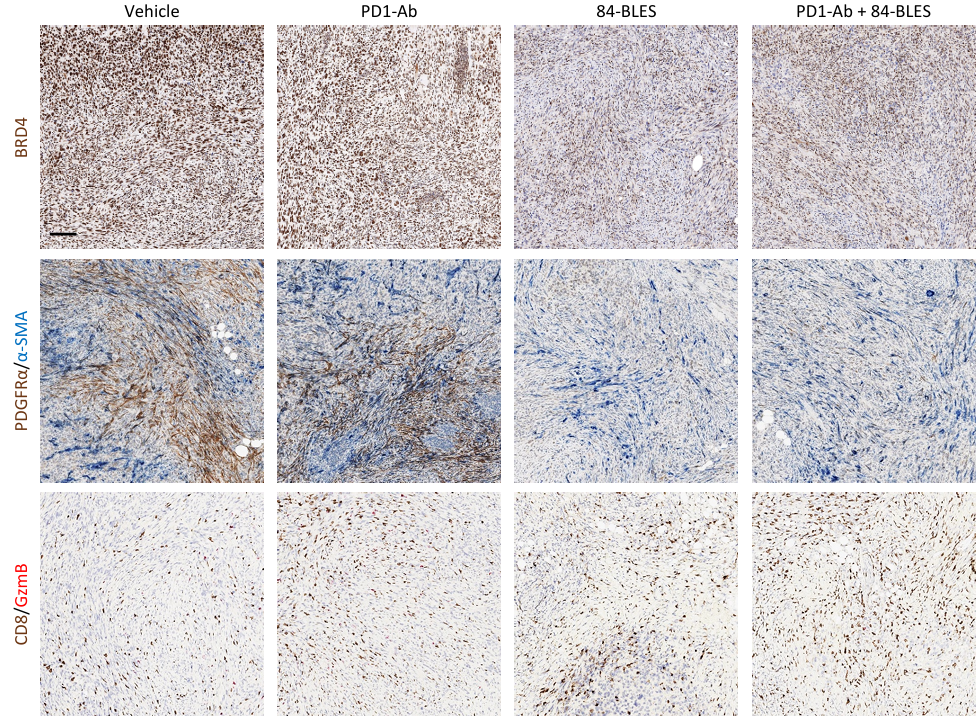
Figure S11. 84-EBET modulates CAFs and increases activated T cells in tumors.
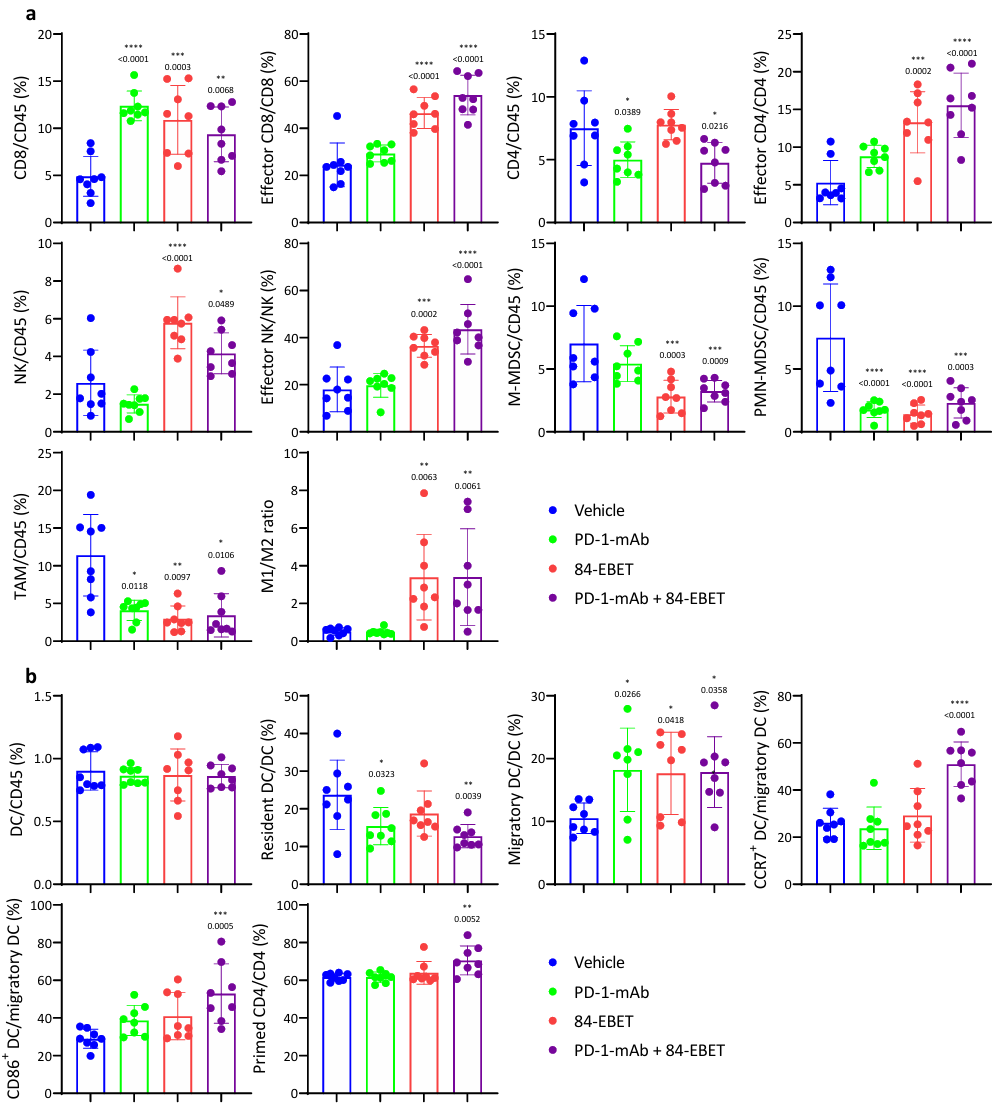
Figure S12. 84-EBET improves immunosuppressive tumor microenvironment.

汇报人:张宇阳
导师:赵宇
审核:李朔、庞文都、任建君



