原创 吴婷婷 华西医院耳鼻喉科
精读分享│【 Science Advances】:基于声学虚拟三维支架的直接交互式肿瘤类器官-免疫细胞共培养系统
英文题目:Acoustic virtual 3D scaffold for direct- interacting tumor
organoid–immune cell coculture systems
中文题目:基于声学虚拟三维支架的直接交互式肿瘤类器官-免疫细胞共培养系统
期刊:Science Advances(IF:11.7 )
单位:中南大学、西安电子科技大学
发表时间:2024年10月

摘要:
三维(3D)细胞培养在生命科学,特别是类器官技术领域,带来了革命性的进展。然而,传统的生物支架材料使得肿瘤类器官的分离变得复杂,且妨碍了类器官-免疫细胞共培养的常规应用。在本研究中,研究者开发了一种声学虚拟三维支架(AV-Scaf)方法,实现了无支架的肿瘤类器官培养,并直接建立肿瘤类器官-免疫细胞共培养系统。AV-Scaf利用旋涡声场促进肿瘤细胞的自组织过程,增强了细胞组装和离子通道的激活,显著提高钙离子内流,从而加速细胞间的相互作用。研究者利用AV-Scaf成功构建了黑色素瘤和乳腺癌类器官,并将黑色素瘤类器官与T细胞共培养。结果表明,该共培养系统显著增强T细胞的激活状态,表现为颗粒酶B(从2.82%上升至17.5%)和干扰素-γ(从1.36%上升至16%)的显著上调。本研究为肿瘤类器官-免疫细胞相互作用研究提供了一种高效策略,推动了癌症研究和免疫治疗的发展。
研究背景:
肿瘤类器官是一种能够自组织的三维培养模型,保留了原始组织的形态学、遗传和功能特性,是强大的临床前模型。
类器官与其他细胞成分(如免疫细胞)的共培养系统可用于化疗、靶向治疗和免疫治疗的临床前测试,为药物筛选和个性化治疗的制定提供可靠平台。
传统类器官支架材料如Matrigel(来源于动物的基底膜)存在可调性差、批次差异大的局限性,并可能引发细胞的意外刺激。此外,在建立共培养系统时需要移除这些基质材料,不可避免地对类器官造成机械损伤,且限制肿瘤细胞与共培养细胞的直接相互作用
声学技术作为一种尖端策略,在三维细胞操控和组织方面具有重要应用。利用非接触式声场组织细胞组分的优势在于消除了传统实体支架可能对细胞行为造成的生物物理影响。超声波(US)可用于捕捉、操控或刺激细胞,这为组织工程提供了可能性。
实验方法:
声学虚拟3D支架(AV-Scaf)
RNA测序分析
钙离子成像
细胞培养与类器官生成
免疫共培养
显微成像与免疫组化分析
研究思路:
研究结果:
1. AV-Scaf用于无支架肿瘤类器官构建
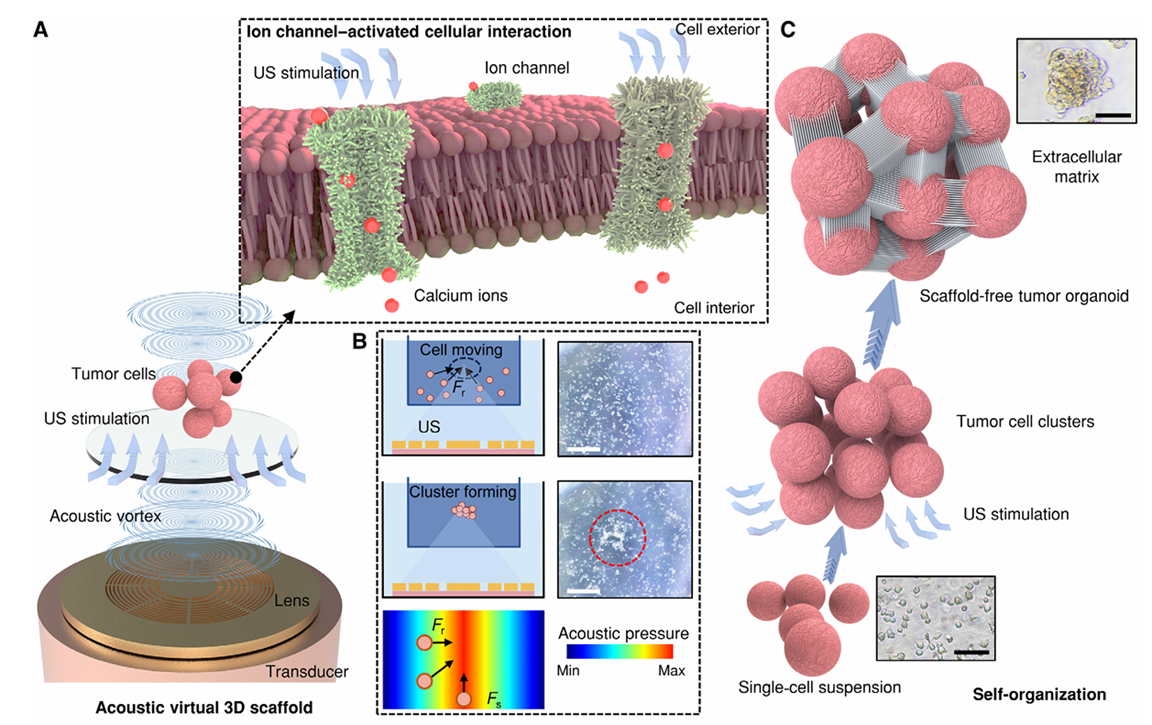
通过超声波换能器和透镜生成聚焦的涡旋声场,使肿瘤细胞在焦平面内聚集(见图1A、1B)。
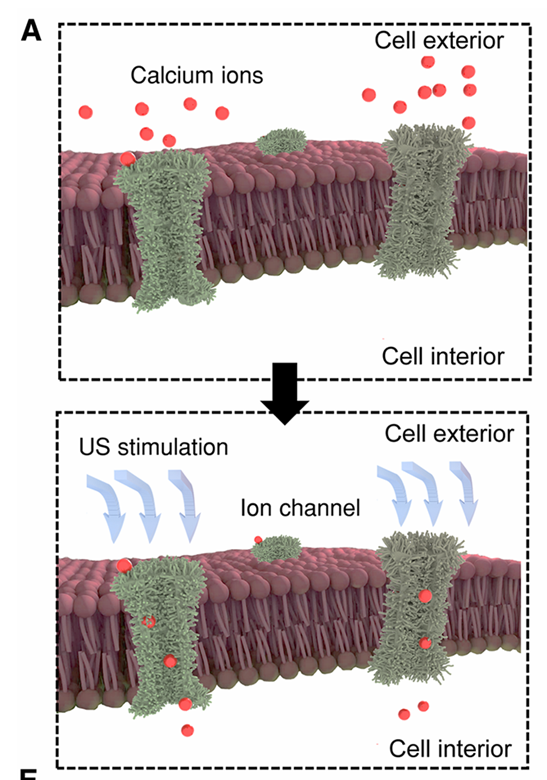
超声波刺激显著增强了钙离子内流,加速了基于细胞组装的细胞间相互作用过程(见图1C)。
2. 通过离子通道激活诱导细胞自组织
(1)为确保AV-Scaf方法不会对细胞活性产生不利影响,研究AV-Scaf的工艺参数(图2B至D),优化参数为100mV电压、2分钟处理,可形成稳定的累器官。
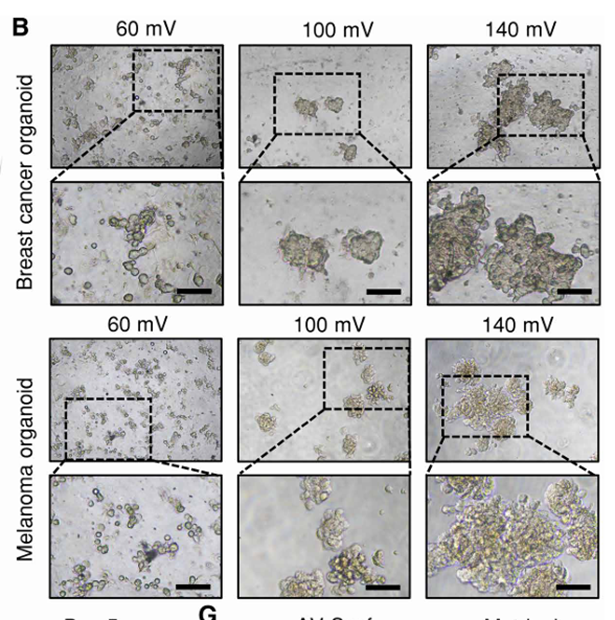
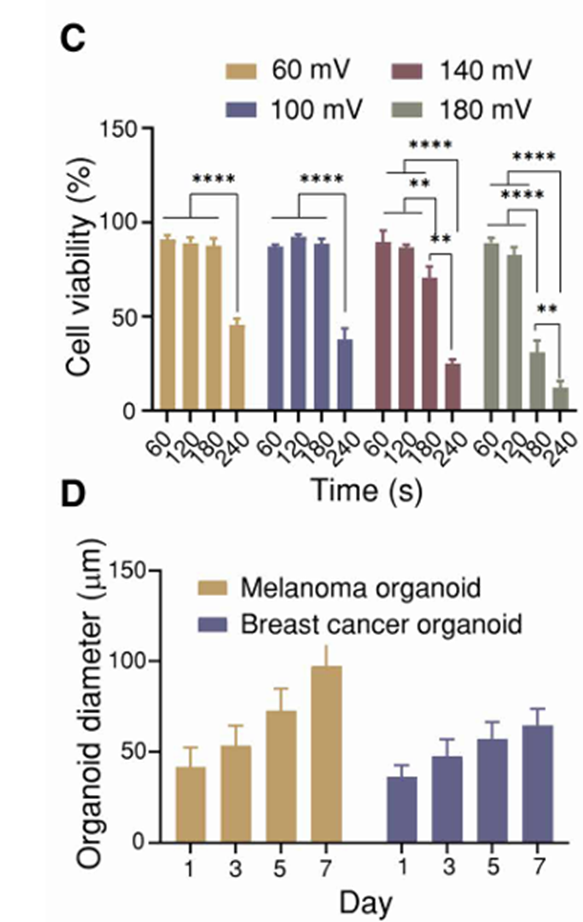
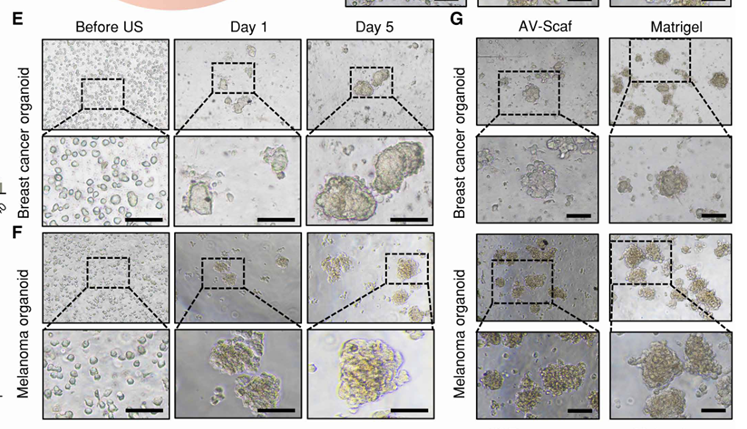
(2)经过AV-Scaf处理的细胞在培养平面中1天后表现出明显的自组织行为(图2E和F)。
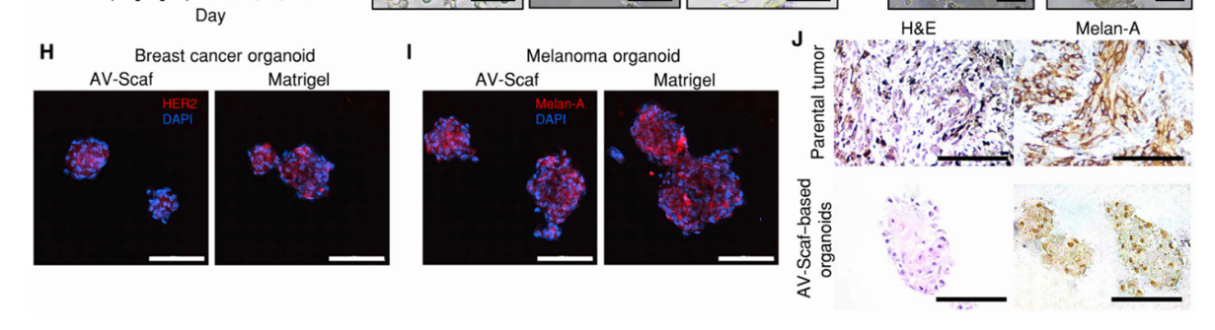
(3)比较AV-Scaf和基于Matrigel方法获得的肿瘤类器官,结果显示,AV-Scaf生成的乳腺癌和黑色素瘤类器官在大小和形态上与Matrigel参考培养物类似(图2G);免疫荧光(IF)染色(图2H和I)表明,两种技术生成的类器官均可表达其来源相关的特异性标志物。
(4)对来自黑色素瘤患者的肿瘤组织和通过AV-Scaf生成的黑色素瘤类器官进行了苏木精-伊红(H&E)和免疫组织化学(IHC)染色,结果显示,通过AV-Scaf生成的类器官具有与患者组织相同的组织结构,并表达相同的标志物(图2J)
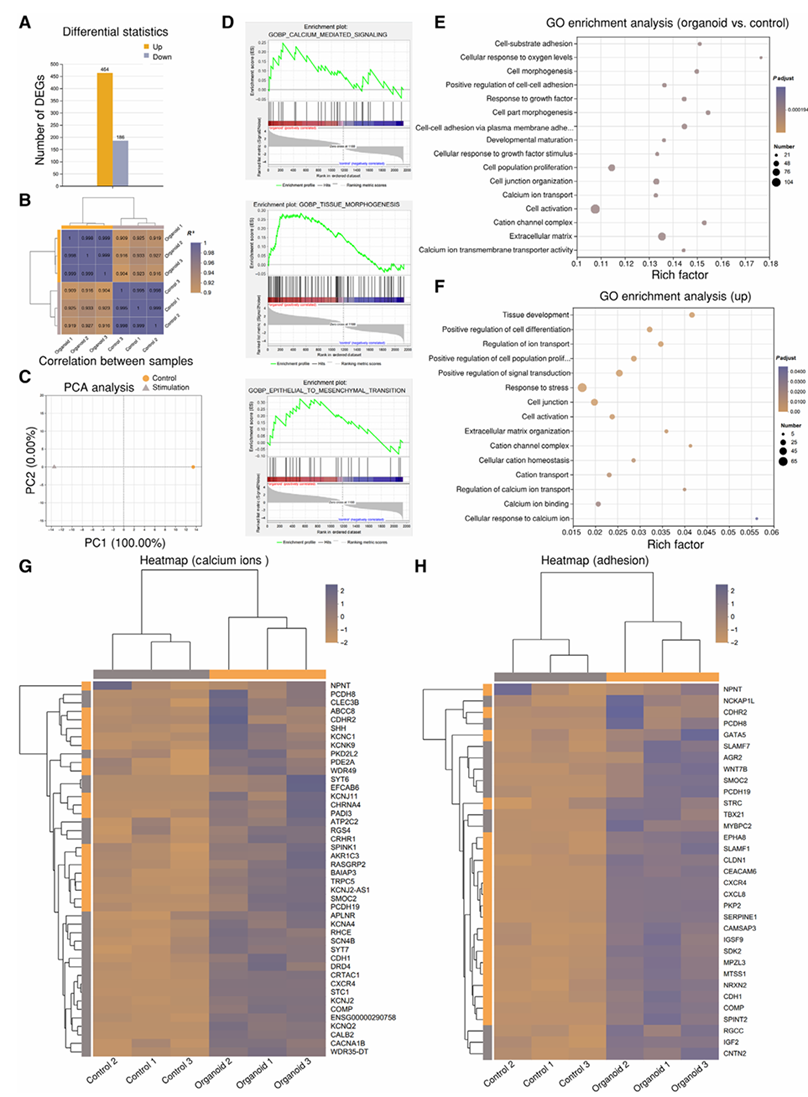
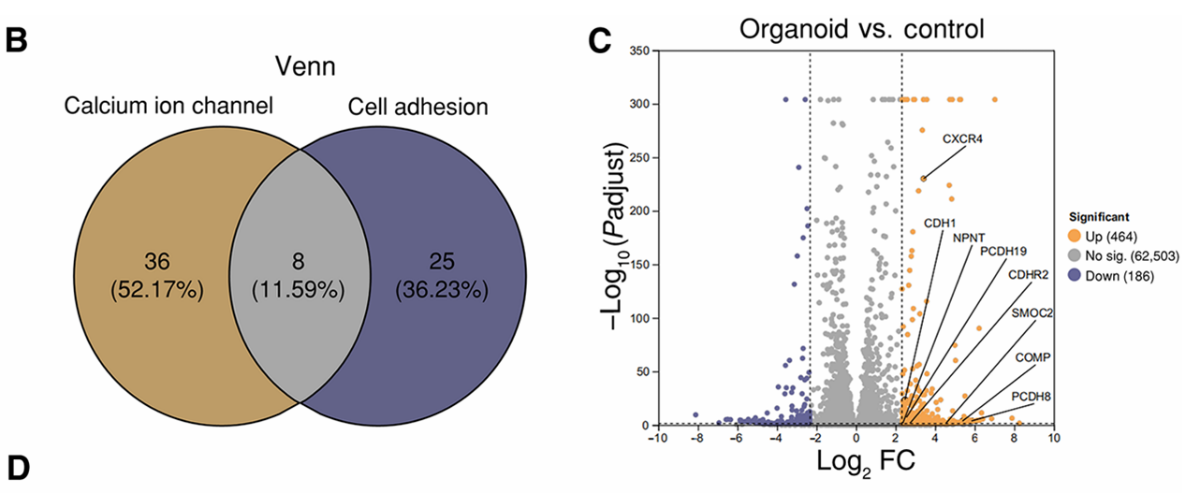
(5)对通过AV-Scaf生成的黑色素瘤类器官进行了RNA测序分析,结果显示,与对照组(未用AV-Scaf处理的患者来源肿瘤细胞)相比,其中464个基因显著上调,186个基因显著下调(图3A);生物学重复间具有高度一致性,且对照组与AV-Scaf组之间存在显著差异(图3B);主成分分析(PCA)清晰地区分了对照组与处理组(图3C);基因集富集分析(GSEA)显示钙介导信号、组织形态发生和上皮-间质转化通路显著富集(图3D);GO富集分析揭示了细胞粘附、钙离子运输和信号转导等过程的显著富集(图3E和3F);与钙和粘附相关基因的热图分析显示了不同的表达模式,表明对超声刺激有多样的调节响应(图3G和3H)。
(6)尽管许多基因是钙离子通道或细胞粘附的特有基因,但也存在大量重叠(图4b)。
(7)类器官与对照组间基因表达的显著变化,重点突出了像CDH1(关键细胞粘附基因)和CXCR4(参与信号传导的基因)等关键基因,这些基因在超声处理后功能增强(图4C)。
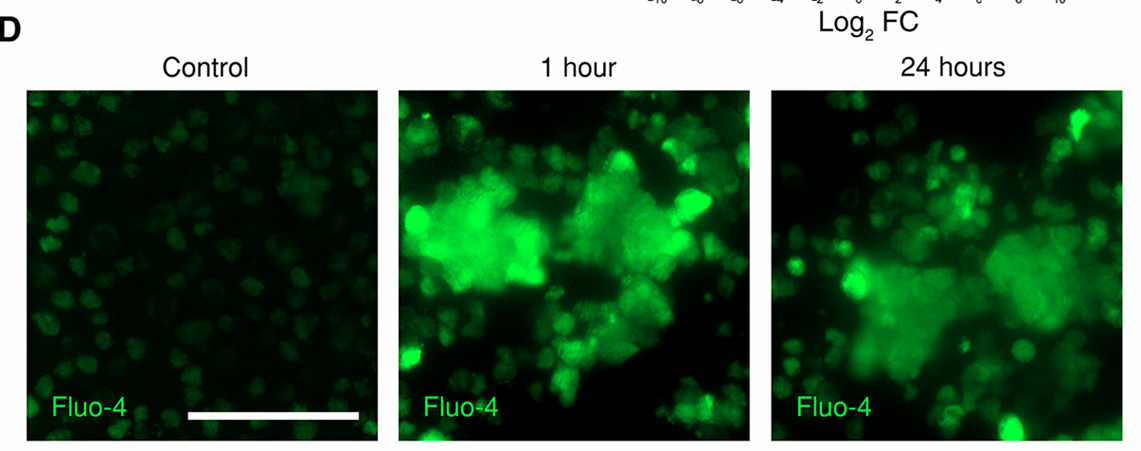
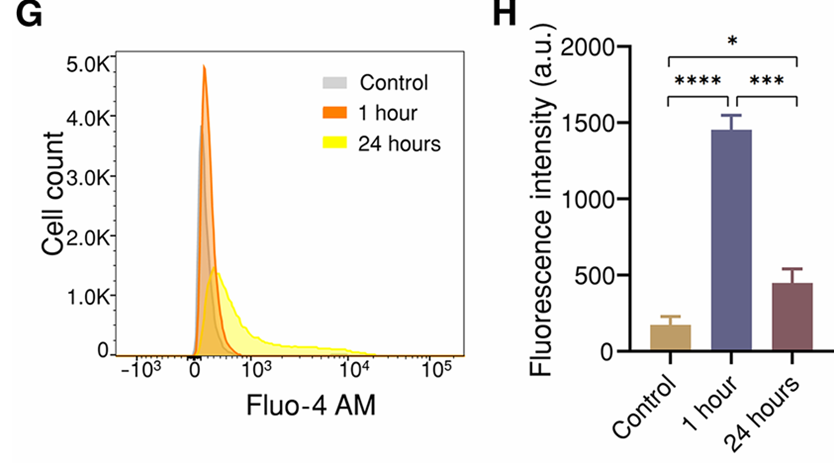
(8)钙离子成像结果:Fluo-4染色细胞的荧光显微图像,显示在超声刺激后1小时观察到细胞内钙水平的瞬时升高(图4D);使用Fluo-4 AM进行的流式细胞术分析直方图表明,与对照组相比,刺激后1小时钙离子荧光强度显著增加,而在24小时后减弱(图4G、H)。
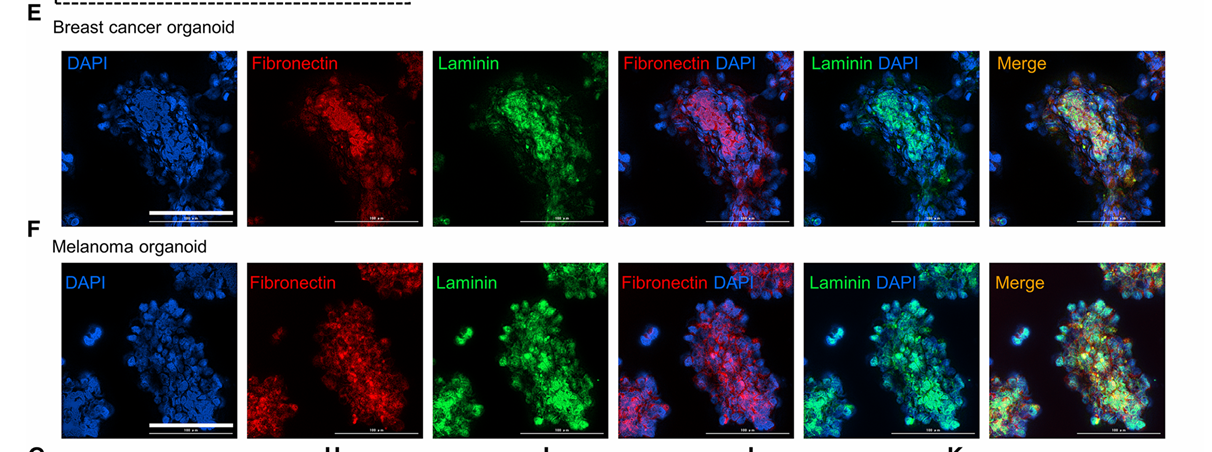
(9)两种由AV-Scaf形成的肿瘤类器官的细胞外基质(ECM)生成的共聚焦观察结果:分别用DAPI(细胞核)、纤维连接蛋白和层粘连蛋白染色,自组织的肿瘤类器官在肿瘤细胞间生成了ECM(图4E和F)。
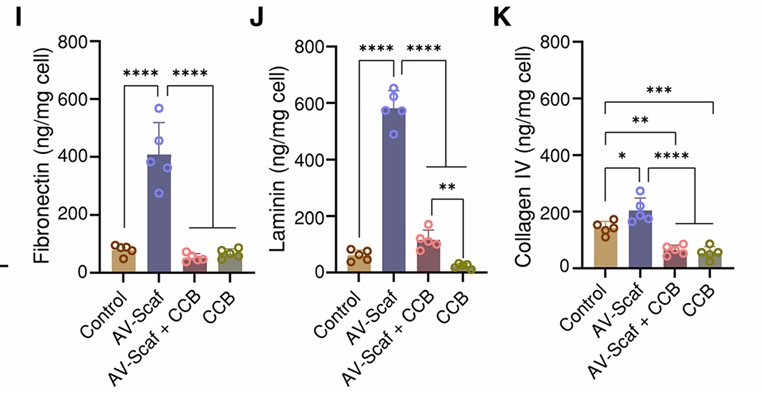
(10)钙通道阻滞剂(CCB)实验:
对使用AV-Scaf方法生成的细胞(有无CCB)进行了纤维连接蛋白、层粘连蛋白和IV型胶原蛋白三种蛋白质的酶联免疫吸附试验(ELISA)分析,结果表明,钙通道阻滞显著降低了与细胞粘附相关的蛋白质含量(图4I至K)。
3. 直接相互作用的共培养系统提高了T细胞激活效率
(1)基于AV-Scaf方法建立肿瘤类器官–T细胞共培养模型,从同一患者获得外周血单个核细胞(PBMCs)。流式细胞术结果显示,与Matrigel相比,使用AV-Scaf方法显著增强了T细胞激活(图5B和D);AV-Scaf组中CD45+CD8+GZMB+细胞的比例显著高于Matrigel组(图5C);AV-Scaf组中CD45+CD8+IFN-γ+细胞的比例也显著高于Matrigel组(图5E)。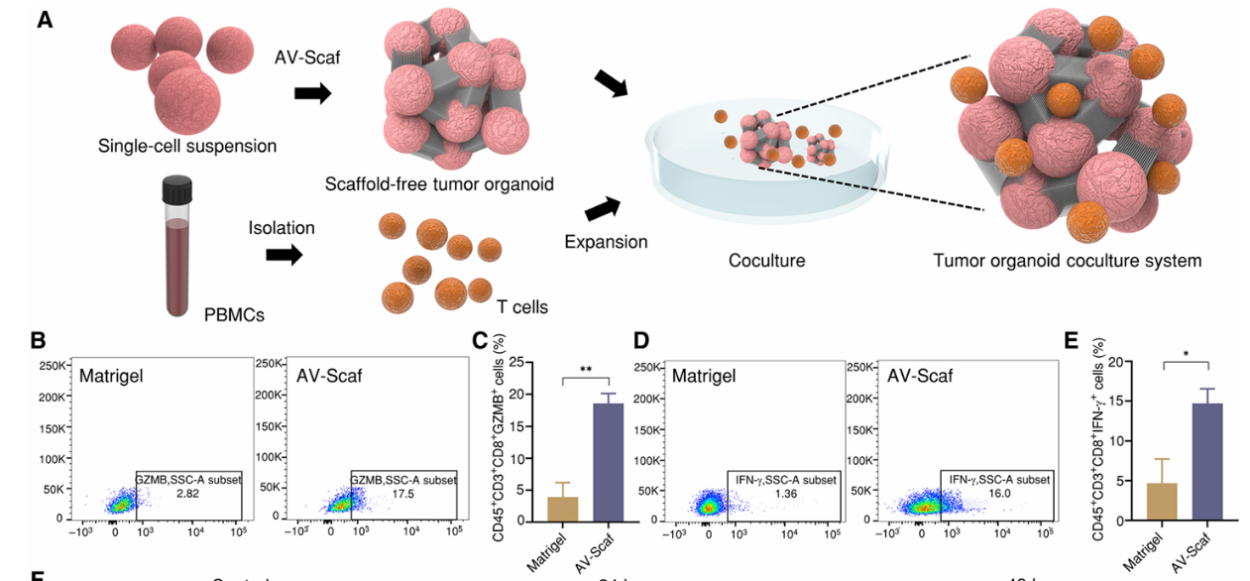
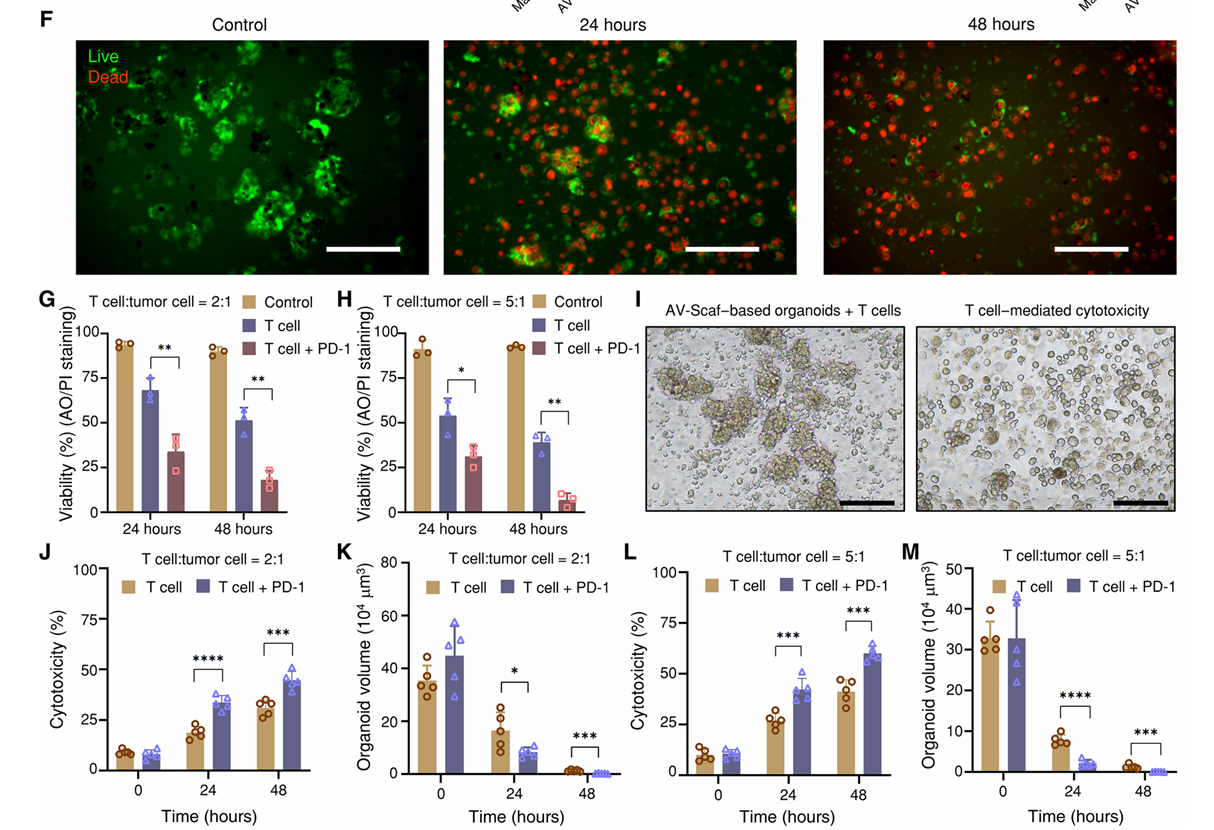
(2)在24小时和48小时内与T细胞共培养的黑色素瘤类器官的活/死染色。结果显示,随着时间推移观察到死细胞显著增加(图5F),在更高的T细胞比例下存活率下降更为显著(图5G和H),被T细胞包围的类器官结构被破坏(图5I),T细胞比例的增加在48小时内导致更高的细胞毒性(图5J和L),在更高T细胞比例下,类器官体积显著减少(图5K和M),并且在类器官–T细胞共培养模型中引入程序性死亡蛋白1(PD-1)抗体。

汇报人:吴婷婷
导师:任建君
审核:程丹妮、任建君



