原创 吴桂儀 华西医院耳鼻喉科
华西耳鼻喉学术前沿速递——文献精读(第60期)
精读分享│【Nature Genetics】:MHC Hammer揭示了癌症进化过程中遗传性和非遗传性HLA破坏
英文题目:MHC Hammer reveals genetic and non-genetic HLA disruption in cancer evolution
中文题目:MHC Hammer揭示了癌症进化过程中遗传性和非遗传性HLA破坏
期刊:Nature Genetics(IF: 31.7)
单位:英国伦敦大学、英国伦敦弗朗西斯-克里克研究所
发表时间:2024年10月2日



摘要:
人类白细胞抗原( human leukocyte antigen,HLA )Ⅰ类分子的破坏对在免疫逃逸和肿瘤进化中具有重要意义。本研究发现了主要组织相容性复合体杂合性缺失(LOH) 和等位基因特异性突变,并且开发了一种用于测量HLA表达和抑制的工具:MHC Hammer。本研究在正常肺和乳腺组织中发现了广泛的HLA等位基因表达和HLA可变剪接变异。在肺TRACERx和肺及乳腺TCGA数据中,61%的肺腺癌(LUAD)、76%的肺鳞癌(LUSC)和35%的雌激素受体阳性乳腺癌(ER+BRCA)存在I类HLA转录抑制,而在LUAD、LUSC和ER+BRCA中,分别有31%、11%和15%的HLA肿瘤富集可变剪接。与HLA功能障碍在肿瘤进化中的重要性相一致,在LUADs中,HLA LOH与转移相关,并且LUAD原发肿瘤区域种植转移灶比非种植区域具有更低的有效新抗原负荷。这些数据突出了HLA转录组损坏的程度及其重要性,和HLA抑制和可变剪接在癌症进化中的作用。
研究思维导图:
(1)分析思路:
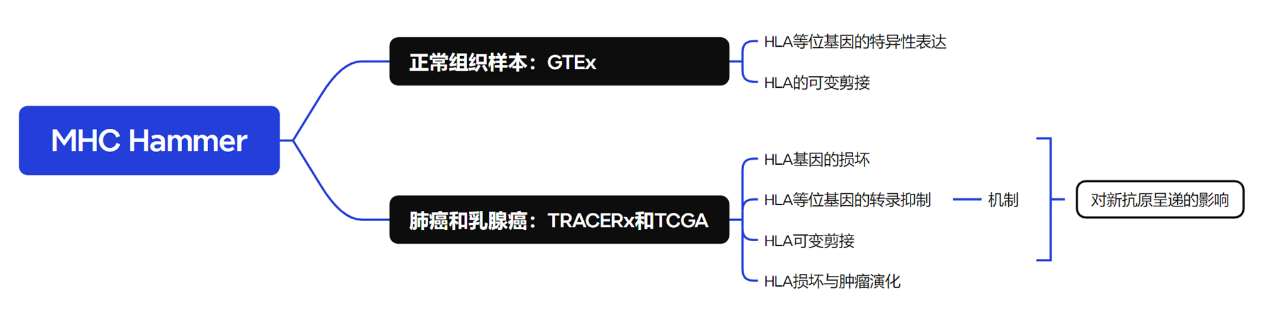
(2)全文总结:
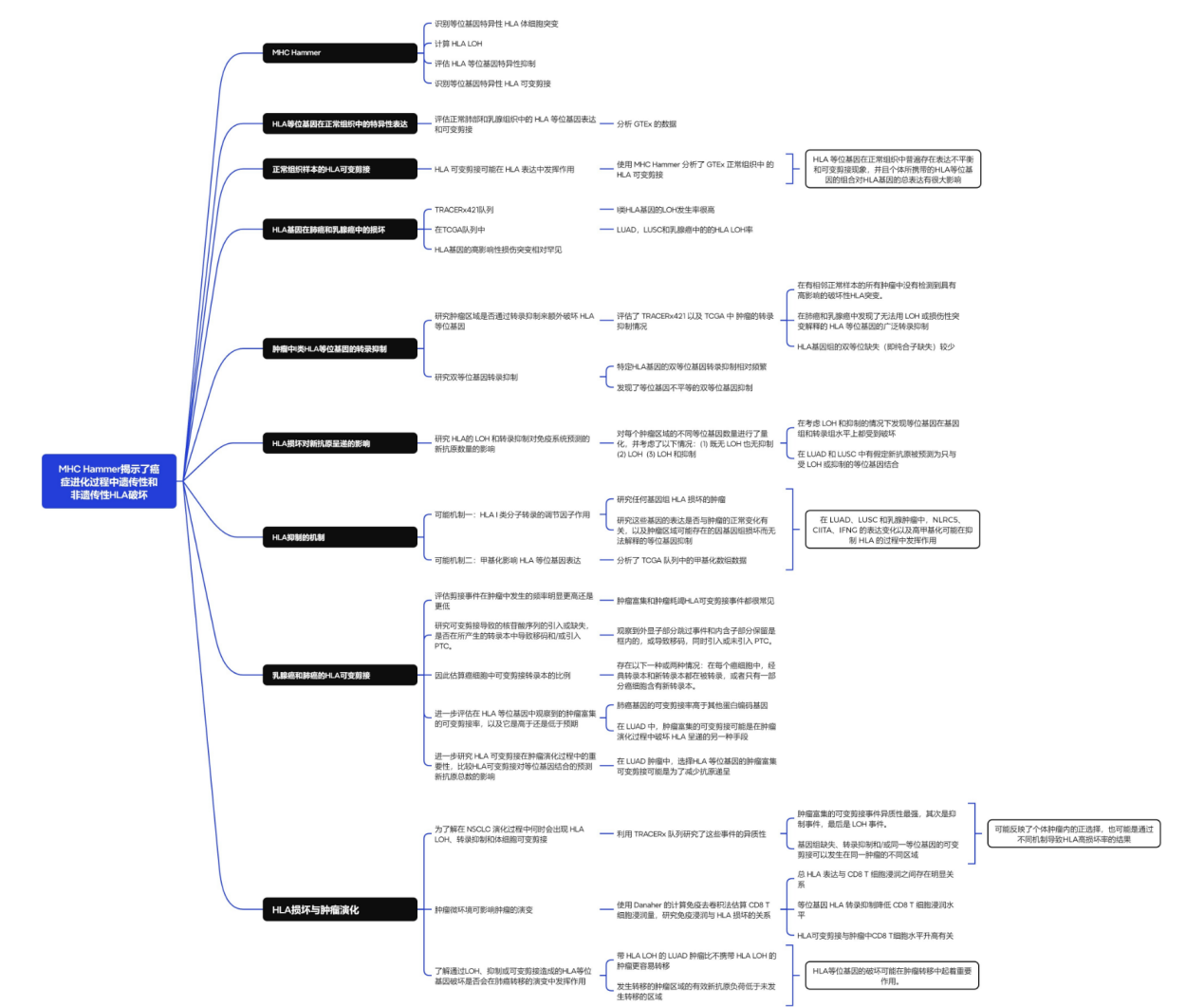
研究背景:
1. 癌症中细胞毒性T细胞反应的关键介质是新抗原,癌细胞特异性改变产生的突变肽能够引发T细胞介导的HLA限制性免疫反应。只有相关的突变肽在HLA分子上呈递给T细胞受体时,才能产生新抗原。因此,HLA分子的破坏对免疫逃逸具有重要意义。
2. 现有研究发现,对抗原递呈机制的破坏发生在许多癌症中。然而,目前对癌症中精细的转录组改变(如可变剪接和等位基因特异性抑制)的研究还很少。
3. 研究表明,在非癌症组织和癌症细胞系中发生的可变剪接可产生无功能的HLA分子,或者在外显子5跳过时生成HLA分子的可溶性同源异构体。因此,在将任何HLA表达的变化归于肿瘤特异性现象之前,了解肿瘤邻近正常组织中的HLA表达情况至关重要。
研究数据:
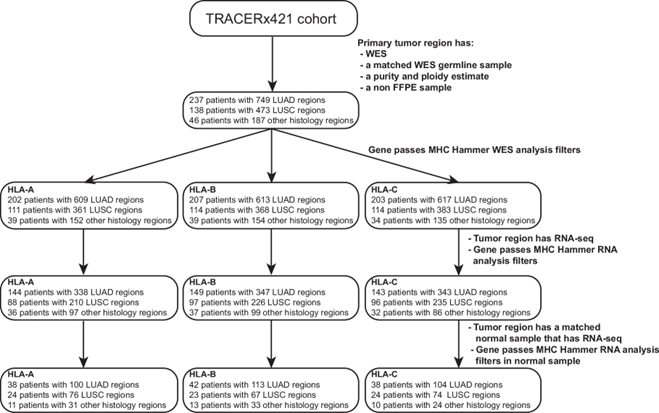
1. 多区域TRACERx421数据中的421例NSCLC患者
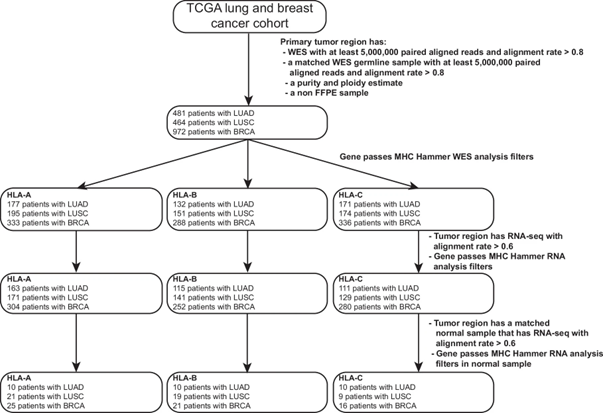
2. 癌症基因组图谱(TCGA)数据中的945例NSCLC患者和972例乳腺癌患者
3. 基因型-组织表达(GTEx)数据中的489例正常肺部样本和397例正常乳腺样本,其中241人同时拥有肺组织和乳腺组织样本
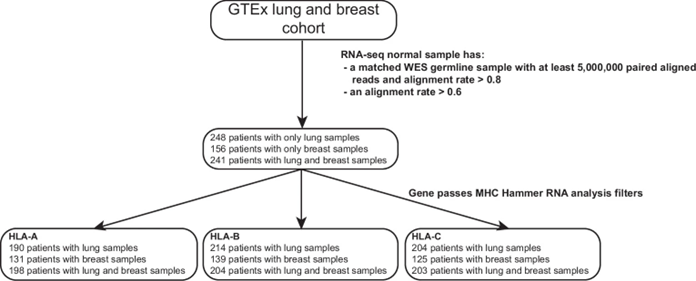
主要结果:
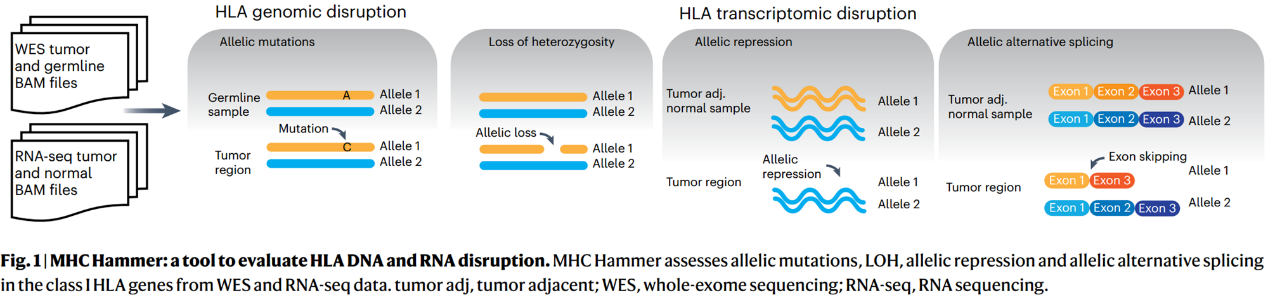
1. 用于评估HLA损坏的pipeline
为了评估基因组和转录组HLA损坏的程度,作者开发了MHC Hammer来分析 LOHHLA(Fig.1)。该工具由以下四个主要部分组成:(1)识别等位基因特异性HLA体细胞突变;(2)计算HLA的LOH;(3)评估HLA等位基因的特异性抑制情况;(4)识别等位基因特异性HLA的可变剪接情况。
2. HLA等位基因在正常组织中的特异性表达
作者利用GTEx的数据分析了正常肺部和乳腺组织中HLA等位基因的表达和可变剪接:
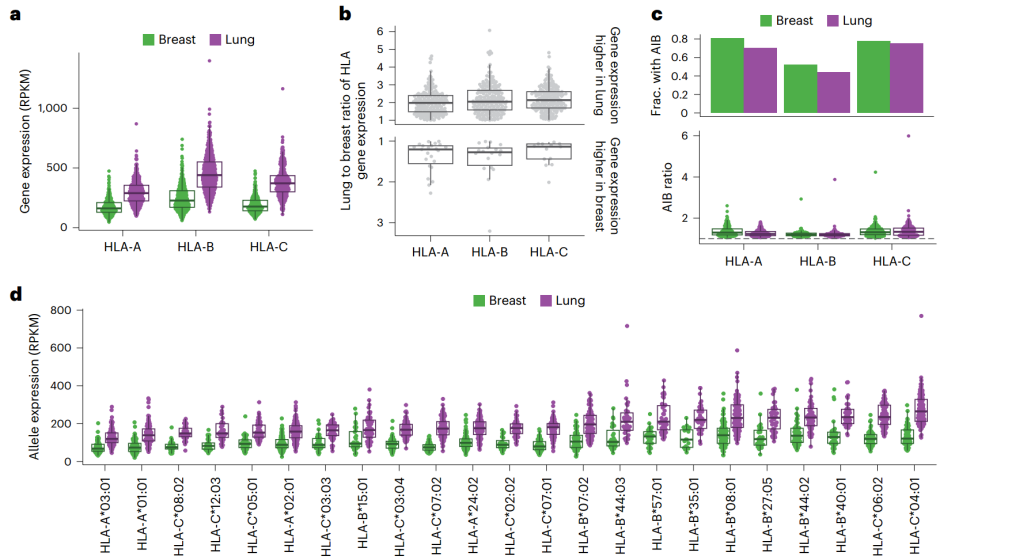
①在正常肺部和乳腺组织中,HLA-B的中位表达量最高,其次为HLA-C,然后是HLA-A(Fig. 2a)。
②计算了HLA-A、HLA-B和HLA-C在肺部组织中的表达。分别为175/198(88%)、186/204(91%)和 190/203(94%)(Fig. 2b)。
③显著的HLA等位基因不平衡(allelic imbalance,AIB)现象普遍存在。这种表达不平衡部分原因可能是个体所携带的HLA等位基因组合(Fig. 2c)。
④观察到以下等位基因表达与等位基因类型之间的关系:(1)肺中:HLA-A * 03:01、HLA-B * 15:01和HLA-C * 08:02在肺中的表达量最低,而HLA-A * 24:02、HLA-B * 40:01和HLA-C * 04:01在肺中的表达量最高。(2)乳腺中:HLA-A * 03:01、HLA-B * 15:01和HLA-C * 07:02在3个基因中表达量最低,而HLA-A * 24:02、HLA-B * 08:01和HLA-C * 04:01在3个基因中表达量最高(Fig. 2d)。
3. 正常组织样本的HLA可变剪接
由于HLA可变剪接可能在HLA表达中发挥作用,作者使用MHC Hammer检测了GTEx数据集中正常组织HLA的可变剪接情况。研究发现:HLA 等位基因在正常组织中普遍存在表达不平衡和可变剪接现象,并且个体所携带的HLA等位基因的组合对HLA基因的总表达有很大影响。这些数据强调了在评估肿瘤的转录改变时,分析正常组织中 HLA 等位基因表达的重要性。
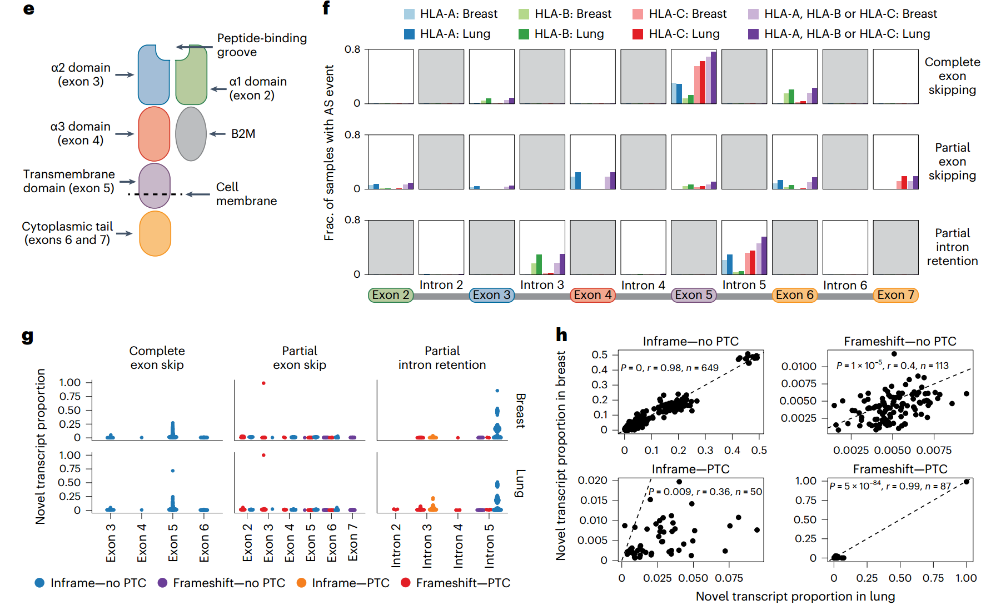
①在HLA等位基因中发现了外显子完全跳过、外显子部分跳过和内含子部分保留的可变剪接模式,但没有在任何HLA等位基因中观察到内含子完全保留的模式。
②HLA等位基因的可变剪接很常见,外显子5跳过是肺部和乳腺组织中最常见的事件,其次是内含子5的部分保留(Fig. 2e-f)。
③观察到了外显子或内含子2、3或4中的HLA可变剪接事件出现在267/483 (55%)份正常肺组织样本和147/392(38%)份正常乳腺组织样本中,这可能会生成不稳定的HLA分子,导致HLA分子无法向免疫系统传递抗原(Fig. 2e-f)。
④为了估算可变剪接产生的新转录本的相对丰度(不同剪接转录本在一个特定样本中的表达量相对于其他转录本的比例),估算了“新转录本比例”。大多数剪接事件的新转录本比例较低(Fig. 2g)。
⑤比较了同一患者的乳腺组织和肺组织中的剪接事件:总共有43%的可变剪接事件同时发生在乳腺和肺组织中,46%只发生在肺样本中,11%只发生在乳腺样本中。如果仅针对在同一个人的两个组织中都发生的事件进行分析,观察到新转录本比例之间的高度一致性(Fig. 2h)。
⑥研究某些等位基因是否富集于特定的可变剪接事件:重点研究了出现在超过30个GTEx乳腺和/或肺组织中的23个HLA等位基因中的可变剪接事件。在肺部,这23个等位基因中的10/105个可变剪接事件发生在50%以上的等位基因样本中。在乳腺中,8/81个等位基因的可变剪接事件发生在50%以上的等位基因样本中。

4. HLA基因在肺癌和乳腺癌中的损坏
对TRACERx421数据进行分析发现:
①I类HLA基因的LOH发生率很高。与此发现一致,在TCGA肺部数据中,LUAD肿瘤的HLA LOH率为65/245(27%),LUSC肿瘤的HLA LOH率为104/267(39%)(Extended fig.6)。在TCGA中,三阴性乳腺癌(TNBC)的HLA LOH率最高(17/61(28%)),其次是雌激素受体阴性(ER-;7/32(22%))和雌激素受体阳性乳腺癌(ER+;60/402(15%))(Extended fig.6)。
②HLA基因的高影响性损伤突变相对罕见,仅出现在TRACERx421数据的5/411(1.2%)个肿瘤,和TCGA乳腺队列的2/514(0.4%)个肿瘤中,TCGA肺癌队列中未观察到这种突变。
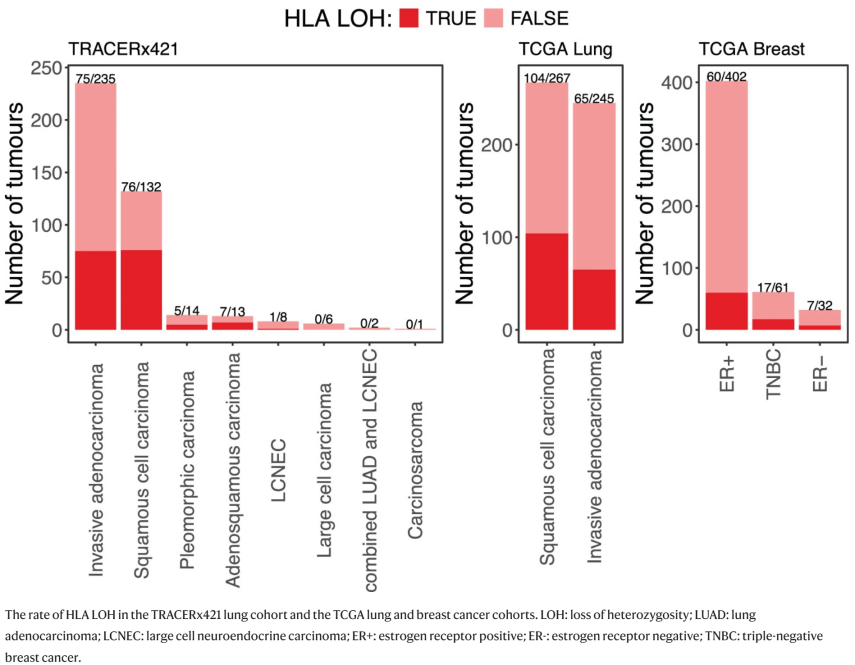
Extended Fig. 6: HLA LOH rates in lung and breast cancer.
5. 肿瘤中I类HLA等位基因的转录抑制
作者研究了肿瘤区域是否存在通过转录抑制额外破坏HLA等位基因的机制(此部分鉴于在正常HLA等位基因表达中观察到的异质性,测量肿瘤的HLA抑制时参照了与患者匹配的肿瘤相邻正常组织样本):
①在有相邻正常样本的所有肿瘤中没有检测到具有高影响的破坏HLA突变。
②在肺癌和乳腺癌中发现了无法用LOH或损伤性突变解释的HLA等位基因的广泛转录抑制(Fig. 3a-b)。在TRACERx421数据中,有13/49(27%)的LUAD肿瘤和2/29(7%)的LUSC肿瘤没有表现出任何一类HLA基因的LOH或抑制(Fig. 3b)。TCGA LUAD和LUSC队列与之一致,有19/34(56%)的ER+乳腺癌没有表现出任何一类HLA基因的损伤性突变、LOH或抑制(Fig. 3b)。
③HLA基因组的双等位缺失(即纯合子缺失)并不常见,为了研究双等位基因转录抑制,将分析范围限制在没有发现基因组改变的HLA基因上:发现特定HLA基因的双等位基因转录抑制相对频繁,且发现了等位基因不平等的双等位基因抑制的证据(Fig. 3c)。
6. HLA损坏对新抗原呈递的影响
为了研究 HLA的 LOH 和转录抑制对免疫系统预测的新抗原数量的影响,对每个肿瘤区域的不同等位基因数量进行了量化,并考虑了以下情况:(1)既无LOH也无抑制,(2)仅存在LOH (3)同时存在LOH和抑制。
①在考虑(3)同时存在LOH和抑制的情况下,39/132(30%)个LUAD肿瘤区域、3/90(3%)个LUSC肿瘤区域和18/36(50%)个ER+乳腺肿瘤区域的所有六个HLA等位基因都完好无损,而9/132(7%)个LUAD肿瘤区域、18/90(20%)个LUSC肿瘤区域和3/36(8%)个ER+乳腺肿瘤区域的所有六个等位基因在基因组和转录组水平上都受到破坏(Fig. 3d)。
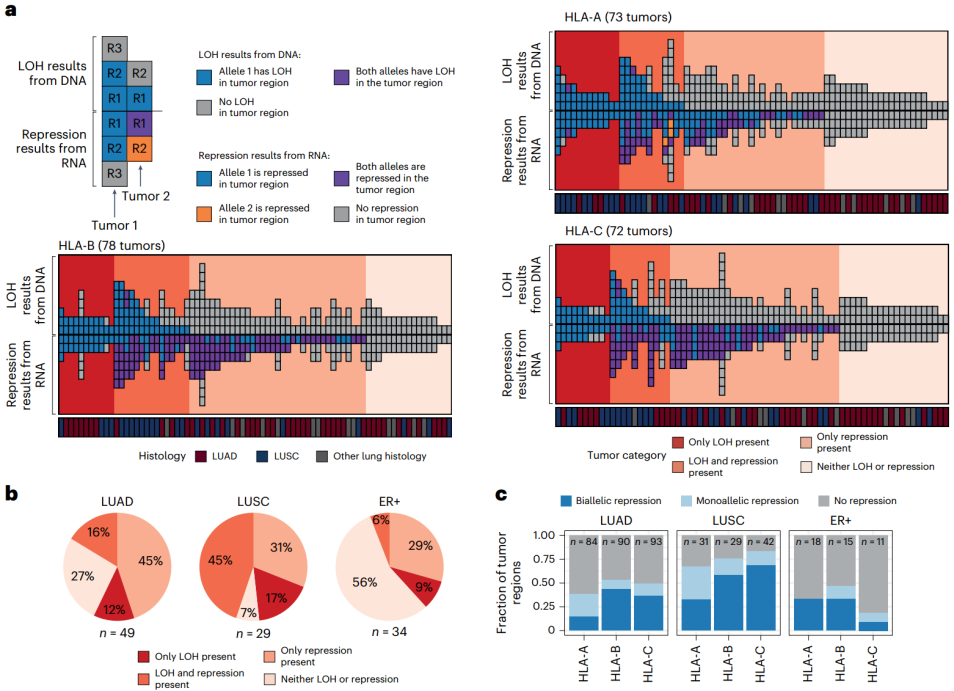
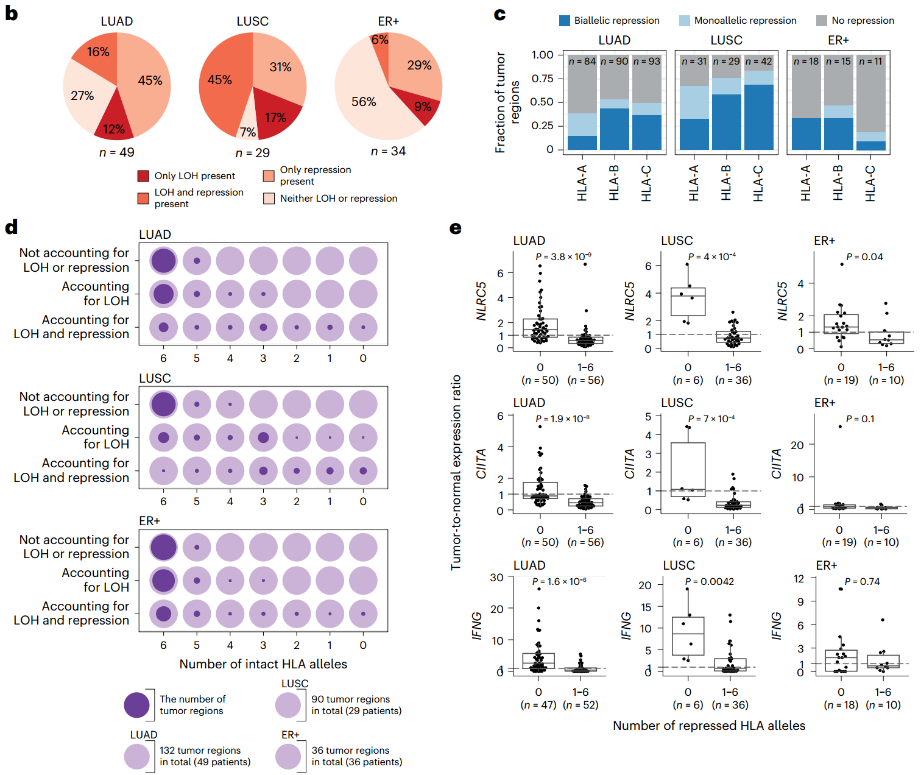
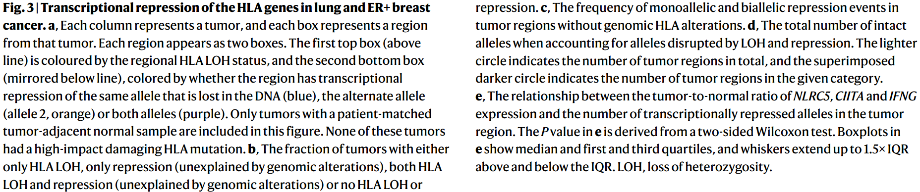
7. HLA抑制的机制
在LUAD、LUSC和乳腺肿瘤中,NLRC5、CIITA、IFNG的表达变化以及高甲基化可能在HLA的抑制过程中发挥作用。
①机制一:HLA-I类分子转录的主要调节因子是NOD样受体(NLR)蛋白NLRC5和CIITA。HLA启动子区域还含有肿瘤坏死因子(TNF)刺激的启动子位点EnhA, 和IFNG刺激的反应元件ISRE。
(1)在没有任何基因组HLA损坏的肿瘤中观察:发现在TRACERx421和TCGA数据的LUAD、LUSC和ER+肿瘤中,总HLA表达与NLRC5和CIITA表达均存在显著正相关;在TRACERx LUAD和TCGA LUAD和LUSC队列中,总HLA表达与IFNG表达也存在显著正相关。仅在 TCGA LUSC 队列中观察到总HLA表达与TNF表达存在明显的正相关性(Extended fig.8)。
(2)研究了这些基因的表达是否与肿瘤的正常变化有关,以及肿瘤区域可能存在的因为基因组损坏而无法解释的等位基因抑制:发现在LUAD、LUSC和ER+乳腺癌中,与无转录抑制的样本相比,NLRC5的肿瘤/正常比例在具有等位基因转录抑制的样本中显著降低。此外,在LUAD和LUSC肿瘤中,CIITA和IFNG在具有等位基因转录抑制的样本中也降低,但在ER+乳腺癌中则不然(Fig. 3e)。对于TNF,只在LUAD中观察到与它的重要关系。
②机制二:甲基化是影响HLA等位基因表达的一种机制。
(1)对TCGA中的甲基化数据进行分析,在LUAD、LUSC和乳腺肿瘤中观察到了不同的 HLA 基因甲基化模式:在肿瘤和正常组织中,HLA-A和HLA-B基因体的甲基化程度最高。在HLA-C中,转录起始位点上游1,500-200 bp区域(称为 TSS1500)的甲基化水平最高,其次是基因体,在肿瘤和正常组织中都是如此(Extended fig.4)。在TCGA LUAD、LUSC和ER+肿瘤样本中,HLA-B基因表达与TSS1500和基因体区域甲基化程度之间存在明显的负相关。
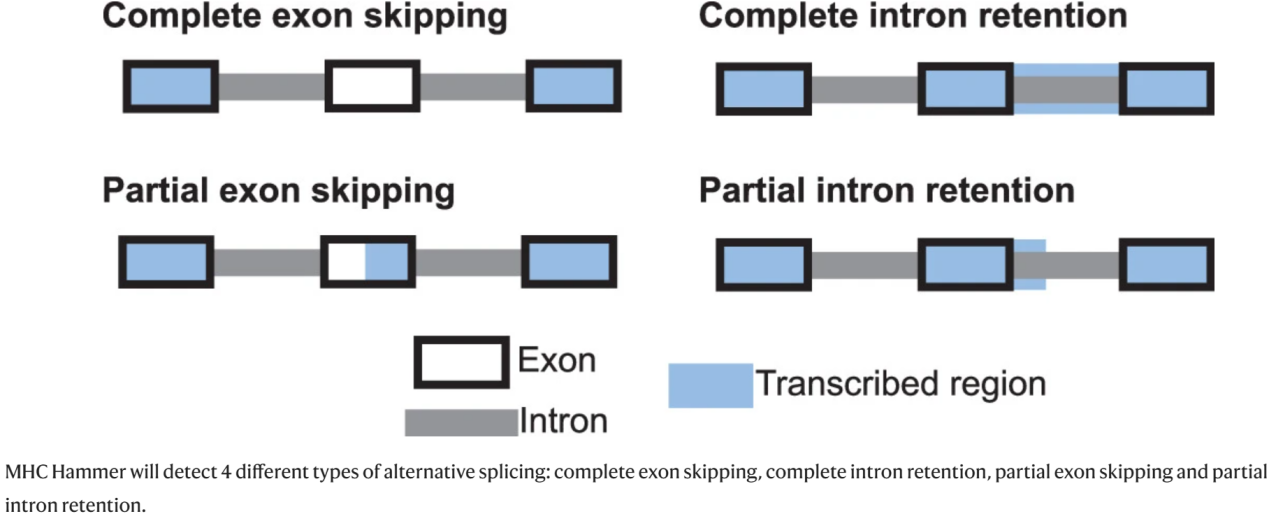
Extended Fig. 4: Types of alternative splicing detected by MHC Hammer.
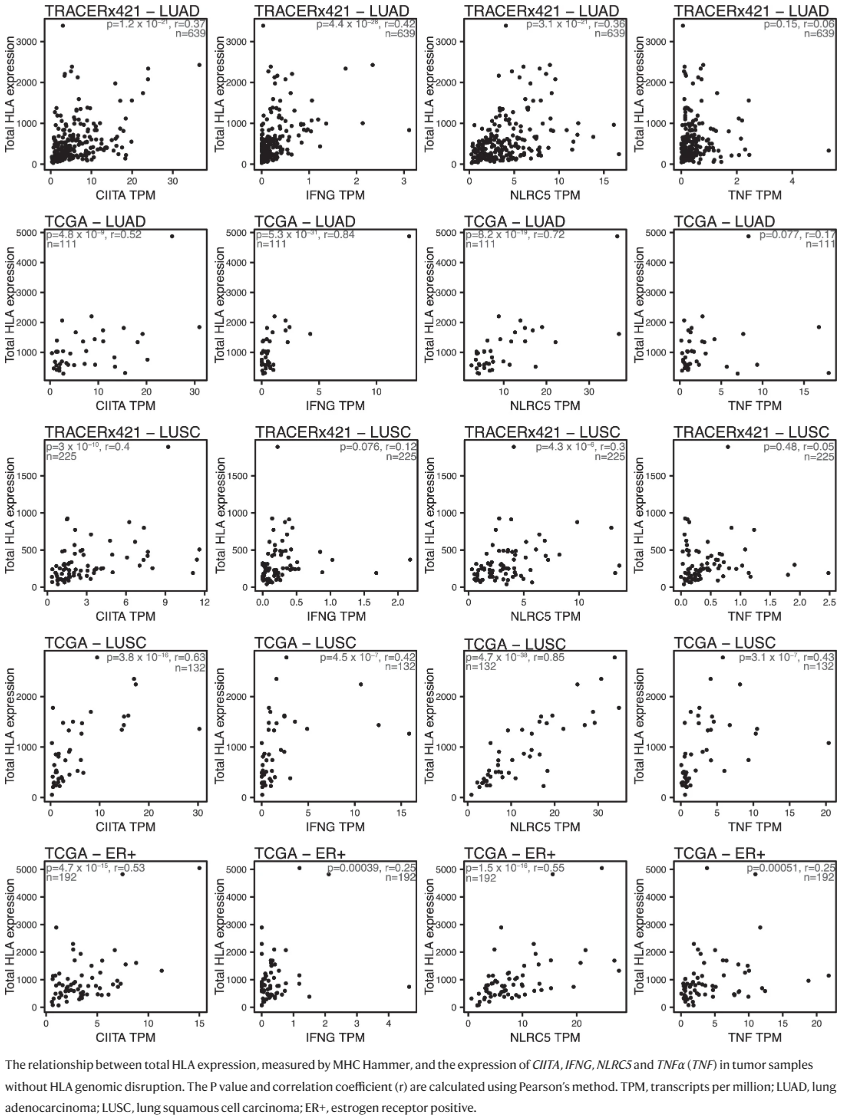
Extended Fig. 8: The HLA gene regulators and HLA expression.
8. 乳腺癌和肺癌的HLA可变剪接
①鉴于可变剪接在正常组织中的普遍性,评估了剪接事件是否在肿瘤中发生的频率明显更高(肿瘤富集)或在肿瘤中发生的频率明显更低(肿瘤耗竭):
(1)肿瘤富集和肿瘤耗竭HLA可变剪接事件都很常见(Fig. 4a)。最常见的肿瘤富集可变剪接事件包括内含子5部分保留和框内外显子3完全跳过(Fig. 4b)。
(2)由于可变剪接导致的核苷酸序列的引入或缺失,可能会在所产生的转录本中导致移码和/或引入PTC(提前终止密码子)。在LUAD、LUSC和ER+肿瘤中,所有的外显子完全跳过事件均发生在框内,相比之下,外显子部分跳过事件和内含子部分保留事件是框内的,或导致移码,同时伴随或不伴随PTC的引入(Fig. 4c)。
②鉴于肿瘤样本反映了癌细胞和非癌细胞的混合情况,为了估算癌细胞中可变剪接转录本的比例,通过估计肿瘤区域的纯度来衡量肿瘤富集事件的新转录本比例。
(1)大多数情况下,纯度标定的新转录本比例都小于0.25(Fig. 4d)。
这些数据表明出现了以下一种或两种情况:在每个癌细胞中,经典转录本和新转录本都在被转录,或者只有一部分癌细胞含有新转录本。
③为了进一步评估在HLA等位基因中观察到的肿瘤富集的可变剪接率是否高于或低于预期,测量了所有蛋白编码基因的体细胞可变剪接率:
(1)发现肺癌基因的可变剪接率高于其他蛋白编码基因。其中HLA-C的可变剪接频率排在第四位,HLA-B排在第七位,HLA-A排在第八位(Fig. 4e)。
(2)与存在HLA LOH或抑制的LUAD肿瘤区域相比,不存在HLA LOH或抑制的LUAD肿瘤区域具有更多肿瘤富集的可变剪接事件(Fig. 4f)。因此,在LUAD中,肿瘤富集的可变剪接可能是在肿瘤演化过程中破坏HLA呈递的另一种手段。
④为了进一步研究HLA可变剪接在肿瘤演化过程中的重要性,比较了具有或不具有肿瘤富集HLA可变剪接的等位基因结合的预测新抗原总数:
(1)在LUAD肿瘤中,表现出肿瘤富集HLA可变剪接的等位基因,其新抗原数量显著高于未表现出肿瘤富集可变剪接的等位基因(Fig. 4g)
在LUAD肿瘤中,选择HLA等位基因的肿瘤富集可变剪接可能是为了减少抗原递呈。但在LUSC肿瘤中没有观察到这种富集现象。
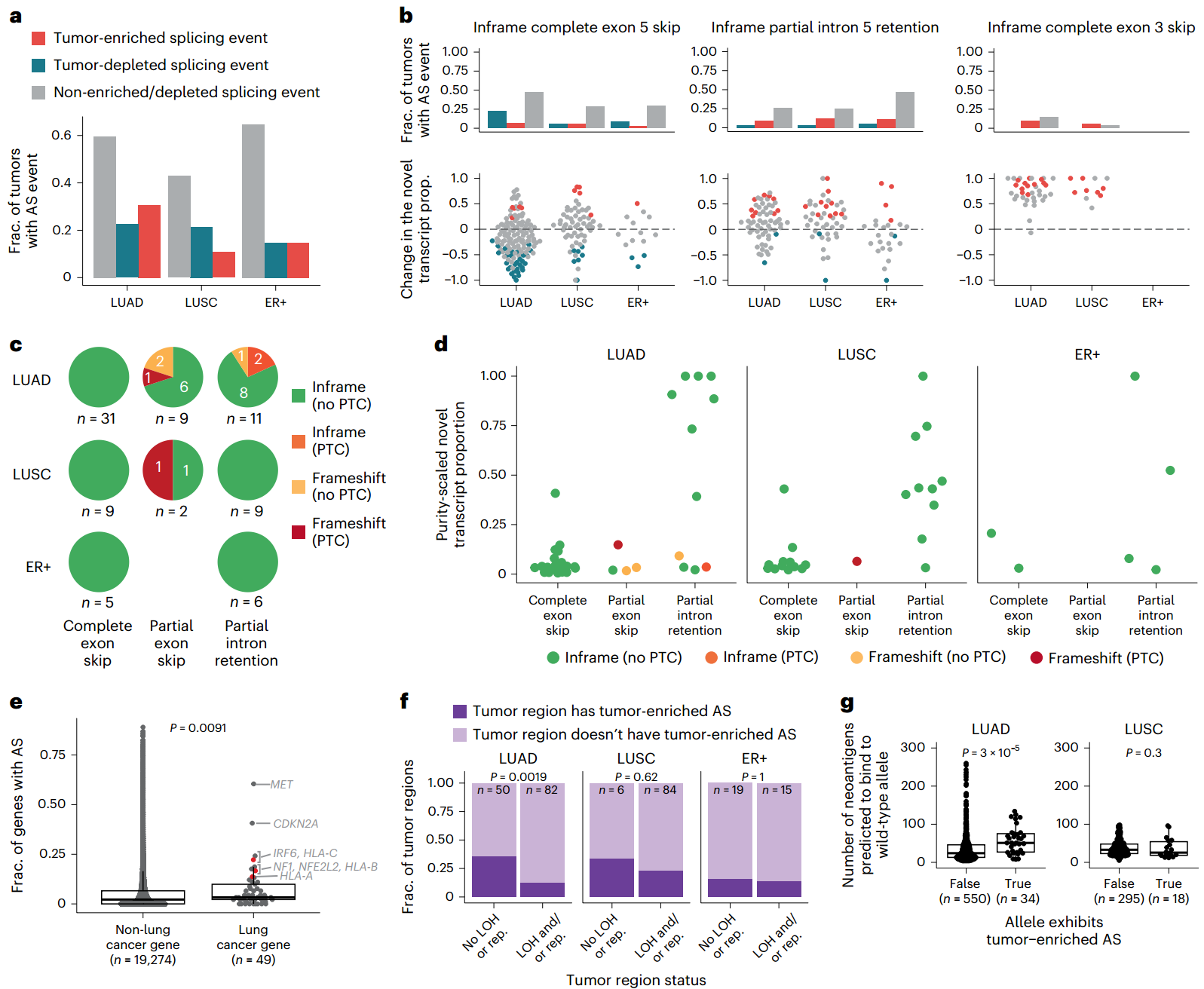

9. HLA损坏与肿瘤演化
①为了了解在NSCLC演化过程中何时会出现HLA的LOH、转录抑制和体细胞可变剪接,利用TRACERx数据分析了这些事件的异质性。
(1)在LUAD和LUSC肿瘤中,肿瘤富集的可变剪接事件异质性最强,其次是抑制事件,然后是LOH事件(Fig. 5a)。
(2)在20/65(30.8%)例存在HLA损坏的TRACERx LUAD和LUSC肿瘤中观察到,通过可变剪接机制损坏同一等位基因后,基因组缺失、转录抑制和/或同一等位基因的可变剪接可发生在同一肿瘤的不同区域(Fig. 5b-c)。
这项结果可能反映了个体肿瘤内的正向选择,也可能是通过不同机制导致HLA高损坏率的结果。
②由于肿瘤微环境可影响肿瘤的演变,因此使用Danaher的计算免疫去卷积法估算 CD8 T细胞浸润量,以进一步研究了免疫浸润与HLA损坏之间的关系:
(1)观察到总HLA表达与CD8 T细胞浸润之间存在显著关系(Extended Fig. 8)。
(2)具有等位基因HLA转录抑制的LUAD和LUSC肿瘤区域与没有等位基因HLA转录抑制的区域相比,浸润的CD8 T细胞水平较低(Fig. 5d)。
(3)HLA可变剪接与LUAD肿瘤中CD8 T细胞水平升高有关(Extended Fig. 9)。
(4)在LUAD、LUSC或ER+肿瘤中均未观察到HLA LOH与HLA总表达量之间的明确关系,这表明等位基因HLA拷贝数丢失后可能会发生剂量补偿效应 (Fig. 5e)。
③探讨了通过LOH、转录抑制或可变剪接导致的HLA等位基因破坏是否在肺癌转移的演变过程中发挥关键作用:
(1)携带HLA LOH的LUAD肿瘤比不携带HLA LOH的肿瘤更容易转移(Fig. 5f)。
(2)进一步研究这个问题,比较了了原发肿瘤播散转移区域与未播散转移区域的新抗原负担。当将新抗原计数限制为只包括预测与完整的HLA等位基因结合的新抗原,而不包括缺失或抑制的HLA等位基因结合的新抗原时,观察到发生转移的LUAD肿瘤区域的有效新抗原负荷低于未发生转移的区域(Fig. 5g),而当只考虑HLA缺失时,这一现象并未出现。
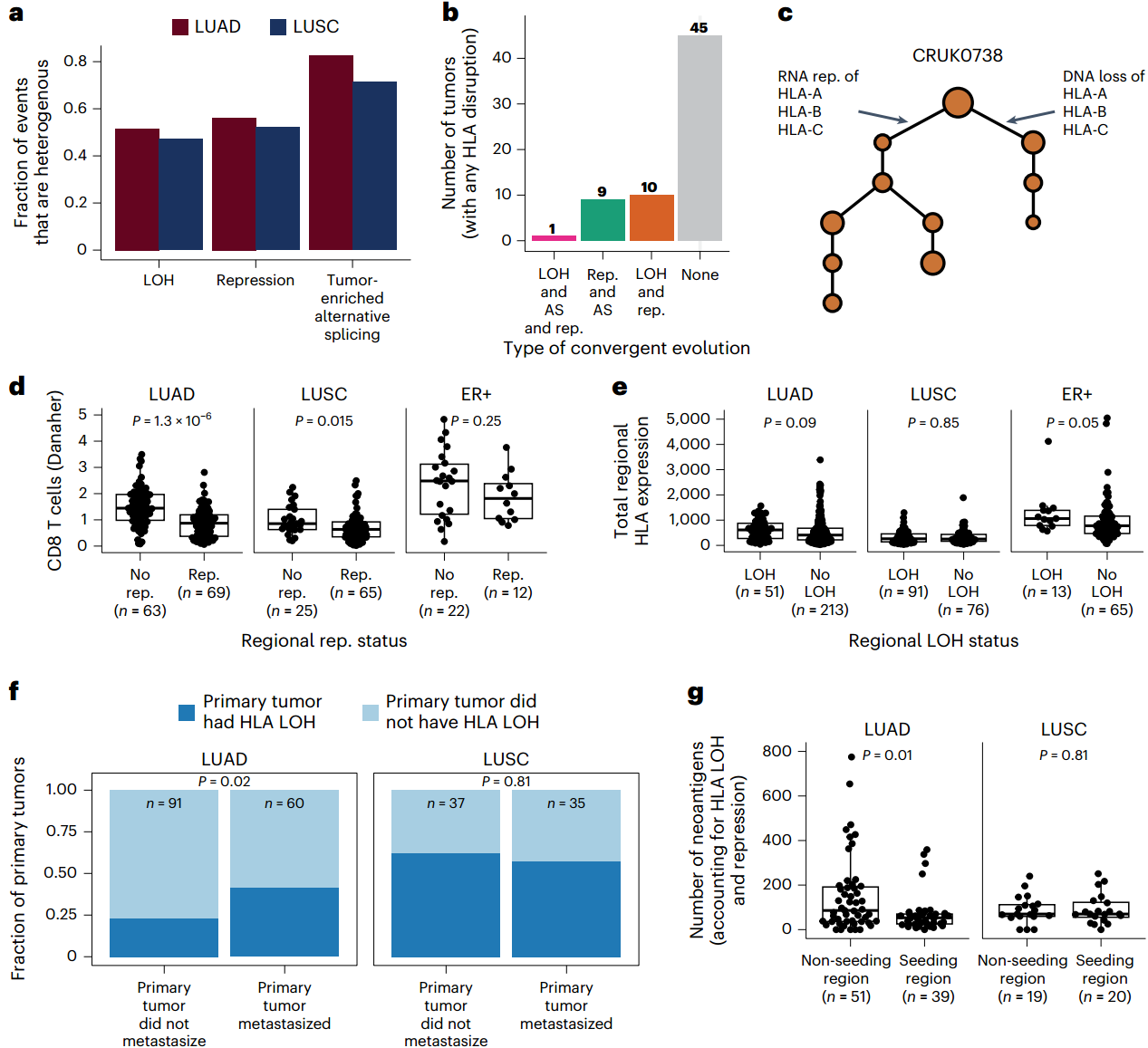

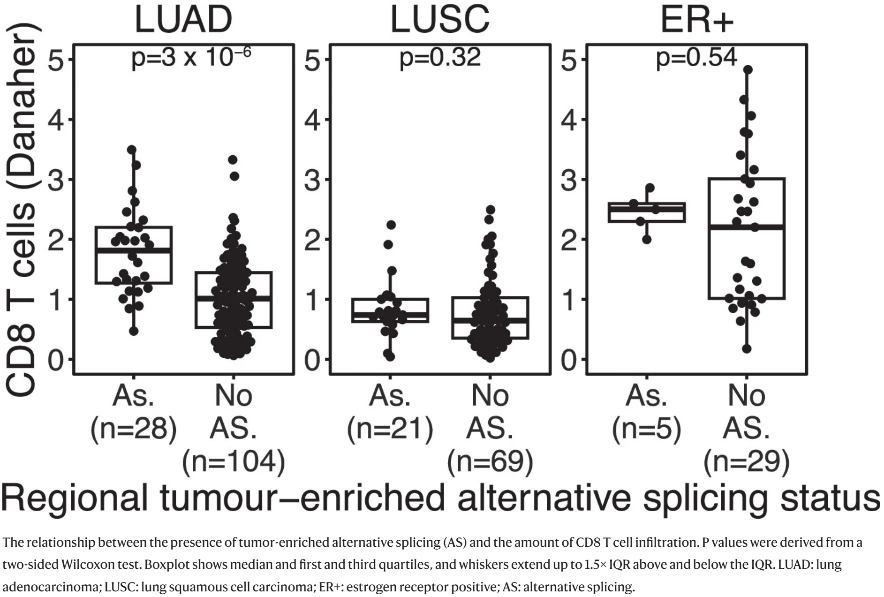
Extended Fig. 9: CD8 T cells and HLA alternative splicing.
总结:
本研究开发了MHC Hammer工具,研究了肺癌和乳腺癌中HLA等位基因基因组和转录组破坏的四种机制——突变、LOH、抑制和可变剪接。
1. 发现HLA等位基因的LOH、抑制和肿瘤富集的可变剪接普遍存在。
2. 在没有LOH或抑制的等位基因中存在可变剪接的富集,新抗原负荷较高的等位基因中肿瘤富含可变剪接的可能性较高,反映了这些癌症类型有通过不同机制造成HLA破坏的倾向。
3. HLA的可变剪接影响外显子或内含子,可能导致HLA分子不稳定,导致其无法呈递新抗原,也可诱导CD8 T细胞和NK细胞凋亡。
4. HLA抑制和可变剪接事件的潜在机制可能与表观遗传有关。

汇报人:吴桂儀
导师:赵宇
审核:王肖宇、张玉忠、任建君



