华西耳鼻喉学术前沿速递——文献精读(第59期)
精读分享│【Science Translational Medicine】:靶向基因组编辑恢复了由人类microRNA突变引起的成年小鼠渐进性听力损失
英文题目:Targeted genome editing restores auditory function in adult mice with progressive hearing loss caused by a human microRNA mutation
中文题目:靶向基因组编辑修复了由人类microRNA突变引起的成年小鼠渐进性听力损失
期刊:Science Translational Medicine(IF: 15.8)
单位:哈佛医学院耳鼻咽喉头颈外科及复旦大学等
发表时间:2024年7月

思维导图:
摘要
microRNA-96(MIR 96)突变会导致一种渐进性常染色体显性遗传性耳聋——DFNA50。虽然基因组编辑在新生小鼠中已展现出恢复听力的潜力,但要实现临床应用,必须在成人内耳中进行编辑,然而这一领域的相关研究尚属空白。本研究通过筛选不同的CRISPR系统,优化Cas9表达和sgRNA骨架,开发了针对MIR96 14C>A突变的基因编辑疗法,实现了高效且特异的突变修复。研究结果显示,将金黄色葡萄球菌Cas9(SaCas9-KKH)变体和sgRNA通过腺病毒(AAV)递送到3周龄(症状前期)和6周龄(症状期)成年Mir 9614C>A/+突变小鼠的耳蜗中,可长期改善听力,且在较年轻的动物中疗效更佳。研究者在注射后的成年小鼠内耳中观察到Cas9的瞬时表达,且未见AAV基因组整合的迹象,这表明本研究的体内基因组编辑策略具有良好的安全性。本研究还开发了一种双AAV系统,其中包括一个针对所有已知人类MIR 96突变的sgRNA的AAV-sgmiR96-master。由于小鼠和人类的MIR 96序列具有100%的同源性,本研究高效且特异的毛细胞编辑方法为长期听力恢复奠定了基础,为因MIR 96突变而引起的DFNA50患者的进一步治疗提供了希望。
介绍
听力损失是一种发病率较高的多因素疾病。单基因突变导致的听力损失占所有先天性感音神经性听力损失的50%以上,但目前尚没有被批准的药物或生物制剂可用于减缓或逆转遗传性耳聋。在这些耳聋相关基因中,microRNA(miRNAs)是一类短小[约20至24个核苷酸(nt)]的内源性非编码RNA,在调节蛋白编码基因的表达中起着至关重要的作用,并被认为是内耳发育的重要因素,且对维持正常听力至关重要。具体而言,MIR 96(microRNA-96;miR-96)突变已被确定为人类和小鼠非综合征性进行性听力损失DFNA50(常染色体显性耳聋-50)的致病原因。在人类的孟德尔遗传病中,MIR96基因种子区的突变是首个被发现的miRNA成熟序列的点突变,并且这种突变被证明是致病的。
MIR 96在内耳的感觉细胞中特异性表达,并且通过减少多个靶基因的mRNA表达在耳蜗发育和听力维持中起关键作用。MIR 96种子区的点突变会导致人类家族中显性遗传模式的进行性听力损失。携带N-乙基-N-亚硝基脲(ENU)诱导突变的小鼠表现出进行性听力损失的表型,纯合Dmdo小鼠(Mir 96Dmdo/Dmdo)和纯合缺失小鼠(Mir 96和Mir 183基因敲除,Mir 183/96dko/dko)完全失聪,表现出毛细胞静纤毛束异常和早期发育中毛细胞数量减少,表明Mir96对于正常毛细胞发育是必需的。相反,杂合Mir 96缺失小鼠(Mir 183/96dko/+)保持正常听力,而杂合Dmdo小鼠(Mir 96Dmdo/+)出现早发性非综合征性进行性听力损失,表明听力损失表型来自新靶基因的获得,而不是功能丧失。在人类中,杂合子MIR 96突变也会导致迟发性非综合征性进行性听力损失,这强烈表明该突变与功能获得密切相关。渐进性听力损失的延迟发病特性为干预小鼠模型恢复听力提供了机会,从而为潜在的临床应用奠定了基础。
Mir96不仅在突变时会导致听力损失,过度表达Mir96也会损害耳蜗功能,影响听力,这使得通过异位表达Mir 96的传统基因治疗方法不可行。然而,靶向显性MIR 96突变的基因组编辑技术在治疗DFNA50方面展现出巨大的前景。通过Lipofectamine核糖核蛋白(RNP)递送或腺相关病毒(AAV)介导递送的体内Cas9核酸酶已被证实能在多种听力损失小鼠模型中有效破坏显性等位基因。此外,内耳的碱基编辑技术已成功用于修复小鼠中的Tmc1显性突变。在所有遗传性听力损失的基因编辑研究中,干预措施都是在耳蜗尚未成熟的新生小鼠中进行的。相比之下,人类新生儿内耳已发育完全。小鼠耳蜗从新生期到成年期经历了一系列发育变化,包括大小、结构和功能的变化。这种差异突显了在成熟耳蜗中评估基因编辑治疗的有效性,安全性及时间窗口的必要性,以确定其潜在的临床应用可行性。
本研究团队通过非同源末端连接(NHEJ)编辑Mir96显性突变(Mir 96tm3.1Wtsi,本研究中称为Mir 9614C>A;等同于人类rs587776523,GRCh38中的g.7:129414596 G>T),并通过AAV介导的递送在年轻成年小鼠中进行听力损失干预。结果表明,AAV递送的编辑复合物耐受性良好,且未损害正常听力。通过筛选不同的编辑工具,本研究优化出一种在体内外均高效且特异的编辑方法。此外,本研究在听力损失发病前后进行了干预测试,并确定了治疗能持续保持听力的时间窗口。为提高编辑策略的安全性,本研究确定了无明显AAV整合的剂量范围,同时结果显示SaCas9-KKH的瞬时表达在注射后12周内终止。由于人类与小鼠Mir 96的种子区序列完全一致,本研究开发了一种可靶向多种Mir 96突变的双AAV系统,为其潜在的广泛适用性提供了证据。综上,本研究确立了体内基因组编辑作为治疗成年动物遗传突变引起的听力损失的可行方法。
结果
人类microRNA-96突变Mir 9614C>A导致听力损失
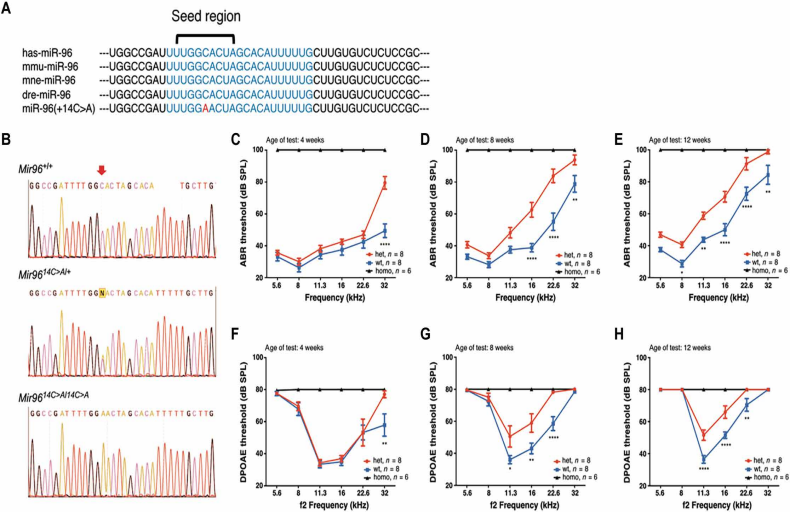
MiR-96在哺乳动物感觉细胞中高表达,并作为控制许多基因表达的主调节因子发挥作用。Mir 96在脊椎动物中高度保守,其种子区内的核苷酸在DNA序列中显示出100%的同一性(图1A)。在该区域内,两处突变(+13G>A, rs587776522 和 +14C>A, rs587776523)已被确定为导致常染色体显性非综合征性进行性听力损失 DFNA50 的重要致病因素。小鼠模型携带Mir9614C>A突变,该突变导致种子区的第 14 位核苷酸由胞嘧啶(C)替换为腺嘌呤(A),破坏了该区域的保守性(图1,A-B)。
为了评估这一突变对听力的影响,本团队对Mir9614C>A小鼠进行了听觉脑干反应(ABR)测试(图1,C-E)和畸变产物耳声发射(DPOAE)测试(图1,F-H)。结果显示,Mir9614C>A/14C>A纯合小鼠在4周龄时即表现出完全听力丧失。对于 Mir96^14C>A/+ 杂合小鼠,研究发现其 ABR 阈值在 32 kHz 频率下升高 30 dB(图1C),DPOAE 阈值升高 19 dB(图1F),但在其他频率下与野生型(WT)相比无显著差异(P>0.05),表明 4 周龄时听力损失首先在 32 kHz 高频率下出现。至 8 周龄时,Mir96^14C>A/+ 小鼠的 ABR 阈值在 16-32 kHz 频率范围内显著升高(P<0.01),较 WT 平均增加 20 dB(图1D)。同样,在 11.3-22.6 kHz 频率范围内,DPOAE 阈值平均升高 16 dB(P<0.05)(图1g)。至 12="" wt="" 14c="">A/+ 小鼠的 ABR 阈值在所有测试频率上均显著升高(P<0.01),平均增加 15 dB(图1E)。DPOAE 阈值亦明显上升(P<0.01),特别是在 16="" 11.3="" khz="" 14c="">A 小鼠的听力损失呈进行性加重,表现为 4 周龄时在 32 kHz 频率下出现初步损失,并在 8 周龄及 12 周龄时随着 ABR/DPOAE 阈值的进一步升高,听力障碍范围逐渐扩展。这些数据进一步证实了 Mir96^14C>A 突变在听力退化过程中的关键作用
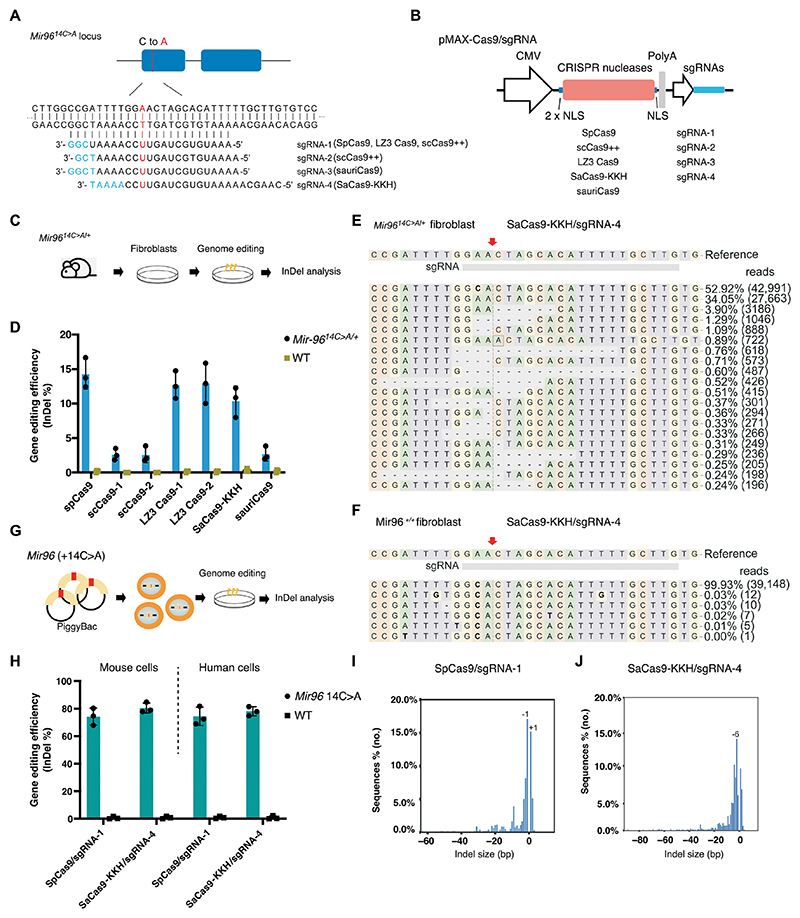
在小鼠和人类细胞中使用不同的CRISPR系统进行Mir 96 14C >A等位基因特异性基因组编辑
针对Mir 9614C>A,本研究使用了五种类型的CRISPR核酸酶,并设计了对应的sgRNA(图2A)。所有Cas9/sgRNA组合均位于相同的pMAX-Cas9/sgRNA骨架中,并具有三个核定位信号(NLS),以确保质粒结构的一致性(图2B) 。
将CRISPR系统通过转染递送到Mir 9614C>A/+成纤维细胞中,并通过二代测序(NGS)分析诱导的插入和缺失(InDel)频率。结果表明,SpCas9/sgRNA-1表现出最高的编辑效率(14.3±2.3%)。LZ3Cas9/sgRNA-1和SaCas9-KKH/sgRNA-4也表现出相当的编辑效率(分别为12.7±2.0%和10.1±2.1%)。而scCas9++/sgRNA-1、scCas9++/sgRNA-2和sauriCas9/sgRNA-4表现出中度的InDel频率(图2C-D)。
SpCas9/sgRNA-1和SaCas9-KKH/sgRNA-4在靶向Mir 9614C>A等位基因方面表现出高度特异性;NGS分析结果显示,所有InDel仅发生在突变等位基因处,并且在Mir 96+/+细胞中未能检测到(小于0.03%)(图2D-F)。
由于跨物种的Mir 96种子区具有100%的同源性,靶向小鼠中Mir 9614C>A等位基因设计的sgRNA可直接用于具有相同突变的人类MIR 96基因。为验证该编辑系统在人类细胞中的有效性,研究者使用PiggyBac转座子系统产生了携带Mir 9614C>A突变的人和小鼠细胞系。在用SpCas 9/sgRNA-1和SaCas 9-KKH/sgRNA-4转染的细胞中,NGS分析显示在人和小鼠Mir 96+ 14 C>A细胞系检测到较高比例的 InDel 读段,而在 Mir96 WT 细胞系中则观察到可忽略的 InDel。InDel图谱显示SpCas9/sgRNA-1和SaCas9-KKH/sgRNA-4产生了各种类型的InDel,其中单核苷酸缺失(-1和+1)是SpCas9/sgRNA-1最常见的类型,而6-nt缺失是SaCas9-KKH/sgRNA-4最常见的类型(图2G-J)。
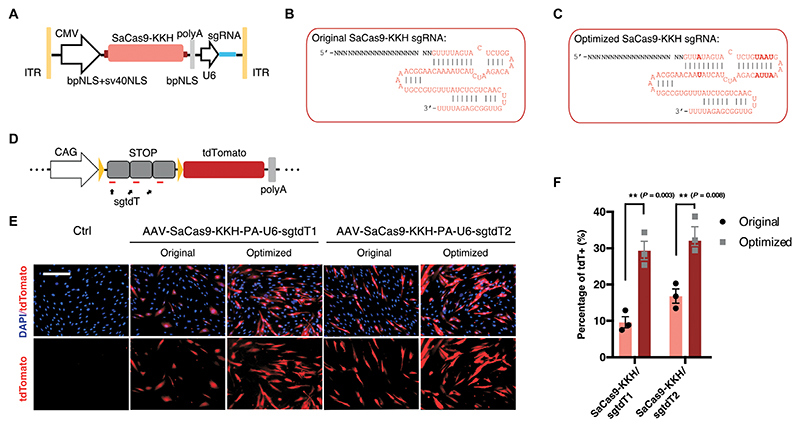
优化CRISPR/sgRNA递送系统用于成年小鼠耳蜗
为了最大限度地提高体内编辑效率以改善听力,本研究在SaCas9-KKH的N端加入了1个双核定位信号(bpNLS)和1个sv40 NLS,同时在C端加入了1个bpNLS来增强核内输入。此外,研究通过使用84-ntsgRNA(crRNA-tracrRNA双链体)优化了SaCas9-KKH sgRNA,使其表现出比典型全长sgRNA更高的活性(图3A)。在茎环区域中引入翻转的A-U序列,排除了可能的RNA Pol III终止子序列(四个连续的U),进一步增强了U6启动子下的表达(图3B-C)。
优化后的构建体在来源于 Ai14 小鼠的原代成纤维细胞中进行了测试,构建体包含“CAG-STOP-tdTomato”盒(图3D)。在用优化后的 SaCas9-KKH/sgRNA 构建体转染的细胞中,SaCas9-KKH/sgtdT-1 和 SaCas9-KKH/sgtdT-2 的编辑效率分别增加了约 3.05 倍和 1.98 倍(图3E-F)。
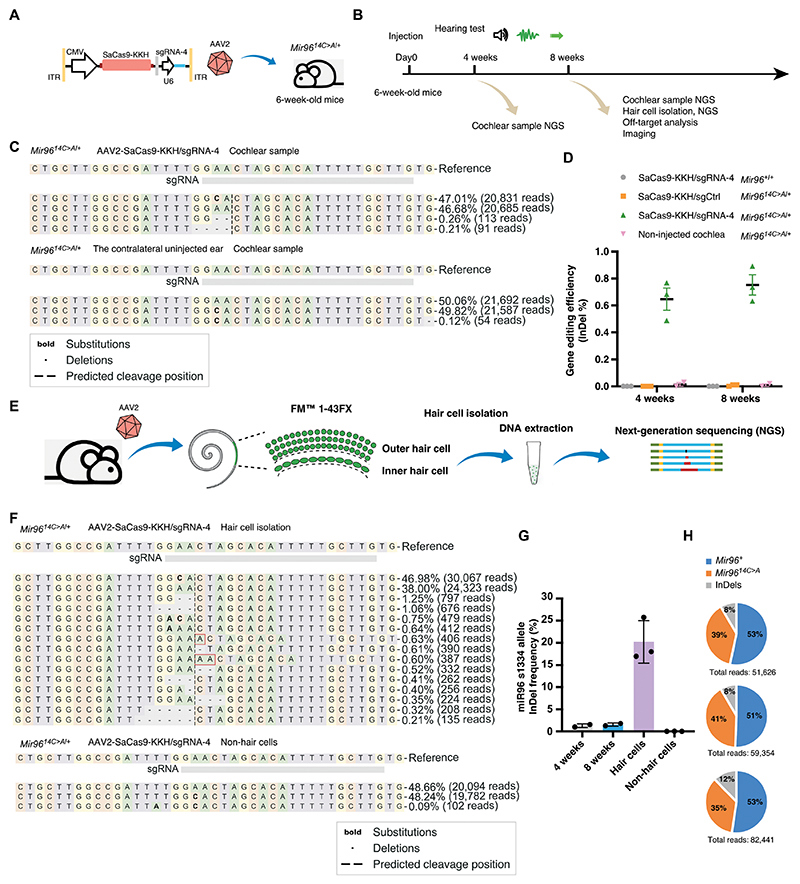
成熟耳蜗中Mir 96 14C>A的体内基因组编辑
将SaCas9-KKH/sgRNA-4和SaCas9-KKH/sgCtrl包装到AAV2中,并通过RWM+CF注射法,以6×109vg的剂量递送到6周龄Mir 9614 C%3 EA/+小鼠的耳蜗(图4A)。在注射后 4 周和 8 周,分别收集耳蜗进行 NGS 分析。
SaCas9-KKH/sgtdT-1用作对照组(SaCas9-KKH/sgCtrl),因为它不靶向小鼠基因组中的任何内源基因座。耳蜗组织的NGS分析显示在注射后4周和8周时检测到注射耳中Mir 96突变基因座处存在InDel,但在对侧未注射耳中未检测到InDel。AAV2-SaCas9-KKH-sgRNA-4特异性编辑了Mir 9614C>A等位基因,因为在AAV2-SaCas9-KKH/sgRNA-4处理的WT小鼠或AAV2-SaCas9-KKH/sgCtrl处理的Mir 9614C>A小鼠中没有观察到InDel。注射后8周,测定的InDel率为0.76±0.13%,略高于注射后1个月观察到的比率(0.63±0.14%)。然而,来自Corti器官样品的InDel频率不能准确地反映毛细胞中的编辑效率,因为毛细胞占耳蜗细胞的不到5%(图4C-D)。
为了精确测量毛细胞中的编辑效率,研究者使用FM1-43标记毛细胞,随后进行注射并评估分离的毛细胞。在倒置荧光显微镜下,手工挑选标记的毛细胞并进行裂解,提取DNA用于聚合酶链反应(PCR)和NGS分析(图4E)。
在处理后8周,在来自注射动物的分离毛细胞中观察到稳健的InDel形成,Mir 9614C>A 的InDel频率为16.3%至25.73%,并且InDel种类多样,包括−2 bp、−4 bp、+1 bp和−1 bp,表明毛细胞中已完成有效的靶向基因组编辑(图4F和G)。
从三个独立的实验中,研究者基于编辑后的NGS结果分析了Mir 96 WT等位基因读段与Mir 9614C>A等位基因读段的比率。在注射耳中,含有InDel的读段+未编辑的Mir 9614C>A等位基因与Mir 96 WT读段之间的比率为47.7% : 52.3%,类似于在未注射耳中观察到的比率,表明基因组编辑没有引起明显的染色质损伤、插入或大缺失(图4H)。
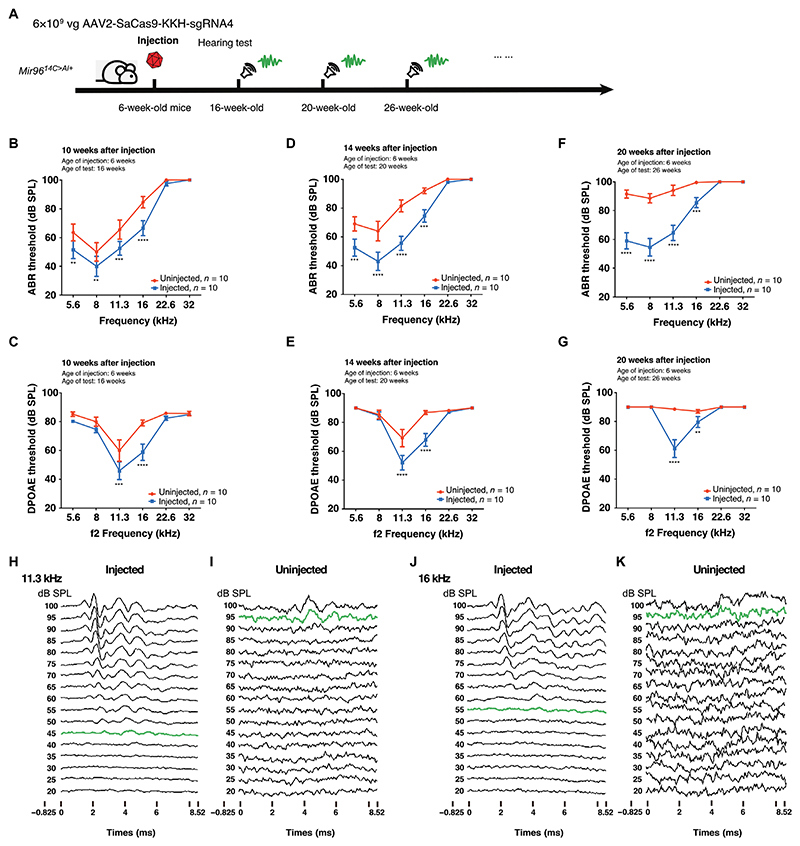
体内基因组编辑实现了短期和长期的听力保护
通过RWM+CF将AAV2-SaCas9-KKH-sgRNA-4注射到6周龄(P40至P45)Mir 9614C>A/+小鼠的耳蜗中,对侧未注射耳朵用作对照(图5A)。注射后10周,即小鼠在16周龄时,注射耳在5.6至16 kHz的频率下,显示出与未注射的对照耳相比总体较低的ABR阈值(图5 B),这表明该耳听力有所改善。在低于22.6 kHz的频率范围内,ABR阈值降低的幅度为5.6 kHz时降低12 dB,16 kHz时降低18 dB,平均降低13 dB。此外,与对照耳相比,在11.3和16 kHz的频率下,注射耳中观察到较低的DPOAE阈值,分别降低14至21 dB(图5C)。
为了评估毛细胞在靶向基因组编辑后的长期听觉功能,研究进行了长时间的听力测试。注射后14周(20周龄),与未注射的对照耳相比,在5.6、8、11.3和16 kHz频率下,注射耳的 ABR 阈值显著(P<0.001)降低,平均降低了 21 dB。在8和11.3 kHz的频率下,分别降低了21和26 dB(图5D)。与未注射的对照耳相比,在11.3和16 kHz的频率下,注射耳的 DPOAE 阈值显著(P<0.0001)降低,分别降低15和19 dB(图5E)。注射20周后(26周龄),听力改善更显著,注射耳的ABR阈值相比未注射对照耳,在5.6-16 kHz的频率范围内ABR阈值平均降低28 dB(图5F)。对于5.6和8 kHz的频率,ABR阈值分别降低了33和34 dB。类似地,在11.3和16 kHz的频率下,与未注射的对照耳相比,在注射耳中检测到显著较低的DPOAE阈值,分别降低27和7 dB(图5G)。在注射后14周,使用11.3kHz(图5,H-I)和16kHz(图5,J-K)短纯音,以从 20 至 100 dB 递增的声压级(SPL)记录 AAV2-SaCas9-KKH-sgRNA-4 注射耳和未注射耳的代表性ABR波形,进一步证明了听力的改善和保持。总的来说,这些结果表明,AAV 2介导的基因组编辑有效地消除了突变体Mir 96的表达,从而改善了短期和长期的听力保护。
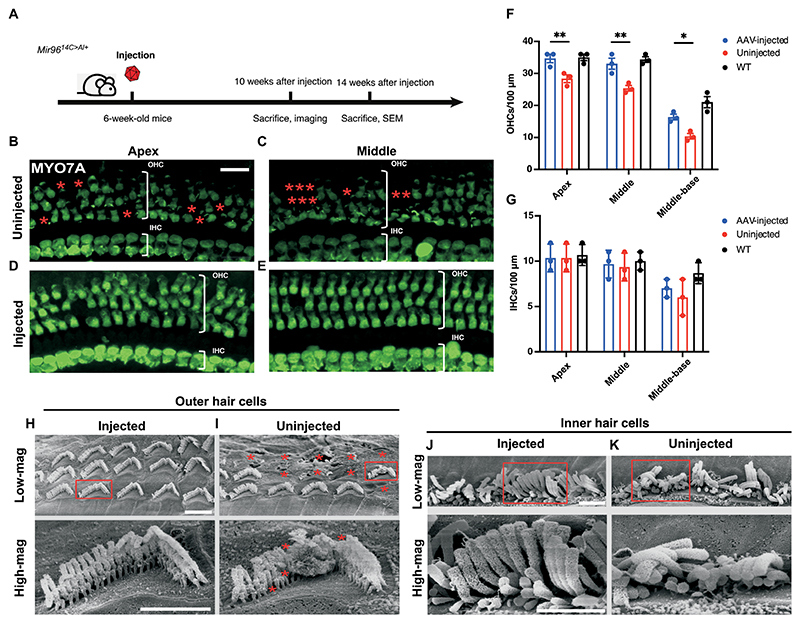
体内基因组编辑保护毛细胞存活
为了测试编辑对体内毛细胞(HC)的影响,本研究将AAV 2-SaCas 9-KKH-sgRNA-4注射到6周龄Mir 9614 C % 3EA/+小鼠的内耳中。注射后10周取下耳蜗,使用抗MYO 7A抗体和共聚焦成像进行毛细胞标记(图6A)。在未注射的Mir 9614C>A/+内耳中,观察到整个耳蜗的外毛细胞(OHC)损失,其中基底部的损失最严重(图6,B-C,及图S8,A-B),而在WT动物中仅观察到轻度OHC损失(图S8,C-E)。对于内毛细胞(IHC),仅在基底至中段区域检测到轻微损失(图6,F-G,及图S8A)。 在注射的Mir 9614C>A/+耳中,与未注射的Mir 9614C>A/+小鼠相比,在所有频率区域中观察到OHC存活情况都有显著改善(图6,D-F,及图S8 B),而在基部中观察到与未注射耳接近的IHC的轻微减少(图6G和图S8,A-B)。为了进一步检查毛细胞结构,研究使用扫描电子显微镜(SEM)可视化OHC和IHC的静纤毛。在注射后14周取下来自未注射和接受AAV 2-SaCas 9-KKH-sgRNA-4注射的Mir 9614 C % 3EA/+小鼠的耳蜗,并进行SEM成像(图6A)。 来自未注射的Mir 9614C>A/+小鼠耳蜗的毛细胞显示出退化的迹象,包括OHC中静纤毛缺失和IHC中静纤毛的紊乱。相比之下,注射的Mir 9614C>A/+小鼠耳蜗的毛细胞具有组织化且保存良好的静纤毛结构(图6,H-K)。这些发现表明,通过AAV 2-SaCas 9-KKH-sgRNA-进行的体内基因组编辑能够通过促进毛细胞的存活和维持静纤毛的结构来挽救Mir 9614C>A/+小鼠中的毛细胞。
研究者使用设计的特异性引物评估了AAV载体在体内的整合(图7C)。实验结果显示,在注射动物的耳蜗样品中,能够扩增出Mir 96基因座(P1+P2)的DNA片段和SaCas9-KKH DNA片段(P3 + P4),但未能扩增出任何Mir 96-ITR整合DNA片段(P1 + ITR-R)(图7E)。此外,在来自注射动物的分离毛细胞中,仅检测到极微量的整合现象(图7F)。通过对分离毛细胞进行的高通量测序(NGS)分析显示,在总共82,453个测序读数中,Mir 96 WT等位基因有42,991个读数,其余的读数均与Mir 9614C>A突变相关。在Mir 9614C>A的读数中,含有插入缺失(InDel)的读数占比为25.7%(图7G)。此外,检测到102个整合相关读数,占总读数的0.26%(图7G)。通过qPCR对Mir 96的表达水平进行定量分析,结果显示,与未注射的对照组相比,注射耳蜗中Mir 96的表达量显著减少(89.2±3.0%)(图7H),这可能是基因组编辑后RNA降解所致。然而,Mir 96-ITR mRNA的表达水平未发生显著变化(P=0.87)(图7I),表明基因组编辑后未产生Mir 96-ITR嵌合体转录物。这些结果表明,在成熟耳蜗中,AAV2介导的基因组编辑仅表现出极低或可忽略的载体整合。为了进一步探索消除AAV整合的可能性,研究者使用了降低剂量的AAV2-SaCas9-KKH-sgRNA4(每个耳蜗1×109 vg)。注射后10周,在来自注射耳朵的分离的毛细胞中没有检测到ITR的整合(图S11A),这一结果通过平均12.05%的InDel频率(n=3)以及低于背景误差的ITR整合读数比率得到验证(图S11B和C)。这些发现表明,AAV载体的整合率与给药剂量密切相关。研究者通过优化剂量,在达到基因组编辑治疗阈值的同时,成功将AAV载体整合率降至最低水平。
AAV介导的基因组编辑治疗在成年小鼠中的安全性评估
为了评估AAV介导的CRISPR基因组编辑在体内的潜在安全性问题,研究者系统分析了SaCas9的长期表达情况以及AAV载体整合的风险。逆转录聚合酶链式反应(RT-PCR)结果显示,在注射耳蜗中,SaCas9-KKH RNA的表达在注射后4周达到峰值,随后逐渐下降,至12周后已无法检测到(图7A)。在对侧未注射耳蜗中,仅检测到微量的SaCas9-KKH mRNA,其表达水平在注射后4周达到峰值,但仅为注射耳的3.33±1.02%(图7A)。值得注意的是,这种微量的SaCas9-KKH表达并未在毛细胞中诱导任何插入缺失(InDel)(图S6D)。此外,研究者比较了短期(注射后10周)和长期(注射后20周)的听觉功能,发现对侧未注射耳与未注射小鼠的听性脑干反应(ABR)(图S9A-C)和畸变产物耳声发射(DPOAE)(图S9B-D)阈值均无显著差异(P>0.5)。通过蛋白质印迹分析进一步证实,SaCas9-KKH蛋白在注射后4周可被检测到,但在12周后完全消失(图7B)。此外,与6周龄小鼠相比,3周龄小鼠在AAV注射后4周表现出更高的SaCas9-KKH蛋白水平(图7B),提示年轻小鼠的转导效率更高。综合以上结果,研究者认为SaCas9-KKH的表达在注射后3个月内被有效关闭,这可能是由于CMV启动子在体内随时间推移而发生沉默所致。
另一个潜在的安全隐患是AAV载体可能整合到CRISPR诱导的DNA双链断裂(DSB)位点。为了评估这种风险,研究者设计了特异性引物,用于检测Mir 96基因座与AAV ITR之间的整合事件(图7C)。首先,研究者探讨了AAV剂量与载体整合率之间的关系。通过使用不同剂量的AAV2-SaCas9-KKH-sgRNA-4处理携带Mir 9614C>A突变的HEK-293T细胞,研究发现当剂量达到每细胞10^3 vg时,可在DSB位点检测到AAV载体整合(图7D和图S10A-B)。进一步分析表明,InDel频率和整合率均随AAV剂量的增加而上升。通过优化AAV剂量,研究者确定了每细胞10^2-10^3 vg的最佳剂量范围,在此范围内,InDel频率接近峰值,同时HEK细胞中的AAV载体整合率保持在较低水平(图7D和图S10A-B)。这些结果表明,通过精确调控AAV剂量,可以在维持高效基因组编辑的同时,显著降低AAV载体整合的潜在风险。
CIRCLEseq是一种高通量方法,可用于鉴定CRISPR-Cas9基因组编辑工具的脱靶位点。本研究利用该方法评估了SaCas9-KKH/sgRNA-4的潜在脱靶效应。从小鼠基因组DNA中仅鉴定出两个脱靶位点(图7J)。此外,研究者还通过计算预测方法识别了潜在的脱靶位点。基于基因组编辑后的切割频率测定(CFD)评分,分析了小鼠基因组中前10个潜在的脱靶位点,其中包括通过CIRCLEseq鉴定出的两个脱靶位点(图S12A-B)。高通量测序(NGS)分析进一步确认了一个脱靶位点,其插入缺失(InDel)频率较低(1.97%),而目标位点的编辑效率高达84.6%(图7K)。值得注意的是,该脱靶位点位于基因间区域(Gm19782-Fam135b),因此不太可能影响任何基因功能。通过对注射小鼠的分离毛细胞进行分析,未检测到任何脱靶相关的InDel事件(图7L)。综上所述,这些结果表明,将AAV2-SaCas9-KKH-sgRNA-4递送至Mir 9614C>A/+细胞中仅引起极低水平的脱靶编辑,且观察到的听觉相关表型主要由靶向编辑所驱动。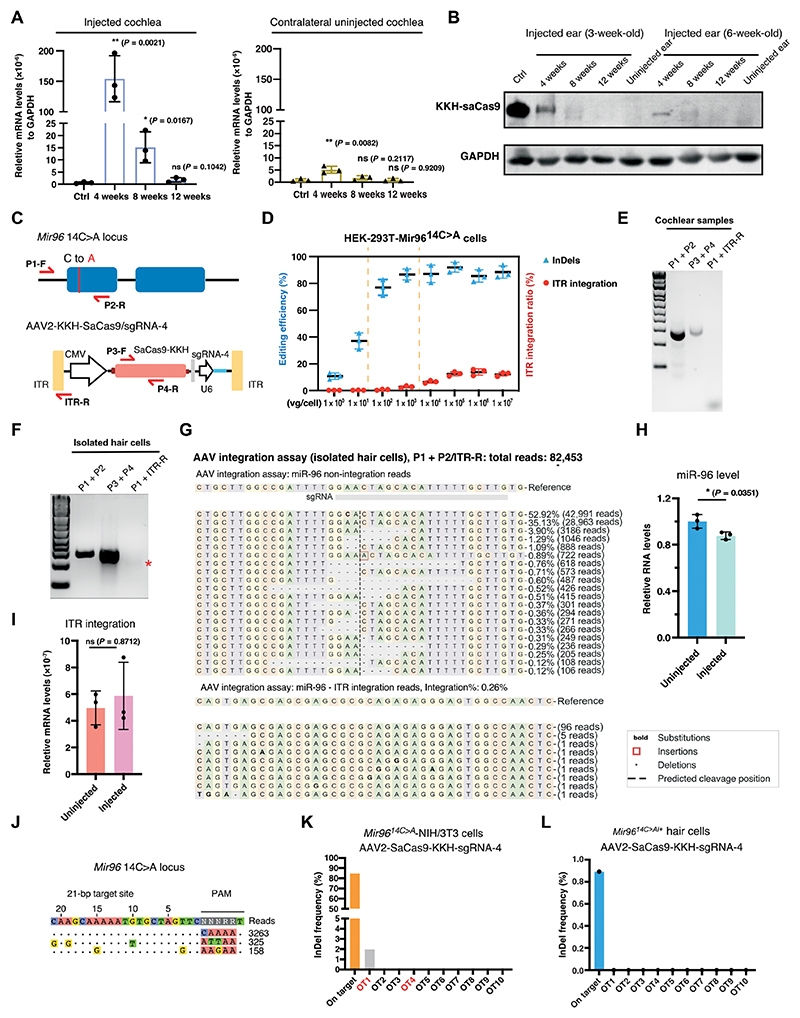
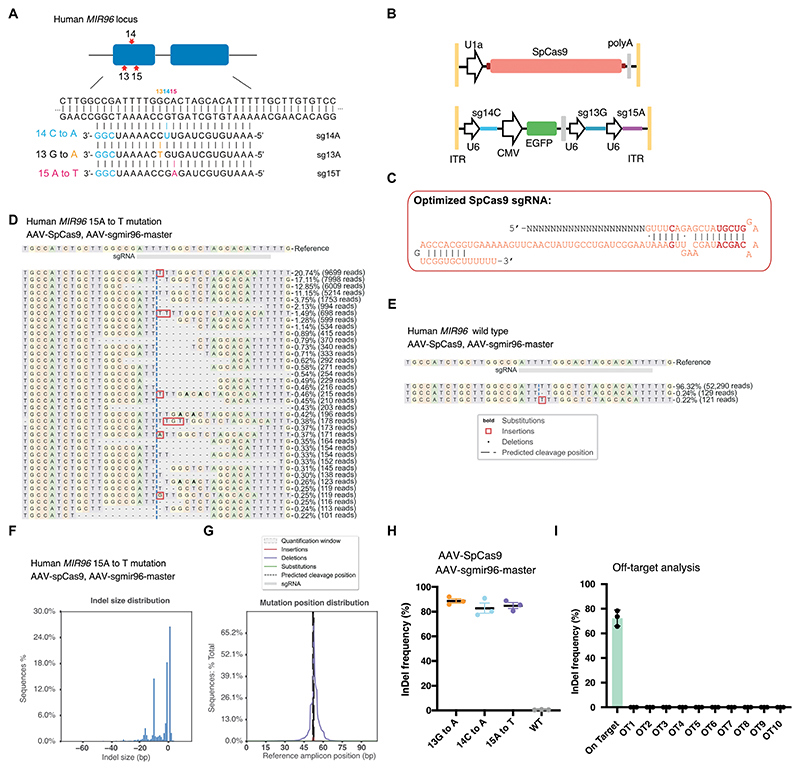
双AAV2系统能够靶向多个人MIR 96突变
由于Mir 96种子序列在哺乳动物物种中高度保守(100%同源性),针对小鼠突变设计的gRNA可直接用于靶向人类直系同源突变。除了+14C>A突变外,MIR 96种子区还存在另外两个已知的显性突变,分别是人类的MIR 96 13G>A和小鼠的MIR 96 15A>T(参考文献11, 17)。为此,研究者为这两种突变分别设计了相应的gRNA(图8A)。由于SpCas9和多个sgRNA的表达盒过大,无法容纳于单个AAV载体中,因此本研究构建了一个双AAV系统,包括携带三个核定位信号(nls)的AAV-U1A-SpCas9-polyA和包含sgRNA表达盒的AAV-sgMir 96-master,以同时靶向三种突变(14C>A、13G>A和15A>T)(图8B-C)。为验证该双AAV系统的有效性,研究者利用PiggyBac系统构建了携带三种MIR 96种子区突变的人源细胞系,并用AAV-U1A-SpCas9-polyA/AAV-sgMir 96-master进行转染。高通量测序(NGS)结果显示,在所有三种MIR 96突变细胞系中均观察到高效的InDel形成,且编辑效率相近(图8D-G,图S13A-F)。在MIR 96基因座检测到的InDel读数比例低于1%(图8E)。数据表明,每种突变等位基因均被其对应的gRNA特异性破坏,编辑效率超过80%(图8H)。此外,研究者分析了人类基因组中前10个潜在的脱靶位点,NGS结果显示,在Cas9/sgRNA转染后未检测到任何InDel事件(图8I,图S13G)。这些结果表明,AAV-U1A-SpCas9-polyA/AAV-sgMir 96-master组合能够高效靶向三种已知的人类MIR 96突变,为治疗由MIR 96相关突变引起的显性听力损失提供了潜在的治疗策略。AAV-sgMir 96-master系统的设计不仅扩大了靶向范围,还简化了AAV给药系统的疗效和安全性评估流程。
结论
为了开发DFNA50人类遗传性听力损失的临床治疗方法,本研究对成年Mir 9614C>A/+小鼠耳蜗进行了基因组编辑,实现了听觉功能的长期改善,并展示了基因组编辑在因 Mir 96 基因突变导致听力损失的成年动物模型中的编辑效率、安全性和长期疗效,为该技术在治疗遗传性听力损失的潜在临床应用提供了启示。

汇报人:谢尔杰
导师:唐玥玓
审核:冯兰、宋瑶、任建君



