华西耳鼻喉学术前沿速递——文献精读(第56期)
精读分享│【Nature Communications】:人胆脂瘤的单细胞转录组学研究鉴定出一种具有骨破坏潜能的分泌Activin A的成纤维细胞亚群
英文题目:Single-cell transcriptomics of human cholesteatoma identifies an activin A-producing osteoclastogenic fibroblast subset inducing bone destruction
中文题目:人胆脂瘤的单细胞转录组学研究鉴定出一种具有骨破坏潜能的分泌Activin A的成纤维细胞亚群
期刊:Nature Communications(IF: 14.7)
单位:1.大阪大学医学部免疫学与细胞生物学系,日本大阪
2.大阪大学WPI免疫学前沿研究中心,日本大阪
3.大阪大学医学部耳鼻喉头颈外科系,日本大阪
4.日本国立生物医疗创新健康营养研究所生物成像与药物发现实验室,日本大阪
5.大阪大学微生物疾病研究所基因信息研究中心,日本大阪
6.大阪大学WPI免疫学前沿研究中心人类免疫学实验室,日本大阪
7.神户药科大学临床药学实验室,日本神户
发表时间:2023年08月



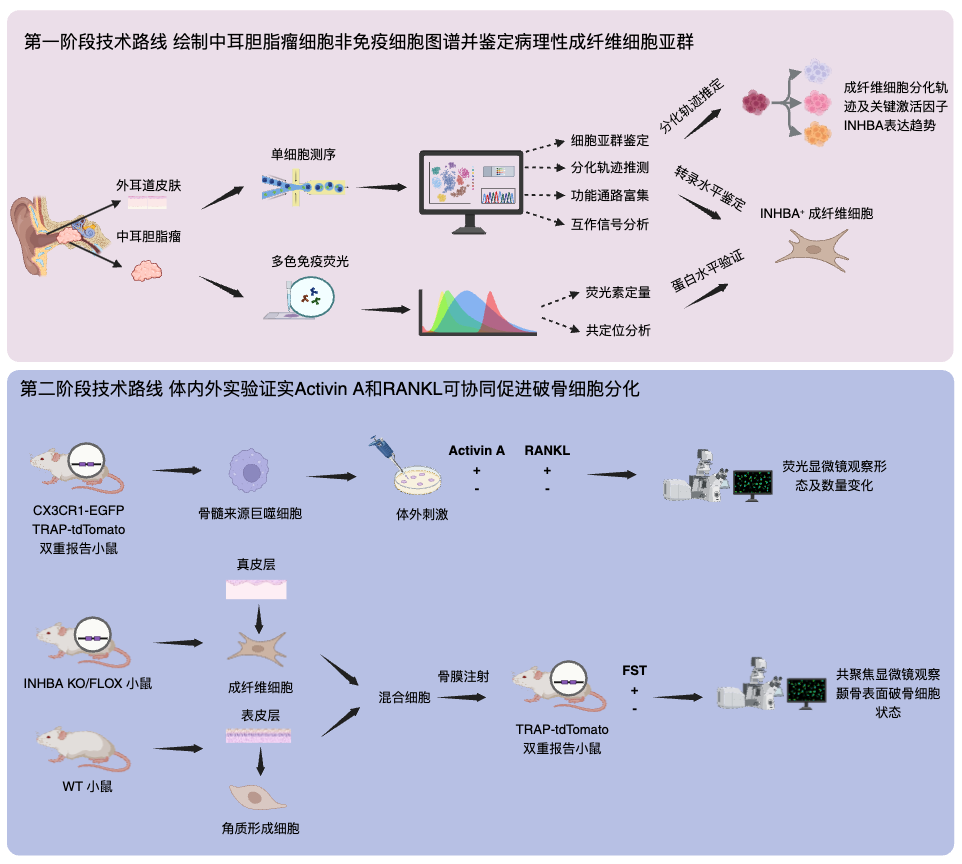 技术路线图
技术路线图
摘要:
中耳胆脂瘤是一种可能由鼓膜内陷引起的疾病,其特征是难以控制的局部骨侵蚀和伴随的听力丧失及脑脓肿形成。然而,中耳胆脂瘤导致骨破坏的病理生理机制仍不明确。研究者对人类胆脂瘤组织样本进行了单细胞RNA测序分析,并识别出一种具有丰富的抑制素βA表达的致病性成纤维细胞亚群。且研究证实抑制素βA的同源二聚体—活化素A可促进破骨细胞分化。此外,在小鼠胆脂瘤模型中,这些成纤维细胞中抑制素βA/活化素A的缺失导致破骨细胞分化减少。与此同时,抗活化素A的卵泡抑素减少了胆脂瘤的破骨细胞生成及骨侵蚀程度。总之,这些发现表明,人类胆脂瘤组织中独特的产生活化素A的成纤维细胞通过诱导局部破骨细胞生成导致骨破坏,这可能作为潜在的治疗靶点。
研究背景:
胆脂瘤是一种慢性中耳炎症,会随着骨质侵蚀而扩大,破坏颞骨结构,并引发诸如听力损失、头晕、面瘫和脑膜炎等症状。此外,胆脂瘤是一种源自鼓膜上皮层的表皮囊肿,由三层组成:基质,由角化复层鳞状上皮构成;周基质,为基质周围与颞骨接触的结构,包含胶原纤维、成纤维细胞和内皮细胞;以及最内层的囊性成分,含有从基质脱落的角蛋白碎片和坏死组织。目前已有多种机制被提出用以解释胆脂瘤中的骨侵蚀,包括破骨细胞活化、酸溶解、压力坏死、炎性介质、酶介质,以及这些机制中至少两种的组合。然而,胆脂瘤局部骨破坏的潜在机制尚未得以阐明。目前唯一有效的治疗手段是彻底的手术切除,但术后复发率仍不尽人意。先前的一项研究表明,与未受影响的区域相比,在与胆脂瘤相邻的被侵蚀的骨表面观察到大量破骨细胞,并且胆脂瘤周基质中的成纤维细胞表达 NF-κB 受体活化配体(RANKL),这是一种对于破骨细胞分化和功能至关重要的蛋白质。由于在其他炎性疾病(如类风湿性关节炎)中已报道存在多种成纤维细胞亚型,所以胆脂瘤很可能也包含若干种成纤维细胞亚型。然而,先前的研究并未对胆脂瘤中存在的细胞类型和亚型进行全面概述。在此,研究者对人类胆脂瘤标本进行了单细胞 RNA 测序(scRNA-seq)分析,以阐明这些细胞对胆脂瘤骨破坏的作用。结果表明,胆脂瘤周基质成纤维细胞高表达 Activin A,这是一种分泌蛋白,其与 RANKL 协同作用诱导成熟破骨细胞的形成。研究者对 Activin A 与胆脂瘤骨侵蚀之间的关系进行了详细评估,结果显示,Activin A 是胆脂瘤的一个潜在治疗靶点。
主要结果:
1.单细胞RNA测序分析发现了一种胆脂瘤特异的病理性成纤维细胞亚群
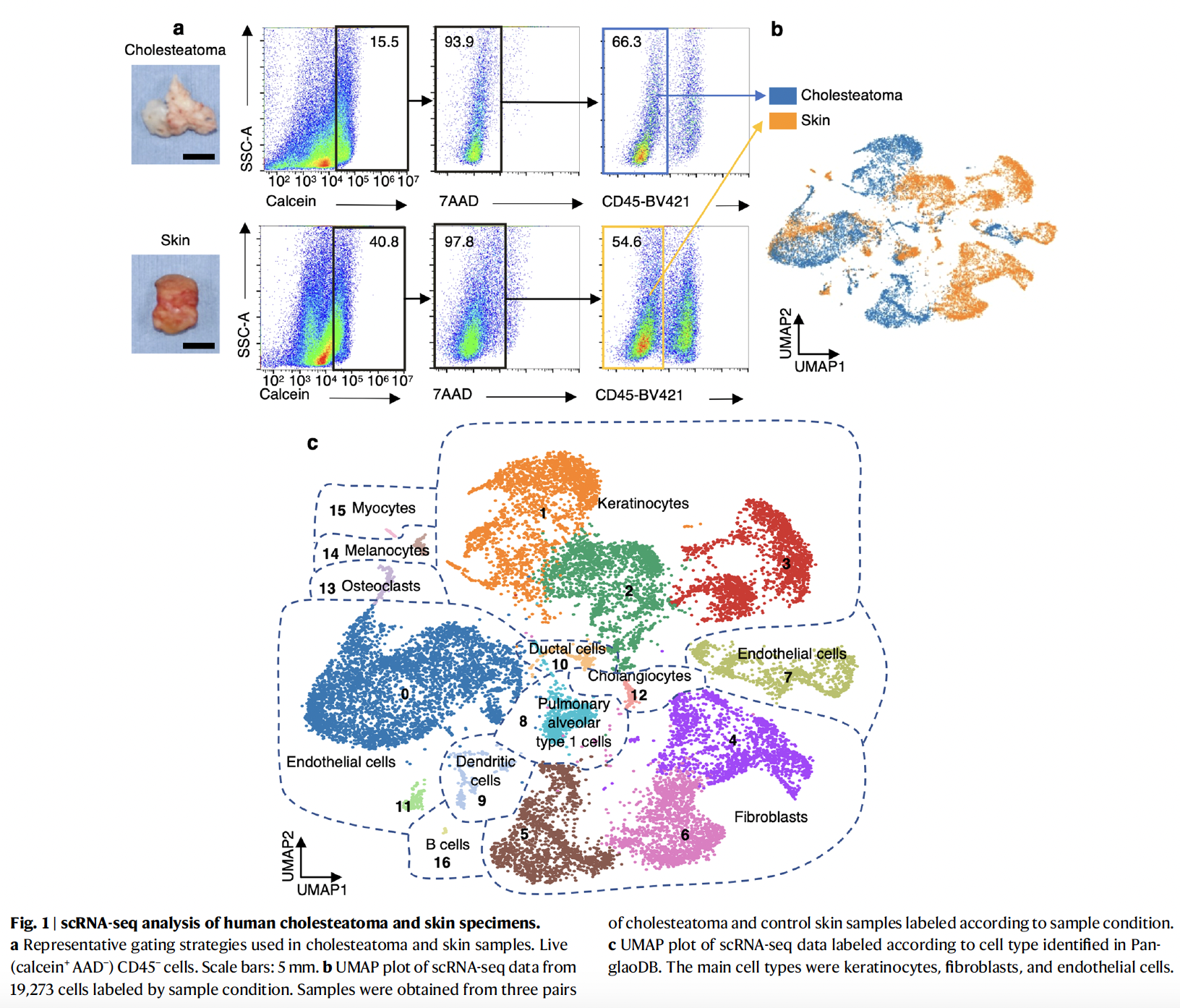
为了阐明中耳胆脂瘤骨质破坏的机制,研究者分离出了人胆脂瘤组织中的非免疫细胞进行了单细胞RNA测序分析。由于中耳内没有与胆脂瘤相对应的“正常”组织,因此研究者将耳后切口处的皮肤作为胆脂瘤的对照组。最终从三个患者的胆脂瘤样本中捕获到了8357个细胞和从对照皮肤样本中捕获到了10916个细胞,共包含11种不同的细胞类型,包括角化细胞、成纤维细胞、内皮细胞和破骨细胞等。中耳胆脂瘤与耳后皮肤在细胞大类组成上具有相似性,但其细胞亚群分布具有明显差异。
为了识别特异性的中耳胆脂瘤角化细胞、成纤维细胞和内皮细胞亚群,研究者评估了每个亚群中中耳胆脂瘤来源细胞和正常皮肤细胞的比例。角质细胞1群和成纤维细胞5群几乎仅来源于中耳胆脂瘤,被定义为胆脂瘤特异性细胞亚群。与此同时,研究发现胆脂瘤特异性成纤维细胞(5群)相比于皮肤特异性成纤维细胞(4群和6群)高表达的TOP1分泌蛋白基因为INHBA,且其主要表达于胆脂瘤特异性成纤维细胞。这些数据促使研究者进一步探索INHBA在胆脂瘤特异性成纤维细胞中的表达是否与胆脂瘤的破骨细胞形成有关。
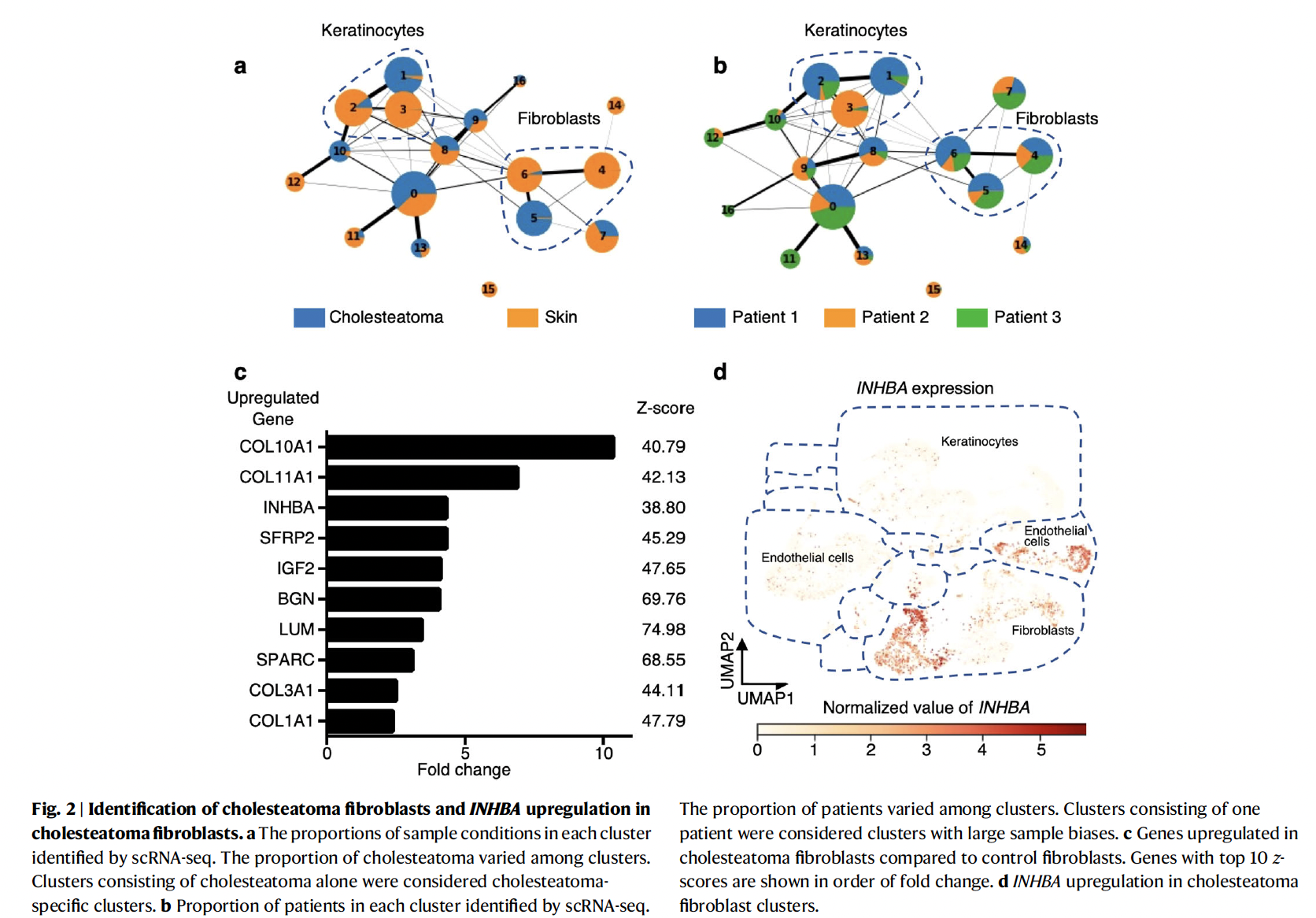
2、INHBA+病理性成纤维细胞分化轨迹探索
为了对从正常纤维细胞到特定疾病纤维细胞的发展过程进行推断,研究者将每个纤维细胞簇划分为更小的子簇,并使用Monocle 3进行拟时序轨迹分析。如图3所示,9群为PI16+成纤维祖细胞,位于分化轨迹的起点,胆脂瘤特异性成纤维细胞的分化轨迹完全独立于皮肤来源正常成纤维细胞,且其分化过程伴随着INHBA基因的表达升高。胆脂瘤周基质的特异性染色也显示INHBA与Vimentin呈现明显的共定位特征,在蛋白层面确认了INHBA+成纤维细胞的富集,且Bulk转录组分析也显示胆脂瘤中INHBA的表达更高。此外,体外实验证实IL-1β、PGE2 和TNF-α可诱导人类正常皮肤成纤维细胞高表达INHBA。这些结果表明INHBA有可能作为一种标志基因,用于识别分化程度更高的病理性胆脂瘤特异成纤维细胞亚群。
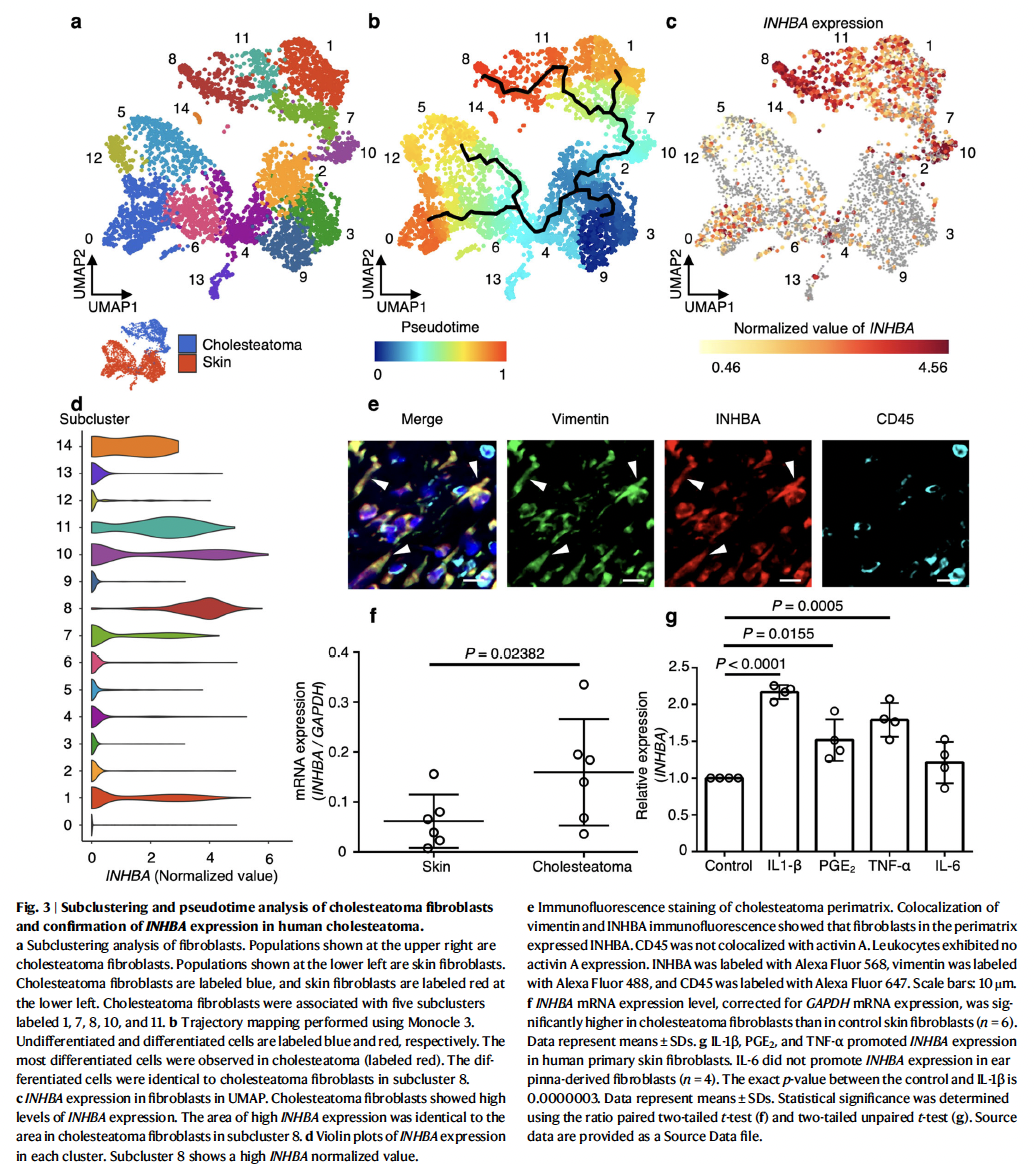
3、体内外实验探索Activin A的功能
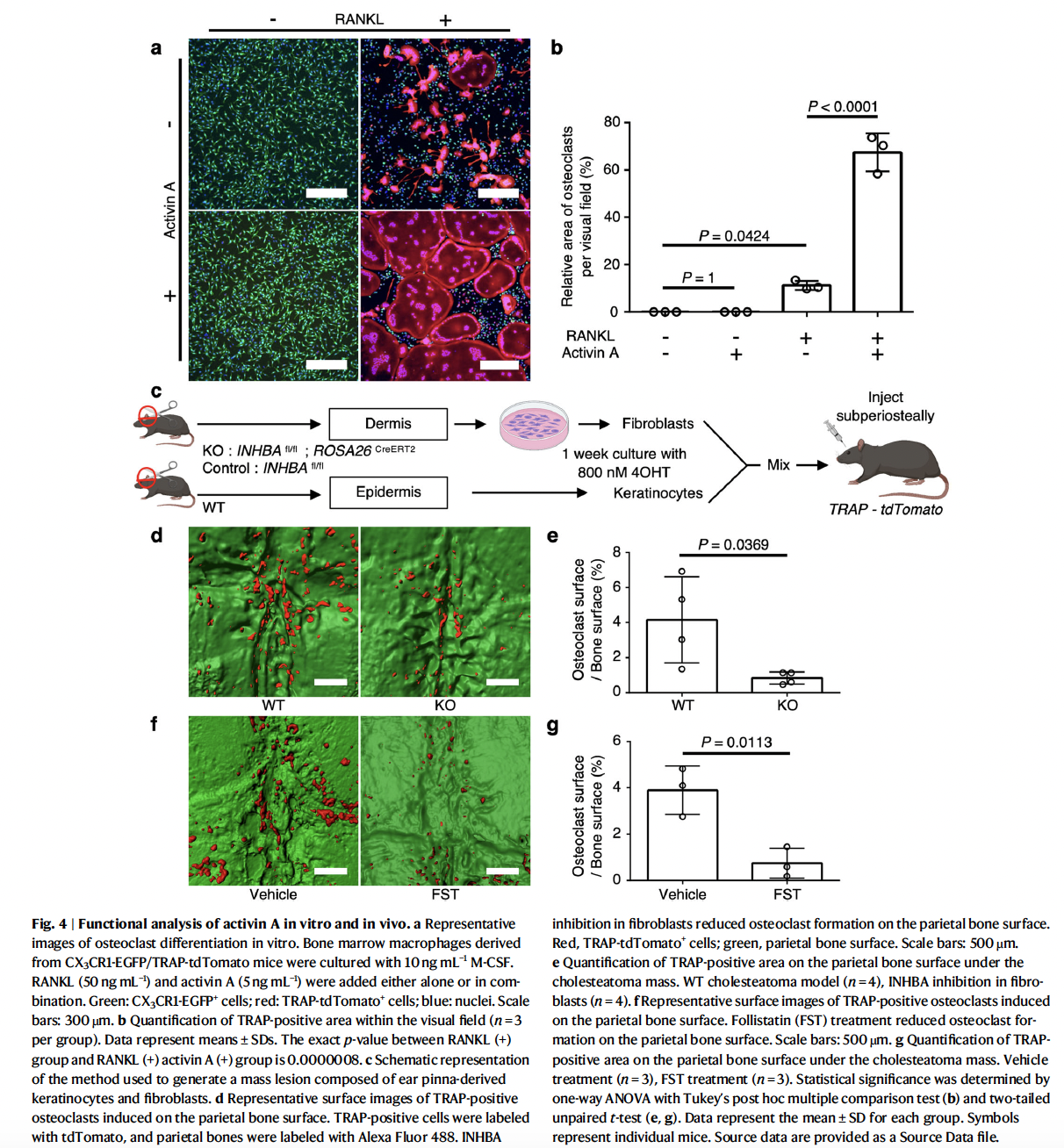
接下来,研究者分析了INHBA在体外促进破骨细胞分化的能力。INHBA编码抑制素β的A亚基,与其他抑制素亚基通过二硫键形成二聚体。INHBA形成INHBA同源二聚体(activin A)、INHBA和INHBB异源二聚体(activin AB)以及INHBA和INHA异源二聚体(inhibin A)。因此,研究者通过ddPCR比较了人胆脂瘤纤维细胞中INHBA、INHBB和INHA的表达模式。结果显示,与INHBB和INHA相比,INHBA在胆脂瘤纤维细胞中显著上调。由于在胆脂瘤纤维细胞中未观察到INHBB和INHA的上调,因而上调的INHBA在胆脂瘤特异性纤维细胞中形成同源二聚体,即activin A。进一步的体外实验显示activin A和RANKL在体外对破骨细胞分化具有协同促进作用。为了评估破骨细胞分化情况,研究者使用了双报告基因CX3CR1(破骨细胞前体细胞的标志物)增强型绿色荧光蛋白(EGFP)敲入(CX3CR1-EGFP)小鼠和磷酸酶敏感的荧光素酶(TRAP,成熟破骨细胞的标志物)依赖的tdTomato表达(TRAP-tdTomato)小鼠。从CX3CR1-EGFP/TRAP-tdTomato小鼠的骨髓中分离出的巨噬细胞在有或没有activin A和/或RANKL的条件下培养并量化TRAP+破骨细胞的面积。研究者发现,activin A不会诱导TRAP+成熟破骨细胞的产生,而activin A与RANKL的组合协同增加了成熟TRAP+破骨细胞的数量。Activin A受体ALK-4的抑制剂拮抗了activin A的协同作用以及RANKL本身对破骨细胞形成的影响,这表明activin A是RANKL依赖性破骨细胞形成的关键辅因子(图4a-b)。
接下来,研究者利用之前建立的胆脂瘤小鼠模型,研究了activin A在胆脂瘤形成过程中的体内作用。研究者从耳部上皮中分离出角质细胞,从真皮中分离出成纤维细胞,将耳廓纤维细胞与4-羟基他莫昔芬(4OHT)共同培养以阻断INHBA的表达,然后将纤维细胞和角质细胞按1:5的比例混合并移植到TRAP-tdTomato小鼠的颅骨骨膜下(图4c)。骨表面形成的破骨细胞数量在缺乏INHBA的成纤维细胞移植组中显著低于对照组成纤维细胞移植组(图4d, e)。此外,应用activin A拮抗剂follistatin(FST)的组别较注射载体组抑制了破骨细胞的形成(图4f, g)。这些数据表明,activin A在体内与胆脂瘤相关的破骨细胞形成过程中起着关键作用。
4.结论
目前,治疗胆脂瘤的唯一有效方法是完全手术切除,然而,术后复发率很高,复发与组织炎症状态有关。在这里,研究者证明了Activin A拮抗剂FST可在胆脂瘤模型中减少异位破骨细胞的生成,提示Activin A及其诱导产生的炎症细胞因子可能是胆脂瘤的潜在治疗靶点。

汇报人:邱轲
审核:夏晓旭、杨柠菲、任建君



