精读分享│【Cell】:中性粒细胞捕获和细胞吞排——肥大细胞介导的炎症信号中继过程
英文题目:Neutrophil trapping and nexocytosis, mast cell-mediated processes for inflammatory signal relay
中文题目: 中性粒细胞捕获和细胞吞排——肥大细胞介导的炎症信号传递过程
期刊:Cell (IF=45.5)
单位:马克斯·普朗克免疫生物学和表观遗传学研究所,德国弗莱堡
发表时间:2024年8月
摘要:
中性粒细胞是哨兵免疫细胞,在微生物防御方面具有重要作用。目前对中性粒细胞组织迁移的大部分认识来自于创伤和感染模型,而过敏性炎症在很大程度上被忽视了。在这里,研究者分析了过敏原激发的小鼠组织,发现正在脱颗粒的肥大细胞(MCs)吞噬活的中性粒细胞。肥大细胞释放吸引剂白三烯B4,以重新引导中性粒细胞向它们移动,从而利用中性粒细胞通常用于细胞间通信的趋化系统。在MCs胞内陷阱(MIT)形成后,中性粒细胞死亡,但它们的残余物质在MCs的空泡内存留数天。MCs从MIT形成中受益,它们的功能和代谢适应性提高。此外,MCs促炎性增强,并且可以延迟排出活性中性粒细胞化合物(nexocytosis),从而在周围巨噬细胞中引发1型干扰素反应。总体而言,该研究强调了肥大细胞介导的中性粒细胞捕获和细胞吞排(nexocytosis),这一过程在慢性过敏性炎症中可能起到传递中性粒细胞特性的作用。
前言:
中性粒细胞是先天免疫反应中的关键细胞,对于清除体内的细菌和真菌具有至关重要的作用。数量众多的中性粒细胞在血液中循环。在稳态条件下,较小的群体也在血管外组织空间进行免疫监视。响应感染、损伤或其他炎症条件时,受损组织通过从血液中招募中性粒细胞来增强其局部抗菌能力。
中性粒细胞通常通过各种机制获得其杀死微生物的潜力,包括吞噬作用、释放抗菌物质或中性粒细胞外陷阱(NETs)。当中性粒细胞寻找潜在的有害威胁时,它们会迅速穿过间质组织。一系列G蛋白偶联受体(GPCRs)帮助它们感知从受损组织或直接从病原体释放的危险相关趋化成分。此外,中性粒细胞彼此之间进行通信,以协调群体行为,帮助它们在组织损伤或病原体入侵的局部部位集中其联合效应功能。中性粒细胞通过临近细胞分泌吸引剂,使其结合到GPCRs,从而自我调控群体行为的启动和终止。这为它们提供了一定程度的自我组织能力,这在很大程度上依赖于二十烷类白三烯B4 (LTB4)和LTB4受体1 (LTB4R1)的信号传导。
目前对于中性粒细胞导航的大部分了解来自小鼠模型中伤口、无菌炎症或微生物感染的活体成像研究。相比之下,研究者对过敏反应中中性粒细胞组织动态的理解有限。Ⅰ型超敏反应涉及免疫球蛋白E(IgE)抗体和肥大细胞(MCs)的产生。肥大细胞是长期存活的髓样免疫细胞,存在于包括皮肤、气道和胃肠道在内的外周组织中。与中性粒细胞的快速移动形成对比,肥大细胞在组织中似乎是固定的,因为它们与细胞外基质的强相互作用控制了它们的位置。肥大细胞富含充满炎症介质和蛋白酶的细胞质颗粒,其释放具有重要的功能,包括动物毒液的解毒和对寄生虫的防御。此外,肥大细胞作为IgE依赖性过敏免疫反应和过敏性休克的效应免疫细胞而闻名。抗原特异性IgE与高亲和力Fcε受体(FcεRI)的结合使MCs致敏,释放免疫调节复合物,以响应特定或交叉反应性抗原。这种反应,称为过敏性脱颗粒,涉及复合物外排,MCs在几分钟内从多个分泌颗粒中一次性释放大量预先合成的物质。此外,MCs在抗原暴露后几分钟内还分泌其他分子,包括脂质介质。在这些即时反应之外,激活的MCs还在数小时内产生细胞因子、趋化因子和生长因子,促进过渡到迟发相超敏反应。
通过释放激活血管内皮的激活剂和免疫细胞的趋化因子,MCs对于从血管中招募中性粒细胞进入过敏炎症组织空间至关重要。尽管已知其在过敏反应中性粒细胞被招募到炎症组织中,但对它们的组织动态以及它们与其他免疫细胞的相互作用如何影响炎症环境仍然了解有限。
一个鲜有关注的重要方面是,过敏性疾病通常涉及多个阶段的炎症细胞流入和MC脱颗粒,如在过敏原反复暴露或与微生物感染共存期间。在这种慢性的炎症条件下,MCs在免疫细胞(包括中性粒细胞和嗜酸性粒细胞)浸润的情况下经历重复脱颗粒。在这种情况下,中性粒细胞的动态、它们的迁移路径和细胞间相互作用知之甚少。此外,这些过程对组织中的长寿MCs表型的影响仍然未被探索。
结果:
1.中性粒细胞向过敏原暴露组织中脱颗粒的肥大细胞聚集
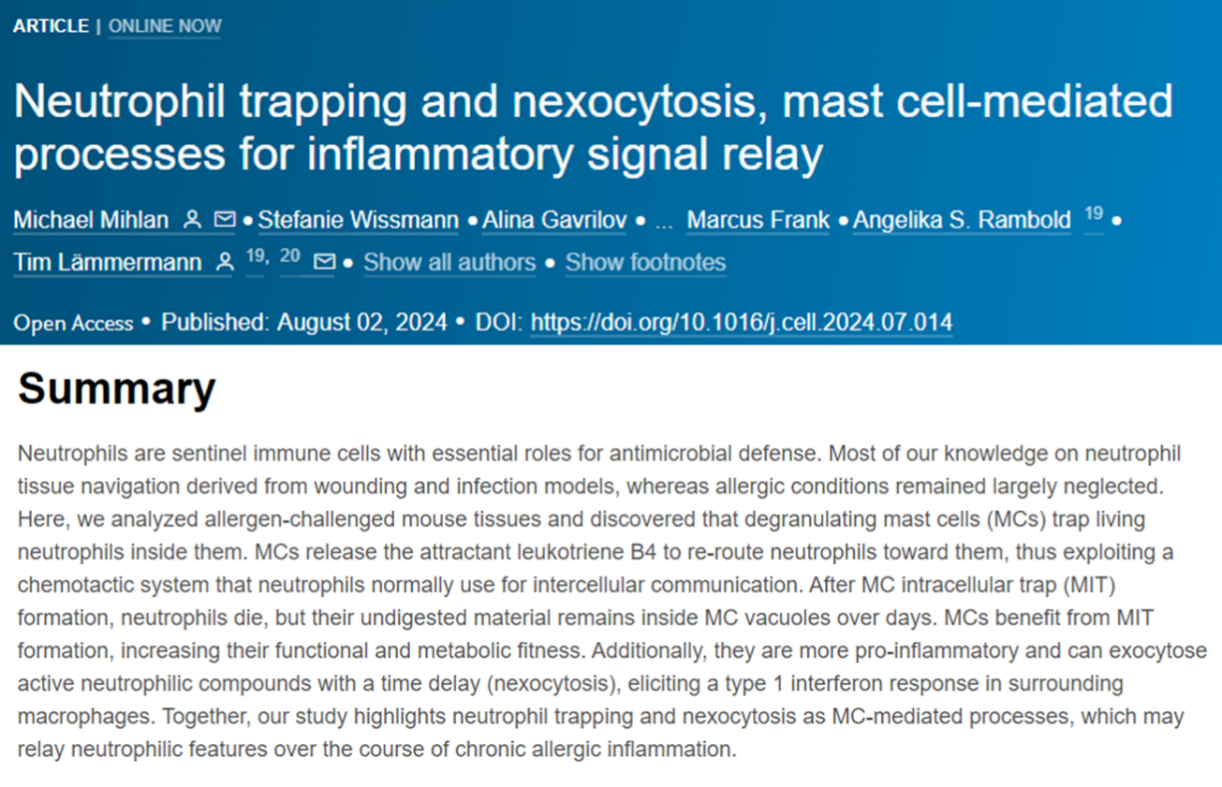
为了研究在过敏反应的背景下研究中性粒细胞的动态,作者使用了双光子活体显微镜(2P-IVM)对进行被动皮肤过敏反应(PCA)的小鼠耳朵皮肤进行了观察。使用针对二硝基苯-人血清白蛋白(DNP-HSA)的IgE抗体对肥大细胞局部致敏,然后在通过全身应用DNP-HSA诱导肥大细胞脱颗粒。作者使用了Mcpt5-Cre+/-Rosa26LSL:Tom Lyz2GFP/+(MCTom/中性粒细胞GFP)小鼠来观察GFPbright中性粒细胞的组织动态与tdTomato肥大细胞的关联。研究观察到,在诱发过敏反应前,中性粒细胞随机移动、分布。诱发MC脱颗粒后,中性粒细胞移动速度增加并向MC定向迁移。脱颗粒10min后,中性粒细胞与MC接触,并在MC周围形成团块;这些团块在20min后解离。
图A-F: 被动皮肤过敏(PCA)小鼠模型中,中性粒细胞与肥大细胞的动态
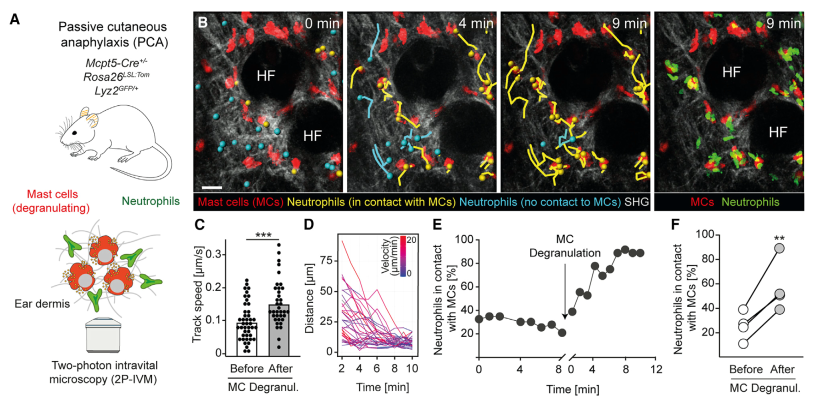
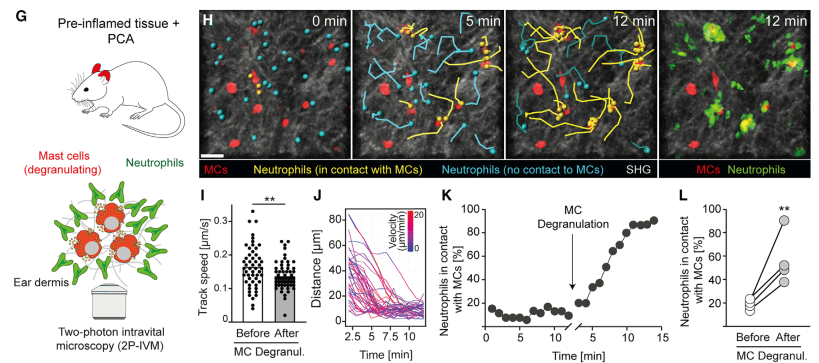
为了观察临床上复杂炎症状态下的细胞动态反应。作者制备了中性粒细胞炎症基础上的过敏反应模型。由于存在基础炎症,中性粒细胞迁移初始速率本就比较快,在诱导过敏后反而略降低。但是与前一个实验相似的是,MC脱颗粒改变了中性粒细胞迁移方向,中性粒细胞向MC聚集,与MC接触。然后作者又用白三烯LTB4局部注射,制备了另一种炎症模型,然后再诱导过敏。观察到的中性粒细胞动态也是相似的。随后,作者进行了体外实验验证。在胶原凝胶中,把鼠骨髓来源MC与中性粒细胞共培养,然后诱导MC脱颗粒,也观察到相似的细胞活动。
图G-L: 中性粒细胞炎症合并被动皮肤过敏(IRI-PCA)小鼠模型中,中性粒细胞与脱颗粒的肥大细胞的动态
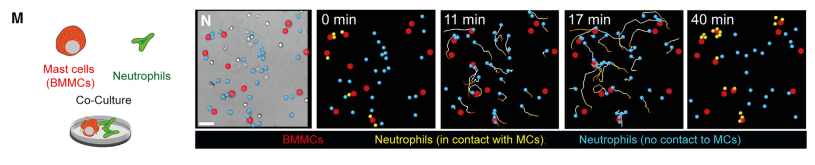
图M-N:小鼠骨髓来源MC与中性粒细胞共培养活细胞成像
2.脱颗粒的肥大细胞在细胞内捕获活的中性粒细胞
活体成像观察到,在诱导MC脱颗粒30min后大部分中性粒细胞远离MC,但少量活的中性粒细胞被MC捕获。下图B显示了被捕获的中性粒细胞。图C中,原位成像显示中性粒细胞整个被MC细胞膜覆盖,位于胞内的囊泡中。被捕获的中性粒细胞尚存活性,在MC中仍然是活动的。另外,一个MC可以同时捕获不止一个中性粒细胞(图E)。这种细胞相互作用被称为Cell in cell结构(CIC)。作者将观察到的这种CIC命名为“MC intracellular trap”——MIT。MIT现象可以在PCA和IRI-PCA模型中被重复观察到,发生的比例占MC总数的3-5%和7-12%。
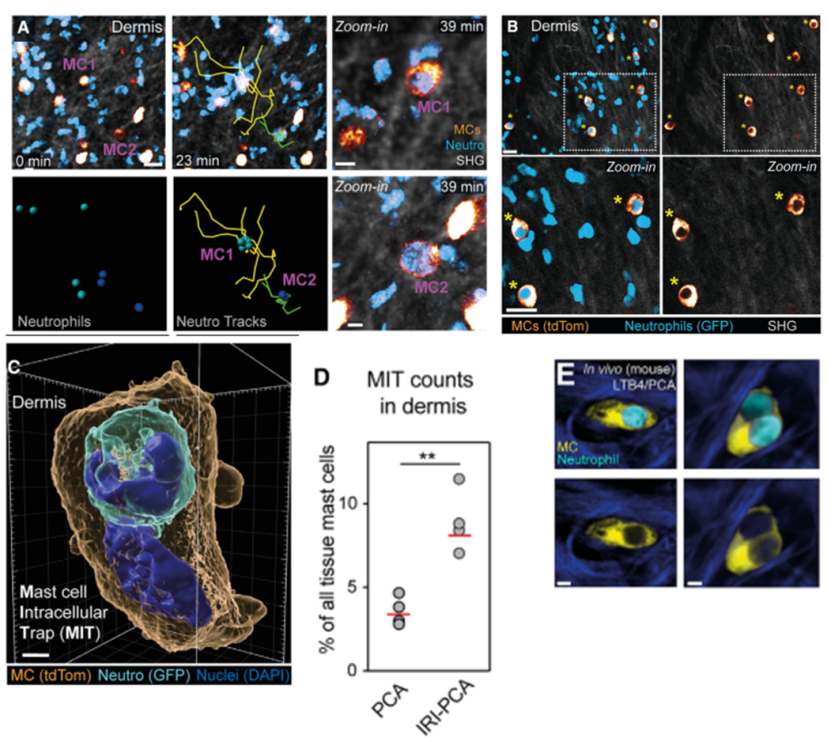
图A. IRI-PCA小鼠中,23min后中性粒细胞向脱颗粒的MC团聚,并被捕获;图B. 60min后MC和被捕获的活中性粒细胞;图C. 原位成像显示中性粒细胞完全被MC细胞膜覆盖,并位于胞内囊泡中;图D. MIT在PCA和IRI-PCA模型中发生的比例占MC总数的3-5%和7-12%;图E. 2个中性粒细胞被同一MC捕获。
为了观察人体中的情况,作者取了慢性荨麻疹患者皮肤组织进行免疫荧光共定位,用c-kit(受体酪氨酸激酶Ⅲ型)和MPO(髓过氧化物酶)检测MC和中性粒细胞,也发现被MC捕获的中性粒细胞。
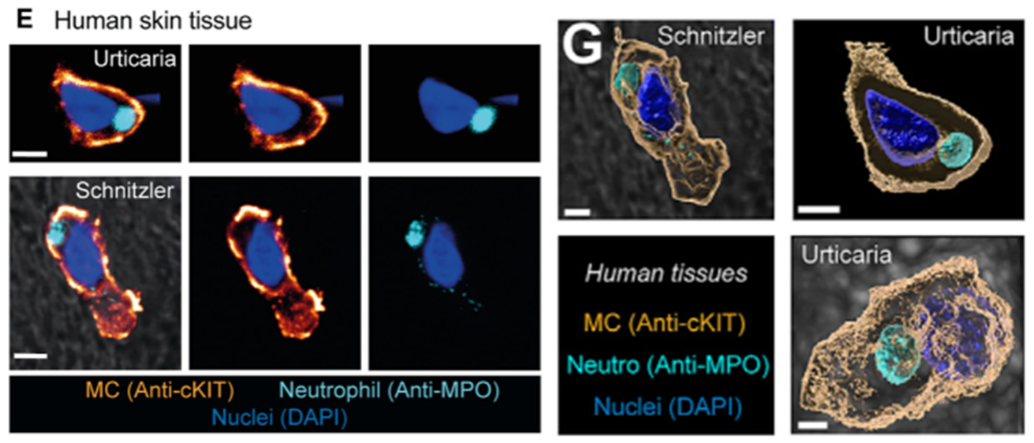
图E-G. 慢性荨麻疹患者皮肤免疫荧光显示中性粒细胞被MC捕获
接下来作者进行了体外实验验证,将小鼠腹膜来源的MC与中性粒细胞共培养,并诱导MC脱颗粒。同样也观察到了中性粒细胞向MC定向迁移,然后被捕获。共聚焦和透射鉴定观察到了MIT。多数MIT只捕获1个中性粒细胞,但也有同时捕获2、3、4个中性粒细胞。
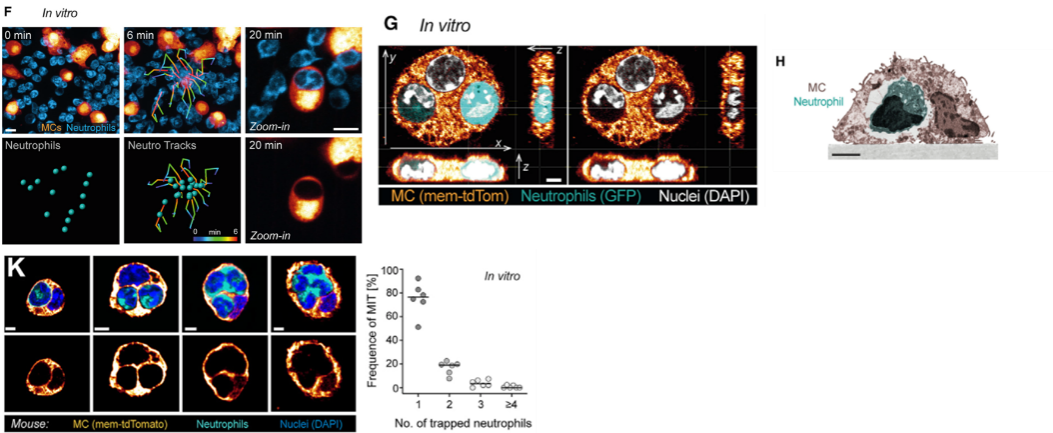
图F-H. 小鼠腹膜MC (PMC)与中性粒细胞的共培养显示IgE介导的PMC体外脱颗粒反应中MIT的形成;K. 多数MIT捕获1个中性粒细胞,少数可捕获2、3、4个中性粒细胞
作者还进行了人血来源的中性粒细胞和MC共培养,也观察到了MIT现象。
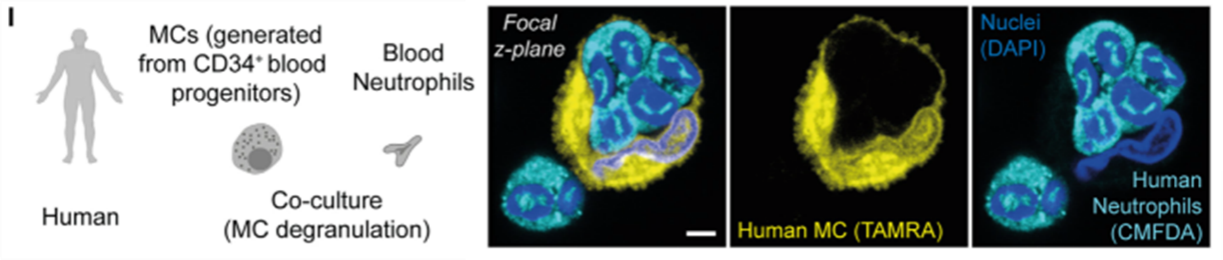
图I. 人血来源中性粒细胞和血来源/皮肤来源/结肠来源MC共培养,观察到MIT
作者用流式法对MIT进行了定量检测,发现8-15% MC形成MIT结构。用不同浓度的DNP-HAS刺激物MC不同程度的脱颗粒,发现MIT数量随脱颗粒程度增加而递增,没有脱颗粒的MC几乎不形成MIT。在PMC和骨髓来源MC(BMMC)体外实验中,因为PMC脱颗粒程度更强,所以PMC实验中MIC形成比例更高。在诱导48小时后,MIT依然存在。
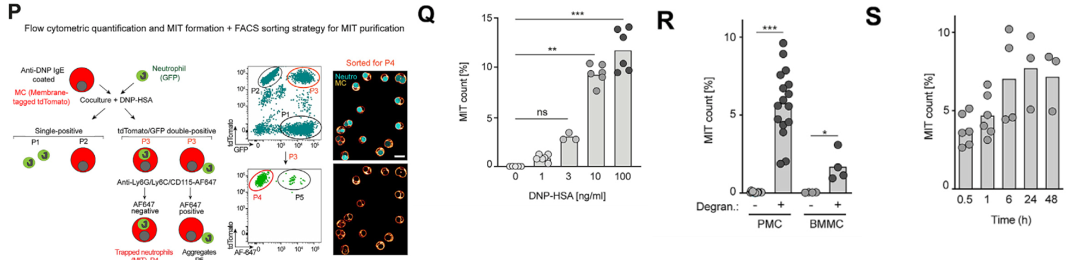
图P. 流式检测显示,MIT占MC总数的8-15%;图Q. MIT形成数量随MC脱颗粒程度增加而递增;图R. PMC中MIT形成数量多于BMMC(PMC脱颗粒更强);图S. 诱导脱颗粒48小时后,MIT依然存在
3.MIT的形成依赖其LTB4分泌、脱颗粒和中性粒细胞迁移
由于中性粒细胞的定向迁移和MIT的形成只发生在脱颗粒的MC中,接下来作者研究了MC颗粒释放在MIT形成中的作用。他们采用了一种Unc13d基因突变小鼠,这种小鼠的缺乏脱颗粒功能。用这种脱颗粒缺陷PMC与中性粒细胞共培养,发现MIT的形成减少了70%。但是中性粒细胞依然向PMC定向迁移(数据未显示),只是不能被吞噬。因此作者认为,MC对中性粒细胞的趋化作用是通过脱颗粒之外的介质。
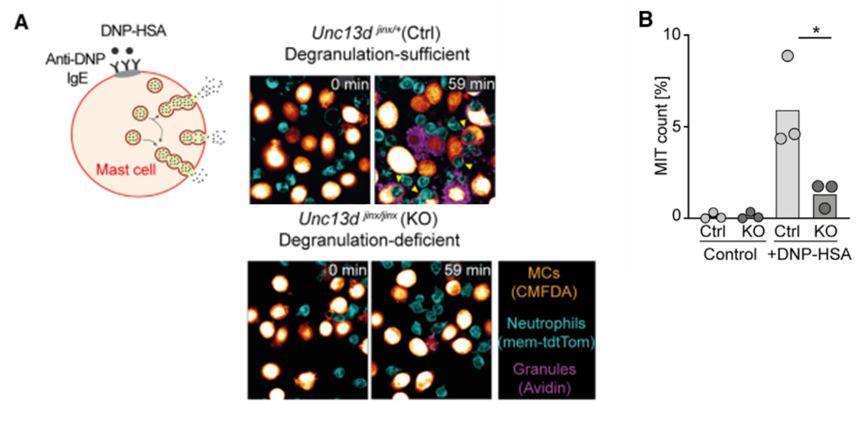
图A. 脱颗粒缺陷PMC(Unc13djinx/jinxKO)在被动过敏反应中仅释放极少颗粒;图B.脱颗粒缺陷的PMC与中性粒细胞共培养,MIT形成减少70%
他们注意到在共培养实验中,MIT形成需要在MC活化后几分钟内加入中性粒细胞,如果在30min或60min之后再加入中性粒细胞,MIT就不能形成。这提示促进MIT形成是MC活化后瞬时释放的某种因子。因此作者推测这种因子可能是LTB4,于是用MK886(5脂氧合酶激动蛋白抑制剂)阻断LTB4的合成,再做共培养。随后观察到中性粒细胞迁移距离被部分抑制,MIT形成完全被抑制。再用LTB4R1抑制剂(LY293111)处理中性粒细胞,抑制GPCR依赖的LTB4信号传导,也抑制了MIT的形成。用Alox5缺陷MC与野生型中性粒细胞共培养,则无法形成MIT。用LTB4R1缺陷中性粒细胞,也无法形成MIT。
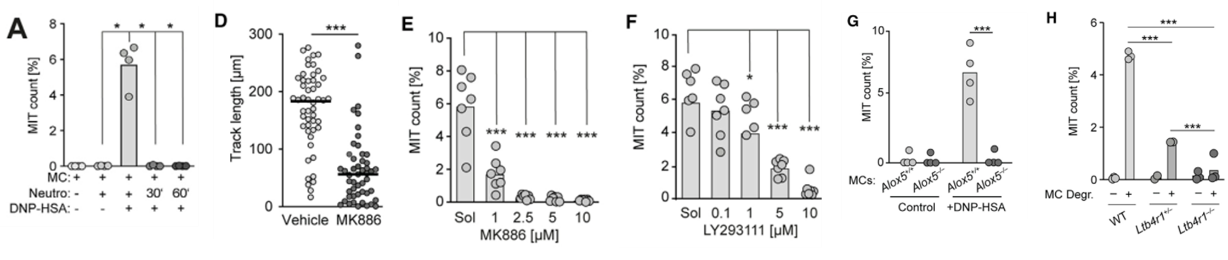
图A. MC活化后立即加入中性粒细胞,才能形成MIT; 图D-E. 中性粒细胞迁移距离和MIT形成与被MK886(LTB4合成抑制剂)抑制; 图F. MIT形成被LY293111(LTB4信号阻断剂)抑制; 图G. Alox5缺陷MC细胞(无法合成LTB4)与野生型中性粒细胞无法形成MIT; 图H. Ltb4r1缺陷中性粒细胞细胞(LTB4信号阻断)与野生型MC无法形成MIT
接下来他们研究了LTB4在体内的作用。在野生型和Alox5缺陷小鼠耳朵先用LTB4使中性粒细胞聚集。再诱导MC脱颗粒,发现在Alox5缺陷小鼠中MIT形成被显著抑制。此外,他们用活力降低的中性粒细胞进行实验,发现与正常中性粒细胞相比,MIT的形成也显著减少。说明中性粒细胞的主动迁移是MIT形成的因素之一,这一点与传统的细胞吞噬不同。
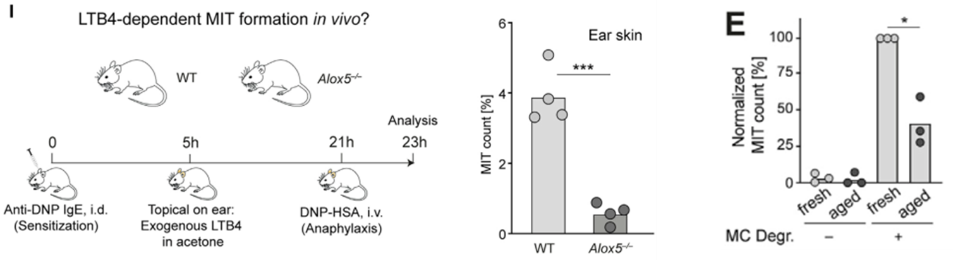
图I. Alox5缺陷小鼠中MIT形成被显著抑制; 图E. 中性粒细胞活力是MIT形成的影响因素
接下来,作者探究了其他LTB4相关的细胞,是否也会被MC捕获。发现MC也可以捕获嗜酸性粒细胞(Eosinophil,EOS),甚至可以同时捕获EOS和中性粒细胞,但不能捕获单核细胞和DC细胞。
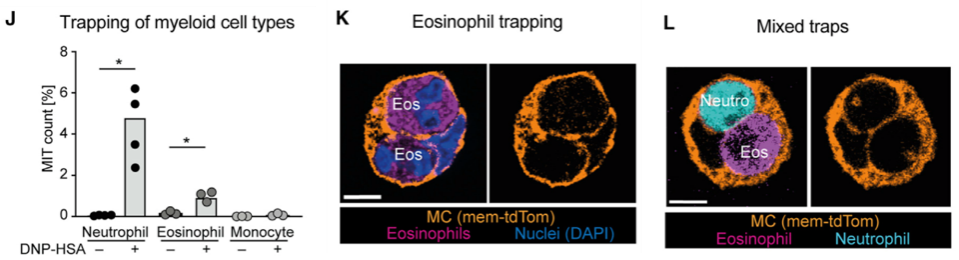
图J-L. MIT还可以捕获EOS,但不能捕获单核细胞(包括DC),可同时捕获两种细胞
4.捕获中性粒细胞依赖于沟通肥大细胞质膜和肌动蛋白皮层的通道结构
接下来,作者更仔细地研究了这一吞噬活动。他们发现IgE介导的脱颗粒使MC更软,并且降低了MC的弹性。有研究认为这是一种有利于其他细胞进入的机制。扫描电镜也显示吞噬中性粒细胞时,中性粒细胞被MC膜部分包裹,还显示中性粒细胞进入MC主要发生在脱颗粒的部位,进入脱颗粒的囊泡通道。
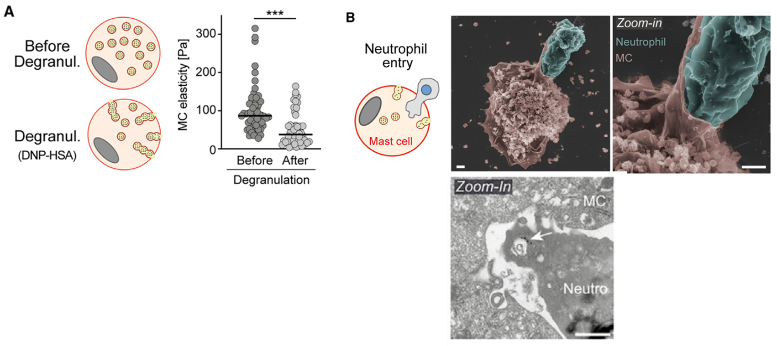
图A. 脱颗粒后MC弹力降低; 图B. 中性粒细胞从脱颗粒部位进入MC,被MC膜包裹
为了研究微观结构,作者用荧光标记MC胞膜和鼠源PMC,观察了中性粒细胞吞噬的步骤。发现中性粒细胞内吞有两种模式,Mode 1占多数。内吞完成后,中性粒细胞待在胞内囊泡中,但不影响MC正常形态。在这个囊泡中,还有组胺、类胰蛋白酶等活性物质,因此他们认为这个囊泡与其他颗粒是相通的。
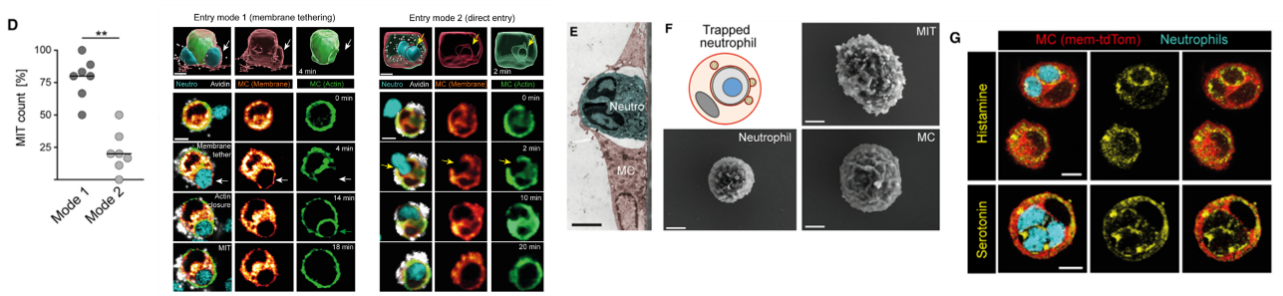
图D. 中性粒细胞内吞有两种方式,多数细胞通过Mode1完成内吞;图E-G. 中性粒细胞内吞后位于胞内囊泡中,该囊泡中也包含组胺等颗粒内容物
5.MC是MIT中的“胜者”
下面,作者研究了MIT形成后两种细胞的结局。首先,他们分选并培养了内吞了中性粒细胞的MC(标记为MIT)和没有内吞中性粒细胞的MC,发现大多数细胞都存活保持完整。被内吞的中性粒细胞在大约12h之后开始凋亡。图D-F显示了中性粒细胞随时间变化的过程。F图中,用磁珠标记中性粒细胞碎片结构,发现120h后中性粒细胞没有被完全消化,仍然保留在囊泡中。
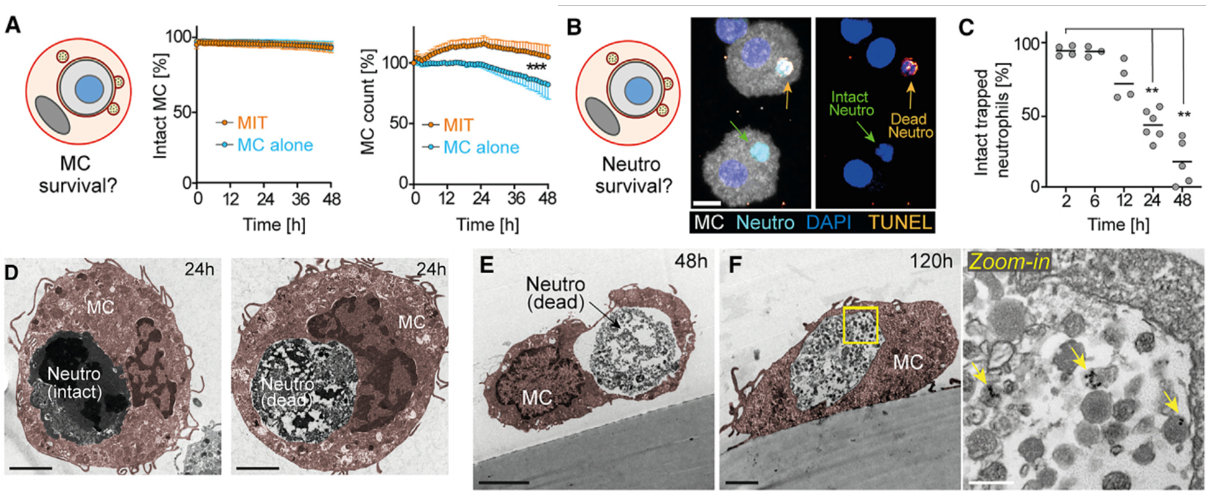
图A. 吞噬中性粒细胞后的MIT存活率和细胞完整性较好;图B-C. 被吞噬的中性粒细胞在12h后开始凋亡;图D-F. 被吞噬的中性粒细胞形态
接着,作者研究了MIT过程是否改变MC的基因表达。为了单独分离出MIC中MC的RNA,他们采用了一种基因鼠,小鼠核糖体带了红细胞凝集素(HA)标签,通过标签纯化出MC核糖体,对核糖体结合的mRNA进行测序。在脱颗粒12或24h后分别对MIT和普通MC核糖体mRNA进行测序,发现MIT上调的通路包括IgE信号通路、氧化磷酸化、蛋白翻译;下调的基因主要富集于代谢通路。
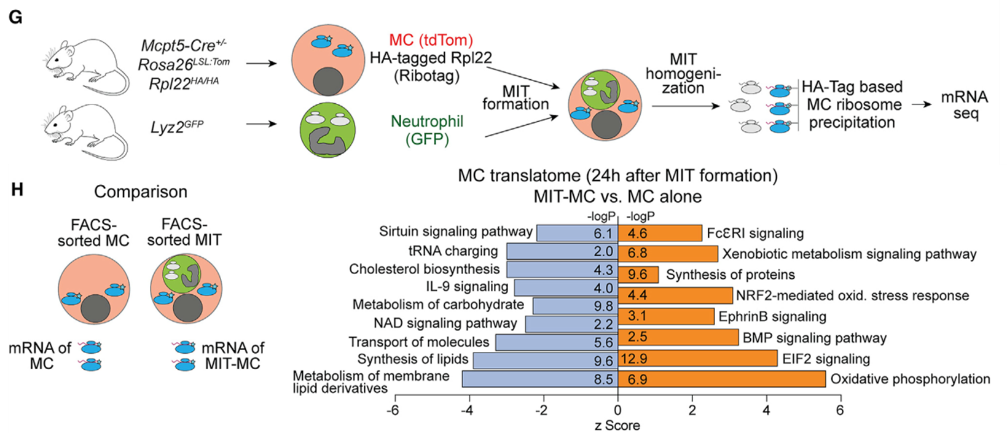
图G. 利用核糖体HA-tag纯化MIT中MC核糖体结合mRNA;图H. 比较MIT和普通MC转录组:FceRI通路、氧化磷酸化、蛋白翻译基因上调
6.MIT形成有利于肥大细胞功能和代谢的恢复
接下来,作者研究了吞噬中性粒细胞对MC功能恢复的影响,他们比较了脱颗粒24-48h后MIT与普通MC的脱颗粒能力、摄取外部脂肪酸的能力和线粒体代谢。在这两个时间点都发现,MIT重新脱颗粒的能力增强,外部脂肪酸摄取减少,线粒体呼吸功能增强。这提示与普通MC相比,MIT的功能恢复更好。
为了探究哪些代谢物增强了线粒体呼吸功能,作者对三羧酸循环进行了干预。他们采用了一个脂转移功能缺陷小鼠,小鼠细胞无法将脂肪酸转移到线粒体。用小鼠的PMC内吞中性粒细胞,制备了MIT,这时,MIT的线粒体呼吸功能未增强。在野生型MIT中,用两种抑制剂分别抑制线粒体丙酮酸和谷氨酰胺通路,线粒体功能也没有恢复(数据未显示)。这些实验说明,MIT是通过多种代谢途径维持线粒体呼吸功能。由于MIT自身代谢通路表达下调,并且对外摄取降低,因此作者认为这些代谢物可能是由中性粒细胞碎片提供的。
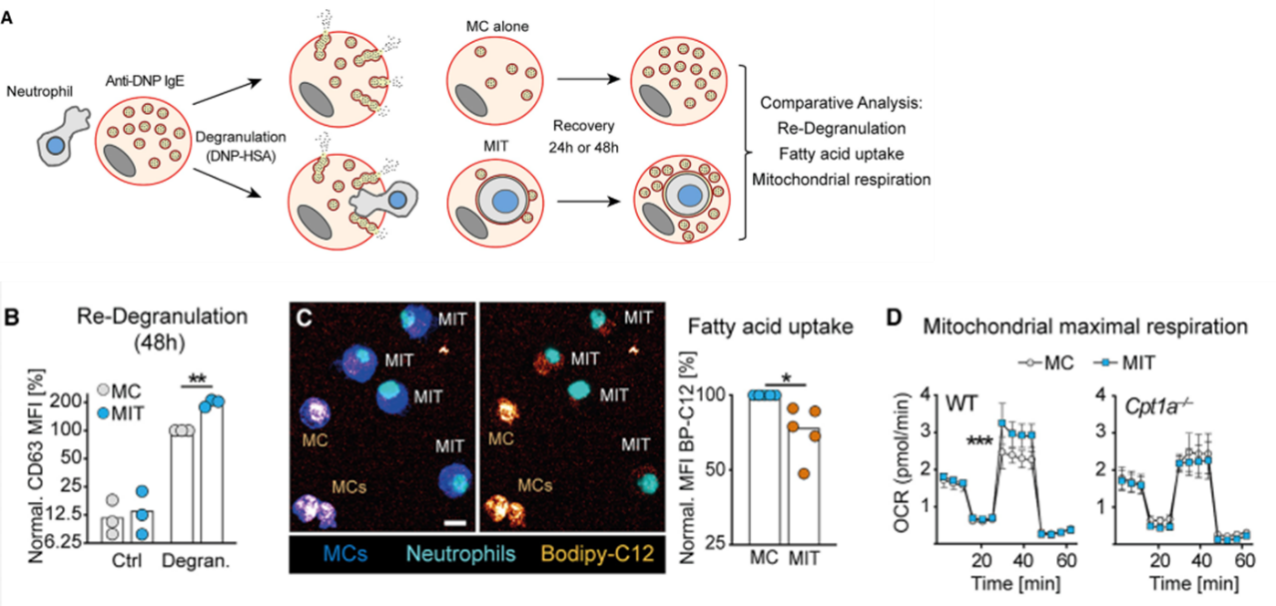
图A. 脱颗粒后24-48h,MIT和普通MC功能对比;图B. 24h和48h MIT的重新脱颗粒能力均高于MC;图C. MIT对外部脂肪酸的摄取较少;图D. 野生型MIT线粒体呼吸功能更强;Cpt1a缺陷MIT呼吸功能未增强
接下来,作者进行营养限制实验,发现野生型MC存活率显著降低,但野生型MIT存活时间相对更长。但用脂转移缺陷PMC时,MIT和MC的存活率同步降低,说明MIT的存活依赖于脂质转运到线粒体。在营养限制状态下,野生型MIT的重新脱颗粒的能力也高于普通MC。此外,在营养限制后4h和24h,实验组MIT囊泡中pH值显著降低。营养限制下,MIT内的中性粒细胞凋亡速率增加。
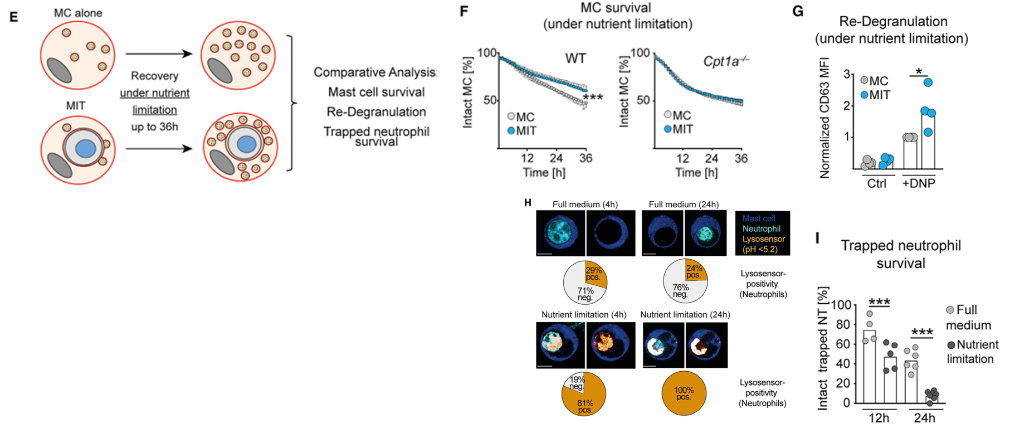
图E. 对培养基进行营养限制研究中性粒细胞是否为MIT提供养分;图F. 营养限制下,野生型MIT存活率高于MC,脂转移缺陷MIT与MC无差异;图G. 营养限制下,野生MIT重新活化脱颗粒能力更强;图H. 营养限制后4h和24h,MIT囊泡pH值降低;图I. 营养限制下,MIT内的中性粒细胞凋亡速率更快
7.MIT获得促炎特性并释放中性粒细胞残余物质
作者探究了在获得中性粒细胞养分几天后,MC在重新诱导脱颗粒中的促炎功能。他们制备MIT后培养了3天,然后重新诱导脱颗粒,检测了炎症活性因子LTB4、PGE1和PGD2水平,MIT分泌比普通MC显著增高,说明MIT的促炎效应更强。
随后他们跟踪了MIT内中性粒细胞碎片的结局,发现在内吞发生几天后,这些碎片都没有被完全消化,仍然能检测到中性粒细胞的DNA和蛋白。在第二次活化脱颗粒后,MIT从囊泡排出了中性粒细胞残留物质。
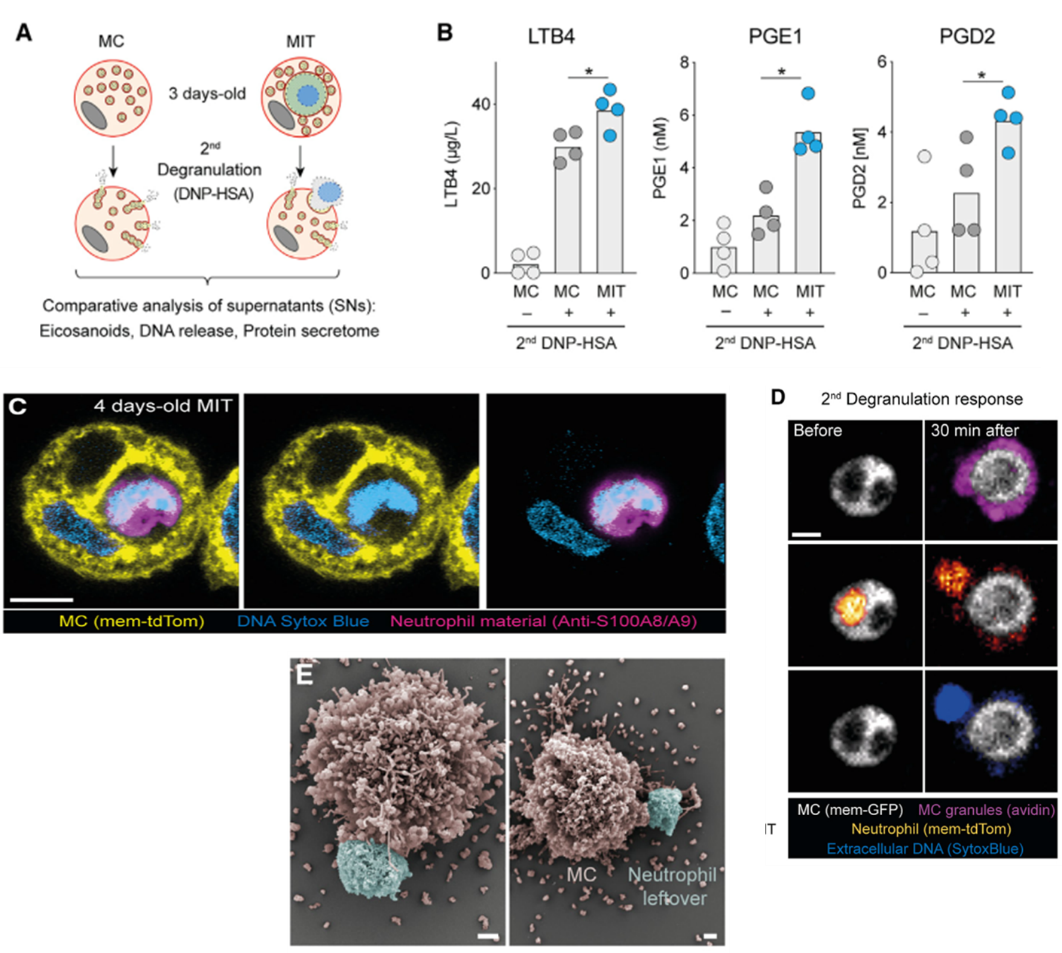
图A. MIT在再活化中释放的促炎因子水平更高;图B. MIT在再活化中炎症活性因子LTB4、PGE1和PGD2的分泌更高;图C. MIT形成4天后,囊泡内可见中性粒细胞 DNA和蛋白;图D-E. 再活化后,MIT排出中性粒细胞残余物
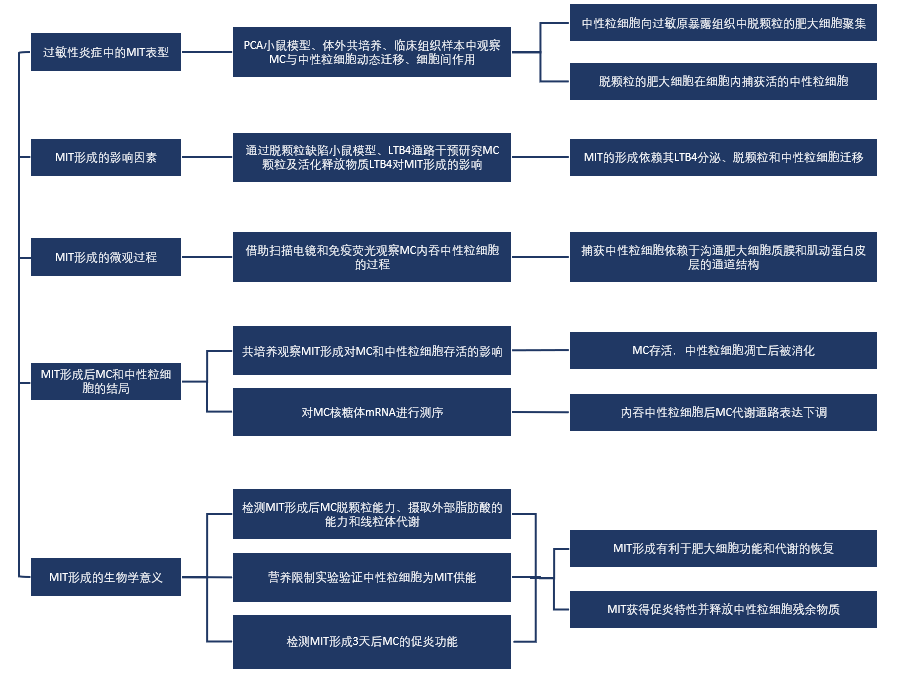
文章思路总结:
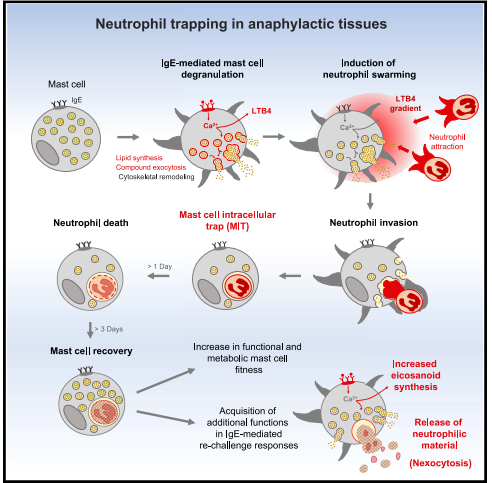
本研究描绘了过敏性炎症中MC和中性粒细胞的相互作用:
1.作者通过动物模型、体外细胞实验、临床样本中反复观察到在过敏反应中,IgE介导的MC脱颗粒可以趋化中性粒细胞,使其与MC接触,随后MC将其内吞(MIT)。
2.作者接着研究了MIT形成的影响因素,验证了MC脱颗粒是MIT形成的关键因素,但MC对中性粒细胞的趋化作用依赖于脱颗粒之外的因素;通过对LTB4通路进行干预,发现LTB4是中性粒细胞趋化的关键影响因素;并且发现中性粒细胞的活力和主动迁移是MIT形成的条件之一。
3.随后作者观察了MC内吞中性粒细胞的微观过程,揭示了中性粒细胞被内吞后存在于沟通肥大细胞质膜和肌动蛋白皮层的囊泡结构,该结构与其他颗粒囊泡相通。
4.接下来,作者研究了MIT形成后两种细胞的结局,通过检测细胞完整性、凋亡等发现MIT形成后中性粒细胞凋亡,被消化;MIT存活,但代谢通路转录水平下调。
5.随后,作者通过检测脱颗粒能力、脂肪酸摄取和线粒体代谢,发现MIT功能恢复优于普通MC;并通过代谢干预实验和营养限制实验,发现MC通过酸化囊泡、消化中性粒细胞来恢复自身功能。
6.最后,作者通过比较MIT和MC在重新活化使释放炎症因子的水平,验证了MIT促炎效应强于普通MC;并且在重新活化后,MIT排出中性粒细胞残余物质。
综上所述,本文描述了过敏性炎症中MC与中性粒细胞交互作用(MIT)的过程,并阐释了影响MIT形成的因素和MIT对MC的作用。
思维导图

汇报人:蒋子涵
导师:刘世喜教授
审核:张宇阳、张子妍、任建君



