精读分享│【Advanced Science】:BHLHE40通过上调SREBF1来抑制胰腺癌细胞的铁死亡
英文题目:BHLHE40 Inhibits Ferroptosis in Pancreatic Cancer Cells via Upregulating SREBF1
中文题目:BHLHE40通过上调SREBF1来抑制胰腺癌细胞的铁死亡
期刊:Advanced Science(IF:14.3)
单位:
1.上海交通大学医学院瑞金医院胰腺疾病中心普外科;
2.上海交通大学医学院胰腺疾病研究所,上海市胰腺肿瘤转化研究重点实验室;
3.上海交通大学转化医学研究所肿瘤基因及相关基因国家重点实验室;
4.上海交通大学转化医学研究所;
5.上海市胰腺肿瘤转化医学重点实验室;
发表时间:2024年02月

Abstract:
Pancreatic cancer (PCa) is one of the most fatal human malignancies. The enhanced infiltration of stromal tissue into the PCa tumor microenvironment limits the identification of key tumor-specific transcription factors and epigenomic abnormalities in malignant epithelial cells. Integrated transcriptome and epigenetic multiomics analyses of the paired PCa organoids indicate that the basic helix-loop-helix transcription factor 40 (BHLHE40) is significantly upregulated in tumor samples. Increased chromatin accessibility at the promoter region and enhanced mTOR pathway activity contribute to the elevated expression of BHLHE40. Integrated analysis of chromatin immunoprecipitation-seq, RNA-seq, and high-throughput chromosome conformation capture data, together with chromosome conformation capture assays, indicate that BHLHE40 not only regulates sterol regulatory element-binding factor 1 (SREBF1) transcription as a classic transcription factor but also links the enhancer and promoter regions of SREBF1. It is found that the BHLHE40-SREBF1-stearoyl-CoA desaturase axis protects PCa cells from ferroptosis, resulting in the reduced accumulation of lipid peroxidation. Moreover, fatostatin, an SREBF1 inhibitor, significantly suppresses the growth of PCa tumors with high expressions of BHLHE40. This study highlights the important roles of BHLHE40-mediated lipid peroxidation in inducing ferroptosis in PCa cells and provides a novel mechanism underlying SREBF1 overexpression in PCa.
摘要:
胰腺癌(PCa)是人类最致命的恶性肿瘤之一。基质组织向胰腺癌肿瘤微环境的浸润限制了对恶性上皮细胞中关键肿瘤特异性转录因子和表观基因组异常的识别。对配对胰腺癌类器官的综合转录组和表观遗传多组学分析表明,肿瘤样本中碱性螺旋-环-螺旋转录因子40(BHLHE40)显著上调。启动子区域染色质可及性增加和mTOR通路活性增强促进了BHLHE40的表达上调。结合染色质免疫沉淀测序(ChIP-seq)、RNA测序(RNA-seq)以及染色体构象捕获实验的综合分析表明,BHLHE40不仅作为经典转录因子调控固醇调节元件结合因子1(SREBF1)的转录,还能连接SREBF1的增强子和启动子区域。研究发现,BHLHE40-SREBF1-硬脂酰辅酶A去饱和酶轴可保护胰腺癌细胞免受铁死亡,并导致脂质过氧化物的积累减少。此外,SREBF1抑制剂(fatostatin)显著抑制了高表达BHLHE40的胰腺癌肿瘤的生长。因此,本研究强调了BHLHE40介导的脂质过氧化在诱导胰腺癌细胞铁死亡中的重要作用,并揭示了胰腺癌中SREBF1过表达的新机制。
研究思路与方法:
主要结果:
1.在胰腺癌(Pancreatic cancer -PCa)患者来源的类器官中,BHLHE40位点的染色质开放度增加。
为了探索PCa发生中的表观基因组异常,研究者使用ATAC-seq和CUT&Tag H3K27ac修饰分析对两对肿瘤(PTO1和PTO2)及其相应肿瘤旁(PNO1和PNO2)组织类器官进行了测序(图1A)。将ATAC-seq分析得出染色质开放程度上升的基因与H3K27ac增强的结合基因,与mRNA表达量升高的转录因子联合进行基因筛选,最终筛选出BHLHE40基因,并进行后续研究。结果显示,与PNOs相比,H3K27ac富集于PCa类器官的BHLHE40启动子区(图1B)。已知EP300/CPB复合物是染色质中H3K27ac修饰的主要调节因子,进一步根据TCGA-PAAD和GTEx的数据显示,BHLHE40的mRNA水平与EP300的水平呈显著正相关。EP300的沉默或抑制(利用C646为抑制剂)降低了PANC-1和BxPC-3细胞系中BHLHE40的H3K27ac修饰水平(图1C)。因此得出结论:EP300介导的H3K27ac修饰参与了BHLHE40的上调。
据文献报道,BHLHE40在肝细胞中的表达可以被mTOR信号通路的抑制剂(雷帕霉素)所抑制,研究者们随后研究了mTOR信号通路对BHLHE40表达的影响。结果显示BHLHE40表达量较高的临床样本或PCa细胞的雷帕霉素半抑制浓度值较低,这表明这些样本更容易受到雷帕霉素的影响(图1D),同时雷帕霉素降低了PANC-1和BxPC-3细胞中BHLHE40的表达水平(图1E)。另外先前的研究表明,mTOR可以激活EP300来诱导脂肪生成。为了证实mTOR-EP300轴在BHLHE40表达中的调控作用,我们进一步证实了雷帕霉素处理显著降低了PANC-1和BxPC- 3细胞中EP300的激活(图1F)。此外,EP300、磷酸化的mTOR和BHLHE40的蛋白表达在PCa细胞系中呈正相关。PCa临床样本的IHC染色显示,BHLHE40在肿瘤样本中的表达水平高于肿瘤旁组织(图1G、H)且与预后不良相关(图1J)。综上所述,启动子区域染色质可及性的增加和mTOR通路活性的增强导致BHLHE40基因的表达升高,且与患者预后不良相关。
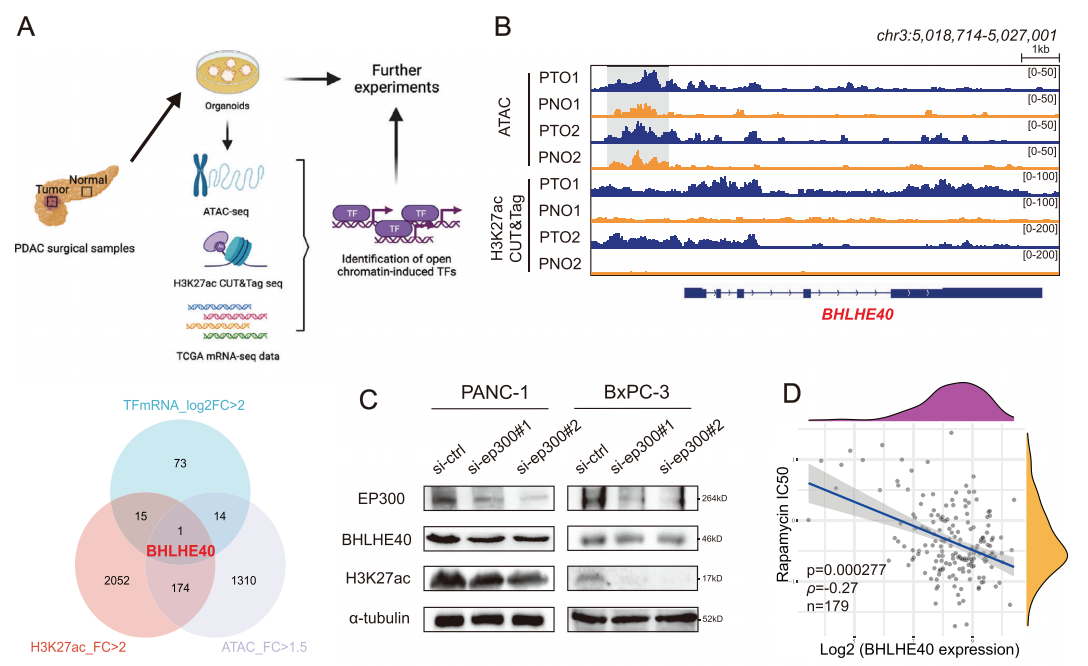
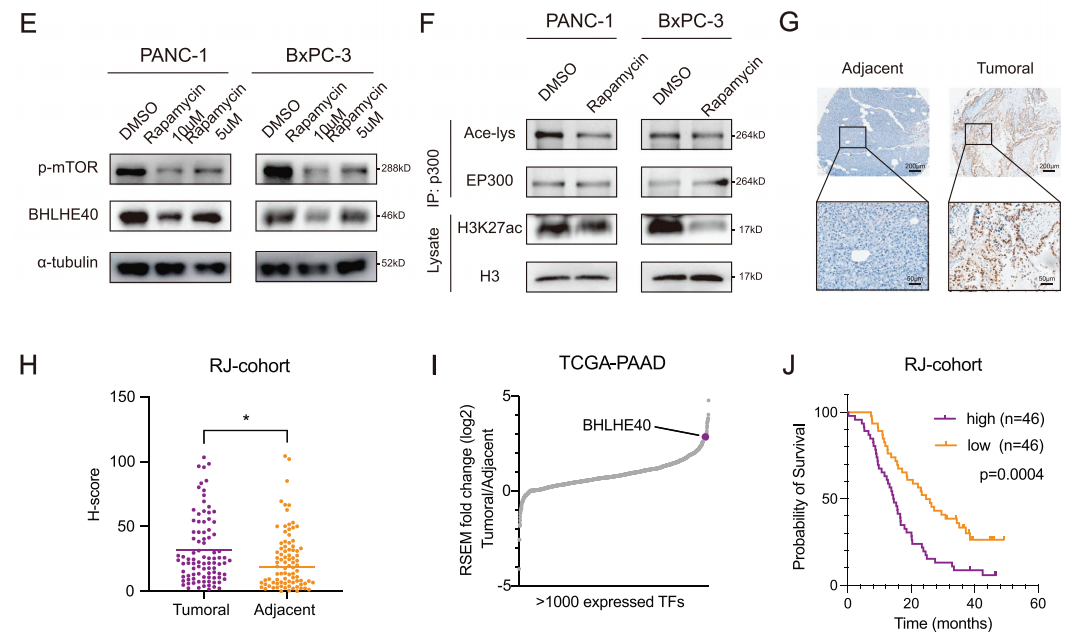
图1
2.敲除BHLHE40可抑制胰腺癌的肿瘤发生和转移
为了探讨BHLHE40在PCa中的作用,研究者们在两种胰腺癌细胞系(PANC-1和BxPC-3)中对BHLHE40进行了敲除。敲除后,细胞系的增殖和迁移能力受到抑制;将细胞系植入小鼠体内发现其与对照组相比,肿瘤大小及转移情况都有所减少。同样在病人来源的类器官中敲除BHLHE40和在MIA PaCa-2胰腺癌细胞系中过表达BHLHE40,都得到了一致的结果。(图2)
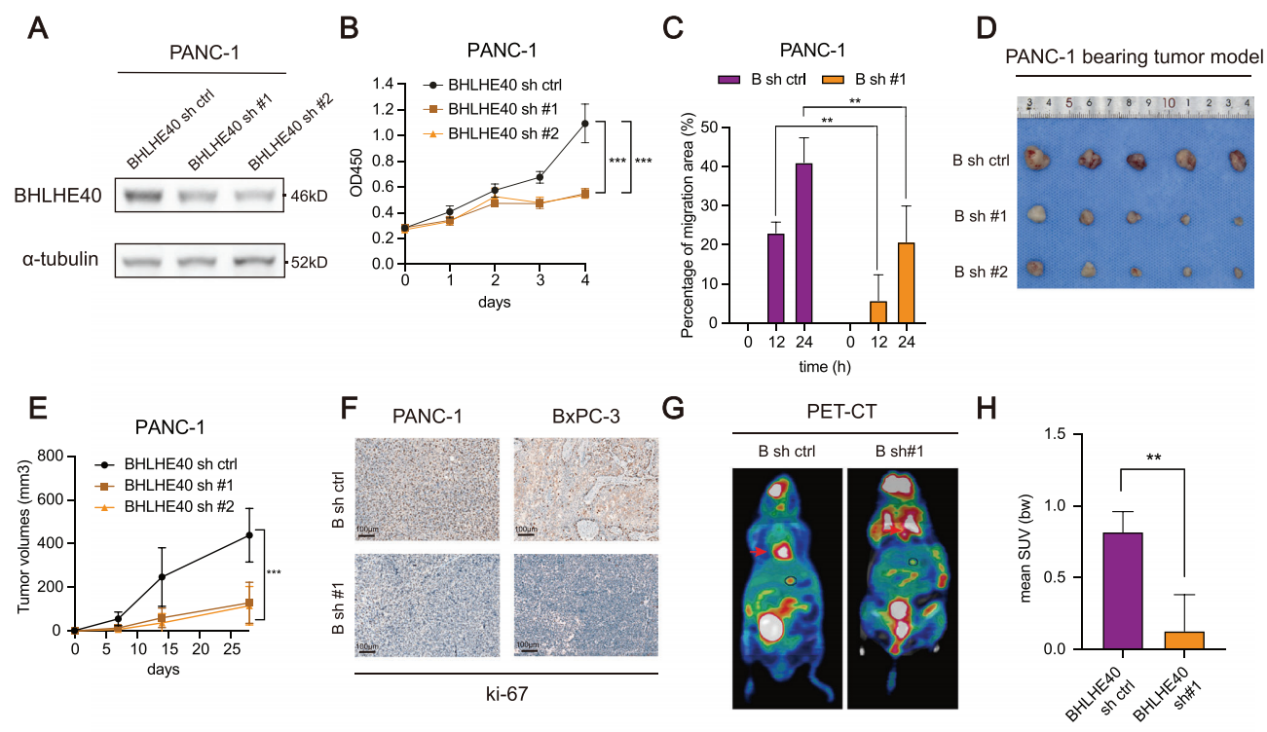
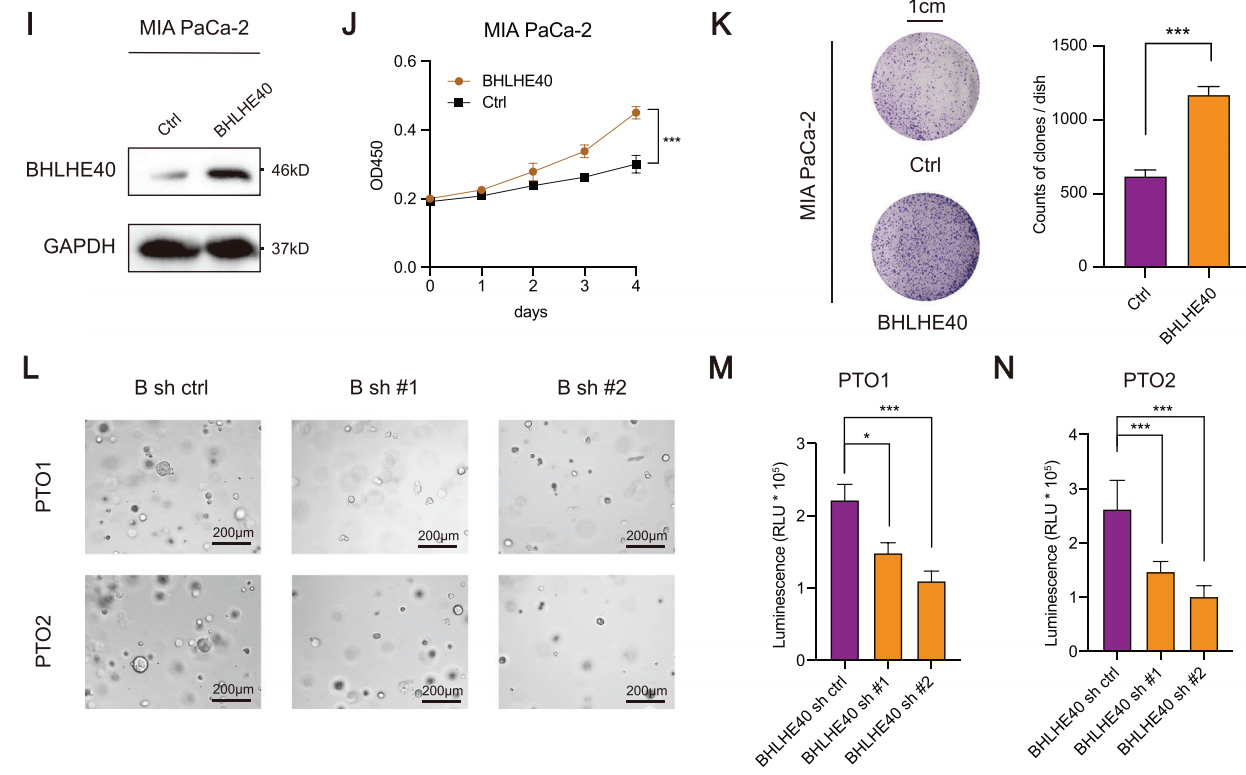
图2
3.BHLHE40通过SREBF1调控PCa中脂肪酸代谢
为了进一步研究BHLHE40在PCa进展中的潜在作用机制,研究者对BHLHE40沉默的PCa细胞系进行了转录组分析。差异基因在脂肪酸代谢的生物过程中存在显著富集(图3A-B)。对BHLHE40的ChIP-seq分析表明,BHLHE40主要与基因启动子和基因间区域结合,提示它可能在靶基因的转录调控中发挥多种作用(图3C)。在其中,SREBF1作为调节参与脂肪酸合成的关键因子,被选择进行后续验证。BHLHE40ChIP-seq(图3D)、荧光素酶报告基因分析(图3E)及对H3K4me3的ChIP-qPCR分析(图3F)表明,BHLHE40能与SREBF1的启动子区域结合,并使其激活。
与其他癌症类型类似,PCa表现出SREBF1的上调(图3G)。且较高的SREBF1表达与总生存率降低相关(图3H)。与预期的一样,在PCa细胞和类器官中进行BHLHE40沉默能降低了SREBF1及其下游靶点的表达。在功能上,SREBF1沉默减弱了PCa细胞的增殖能力。在BHLHE40沉默的细胞中过表达SREBF1恢复了PANC-1和BxPC-3细胞的活力。免疫荧光(IF)检测显示,BHLHE40与SREBF1在从PTO1细胞衍生的恶性导管细胞中共定位(图3K)。综上所述,BHLHE40调控了PCa中脂肪酸代谢的关键因子SREBF1的转录。
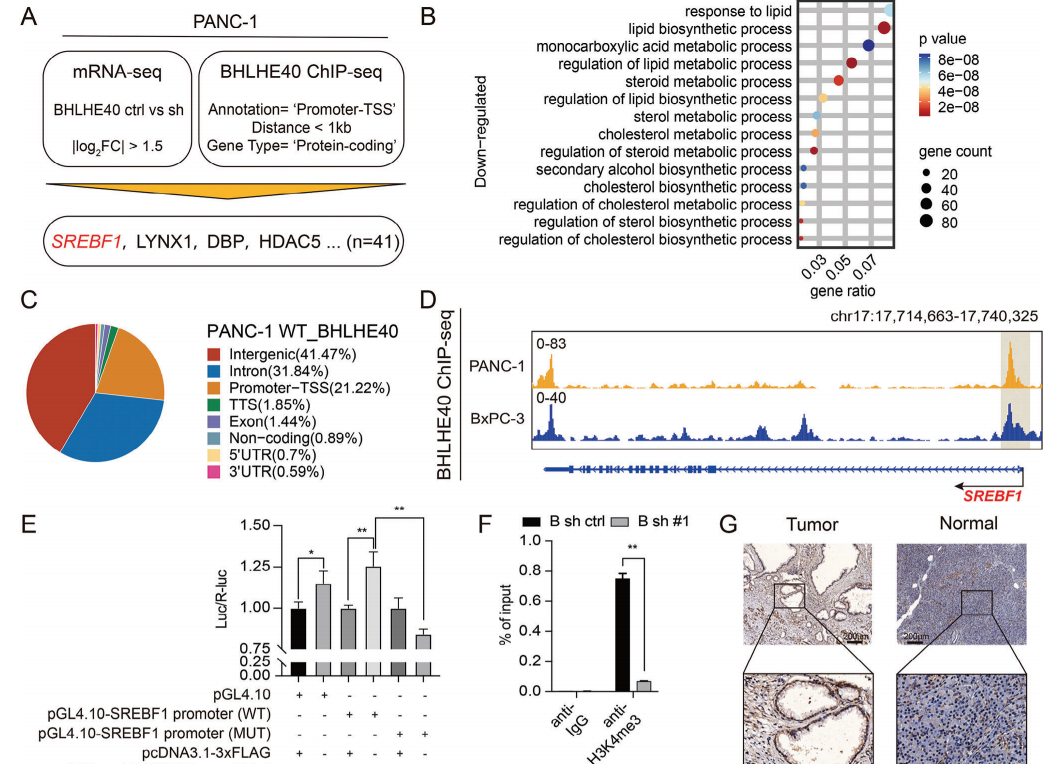
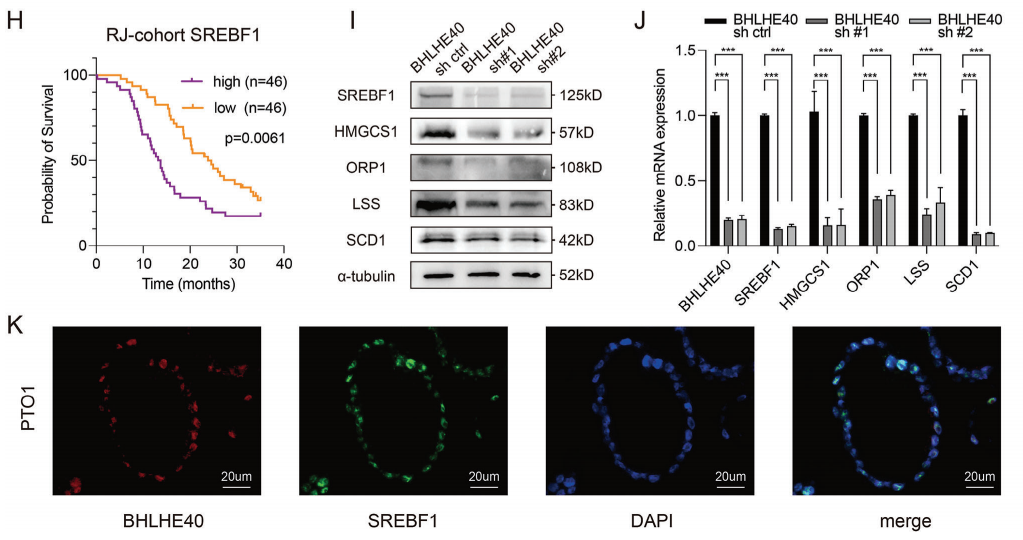
图3
4.相分离的BHLHE40凝聚物促进了SREBF1位点的增强子和启动子区域的连接
对PANC-1细胞的Hi-C测序数据进行分析发现SREBF1的启动子和潜在增强子区域之间有一个染色体内环;然而,这个环在永久的正常胰腺上皮细胞系(HPNE)中并不明显(图4A)。考虑到BHLHE40结合在SREBF1位点的上游,因此研究者们进一步研究了BHLHE40是否有助于SREBF1的染色体内环的形成。值得注意的是,在BHLHE40沉默后没有检测到这个染色质环(图4B),这表明它是由BHLHE40介导的。此外,BHLHE40沉默降低了基因组水平上的H3K27ac修饰,特别是在SREBF1位点的上游,从而进一步证实了BHLHE40对SREBF1转录的调控(图4C)。接下来研究者们试图探索经典的超增强子形成相关的共激活子,如含溴域4(BRD4)、中介复合物亚基1(MED1)和RNA聚合酶II(Pol II),是否有助于BHLHE40介导的增强子-启动子环的形成。免疫共沉淀(Co-IP)证实了BHLHE40与BRD4、MED1和Pol II的相互作用(图4E)。ChIP-qPCR还表明,这些共激活子以BHLHE40依赖的方式与SREBF1的启动子和增强子区域结合(图4F)。
自然无序区域(PONDRs)评分的预测结果显示,BHLHE40含有较大的IDRs(177-319个氨基酸片段)。由于IDRs能够形成相分离液滴,研究者们探讨了BHLHE40及其IDRs是否可以形成相分离凝聚物。液滴形成实验表明由mEGFP-BHLHE40或mEGFP-BHLHE40(177-319aa)形成的液滴能够逐渐融合,形成更大、更亮的液滴。相比之下,BHLHE40(Δ177-319aa)没有形成液滴。因此,可以得出结论:相分离的BHLHE40缩合物促进了SREBF1位点的增强子和启动子区域的连接,从而促进了SREBF1的转录(图5)。
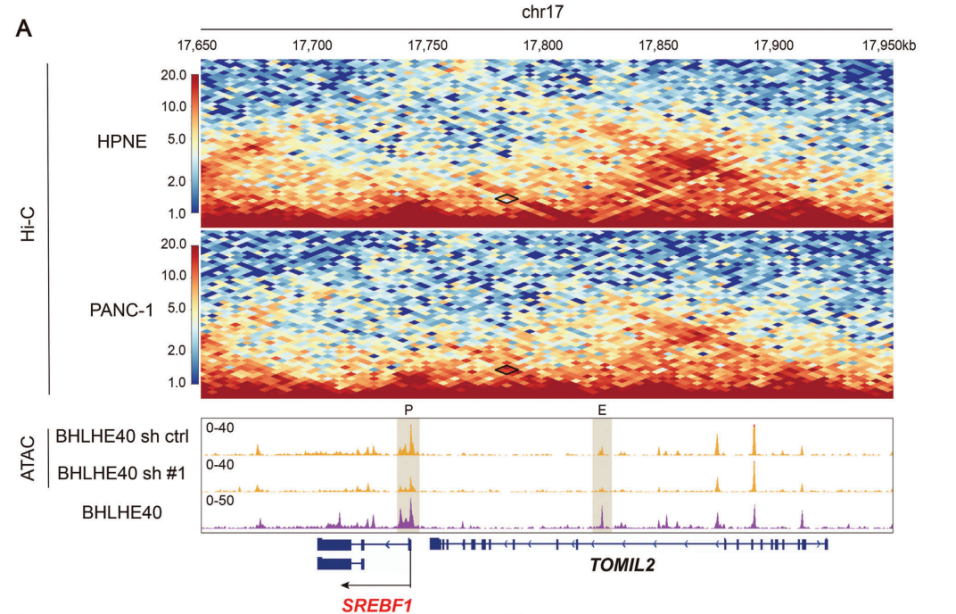
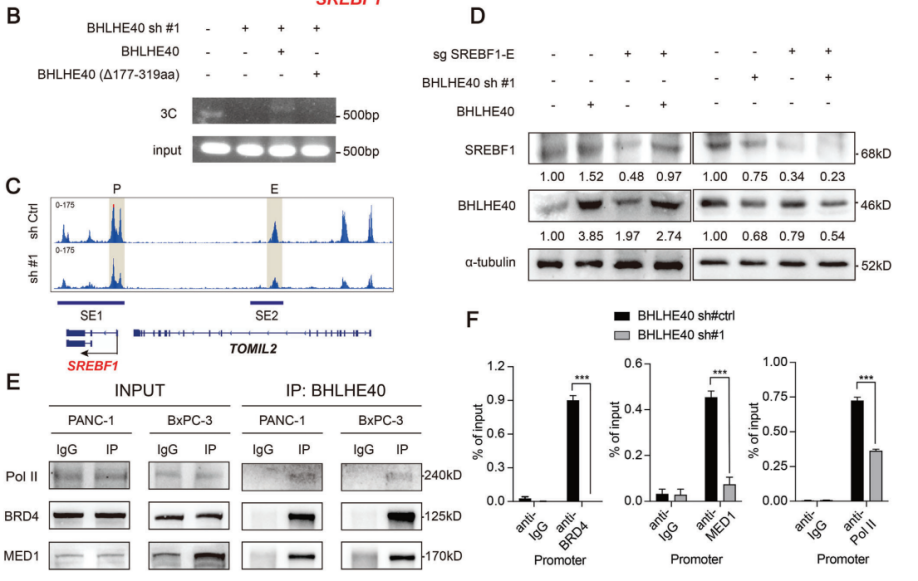
图4
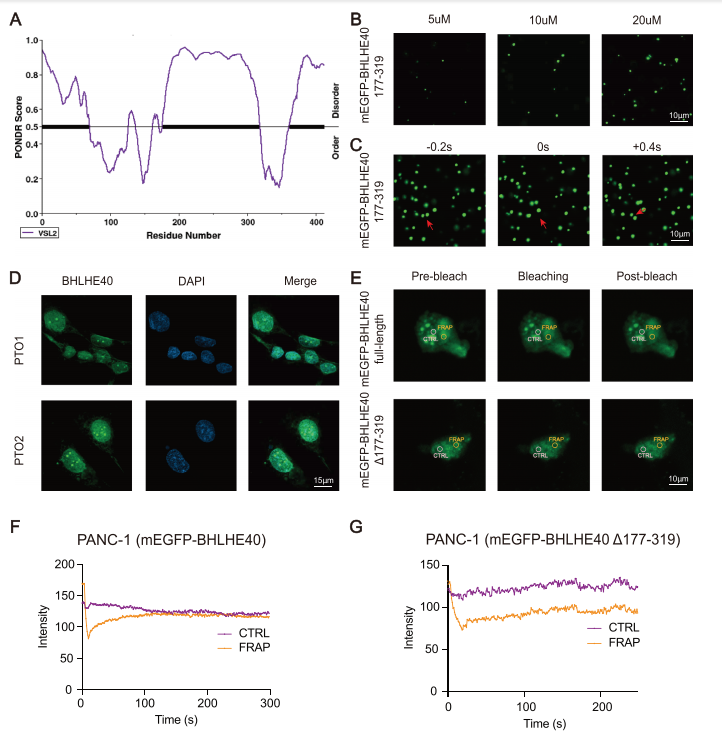
图5
5.BHLHE40诱导的SREBF1上调可通过SCD1保护PCa细胞免于铁死亡
由于BHLHE40和SREBF1参与了PCa中脂肪酸代谢的失调(图3B,C),因此研究者们探讨了BHLHE40通过SREBF1在过氧化过程中发挥的作用。在流式细胞术检测中使用BODIPY 581/591 C11探针检测氧化的脂质,发现BHLHE40敲低增加了脂质过氧化。在BHLHE40基因敲低的细胞中,丙二醛(MDA)的水平也有所升高。此外,BHLHE40或SREBF1基因敲低的细胞表现出线粒体萎缩和脂滴增加,类似于ras选择性致死-3(RSL3)诱导的铁依赖性氧化细胞死亡。铁死亡抑制剂部分消除了增强的脂质过氧化,并恢复了BHLHE40降低的细胞活力。此外,SREBF1沉默促进了PCa细胞的铁下垂。为了研究BHLHE40是否需要SREBF1来抑制铁死亡,在BHLHE40敲低的PCa细胞中过表达了SREBF1。SREBF1过表达缓解了BHLHE40敲低诱导的脂质过氧化,并恢复了细胞活力。SCD1改变了脂质膜组成,减少了脂质过氧化,诱导了铁死亡,是SREBF1的下游靶点。在PCa临床样本中,BHLHE40的表达水平与SREBF1和SCD1的表达水平呈现正相关。因此,BHLHE40主要通过上调SREBF1的表达来保护PCa细胞免受铁垂病的影响(图6)。
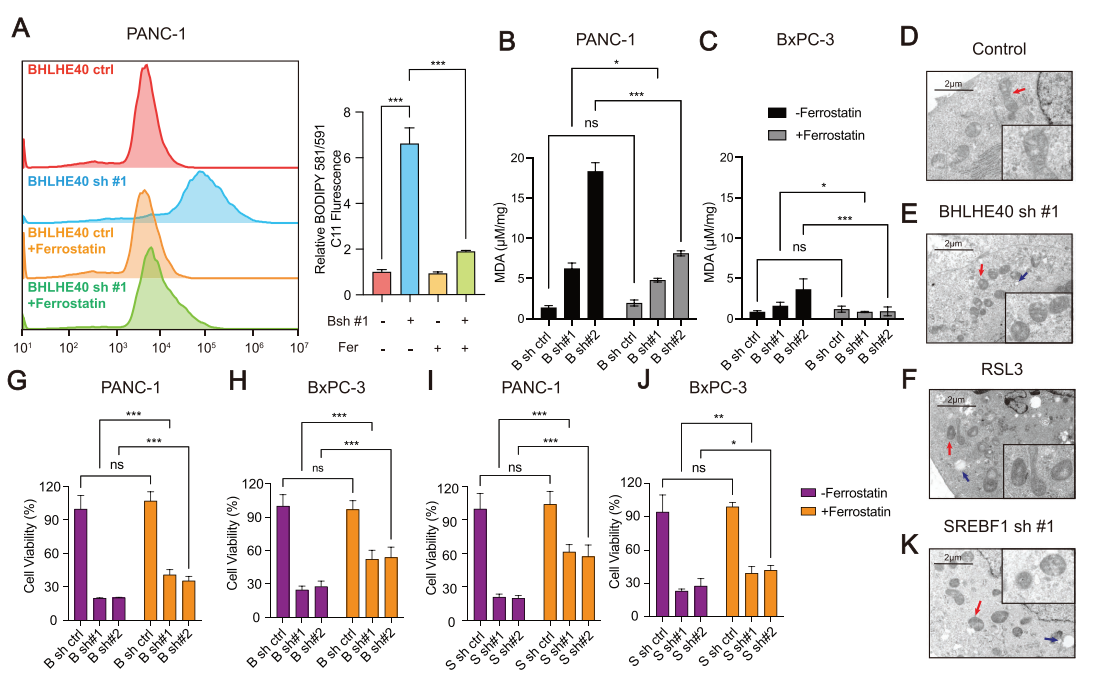
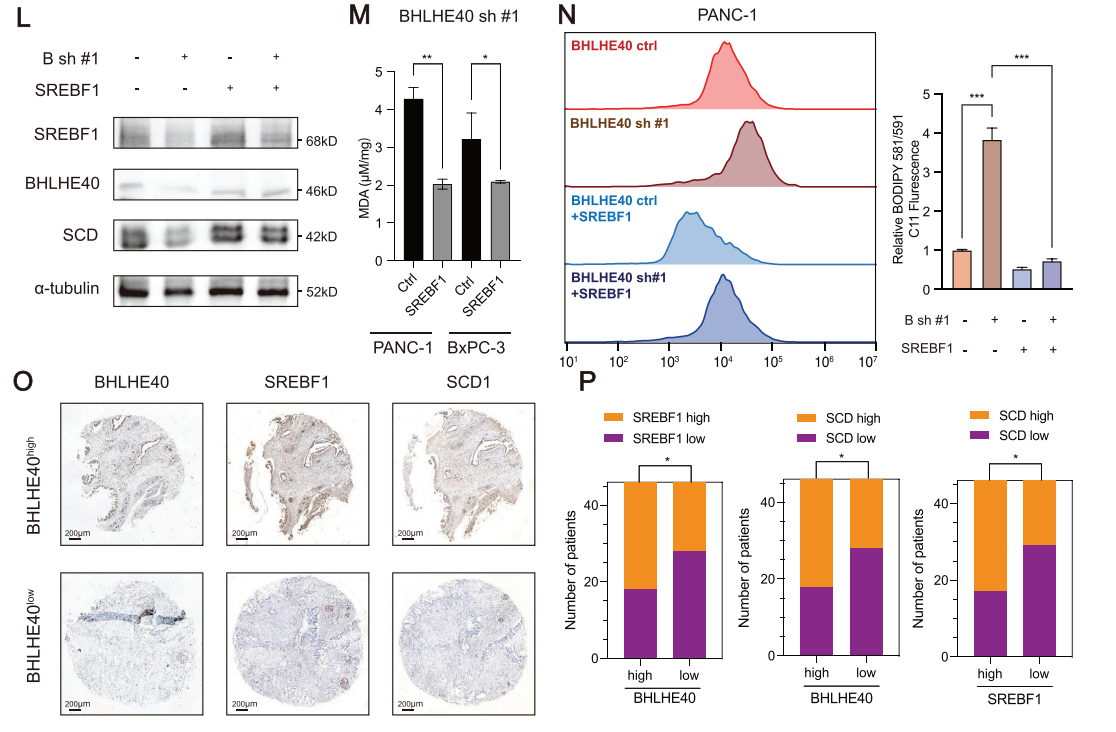
图6
6.SREBF1抑制剂(脂肪抑素)对BHLHE40高表达的PCa具有显著的抗肿瘤疗效
脂肪抑素处理显著降低PANC-1的细胞活力,且呈剂量依赖性,但抑素处理后MIA PaCa-2细胞活力无显著差异,可能是由于MIA PaCa-2细胞中BHLHE40的低表达所致(图7A)。在患者来源的类器官模型(图7B,C)和KPC小鼠细胞系的体内胰腺肿瘤原位模型(图7D-H)中也观察到了类似的结果。此外,IHC染色显示,高表达BHLHE40表达的KPC肿瘤细胞与低表达BHLHE40的细胞诱导的原位肿瘤相比,Ki-67的表达水平明显降低(图7I)。因此,这些数据表明,SREBF1抑制剂对PCa具有显著的抗肿瘤作用,而该作用依赖于BHLHE40的表达水平。
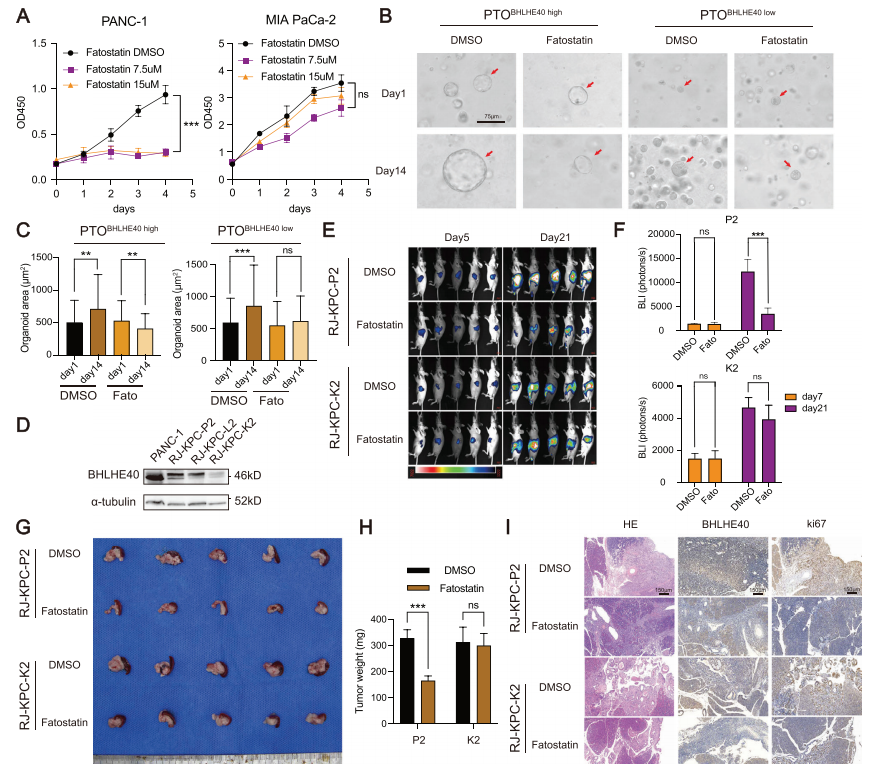
图7

汇报人:冯兰
导师:任建君、赵宇
审核:王肖宇、任建君



