精读分享│【Nature】:Ras通过干细胞与微环境的串扰驱动恶性肿瘤
英文题目:Ras drives malignancy through stem cell crosstalk with the microenvironment
中文题目:Ras通过干细胞与微环境的串扰驱动恶性肿瘤
期刊:Nature(IF: 64.8)
单位:美国洛克菲勒大学、霍华德休斯医学研究所
发表时间:2022年12月

摘要:
鳞状细胞癌是由RAS-MAPK信号的明显升高和从良性乳头状瘤到浸润性恶性肿瘤的进展引发。在肿瘤-间质界面,肿瘤起始祖细胞(即癌症干细胞)的一个亚群沿着这一途径获得了对化疗和免疫治疗的耐药性增加。从良性向浸润性鳞状细胞癌进展过程中肿瘤干细胞的分布和变化尚不清楚。本研究在小鼠中表明,在致癌RAS基因激活后,癌症干细胞重新连接其基因表达程序,并与驱动其恶性进展的组织微环境触发自我推进的异常信号串扰。细胞间交换的非遗传、动态级联涉及在高突变负荷的晚期转移性鳞状细胞癌中经常发生突变的下游通路。将克隆皮肤HRASG12V小鼠模型与单细胞转录组学、染色质修饰、慢病毒报告和谱系追踪相结合,结果表明,癌症干细胞及其微环境之间的异常交互作用触发了血管生成和TGFβ信号传导,为劫持瘦素和瘦素受体信号传导创造了有利条件,而瘦素和瘦素受体信号传导反过来在良性向恶性转化期间启动下游磷脂酰肌醇3-激酶(PI3K)-AKT-mTOR信号传导。通过对这一通路中的每一步进行功能验证,揭示了干细胞与微环境的动态时序交互如何推动这条通往恶性肿瘤的路径。这些见解对癌症治疗具有广泛意义。
主要结果:
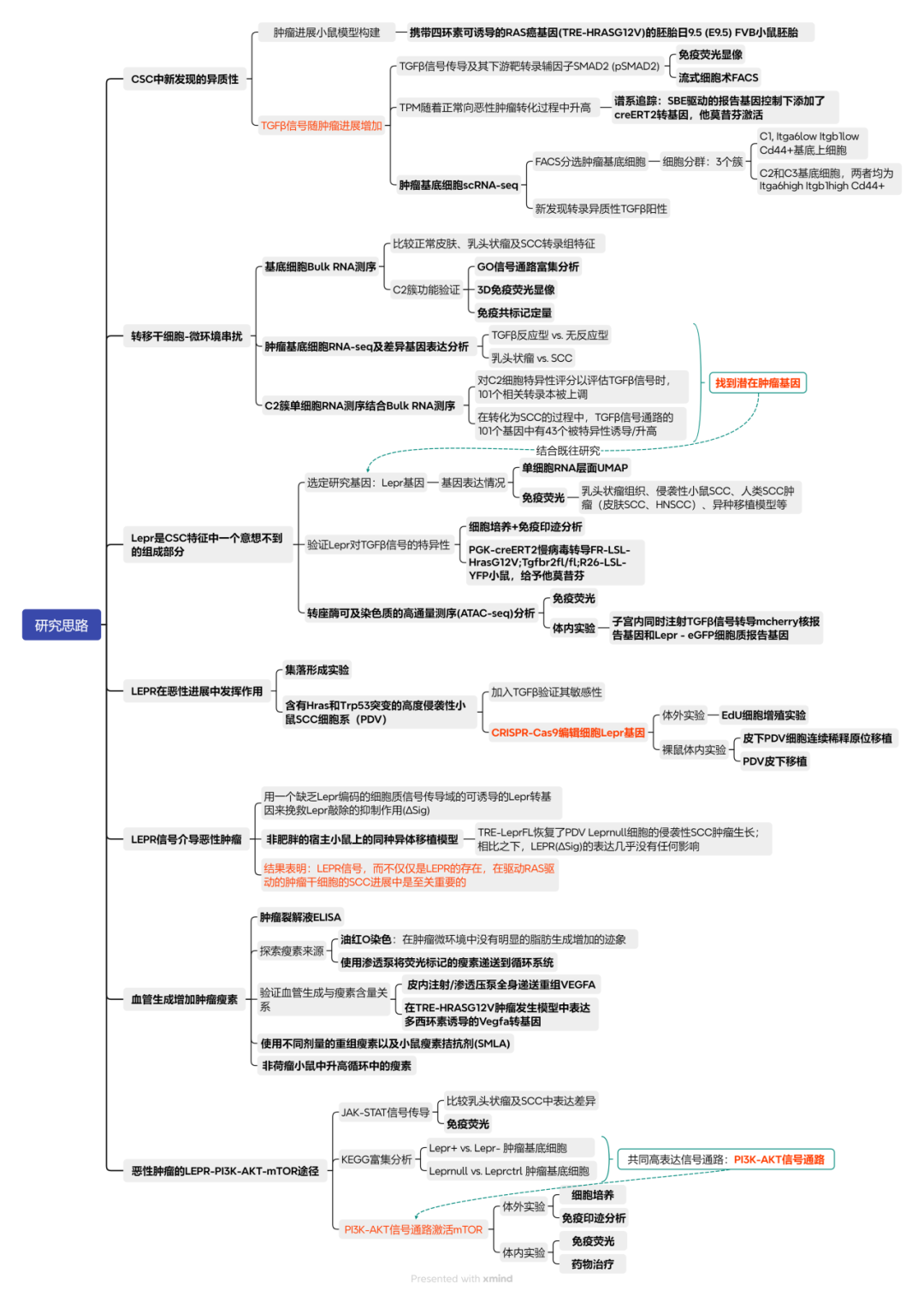
1、CSC中新发现的异质性
①构建皮肤SCC小鼠模型:本研究选用携带四环素可诱导的RAS癌基因(TRE-HRASG12V)的胚胎日9.5(E9.5)FVB小鼠胚胎,在子宫内进行低滴度慢病毒递送,以在pSMAD2/3-SMAD4复合物结合元件(SBE)的控制下,选择性地转导少量具有rtTA3反式激活因子和TGFβ报告基因的皮肤基底祖细胞。小鼠出生后多西环素活化HRASG12V克隆转导可形成皮肤斑;约4周时,具有平滑起伏的上皮-间质边界的增生性、分化良好的良性乳头状瘤形成;大多数在约8周时进展为未分化、均匀侵袭性SCC(Figure 1a)。
②通过免疫荧光成像、FACS和谱系追踪发现,TGFβ信号传导及其下游靶转录辅因子SMAD2 (pSMAD2)的磷酸化在乳头状瘤中罕见,但在侵袭性SCC祖细胞中显著增加。TPM随着正常向恶性肿瘤转化过程中升高(Figure 1b,Figure S1a-d)。
③通过肿瘤细胞scRNA-seq,分出三个细胞簇:C1, Itga6lowItgb1lowCd44+基底上细胞;C2和C3基底细胞,两者均为Itga6highItgb1highCd44+。同时,本研究发现了新的转录异质性,TGFβ+(mCherry)祖细胞尽管发现于混合肿瘤的侵袭性前沿,但在侵袭性SCC之间仍显示出异质性,57%的C2细胞mCherry转录阳性,而C3细胞mCherry转录阳性为35%(Figure 1c,Figure S1g)。
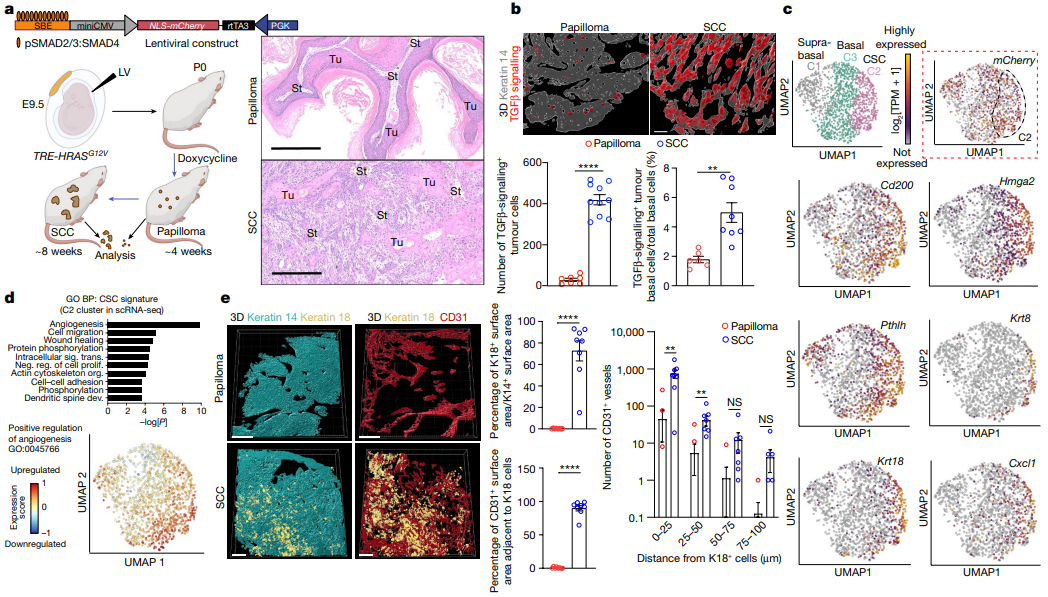
Figure 1. Benign-to-invasive rewiring of the tumour-initiating CSC transcriptome fuels angiogenesis
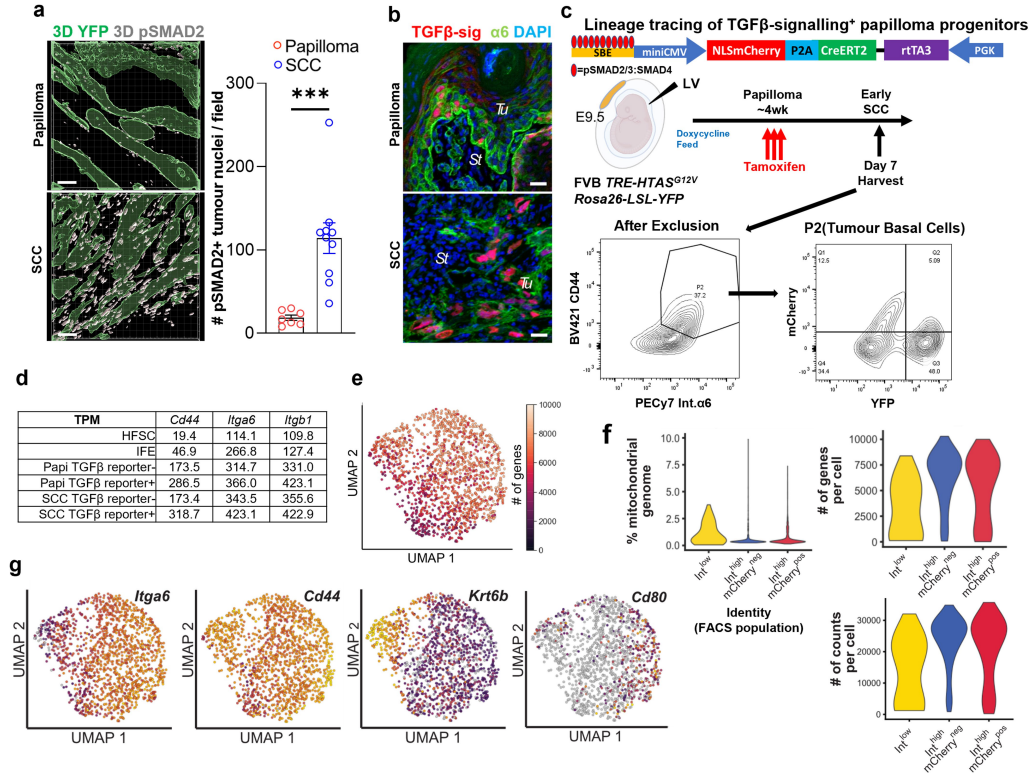
Figure S1. Benign papillomas and invasive SCCs exhibit distinct molecular signatures for angiogenesis and TGFβ responsiveness.
2、转移干细胞-微环境串扰
①C2簇富集了Cd200, Hmga2和Pthlh,为富集于肿瘤起始CSC的SCC祖细胞的典型特征。然而,这一簇也显示了许多与既往SCC-CSC特征不明确一致的其他转录本(Figure 1c)。 ②对基底祖细胞进行bulk RNA-seq发现,与正常皮肤基底细胞相比,886个转录本在泛肿瘤基底细胞中上调了至少2倍,而562个转录本在从良性到恶性状态的转变过程中特异性上调;尽管在乳头状瘤中发现了许多C2转录本,但许多是在SCC中诱导的(Figure S2a-d)。 ③C2簇的GO分析显示血管生成基因富集,其中许多在良性-恶性转变期间上调;3D免疫荧光显像、免疫共标记结果显示,C2细胞与侵袭性SCC及CD31血管系统相关联(Figure 1d、e)。 ④肿瘤基底细胞RNA-seq及差异基因表达分析显示:CSC(C2簇)与血管生成增加以及TGFβ信号传导同时出现,其在功能上相互交织(Figure S2e、f)。 ⑤对C2细胞进行特异性评分以评估TGFβ信号,发现101个相关转录本被上调;而在转化为SCC的过程中,其中有43个特异性升高(Figure 2a)。
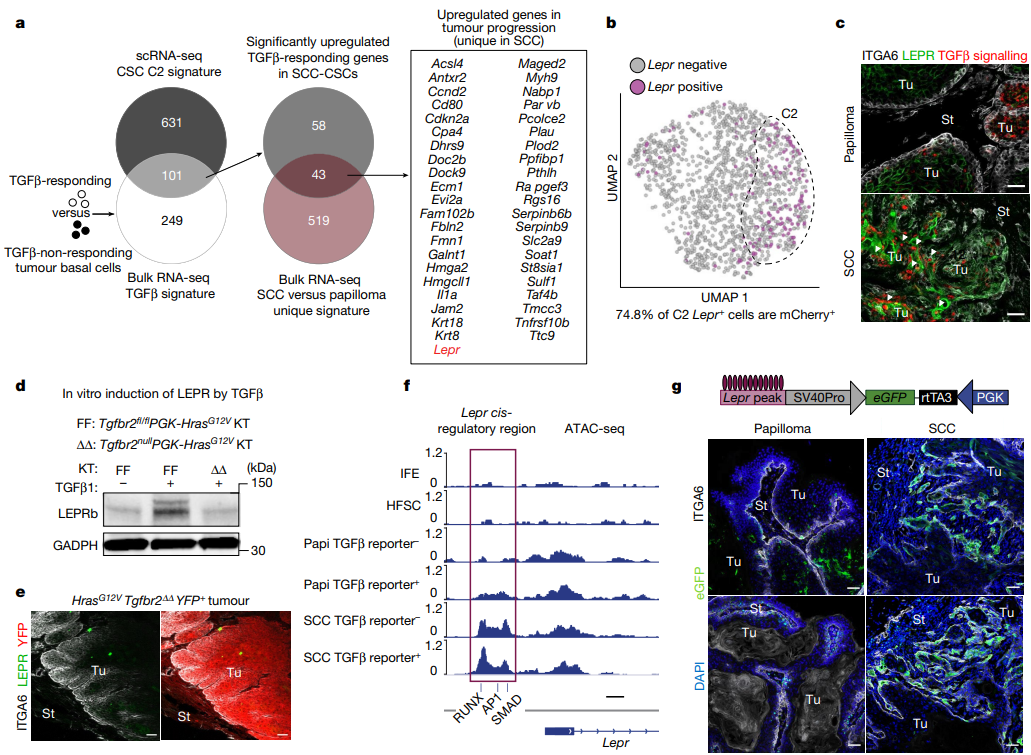
Figure 2. Leptin receptor is a TGFβ-regulated gene induced in tumour-initiating CSCs and localized to invasive SCC fronts.
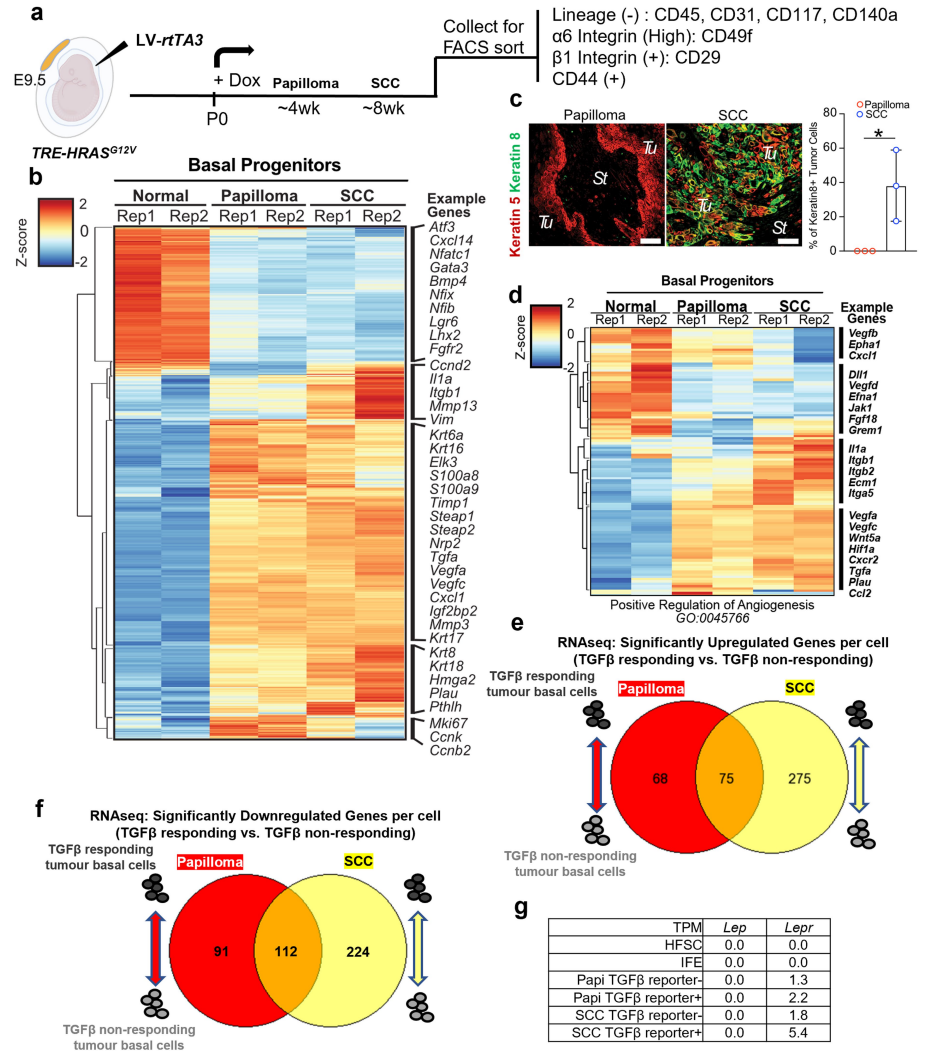
Figure S2. FACS-isolation and transcriptomic analysis of basal progenitors from normal skin, benign papilloma and SCC.
3、Lepr是CSC特征中一个意想不到的组成部分
①Lepr在正常皮肤上皮中不表达,在乳头状瘤中很少表达;在SCC祖细胞中,Lepr在mCherry TGFβ信号通路的C2 CSCs中特异性转录。通过免疫荧光验证了LEPR在侵袭性小鼠SCC、人类SCC肿瘤及异种移植模型中的表达(Figure 2a-c)。 ②Tgfbr2 floxed/null的HrasG12V角质形成细胞体外培养及免疫印迹分析结果显示LEPR对TGFβ信号传导的敏感性。使用PGK-creERT2慢病毒转导FR-LSL-HrasG12V;Tgfbr2fl/fl;R26-LSL-YFP小鼠并给予他莫昔芬,发现其缺乏TGFβ受体信号,只检测到少数罕见的LEPR细胞(Figure 2d、e)。 ③转座酶可及染色质的高通量测序(ATAC-seq)分析将基底细胞分成7个簇,Lepr的峰大多落在C4和C6中,其中染色质状态在肿瘤发生过程中显示出明显的开放,特别是与TGFβ信号通路的CSC相关。Lepr是具有这种ATAC峰的基因之一,其可及性对TGFβ信号传导和恶性进展敏感。此外,免疫荧光检测了C6顺式调节元件在肿瘤发生期间驱动eGFP报告基因的临时激活的能力:Lepr报告基因在侵袭性SCC前沿高度活跃,而在乳头状瘤中则低得多(Figure 2f,Figure S5)。
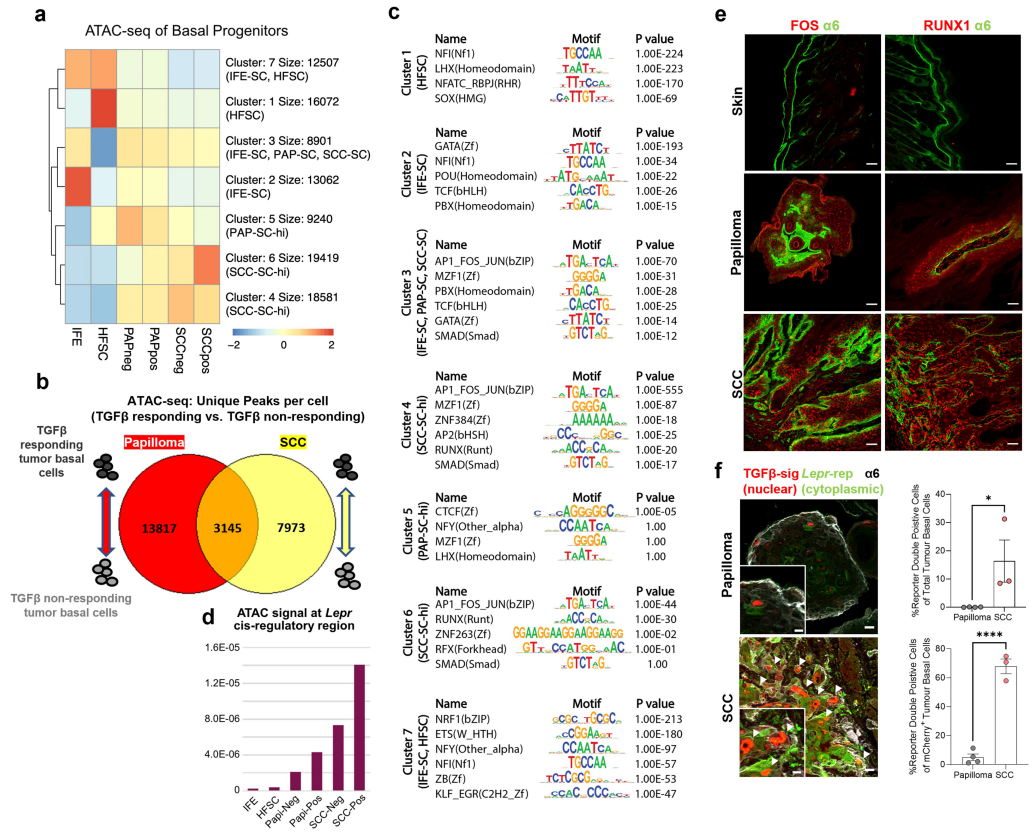
Figure S5. Benign papilloma and invasive SCC display distinct epigenetic signatures.
4、LEPR在恶性进展中发挥作用 ①集落形成分析显示,与Lepr+/- C3细胞相比,Lepr C2细胞显示出近3倍的集落形成效率,并且形成了更大的集落(Figure 3a)。 ②研究者选用含有Hras和Trp53突变的高度侵袭性小鼠SCC细胞系(PDV)并使用CRISPR-Cas9编辑其产生Lepr无效突变。裸鼠皮下Leprctrl/null PDV细胞连续稀释原位移植显示,LEPR+细胞肿瘤起始能力提高约10倍;裸鼠PDV系皮下移植显示,Leprctrl肿瘤具有SCC特征,而Leprnull PDV肿瘤要小得多,并且表现出乳头状瘤样形态;EdU细胞增殖实验显示,Lepr缺失减弱了细胞增殖,但并未完全消除(Figure 3b、c)。
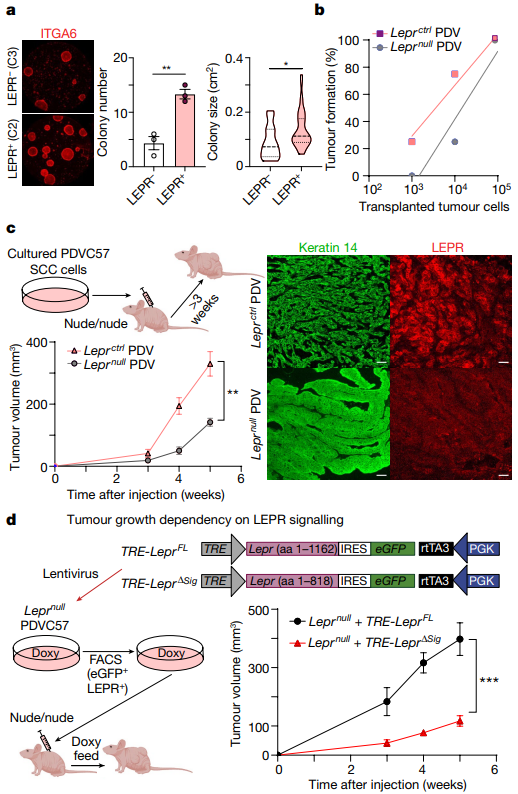
Figure 3. Leptin receptor promotes superior tumour-initiating ability and is an essential regulator of SCC progression.
5、LEPR信号介导恶性肿瘤 ①研究者使用一个缺乏Lepr编码的细胞质信号传导域的可诱导的Lepr转基因来达到Lepr敲除的抑制作用(ΔSig)。在非肥胖宿主小鼠的同种异体移植模型显示,TRE-LeprFL恢复了PDV Leprnull细胞的侵袭性SCC肿瘤生长;相比之下,LEPRΔSig的表达几乎没有任何影响(Figure 3d)。 ②结果表明,LEPR信号,而不仅仅是LEPR的存在,在驱动RAS驱动的肿瘤干细胞的SCC进展中是至关重要的。 6、血管生成增加肿瘤瘦素 ①肿瘤裂解液ELISA分析显示,瘦素水平在SCC肿瘤组织中比乳头状瘤高5倍以上;且升高源于肿瘤微环境,因为上皮乳头状瘤和SCC细胞均不表达配体(Figure 4a)。 ②探索瘦素升高来源:油红O染色显示在肿瘤微环境中没有明显的脂肪生成增加的迹象;无论是基质还是FACS纯化的基质群体都没有显示明显的Lep mRNA;使用渗透泵将荧光标记的瘦素递送到循环系统,证实了瘦素具有从循环系统进入正常皮肤真皮和肿瘤基质的能力,但是在肿瘤进展过程中,没有检测到血清瘦素显著升高(Figure 4b-d,Figure S7a)。 ③验证血管生成与瘦素含量关系:通过皮内注射及渗透压泵全身递送重组VEGFA,证实血管生成和肿瘤生长均显著增加;在TRE-HRASG12V肿瘤发生模型中表达多西环素诱导的Vegfa转基因显示,肿瘤干细胞中Vegfa的诱导直接增加了局部血管生成和侵袭性肿瘤行为,随后升高的血管生成直接升高了肿瘤微环境中的瘦素水平(Figure 4e、f,Figure S7b)。 ④研究者使用不同剂量的重组瘦素以及小鼠瘦素拮抗剂(SMLA)以直接调控循环瘦素水平,发现循环中的瘦素以剂量依赖性方式加速肿瘤生长,而SMLA有轻微的抑制作用(Figure 4g)。 ⑤在非荷瘤小鼠中升高循环中的瘦素时,没有观察到皮肤血管生成的实质性变化,表明瘦素不是驱动因素,而是恶性进展过程中发生的血管生成增加的结果(Figure S7c、d)。
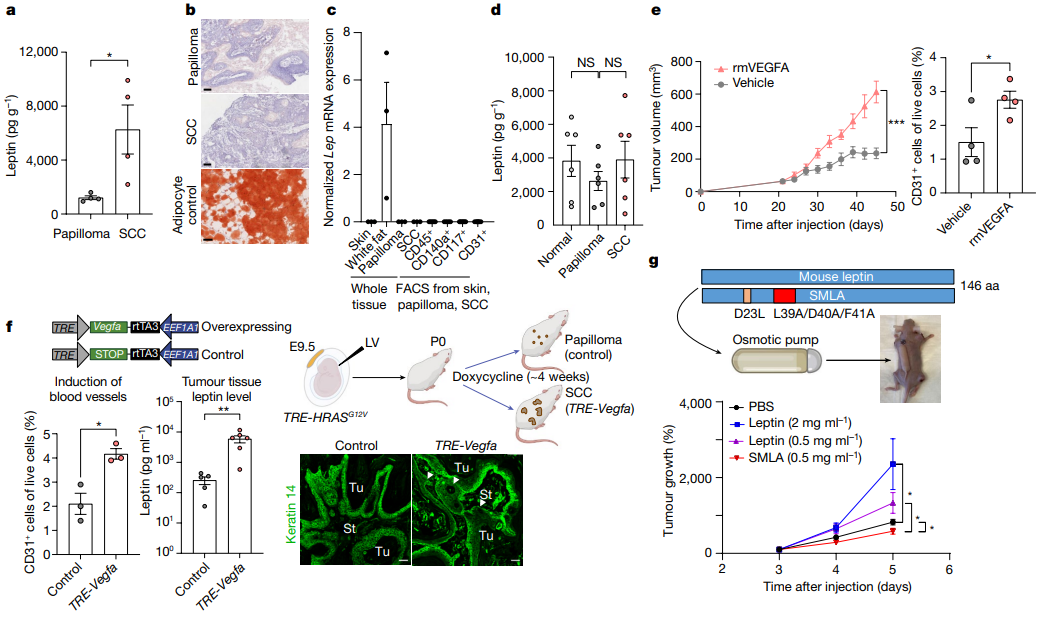
Figure 4. Leptin levels increase in the malignant tumour microenvironment and are caused by elevated angiogenesis.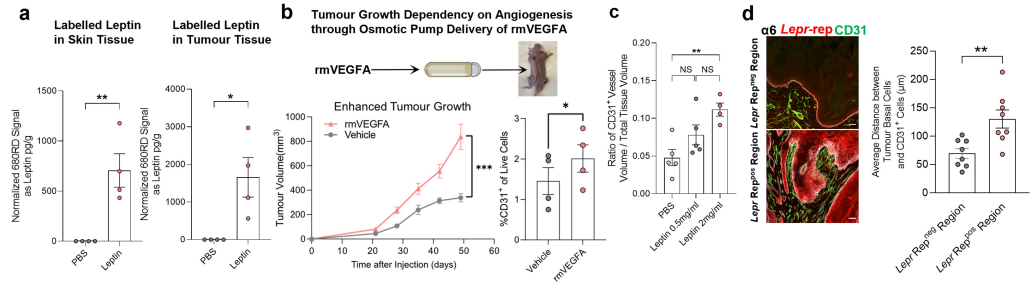
Figure S7. Increased angiogenesis elevates local leptin levels and promotes Lepr-mediated tumour progression.
7、恶性肿瘤的LEPR-PI3K-AKT-mTOR途径 ①转录组水平分析显示,JAK-STAT标签在SCC-CSCs中没有富集,乳头状瘤和SCC之间的差异虽然可变,但不显著;免疫荧光分析显示,乳头状瘤中STAT3发生磷酸化并存在于细胞核中,尽管pSTAT3在Leprnull PDV肿瘤中减少,但并未被消除。因此,LEPR-瘦素信号传导作为一种催化剂,增强而不是诱导JAK-STAT信号传导,使其促进SCC从良性进展到侵袭性状态(Figure S8a-c)。 ②KEGG通路分析结果表明,PI3K-AKT信号通路的综合基因标签表达评分在C2 SCC-CSCs中显著上调,在乳头状瘤和SCC之间显著升高。Leprctrl/Leprnull SCC细胞免疫印迹分析显示,仅在SCC细胞表达LEPR的情况下瘦素增强了AKT的稳定性和活化(磷酸化)。体内实验方面,口服PI3K抑制剂BKM12033阻断PI3K信号传导发现,仅在Leprctrl SCC中减少了肿瘤生长,而在Leprnull SCC中没有。结果表明,LEPR-PI3K-AKT被认为是可以解释侵袭性SCC基底祖细胞群体异质性的信号通路的首选候选(Figure 5b-d)。 ③PI3K-AKT信号通路可通过不同的机制激活mTOR:体外培养的Leprctrl PDV细胞比Leprnull PDV细胞体积更大;免疫印迹分析显示mTOR靶点丝氨酸/苏氨酸激酶p70-S6K和核糖体蛋白S6均以对Lepr敏感的方式显示出磷酸化。体内实验显示,与来自植入Leprnull PDV细胞的肿瘤显示出较低的pS6免疫荧光(Figure 5e-g)。 ④研究者持续递送强效mTOR抑制剂雷帕霉素进行药物治疗,Leprctrl PDV细胞来源的移植肿瘤生长减少,而对Leprnull肿瘤的作用较小(Figure 5h)。
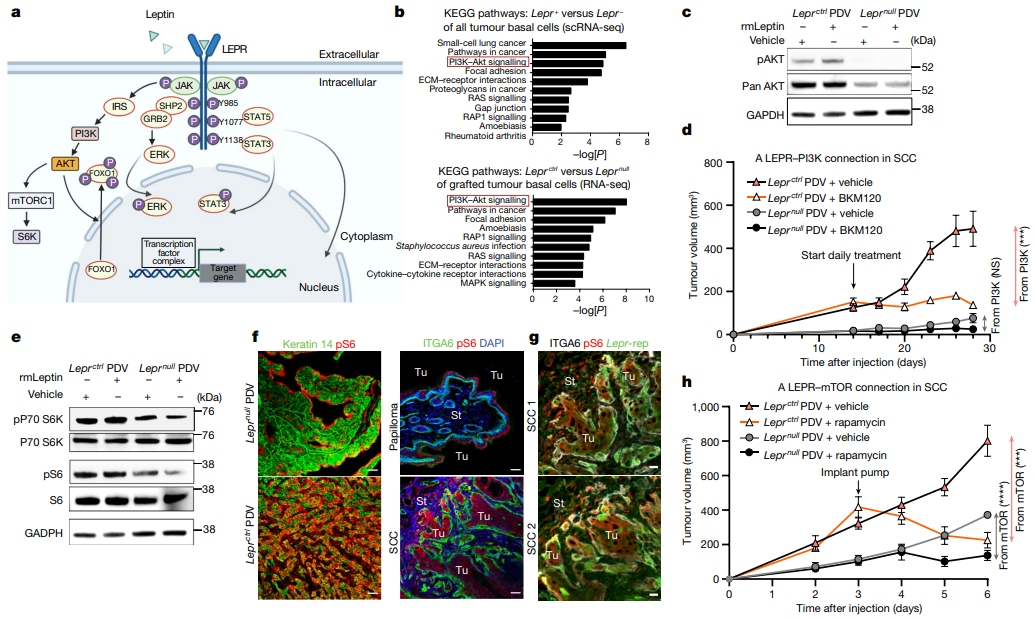
Figure 5. Leptin receptor signalling promotes SCC progression through the PI3K-AKT and mTOR pathways.
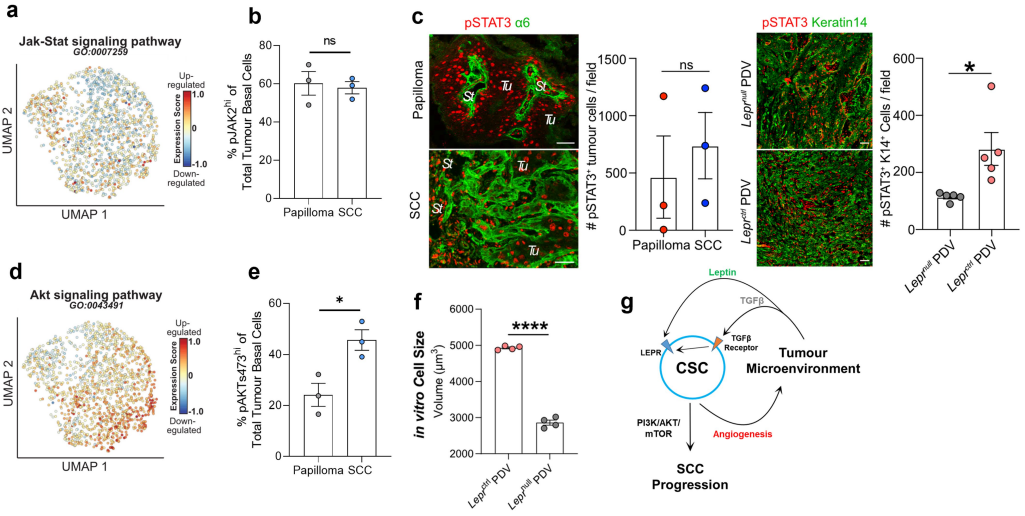
Figure S8. Akt but not Jak/Stat pathway signature is enriched in SCC CSCs.
结论:
1、致癌RAS突变发生后,癌症干细胞与其微环境之间进行异常串扰,触发血管生成和TGFβ信号传导;
2、CSC中TGFβ介导的LEPR及LEPR-瘦素信号传导在肿瘤恶性进展中发挥重要作用;
3、LEPR-瘦素信号传导启动下游PI3K-AKT-mTOR信号传导通路,从而促进肿瘤良恶性转变。
汇报人: 张宇阳
导师:赵宇
编辑:陈秋蓉
审核:任建君 张子妍



