精读分享│【Nature Genetics】:HPV相关口咽癌的细胞状态与基因组和病毒异质性相关
英文题目:Cellular states are coupled to genomic and viral heterogeneity in HPV-related oropharyngeal carcinoma
中文题目:HPV相关口咽癌的细胞状态与基因组和病毒异质性相关
期刊:Nature Genetics(IF: 30.8)
单位:美国密苏里州圣路易斯市华盛顿大学医学院,以色列魏茨曼科学研究所
发表时间:2023年4月


摘要:
头颈部鳞状细胞癌(HNSCC)包括一种由人乳头状瘤病毒 (HPV) 驱动的癌症亚群。在这里,我们利用单细胞转录组测序(scRNA-seq)对HPV阳性和HPV阴性的口咽肿瘤进行分析,揭示了肿瘤内部和肿瘤之间高度的细胞多样性。首先,我们在单个肿瘤内检测到多种染色体畸变,这表明基因组不稳定,并且即使在样本的病理阴性边缘也能识别恶性细胞。其次,我们发现了HNSCC亚型和其他细胞状态(如细胞周期、衰老和上皮-间质转化)的多样性。第三,我们发现HPV阳性肿瘤内病毒基因表达存在异质性。在一部分细胞中,HPV表达丢失或被抑制,这与HPV相关细胞周期表型的减少、对治疗反应的降低、侵袭性的增加和不良的预后有关。这些发现表明,在诊断和治疗HPV阳性肿瘤时,必须考虑HPV表达的多样性,这对预后的判断有重要影响。
研究背景:
1.与其他HNSCC相比,HPV相关的OPSCC预后较好,因此需要降阶梯治疗以减少副作用,同时保持良好的预后效果。然而,一部分HPV相关OPSCC的治疗反应不佳且容易复发,需要深入了解这些肿瘤并开发新的治疗方法。
2.虽然目前对HPV致病的起始机制已基本了解,但对HPV后续如何导致肿瘤形成仍了解较少,并尚未阐明HPV相关肿瘤的生物学特性及脆弱性。
3.本研究重点关注OPSCC,对HPV阳性和HPV阴性肿瘤进行了分析。作者发现了非预期的染色体畸变和HPV表达模式的多样性。值得注意的是,每个HPV阳性肿瘤中都有一个恶性细胞亚群,其中并未检测到HPV表达,且HPV相关表型减少,这些细胞可能会影响预后和治疗效果。
主要结果:
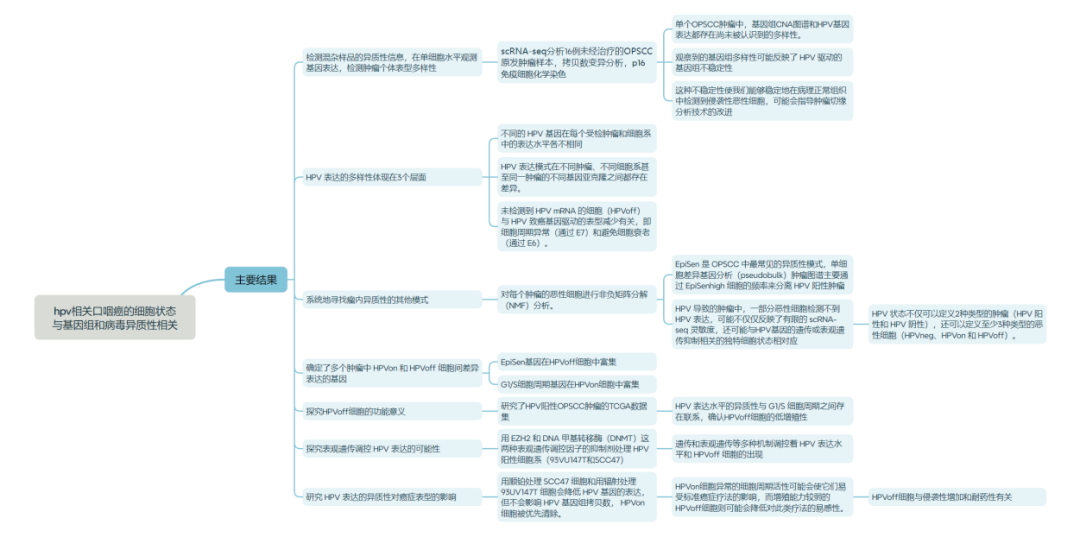
研究思路及方法:
1. OPSCC的scRNA-seq分析
①使用10x Genomics Chromium平台(单细胞测序平台)分析16个未经治疗的OPSCC原发肿瘤样本:剔除低质量细胞和双联体细胞后,保留了70970个细胞,用于描述细胞多样性的四个不同层次,包括细胞类型、基因克隆、细胞状态和HPV表达模式。(Fig.1a)
②对所有细胞进行聚类分析并通过差异表达的标记基因对聚类进行注释:定义了12个非上皮细胞集群,包括典型的肿瘤微环境成分(如T细胞和成纤维细胞)及不常见的成分(如肌成纤维细胞和淋巴脉管细胞)。(Fig.1b-d)
③进行标准的p16免疫细胞化学染色:据此将12例OPSCC肿瘤定义为HPV阳性,4例为HPV阴性。(Extended Data Fig.1c)
④将所有上皮细胞的scRNA-seq读长与五种最常见的高危HPV基因型进行比对:在临床定义为HPV阳性的12例肿瘤的其中11个中发现了最常见的HPV基因型(HPV16)的转录本,而在临床定义为HPV阴性的肿瘤中没有这种发现。在一个特殊的肿瘤(OP8)中,尽管临床诊断为HPV阳性,但没有发现任何HPV转录本,进一步的检测和测序分析也未能发现任何其他的HPV基因型(尽管不能排除未检测到少见基因型的可能性)。(Extended Data Fig.1d,e)
这些结果要么是因为p16得出了假阳性的临床诊断,要么是因为病毒清除,或是HPV转录本的检测有局限(根据其他肿瘤的结果来看最后一种可能性不大)。
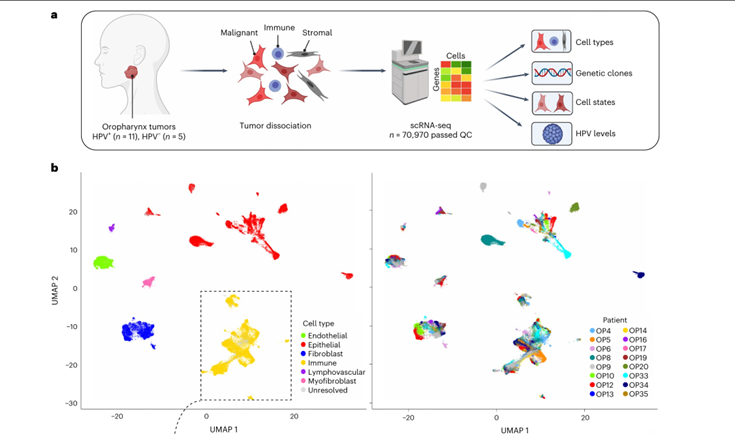
Fig. 1 ScRNA-seq analysis of 16 OPSCC tumors.
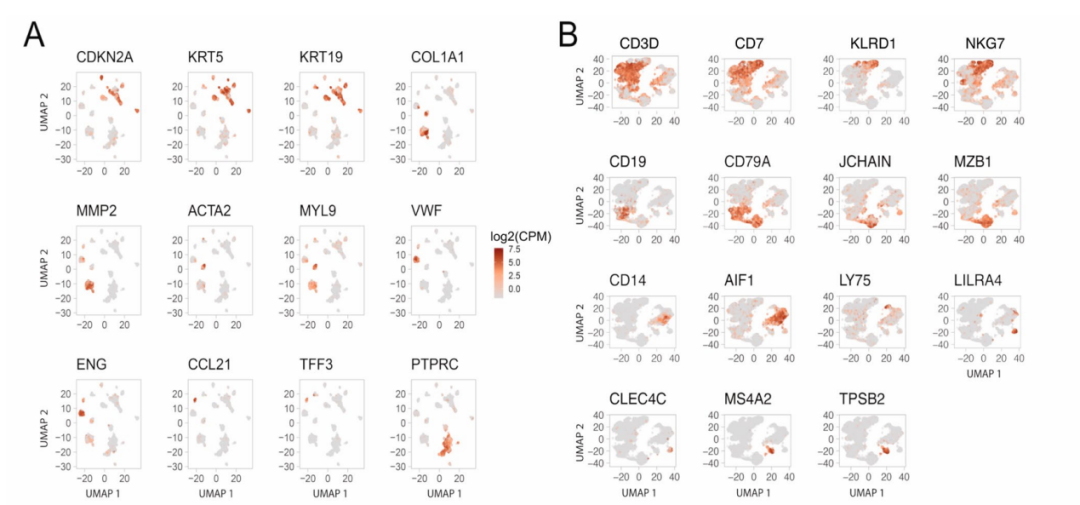
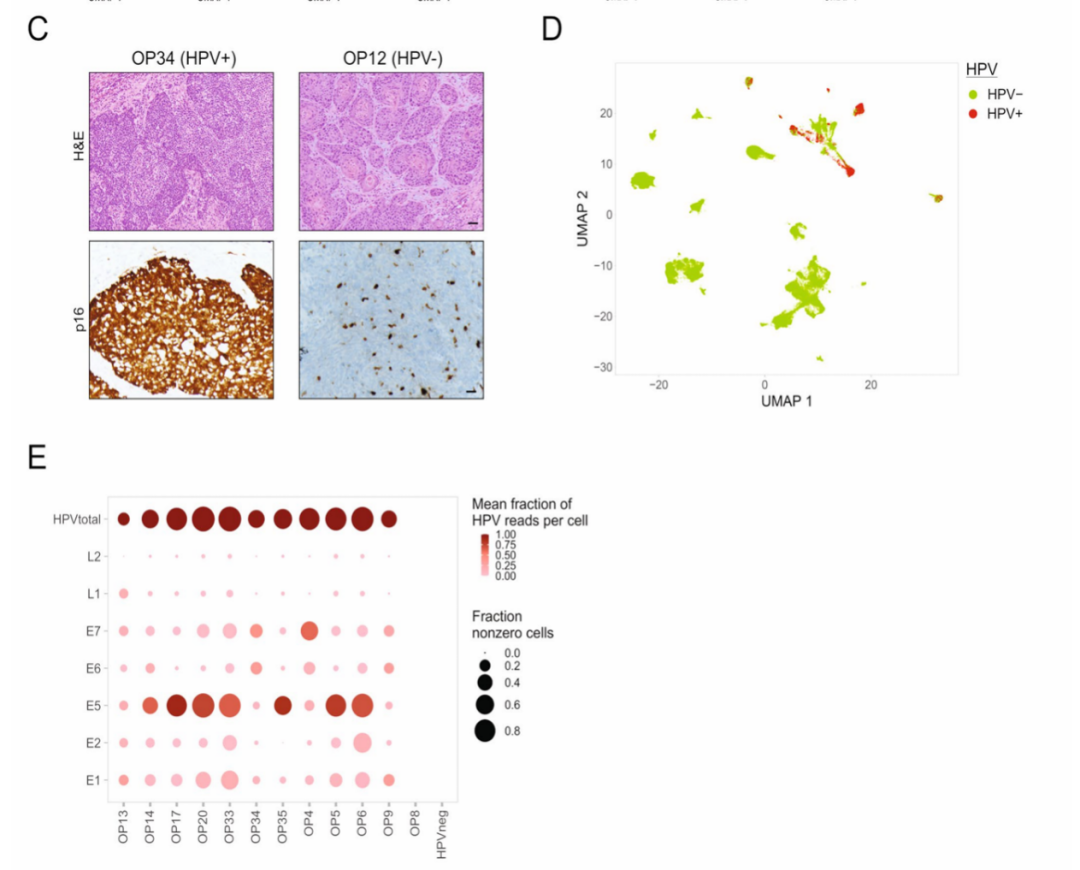
Extended Data Fig.1 Expression of marker genes and HPV genes, related to Fig. 1.
2. 染色体畸变识别恶性细胞和克隆性
①根据染色体拷贝数畸变(CNAs),将上皮细胞分为恶性和非恶性细胞:综合分析所有染色体的CNA与来自同一肿瘤的其他细胞的CNA模式的相似性,将20323个(85%)上皮细胞归类为恶性细胞,2625个(11%)细胞归类为非恶性(正常)上皮细胞。(Fig.2a,b) ②在14个肿瘤样本中发现了多个CNA亚克隆。OP9显示出尤为广泛的亚克隆多样性,有六个不同的基因亚克隆,作者为此推断出一个系统发育树,定义了两个主要分支(亚克隆 A-B 和亚克隆 C-F)。(Fig.2c-e) ③在10个具有多个亚克隆的HPV阳性肿瘤中,有8个的HPV检测结果存在显著差异。在某些情况下,亚克隆不仅在HPV检测频率上存在差异,而且在不同HPV基因的相对检测上也存在差异(Fig.2c)。 HPV基因的总体丰度和表达模式似乎在肿瘤演变过程中发生了改变,并且在HPV阳性肿瘤之间和肿瘤内部都存在差异。
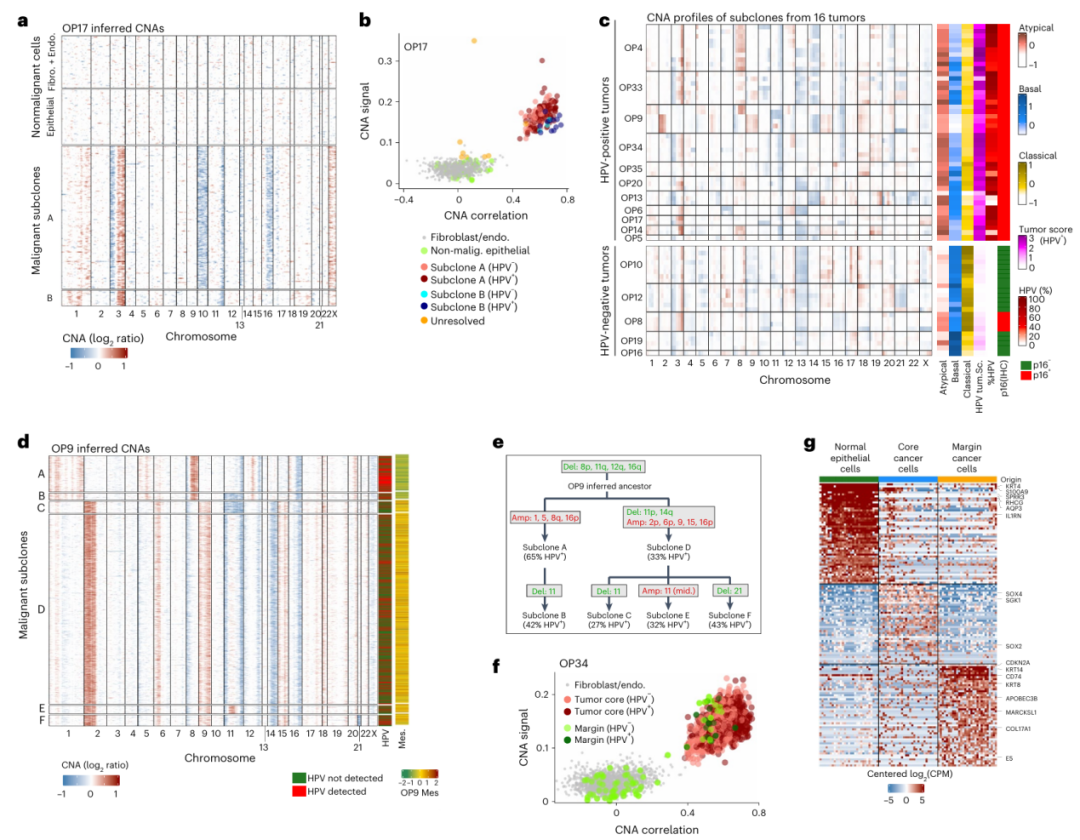
Fig. 2 Inference of chromosomal aberrations for identification of malignant cells, genetic subclones and invasive cells.
3. 在组织学检测为阴性的肿瘤切缘发现恶性细胞
①对3例样本的癌旁正常组织进行CNA分析:样本中大多数上皮细胞被归类为非恶性细胞,但在OP34样本中,80个上皮细胞中有29个被CNA和HPV相关恶性表达标志物分类为恶性。这些细胞中有一部分表达了HPV基因,进一步支持了将它们分类为恶性。(Fig.2f) ②比较阴性组织切缘的恶性细胞、肿瘤核心组织的恶性细胞以及阴性切缘样本中的非恶性上皮细胞的表达情况:切缘的恶性细胞中有57个基因明显上调,包括细胞角蛋白基因、EMT相关基因、APOBEC基因、免疫相关基因和HPV E5基因,明显将这一侵袭性细胞群体与其它细胞区分开来。(Fig.2g) ③作者搜索了其他包含了相匹配的肿瘤-阴性切缘样本的scRNA-seq数据集,探索在组织学阴性切缘范围内识别恶性细胞方法的普适性:找到了两个符合标准的肺腺癌样本并根据推断的CNA对样本细胞进行分类,在其中一个肿瘤的阴性切缘样本中识别出恶性细胞。(Extended Data Fig.3d,e) 这些结果表明在肿瘤组织边缘处侵袭性的亚克隆在进一步演进,强调了在组织学阴性切缘样本中存在可能导致不良预后的恶性细胞。
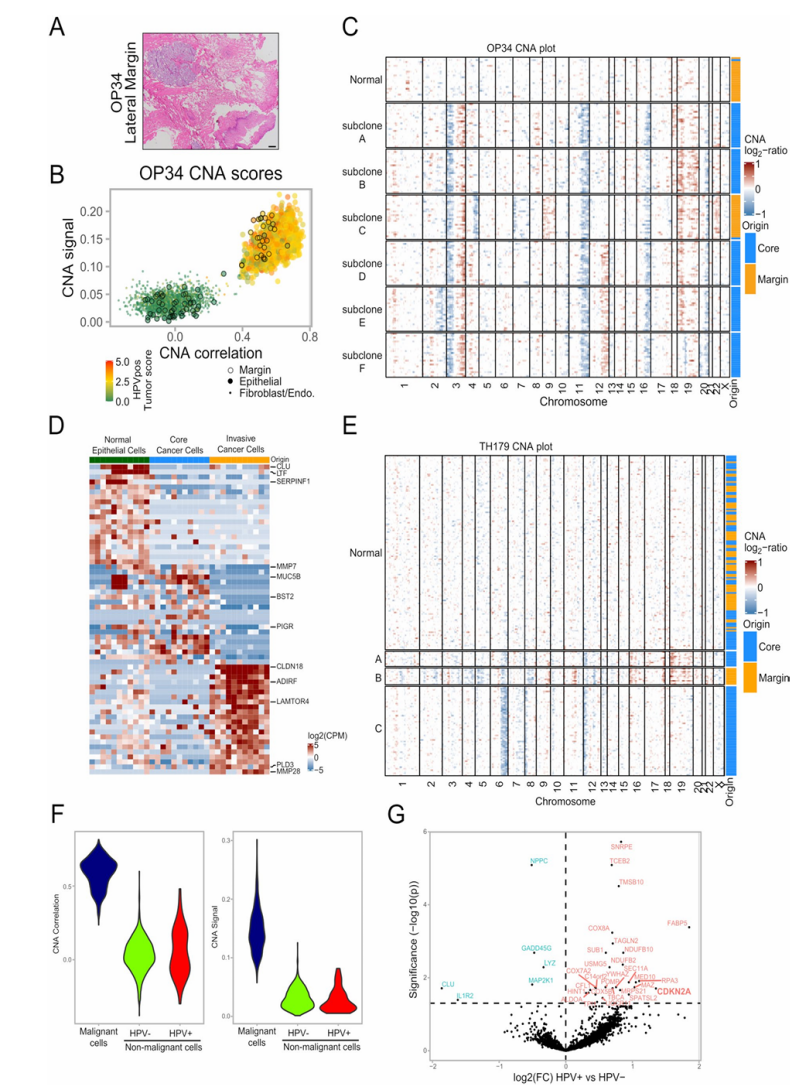
Extended Data Fig. 3 CNA-based detection of invasive malignant cells, related to Fig. 2.
4. OPSCC肿瘤的多样性主要表现为三种细胞亚型
恶性细胞的多样性与患者身份、HPV状态和TCGA(癌症基因图谱数据库)的三种亚型——非典型、基底型和经典型——相关,每个肿瘤都有一个优势亚型。本研究的样本中,所有HPV阳性肿瘤都有一个优势的非典型亚型,HPV阴性肿瘤中有2例以基底亚型占主导地位,2例以经典亚型占主导地位。而OP8以中间型细胞居多(不能确定归属于任何TCGA亚型),这可能反映了其作为p16阳性但HPV阴性的肿瘤的独特模式。(Fig.3a,b) 在所有样本中,亚型异质性都与基因亚克隆有关。
5. 肿瘤内异质性和上皮细胞衰老
①对每个肿瘤的恶性细胞进行非负矩阵分解(NMF)分析来系统地寻找肿瘤内异质性的其他表达模式:比较了肿瘤内可变的表达程序,确定了8组重复出现的表达程序,对这8组中的每一组都定义一个共识“元程序”,通过功能富集分析对其进行注释,根据这些元程序对所有恶性细胞进行评分,并对6种常见的非恶性细胞类型也进行了类似的分析。(Fig.3c-d) ②恶性细胞元程序包括细胞周期(G1/S和G2/M期)、应激和缺氧反应、氧化磷酸化、干扰素反应、部分EMT(p-EMT)和上皮细胞衰老相关(EpiSen)程序。后两个元程序似乎在HNSCC中富集,并分别与转移和药物反应相关。EpiSen是OPSCC中最常见的异质性模式,因此单细胞差异基因分析(pseudobulk)肿瘤图谱主要通过EpiSenhigh细胞频率来划分HPV阳性肿瘤。
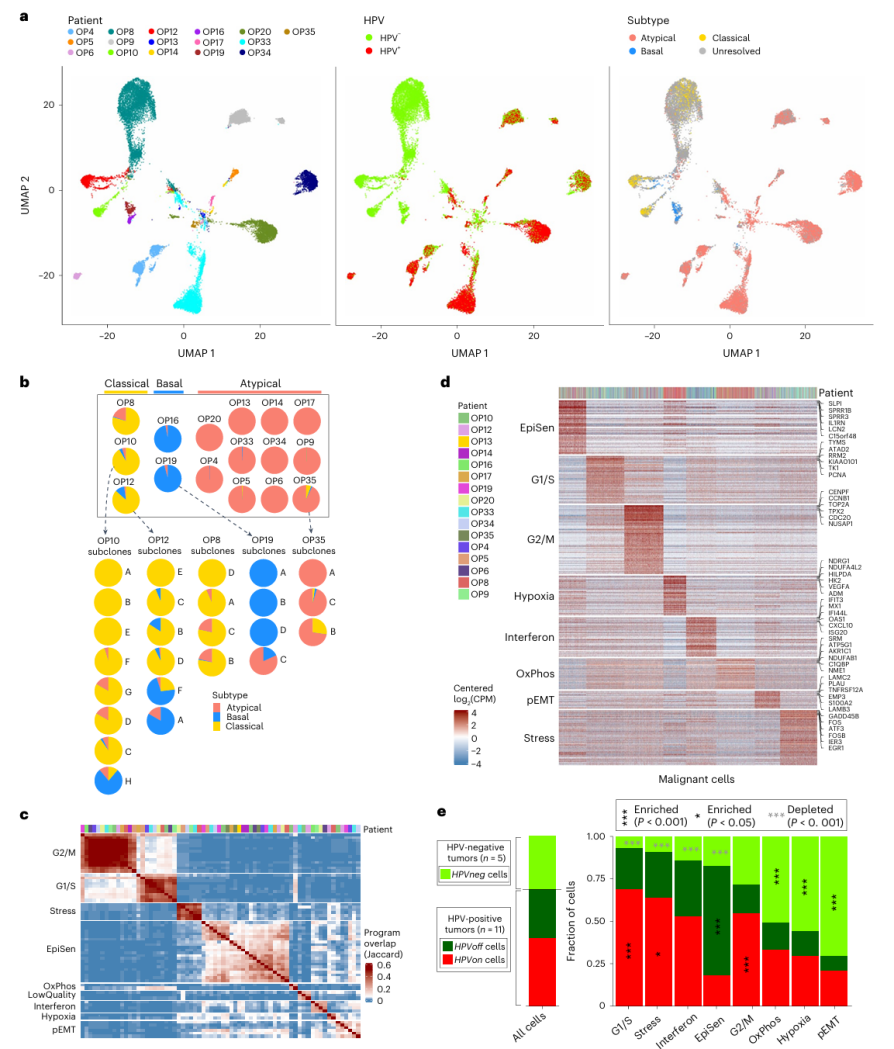
Fig. 3 Diversity of OPSCC malignant cells.
6. HPV导致的肿瘤中,有一部分恶性细胞检测不到HPV的表达
①除G2/M元程序外,其他所有元程序在HPV阳性和HPV阴性肿瘤之间的丰度差异都很大,且HPV阳性肿瘤内元程序的丰度也存在差异。在HPVoff细胞中检测不到HPV可能不仅仅反映了有限的scRNA-seq灵敏度,还可能反映了与HPV基因遗传或表观遗传抑制相关的独特细胞状态。因此,HPV状态不仅可以定义2种类型的肿瘤(HPV 阳性和 HPV 阴性),还可以定义至少3种类型的恶性细胞(HPVneg——即HPV阴性肿瘤的细胞、HPVon——即HPV阳性肿瘤中检测出了HPV读长的细胞和HPVoff——即HPV阳性肿瘤中未检测出HPV读长的细胞)。(Fig.3e) ②为研究HPVoff细胞中的HPV基因是否受到抑制,或者是否由于技术限制未检测到它们的表达,研究者将HPVoff的细胞频率与未检测到其他基因的细胞的频率进行比较:对其他对照基因组的检测显示,HPVoff的比例显著高于预期。数据结果确认了这类HPV表达丢失或减少的恶性细胞亚群(HPVoff)的存在。(Fig.4a,b)
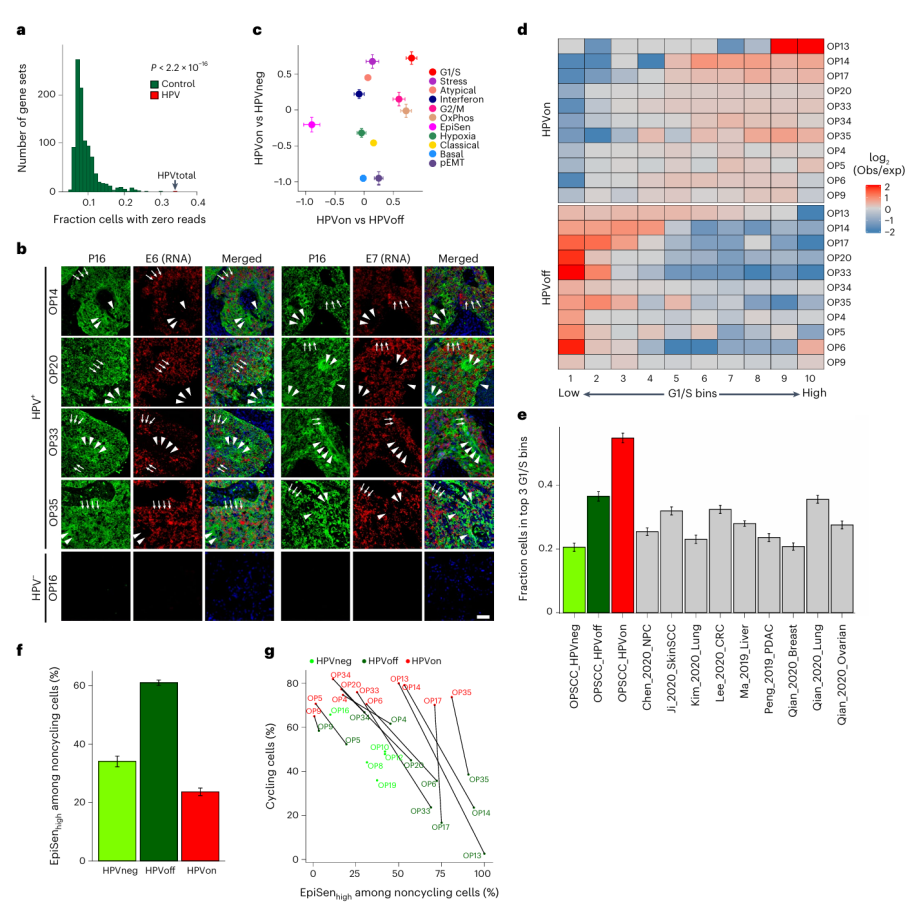
Fig. 4 HPVoff cells and their association with cell cycle and senescence.
7. HPVoff细胞与HPV阴性表型有关
研究者确定了多个肿瘤中HPVon和HPVoff细胞间差异表达的基因,EpiSen基因在HPVoff细胞中富集,而G1/S细胞周期基因在HPVon细胞中富集。为了进一步体现HPVon和HPVoff细胞的细胞周期差异,按G1/S程序的表达将所有恶性细胞分为了十个区。HPV-E7致癌基因对pRb抑制作用缺失可能降低了处于G1/S期的HPVoff细胞的比例,而HPV-E6致癌基因对p53抑制作用的缺失可能导致EpiSen在HPVoff细胞中富集。(Fig.4, Extended Data Fig.6)
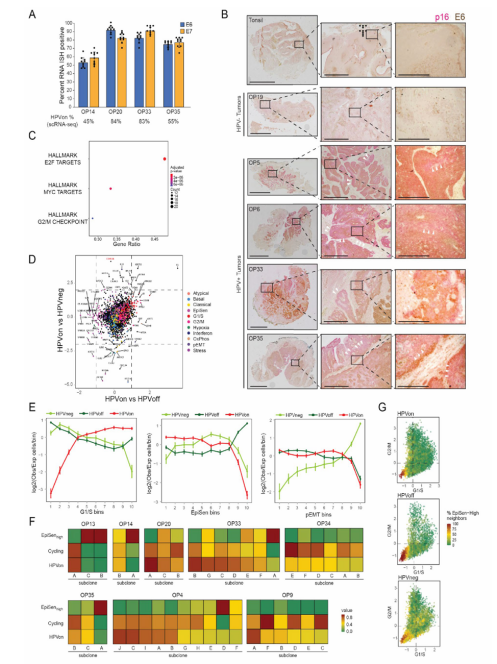
Extended Data Fig. 6 Characteristics of HPVoff cells, related to Fig. 4.
8. TCGA数据和细胞系支持HPVoff细胞的低增殖
①作者研究了HPV阳性OPSCC肿瘤的TCGA数据集,来探索HPVoff细胞的功能意义:HPV转录本的整体表达水平可以作为恶性细胞HPVon与HPVoff比例的近似值。与研究者的scRNA-seq分析一致,标准化的HPV表达与HPV阳性TCGA肿瘤的G1/S评分相关。在TCGA宫颈癌标本的分析中获得了类似的结果,表明HPV表达水平与不同背景下的G1/S诱导有关(Fig.5a) ②HPVon和HPVoff克隆在多次传代过程中基本保持了其HPV表达水平,证明了这些表达状态的遗传性。免疫细胞化学分析证实HPV蛋白E6和E7的表达与细胞增殖相关。HPVon克隆增殖能力更强,虽然血清饥饿抑制了它们的增殖,但对HPV的表达几乎没有影响。这表明HPV的表达不仅反映了细胞正处在细胞周期中,还反映了E6和E7的功能直接促进了细胞周期。(Fig.5h-i, Extended Data Fig.7h-l) 综上所述,这些结果突出了HPV表达水平的异质性与G1/S细胞周期活性之间的关联。
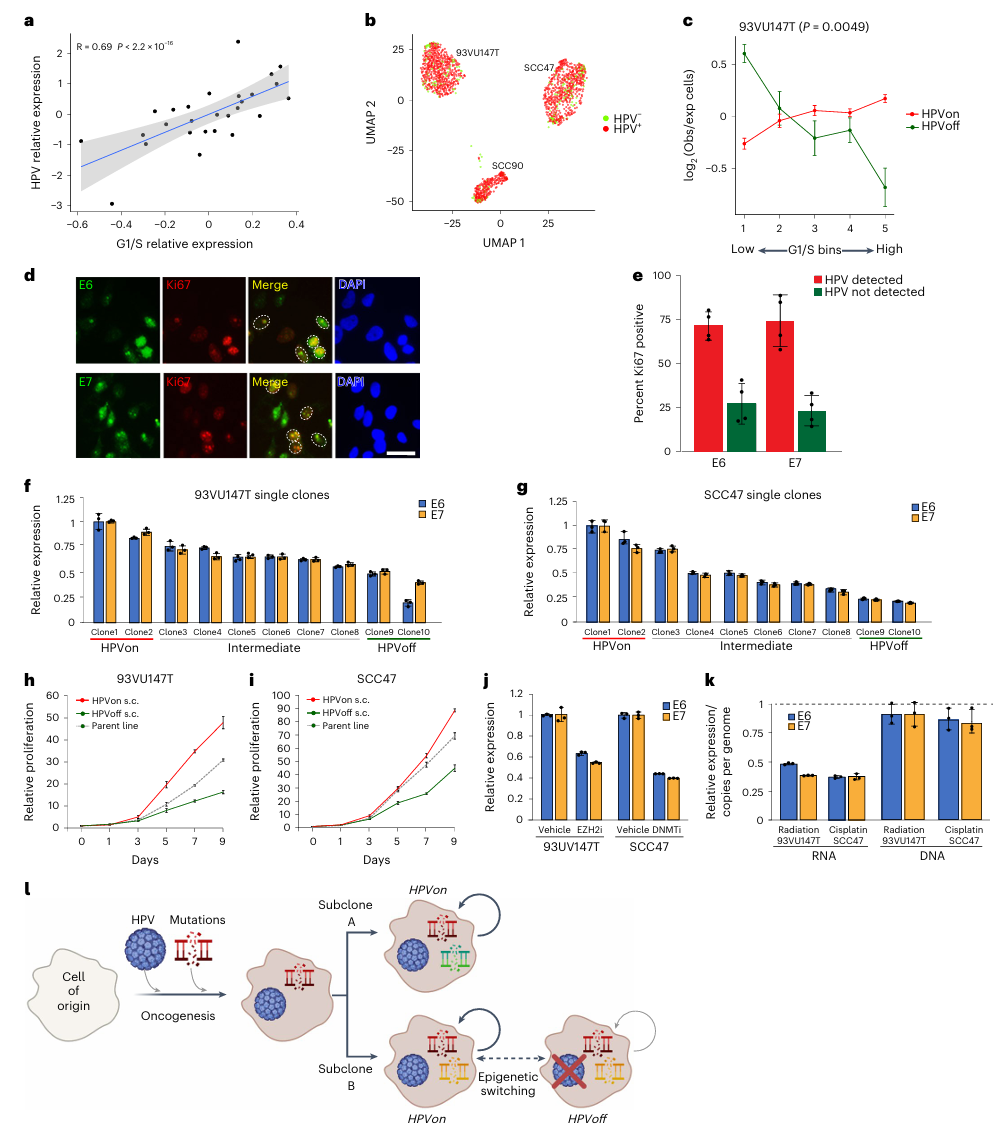
Fig. 5 Regulation and function of HPVoff cells.
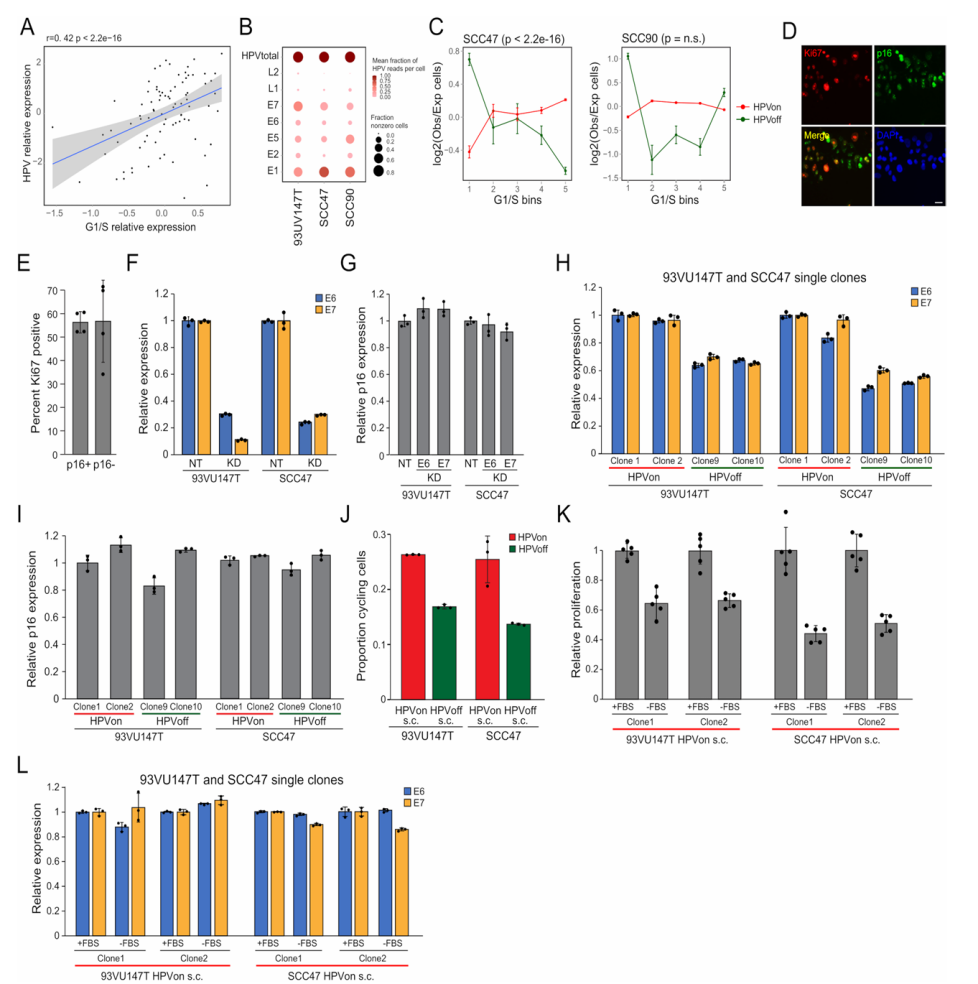
Extended Data Fig. 7 Regulation and function of HPVoff cells, related to Fig. 5.
9. HPVoff细胞受表观遗传调控,可能与其侵袭性和耐药性有关
①HPVon和HPVoff克隆相比,HPV基因的基因组拷贝数相当而表达存在差异,且DNAScope原位杂交实验并未显示不同肿瘤之间和肿瘤内部E6和E7的实质性差异。这些结果支持了HPV表达存在表观遗传调控的可能性。(Extended Data Fig.8a-c) ②用EZH2和DNA甲基转移酶(DNMT)这两种表观遗传调控因子的抑制剂处理HPV阳性细胞系,验证表观遗传的调控作用:结果表明表观遗传调节因子可能直接调控HPV的表达和异质性。(Extended Data Fig.8d-f) ③用顺铂处理SCC47细胞系和用放疗处理93UV147T细胞系,研究HPV表达的异质性对癌症表型的影响:HPVon细胞异常的细胞周期活性可能会使它们易受标准癌症疗法的影响,而增殖能力较弱的HPVoff细胞则可能会降低对此类疗法的易感性。此外,HPVoff克隆的侵袭性比HPVon克隆更强。(Extended Data Fig.8g-j)
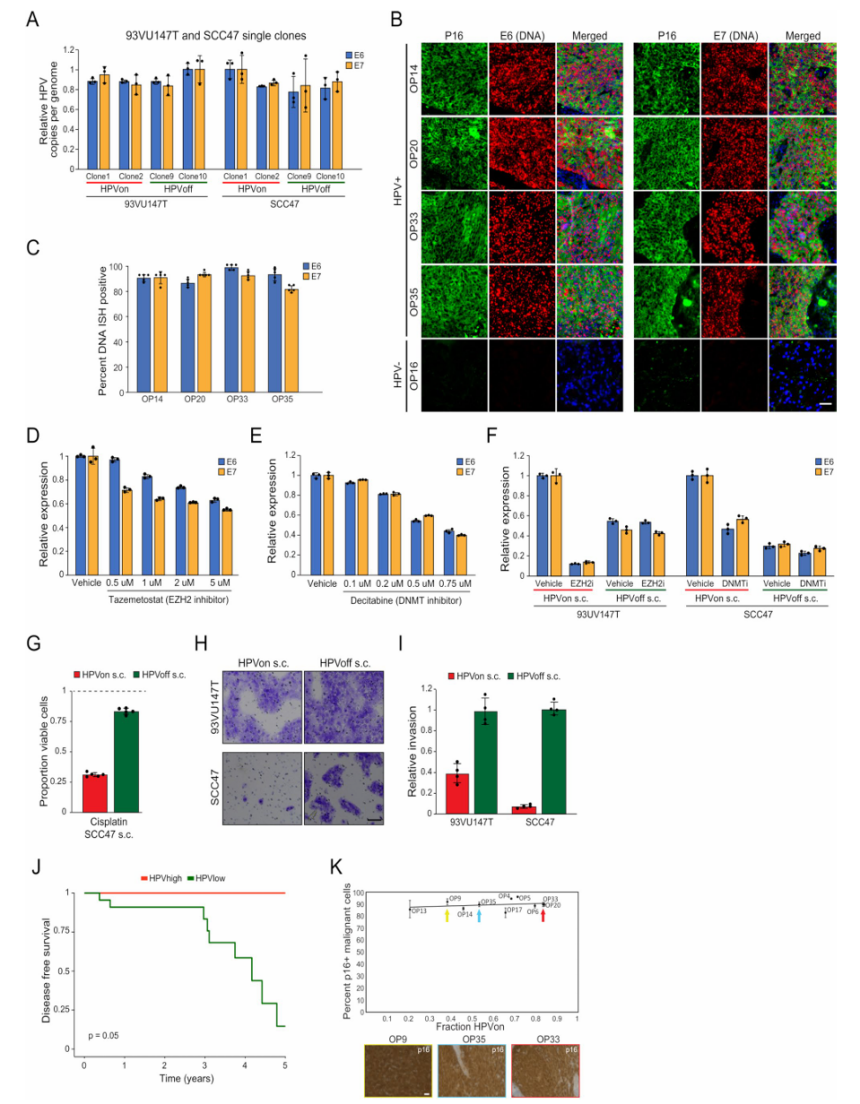
Extended Data Fig. 8 Functional impact of HPVoff cells and p16 expression, related to Fig. 5.
结论:
OPSCC单细胞图谱显示,由致癌病毒(在本研究中为HPV)编码的基因可能会在一部分细胞中停止表达,降低细胞致癌特性的同时也降低了细胞对治疗的反应性,这可能会使恶性细胞在抗肿瘤治疗中存活下来,之后重新表达病毒编码的致癌基因并恢复肿瘤的生长。
汇报人:吴桂儀
导师:赵宇
编辑:陈秋蓉
审核:任建君、胥飞宇



