精读分享│【Nature Immunology】:低亲和力T细胞驱动小鼠和人类的内源性肿瘤免疫
英文题目:Low-avidity T cells drive endogenous tumor immunity in mice and humans
中文题目:低亲和力T细胞驱动小鼠和人类的内源性肿瘤免疫
期刊:Nature Immunology(IF: 27.6)
单位:美国康涅狄格大学医学院免疫学系和尼格综合癌症中心、计算机科学与工程系
发表时间:2025年02月09日



摘要:
T细胞识别肿瘤细胞表面的新抗原肽-MHC-I类分子。T细胞受体与肽-MHC-I类分子之间的相互作用强度(或亲和力/多价亲和性)是免疫控制肿瘤的关键因素。在此,研究者分析了不同亲和力的新抗原特异性CD8细胞,发现低亲和力T细胞是小鼠体内癌症控制的唯一介导者,并且是小鼠和人类中唯一对免疫检查点阻断疗法产生应答的细胞群体。而高亲和力T细胞不仅抗肿瘤无效,反而具有免疫抑制作用。这些差异的机制基础在于高亲和力T细胞更严重的耗竭状态。高亲和力T细胞具有独特的转录组特征,研究者利用该特征计算“亲和力评分”,并以此在体外识别小鼠和人类中的低亲和力和高亲和力T细胞。令人意外的是,具有相同T细胞受体的CD8+T细胞在亲和力上存在显著差异,这表明T细胞活性存在其它的调控层次。除加深对内源性T细胞对癌症反应的理解外,这些发现可能为未来免疫治疗策略提供指导。
研究思维导图:
(1)研究总览:
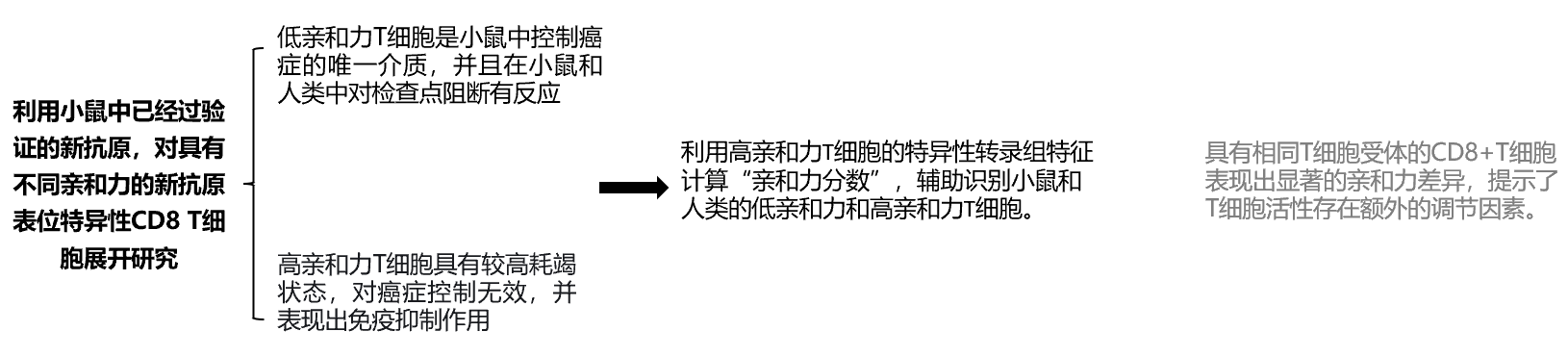
(2)分析思路:

研究背景:
1. CD8+T细胞通过识别肿瘤细胞上MHC-I分子呈递的抗原肽来介导抗肿瘤免疫反应。在T细胞层面,这种识别是依赖T细胞受体(TCRs)实现的。尽管TCR与肽-MHC-I复合物(pMHC-I)的亲和力是T细胞与肿瘤细胞相互作用的核心决定因素,但其他因素,如T细胞表面的TCR分子数量、肿瘤细胞表面的同源pMHC-I复合物数量以及T细胞表面的共受体的表达水平,均会影响TCR-pMHC-I相互作用的有效强度,即TCR亲和力。
2. TCR-pMHC-I之间的相互作用强度(或亲和力)是免疫控制肿瘤的关键因素,大量研究围绕不同抗原类型探究TCR亲和力在对控制肿瘤的影响,包括未突变的自身抗原、外源抗原、作为肿瘤抗原表达的模型抗原、隐性抗原或致癌基因产物等。
3. 与自身抗原、模型抗原、癌基因编码抗原和外源抗原相比,肿瘤新抗原已成为驱动小鼠和人类抗肿瘤免疫应答中关键的刺激物和关键靶点。CD8+T和CD4+T细胞对新抗原的应答是当前研究的重点,但TCR亲和力在内源性CD8+T细胞对新抗原的反应中的作用尚未明确。
主要结果:
1.内源性CD8+T细胞对肿瘤新抗原反应的研究模型
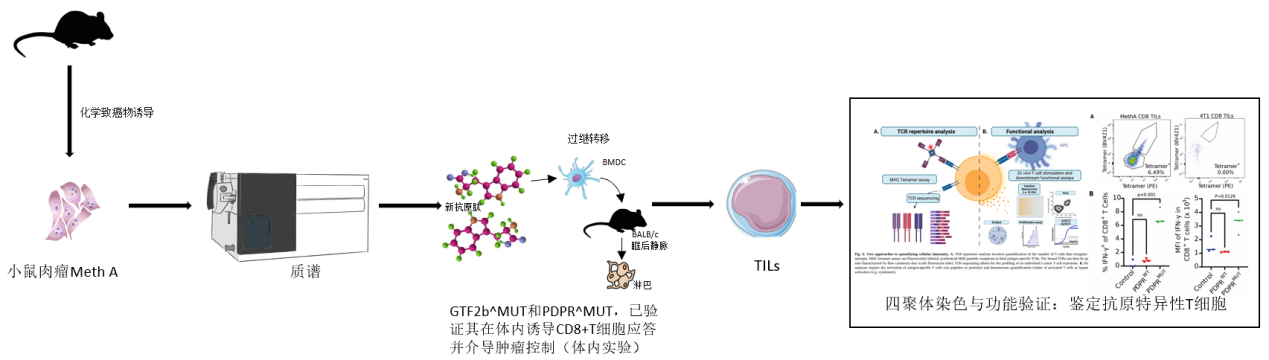
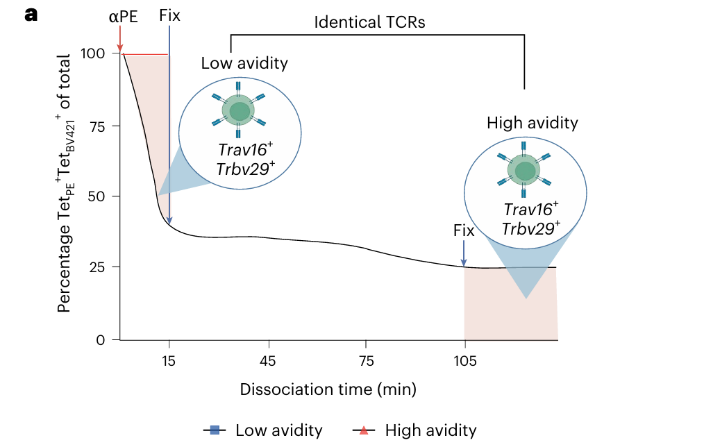
2.改良四聚体染色测定法
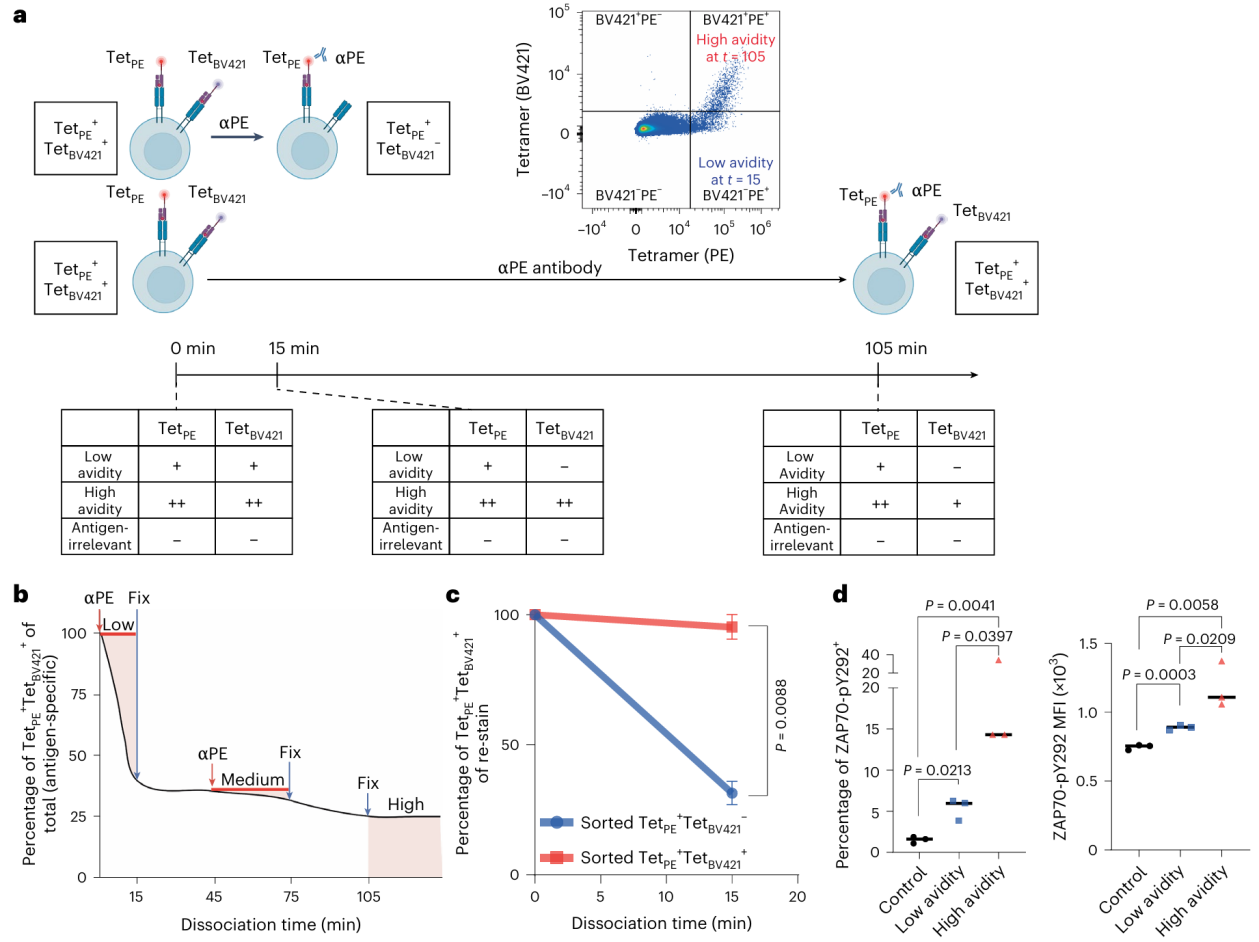
传统四聚体染色实验仅能通过解离速度区分高亲和力T细胞,但难以有效解析低亲和力与中等亲和力细胞之间的差异。因此该研究对该传统检测方法进行了改进,以实现从异质性T细胞群体中对低亲和力、中亲和力和高亲和力抗原特异性T细胞亚群的分离制备和功能特征分析(Fig. 1a-f)。在IFN-γ分泌、细胞毒性等体外实验中,中亲和力细胞表现更接近低亲和力细胞,与高亲和力细胞的功能有差异,未形成独立的功能表型,故未被纳入后续主要分析。

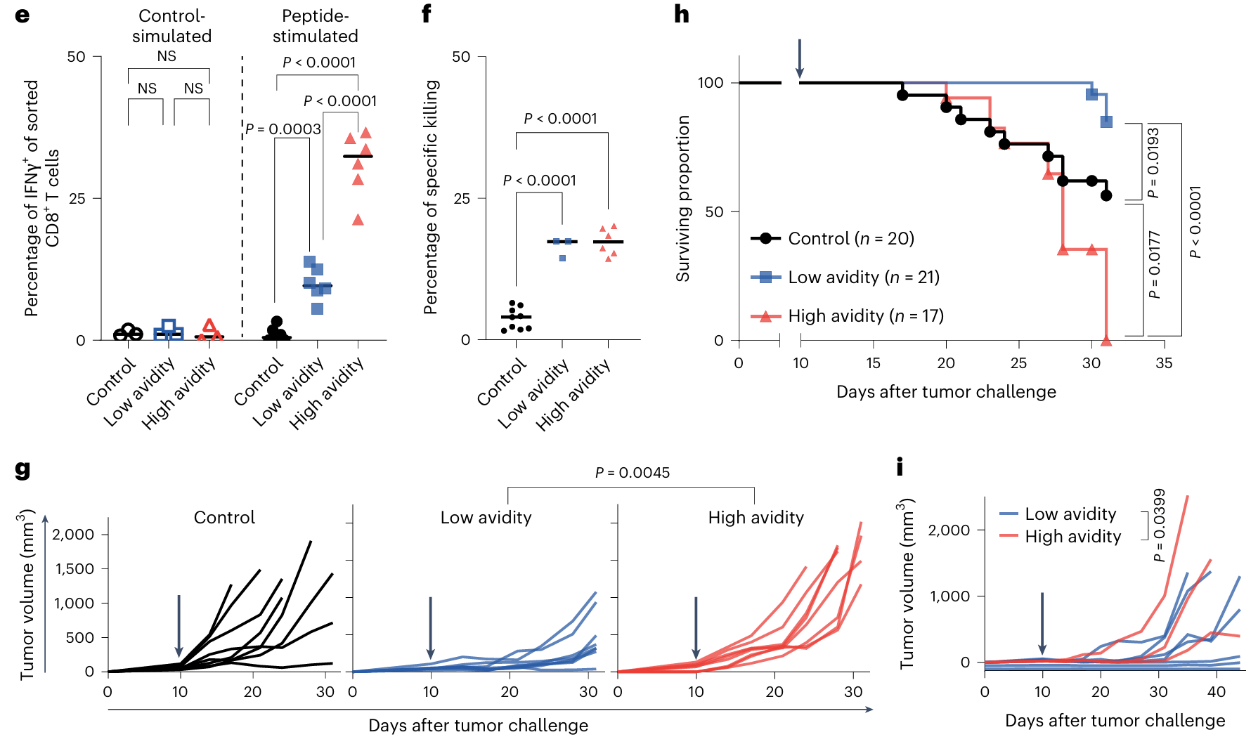

3.肿瘤控制完全依赖于低亲和力T细胞
研究者分别在体内测试了抗原特异性低亲和力和高亲和力T细胞的肿瘤控制能力。
将1000个对照组(四聚体阴性)、低亲和力或高亲和力细胞静脉注射至携带逐渐长大的、10天龄可触及Meth A肿瘤的小鼠体内,发现:
①接受高亲和力T细胞的小鼠肿瘤生长速度快于接受对照处理的小鼠,而接受低亲和力PDPRMUT特异性T细胞的小鼠肿瘤生长显著减缓或消退(Fig. 1g)。
②接受低亲和力T细胞的小鼠存活率显著高于接受四聚体阴性T细胞或高亲和力T细胞的小鼠(Fig.1h)。
③在识别新抗原GTF2bMUT的抗原特异性T细胞中观察到低亲和力T细胞比高亲和力T细胞的抗肿瘤活性更高(Fig. 1i)。
综上所述,高亲和力CD8+T细胞在体内缺乏抗肿瘤活性(Fig. 1g-i),与低亲和力和高亲和力T细胞在体外具有相当的细胞毒性活性形成鲜明对比(Fig. 1f)。
4.高亲和力T细胞表达耗竭标志物
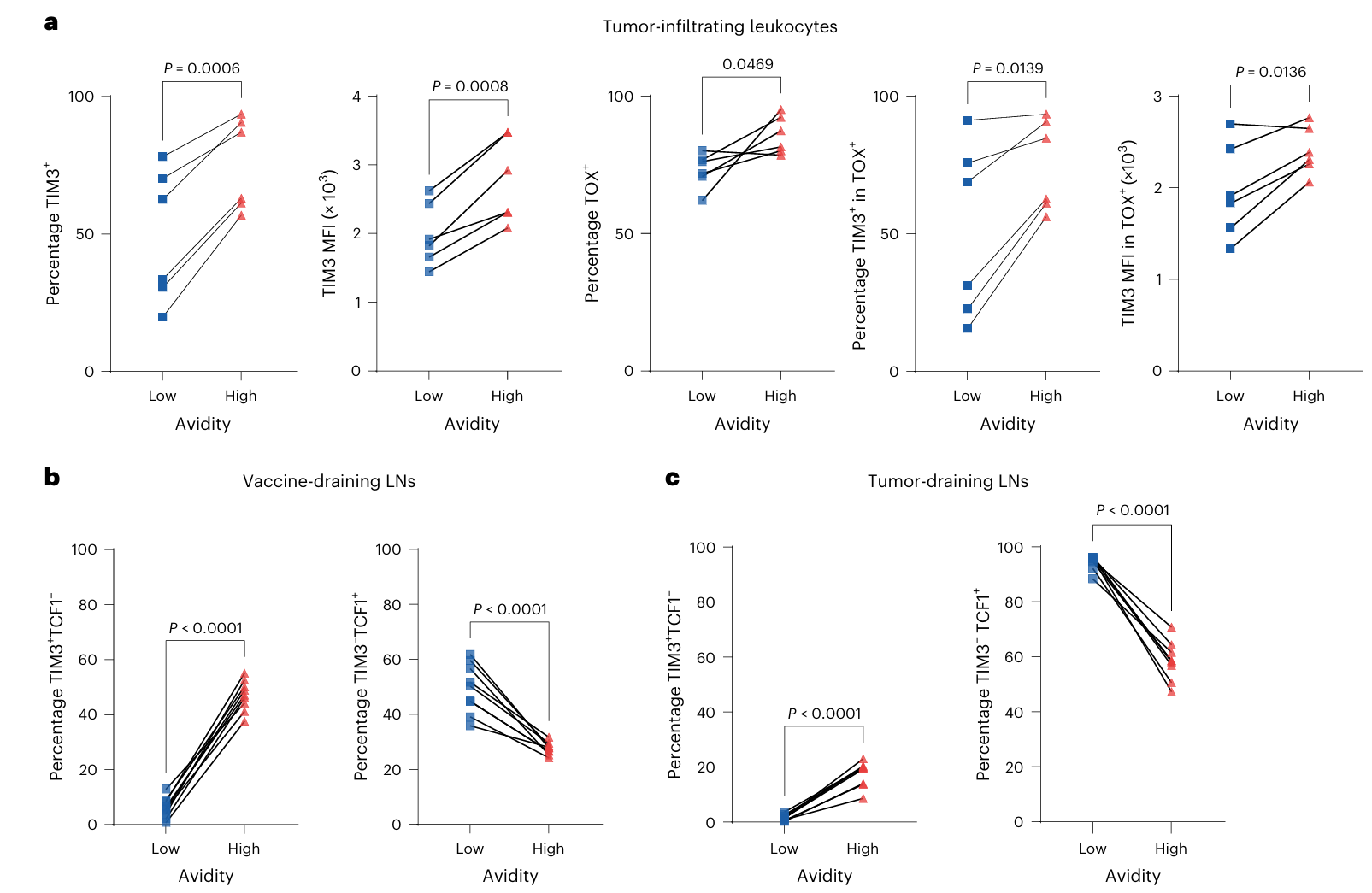
鉴于这种抗肿瘤活性的差异可能源于体内CD8+T细胞的差异性耗竭,对低亲和力和高亲和力T细胞耗竭标志物进行了检测。
①第28天时,对PDPRMUT的特异性低亲和力和高亲和力TIL细胞的TOX和TIM3进行了特征分析(Fig. 2a),结果显示:高亲和力TIL显示TIM3+和TOX+的比例显著更高,提示其处于更深层的耗竭状态。
②在疫苗引流淋巴结(VDLN)和肿瘤引流淋巴结(TDLN)中,检测了低亲和力和高亲和力T细胞中与耗竭相关的标志物表达情况:在疫苗引流淋巴结(Fig. 2b左)和肿瘤引流淋巴结(Fig. 2c左)中,高亲和力T细胞群中TIM3+TCF1−细胞(耗竭细胞群)的比例显著高于低亲和力T细胞群。相反,高亲和力T细胞群在疫苗引流和肿瘤引流淋巴结中均显著低于低亲和力T细胞群的TIM3−TCF1+(干细胞样群)细胞比例(Fig. 2b右&2c右)。这些结果说明,高亲和力 T 细胞更容易在体内失去可塑性与增殖潜能。
③通过多组学测序技术(CITE-seq、scRNA-seq 和 TCR 测序)对不同亲和力的抗原特异性TILs进行了分析。TILs来自肿瘤携带小鼠(n=11),在肿瘤刺激后28天进行分离,并使用针对PD-1、CX3CR1、TIM3和LY108的抗体进行表面细胞转录组和表位测序(CITE-seq)染色,分为低亲和力、中亲和力和高亲和力细胞,进行单细胞RNA测序(scRNA-seq)、TCR测序和CITE-seq测序(Fig. 2d):基于转录组数据将过滤后的CD8+TILs分为五个群集:干细胞样(stem-like)、自然杀伤样(NK-like)、效应耗竭(TEFF-EX)、终末耗竭1(TEX1)和终末耗竭2(TEX2)(Fig. 2e、g、h),所有亲和力水平的T细胞在每个聚类中均被标记(Fig. 2f)。
④基于转录动态和RNA速率的轨迹推断被用于理解PDPRMUT特异性CD8+TILs的分化:干细胞样细胞被预测会分化为自然杀伤细胞样(NK-like)和效应T细胞-耗竭(TEFF-EX)细胞;TEFF-EX细胞随后会分化为TEX1或TEX2细胞(Fig. 2i)。
⑤用流式细胞术检测来自28天Meth A-bearing小鼠的PDPRMUT特异性CD8+TILs,以鉴定分群中观察到的表型,确定低亲和力和高亲和力细胞间是否存在差异分布:干细胞样细胞和TEFF-EX细胞形成低亲和力CD8+TILs的比例明显高于高亲和力的CD8+TILs。此外,PDPRMUT特异性TILs中发现的TEX1和TEX2细胞比例明显低于高亲和力(Fig. 2j)。
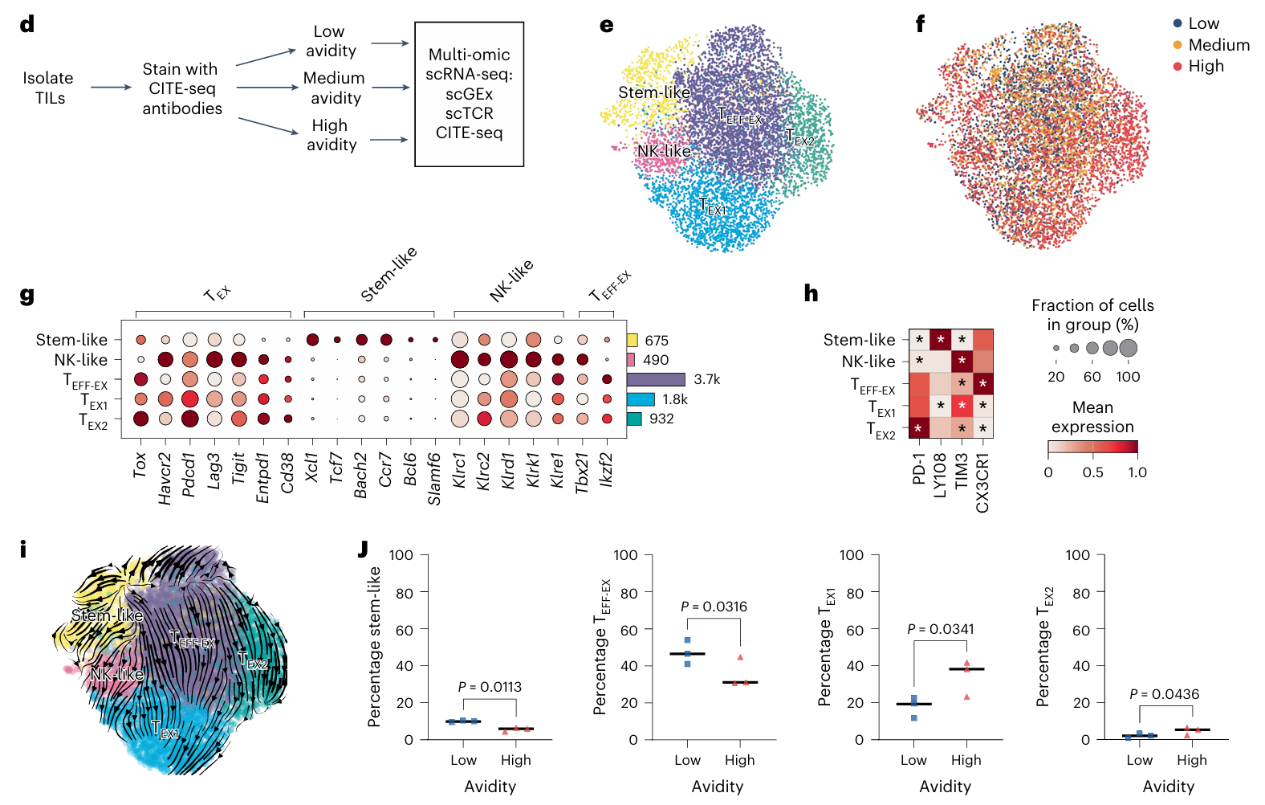

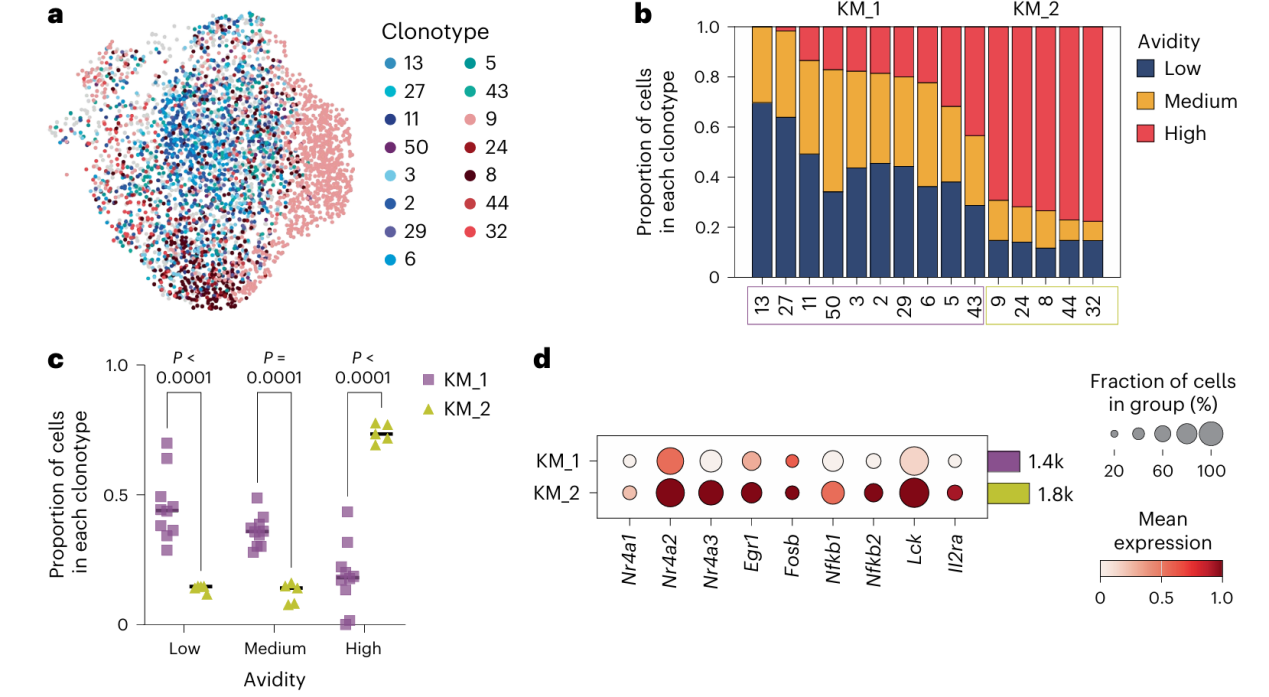
5.T细胞耗竭取决于T细胞受体的亲和力
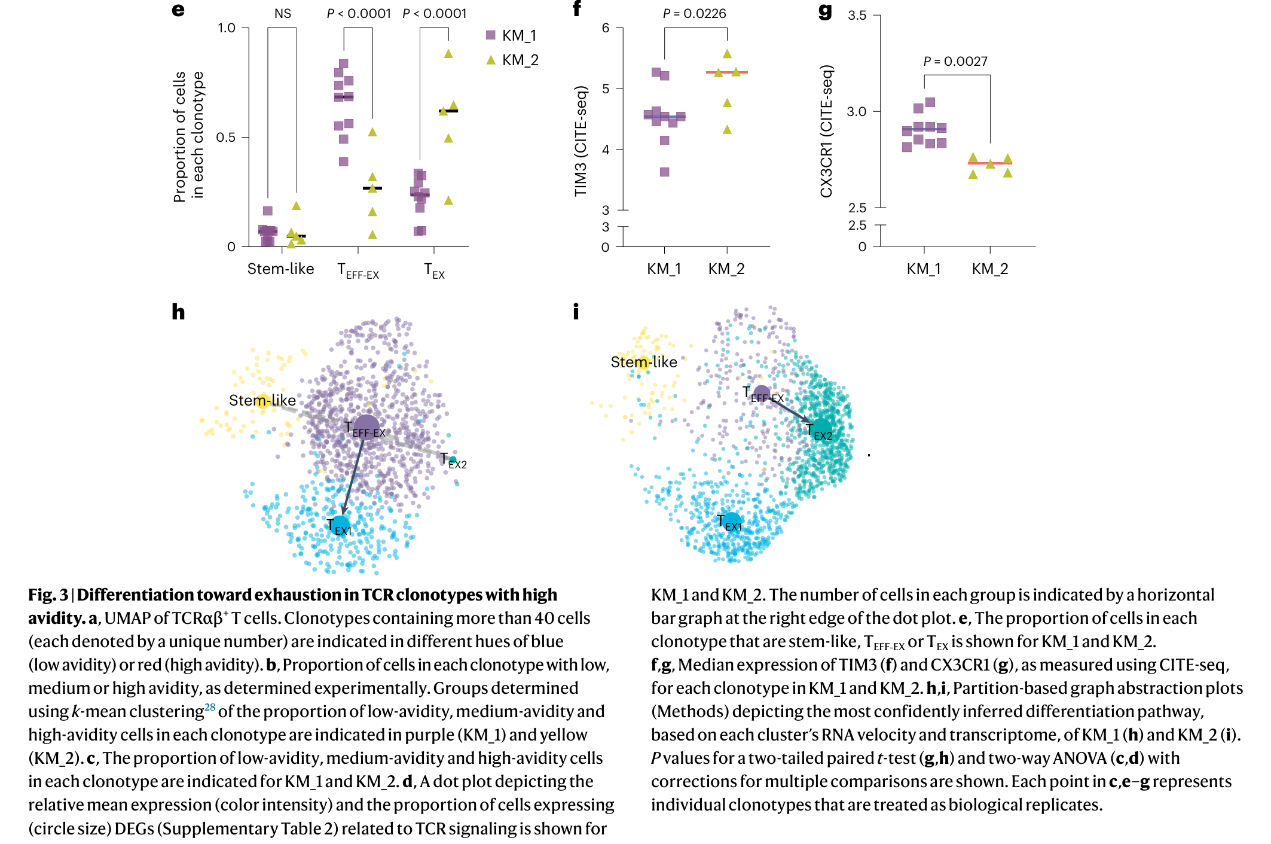
(1)选择具有单对TCRαβ序列(排除TCR序列本身差异对亲和力的影响)且属于克隆型细胞数超过40个(40个以上细胞的克隆型能更稳定地反映该克隆的真实亲和力分布,避免小样本导致的假阳性结论,克服极端值)的PDPRMUT特异性CD8+TILs进行进一步分析:同一克隆型细胞的TCRα和TCRβ的CDR1、CDR2和CDR3核苷酸序列相同。每个克隆型被分配一个唯一的数字标识符和一个颜色(Fig. 3a)。
①将克隆型按 “亲和力分布模式” 分群,K均值聚类确定了两个群:KM_1(中低亲和力细胞为主)和KM_2(高亲和力细胞为主),并确定了低亲和力、中亲和力和高亲和力T细胞在每个克隆型中的比例(Fig. 3b)。
②KM_1组低、中亲和力细胞比例显著高于KM_2组。与KM_1相比,KM_2组具有高亲和力细胞的细胞比例显著增加(Fig. 3c)。
③与KM_1相比,KM_2组细胞表达的与TCR信号或TCR-pMHC亲和力相关的基因水平明显更高(Fig. 3d)。
(2)由于慢性和过量的TCR信号传导会促进T细胞耗竭,探究了TCR亲和力在CD8+TIL向耗竭表型分化中的作用,比较两组间各克隆型中干细胞样、TEFF‐EX和TEX(TEX1和TEX2的总和)的细胞比例:
①与KM_1相比,KM_2组的TEX细胞比例显著增加,TEFF-EX细胞比例显著减少(Fig. 3e)。两组KM间干细胞样细胞比例无差异(Fig. 3e)。
②KM_1组CX3CR1(抗肿瘤)的中位表面表达量(Fig. 3g)显著更高,TIM3的中位表面表达量(Fig. 3f)显著更低。
③KM_1组细胞表达较高水平的细胞毒性相关基因Gzmk和Nkg7,而KM_2组细胞表达较高水平的抑制相关基因,如Tgfb1、Cd274和Entpd1(Extended Data Fig. 6a)。
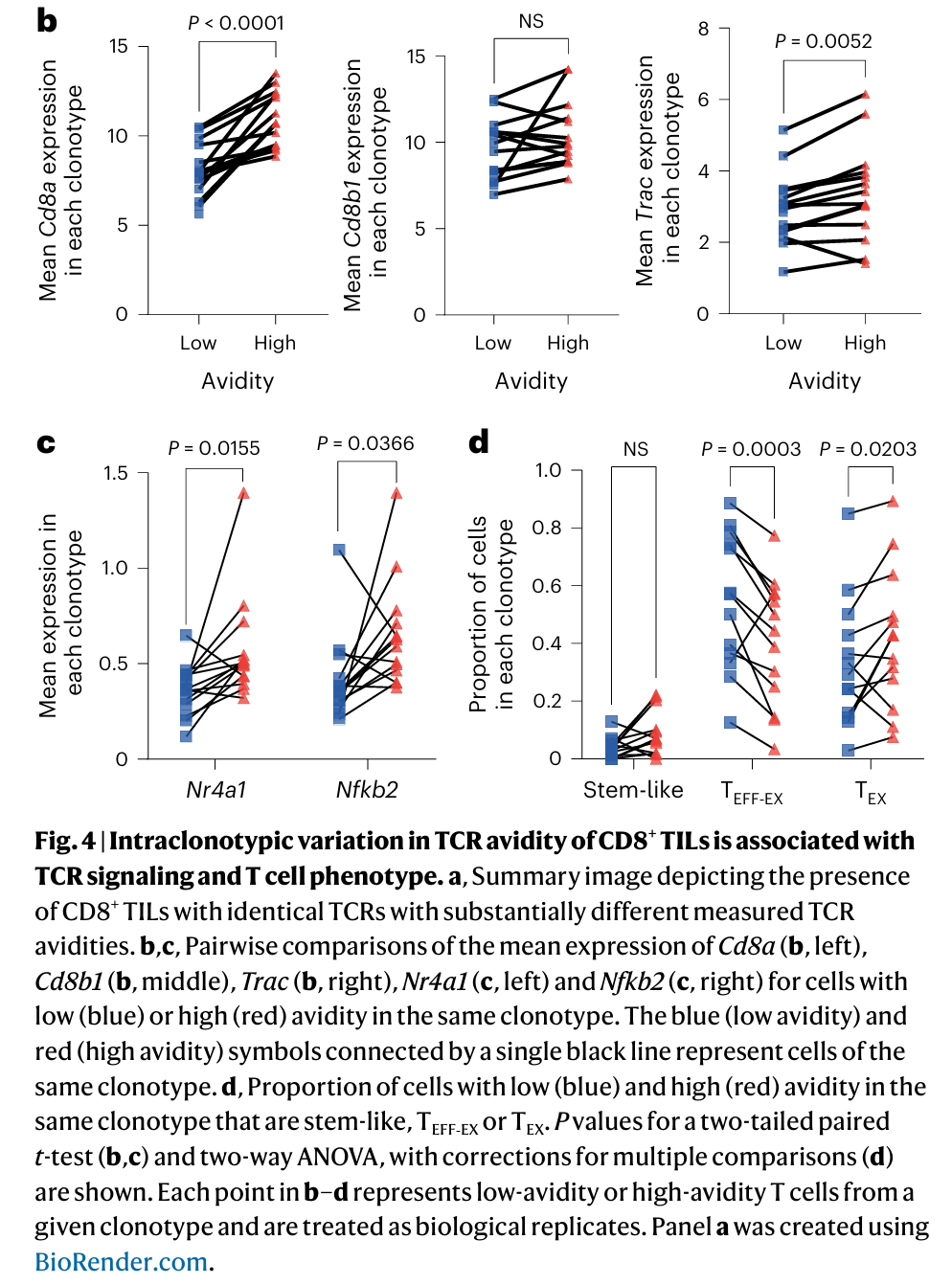
6.克隆型中测得的TCR亲和力存在较大差异
(1)为了进一步了解相同克隆型细胞中所测亲和力的差异,研究者比较了低亲和力和高亲和力细胞中Cd8α(CD8α链直接与 MHC I 类分子的α3结构域结合,增强 TCR-pMHC 的相互作用强度)和Cd8β1(作用更倾向于结构,作为对照明确亲和力差异是否仅由α链介导,而非CD8分子的整体表达变化)的平均表达:
①在给定的克隆型中,具有高亲和力的细胞比具有低亲和力的细胞有更高的Cd8α的平均表达,而非Cd8β1的平均表达。在相同的克隆型中,具有高亲和力的细胞比具有低亲和力的细胞具有更高的TCRα链(Trac,识别和结合抗原)的平均表达(Fig. 4b)。
(2)TCR亲和力的变化与TCR信号的变化有关,因此分析高、低亲和力克隆型细胞TCR信号相关转录因子NR4A1(在持续抗原刺激下高表达,促进耗竭标志物表达)和NFKB2(激活程度反映 TCR 信号的持续强度)的变化:
①NR4A1和NFKB2在高亲和力T细胞中的平均表达明显高于相同克隆型的低亲和力T细胞(Fig. 4c)。
②在相同的克隆型中,高亲和力群体比低亲和力群体包含更多的TEX(耗竭) 细胞和更少的TEFF-EX(前效应)细胞(Fig. 4d)。
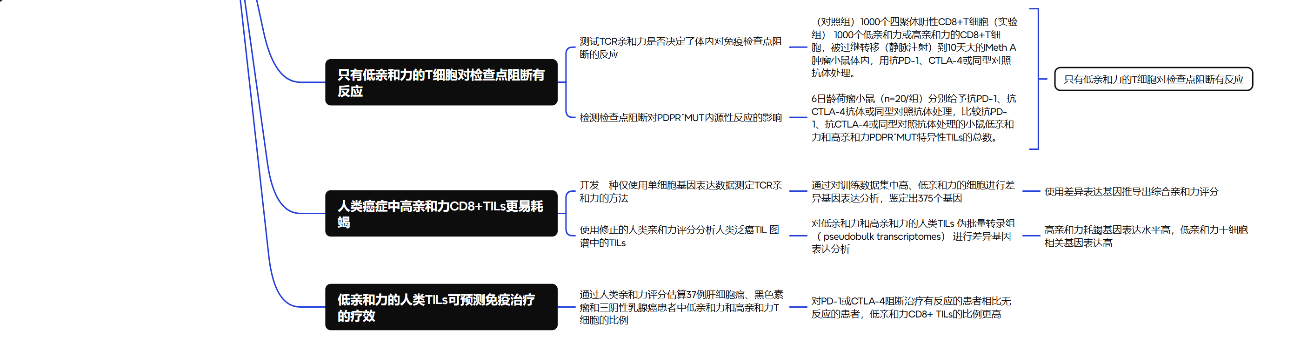
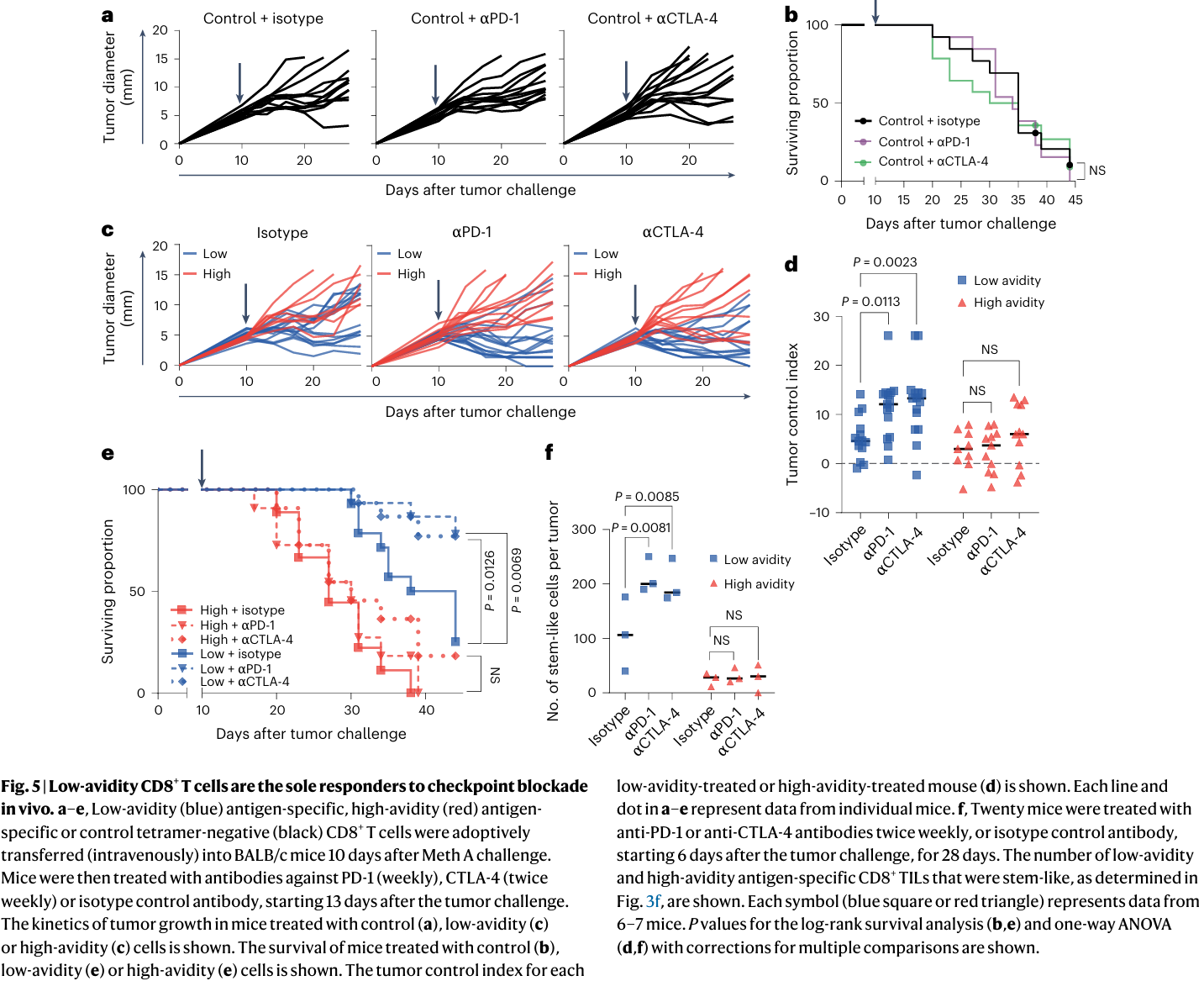
7.只有低亲和力的T细胞对检查点阻断有反应
(1)测试TCR亲和力是否决定了体内对免疫检查点阻断的反应:(对照组)1000个四聚体阴性CD8+T细胞(实验组) 1000个低亲和力或高亲和力的CD8+T细胞,被过继转移(静脉注射)到10天大的Meth A肿瘤小鼠体内,用抗PD-1、CTLA-4或同型对照抗体处理。
①通过生长动力学或生存率测量,两种处理对肿瘤生长都没有任何影响(Fig. 5a、b)。
②PD-1或CTLA-4增强了低亲和力PDPR^MUT特异性T细胞的抗肿瘤活性,但对高亲和力T细胞的活性没有影响(Fig. 5c、d)。
③体内接受低亲和力T细胞的小鼠存活率改善,高亲和力T细胞处理的小鼠生存率没有这种改善(Fig. 5e)。
(2)检测了检查点阻断对PDPR^MUT内源性反应的影响:6日龄荷瘤小鼠(n=20/组)分别给予抗PD-1、抗CTLA-4抗体或同型对照抗体处理,比较抗PD-1、抗CTLA-4或同型对照抗体处理的小鼠低亲和力和高亲和力PDPR^MUT特异性TILs的总数。
①经PD-1或CTLA-4抗体处理的小鼠中,低亲和力的干性TILs数量增加;在高亲和力的干细胞样TILs中没有观察到这种变化(Fig. 5f)。表明检查点阻断的有效成分来源于低亲和力 T 细胞,而非高亲和力 T 细胞。
8.人类癌症中高亲和力CD8+TILs更易耗竭
(1)开发仅使用单细胞基因表达数据测定TCR亲和力的方法:
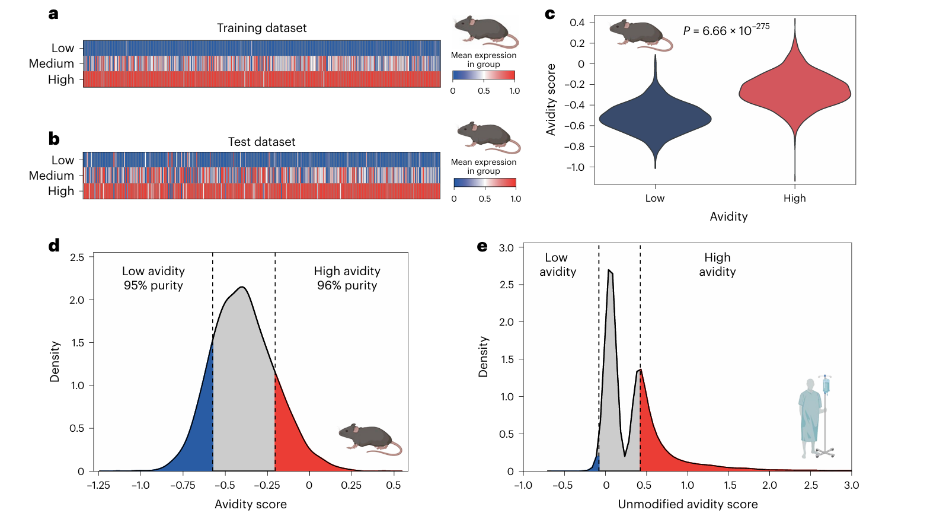
①将所有抗原特异性CD8+TILs平均分为训练集和测试集。通过对训练数据集中高、低亲和力的细胞进行差异基因表达分析,鉴定出375个基因(Fig. 6a、b)。使用这些差异表达基因(DEGs)推导出综合亲和力评分。
(2)使用亲和力评分分析人类泛癌TIL图谱(包括来自8种癌症类型的36例癌症患者的CD8+TILs的scRNA-seq数据)中的TILs。为了消除干扰,研究了构成小鼠亲和力评分基础的375个DEGs和由ARCHS4数据库预测的2703个TCR信号相关转录因子的基因靶点之间的共同基因,得出97个基因作为人类亲和力评分的基础。
(3)对低亲和力和高亲和力的人类TILs伪批量转录组(pseudobulk transcriptomes)进行差异基因表达分析:
①结果显示高亲和力TILs中耗竭相关基因的表达显著更高;低亲和力TILs则表达了更高水平的干细胞相关基因(Fig. 6g)。
②人类亲和力评分认为具有高亲和力的人类TILs表达的CD8A和TRAC水平明显高于具有低亲和力的T细胞(Extended Data Fig. 7)。
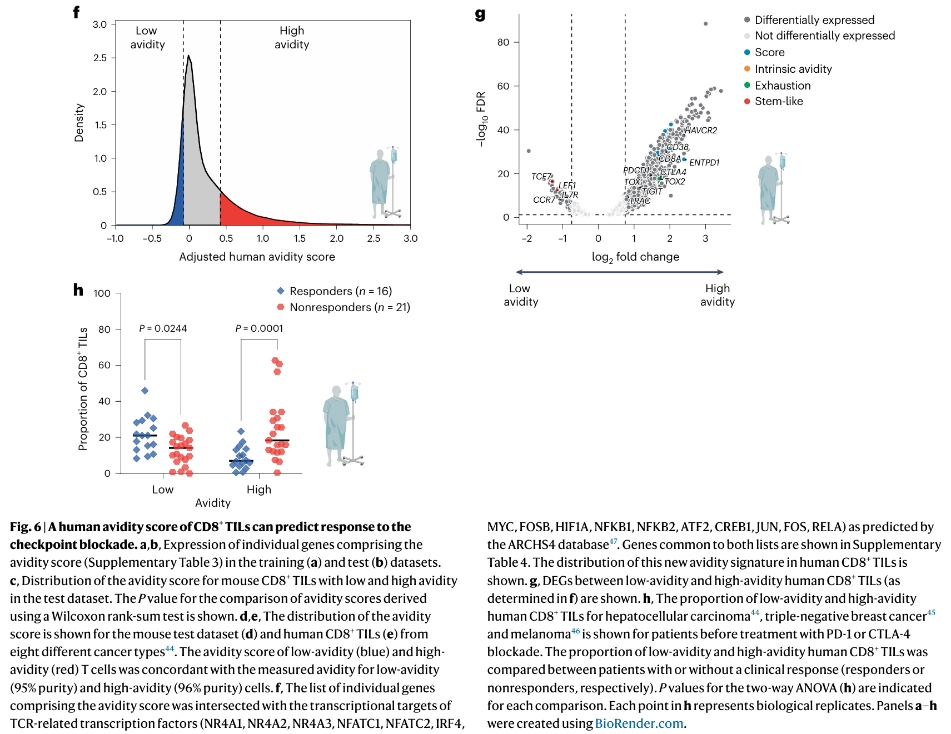
9.低亲和力的人类TILs可预测免疫治疗的疗效
利用37例肝细胞癌、黑色素瘤和三阴性乳腺癌患者的人类CD8+TILs scRNA-seq,通过人类亲和力评分估算每位患者中低亲和力和高亲和力T细胞的比例:
对PD-1或CTLA-4阻断治疗有反应的患者(根据实体瘤疗效评价标准(RECIST)或改良的RECIST标准)与无反应患者相比,低亲和力CD8+ TILs的比例显著更高(P < 0.05),而高亲和力CD8+TILs的比例显著更低(P < 0.001)(Fig. 6h)。

汇报人:吴桂儀
导师:赵宇
审核:向琳、任建君



