精读分享│:复杂的基因重排推动ER+和HER2+乳腺肿瘤的发展
英文题目: Complex rearrangements fuel ER+ and HER2+ breast tumours
中文题目:复杂的基因重排推动ER+和HER2+乳腺肿瘤的发展
期刊:Nature(IF=48.5)
单位:斯坦福大学医学中心

Abstract
Breast cancer is a highly heterogeneous disease whose prognosis and treatment as defined by the expression of three receptors—oestrogen receptor (ER), progesterone receptor and human epidermal growth factor receptor 2 (HER2; encoded by ERBB2)—is insufficient to capture the full spectrum of clinical outcomes and therapeutic vulnerabilities. Previously, we demonstrated that transcriptional and genomic profiles define eleven integrative subtypes with distinct clinical outcomes, including four ER+ subtypes with increased risk of relapse decades after diagnosis. Here, to determine whether these subtypes reflect distinct evolutionary histories, interactions with the immune system and pathway dependencies, we established a meta-cohort of 1,828 breast tumours spanning pre-invasive, primary invasive and metastatic disease with whole-genome and transcriptome sequencing. We demonstrate that breast tumours fall along a continuum constrained by three genomic archetypes. The ER+ high-risk integrative subgroup is characterized by complex focal amplifications, similar to HER2+ tumours, including cyclic extrachromosomal DNA amplifications induced by ER through R-loop formation and APOBEC3B-editing, which arise in pre-invasive lesions. By contrast, triple-negative tumours exhibit genome-wide instability and tandem duplications and are enriched for homologous repair deficiency-like signatures, whereas ER+ typical-risk tumours are largely genomically stable. These genomic archetypes, which replicate in an independent cohort of 2,659 primary tumours, are established early during tumorigenesis, sculpt the tumour microenvironment and are conserved in metastatic disease. These complex structural alterations contribute to replication stress and immune evasion, and persist throughout tumour evolution, unveiling potential vulnerabilities.
摘要
乳腺癌是一种高度异质性疾病,仅通过雌激素受体(ER)、孕激素受体和人表皮生长因子受体2(HER2,由ERBB2基因编码)的表达来判断其预后和治疗,尚不足以涵盖其全部的临床结果和治疗上的弱点。之前,研究者通过转录和基因组学特征定义了11种具有不同临床结果的整合亚型,其中包括4种在诊断数十年后仍有复发风险增加的ER+亚型。在此,为了确定这些亚型是否反映了不同的进化历史、与免疫系统的相互作用以及通路依赖性,研究者建立了一个包含1828例乳腺肿瘤的元队列,覆盖了原位癌、原发浸润癌和转移癌,并进行了全基因组和转录组测序。研究者发现乳腺肿瘤沿着由三种基因组原型限定的连续谱分布。ER+高风险整合亚组的特征是复杂的局灶性扩增,类似于HER2+肿瘤,包括由ER通过R环形成和APOBEC3B编辑诱导的循环型细胞外染色体DNA扩增,这些扩增起源于原位癌病变。相比之下,三阴性肿瘤表现出全基因组不稳定性、串联重复,并富含同源修复缺陷样特征,而ER+典型风险肿瘤在基因组上大多保持稳定。这些基因组原型在2659例原发肿瘤的独立队列中得到复制,它们在肿瘤发生早期就已形成,塑造了肿瘤微环境,并在转移性疾病中得以保留。这些复杂的结构改变有助于复制应激和免疫逃逸,并在整个肿瘤进化过程中持续存在,揭示了潜在的弱点。
研究背景:
乳腺癌作为女性中最常见的恶性肿瘤,传统上依据雌激素受体(ER)、孕激素受体及HER2的表达情况被分为三种亚型:ER+HER2−、HER2型和三阴性乳腺癌(TNBC)。然而,这种分类方式在预后评估和治疗指导方面存在局限性。既往研究通过整合基因组和转录组特征,进一步将乳腺癌细分为11种亚型,其中ER+乳腺癌患者存在一个“高风险”亚组,具有较高的远处复发风险,且该亚组富含局灶性癌基因扩增和过表达的肿瘤。尽管如此,这些亚型的起源、进化过程以及肿瘤免疫微环境(TME)特征仍不清楚。为了深入探究这些问题,研究者们对涵盖原位导管癌、原发性和转移性病变的1828例乳腺肿瘤样本进行了全基因组和转录组测序,并借助机器学习框架,仅从DNA特征出发来确定IC亚型。研究结果揭示了乳腺癌的三种主要基因组原型,分别为TNBC、典型风险ER+HER2−以及高风险ER+HER2−和HER2+。其中,高风险亚型以早期、反复的扩增为特征,包括因APOBEC3B(A3B)在ER诱导的R环上编辑而产生的细胞外染色体DNA(ecDNA)。这些复杂的基因组重排模式,伴随不同的TME,被认为是免疫逃逸的主要驱动因素,并在侵袭性亚组中暴露出新的治疗弱点。
研究方法和思路:
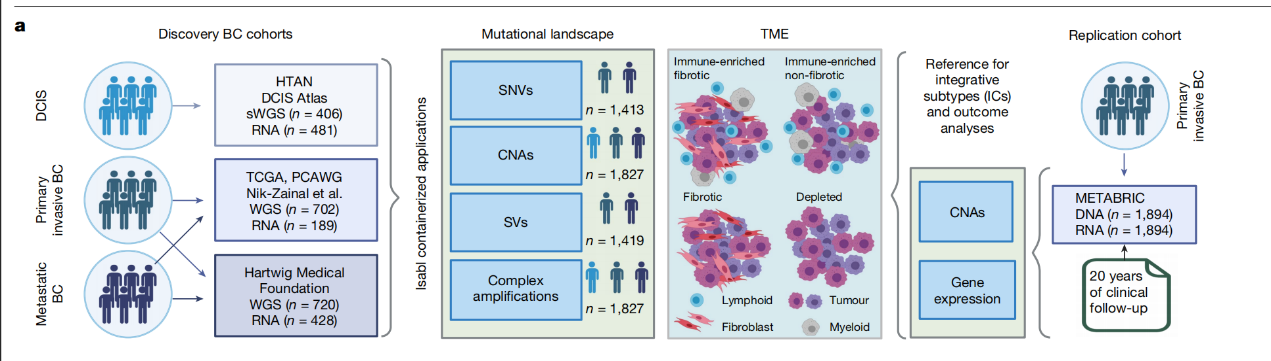
研究首先利用多个发现性队列,包括HTAN、TCGA、PCAWG和Hartwig Medical Foundation的数据,对乳腺癌样本进行全基因组和转录组测序,分析突变特征和肿瘤微环境(TME)。随后,通过独立验证队列METABRIC,对整合亚型(ICs)和结果进行验证,并结合20年的临床随访数据,评估基因组原型与临床结果的相关性。
研究结果:
IC亚群的演变
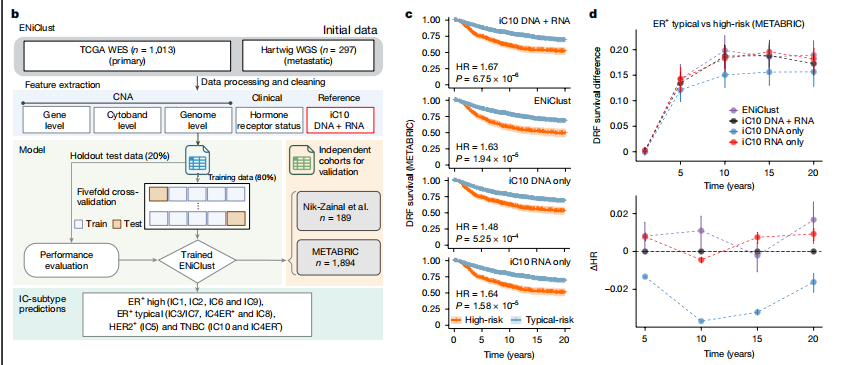
研究深入分析了乳腺癌的整合亚型(IC)的演变过程。通过对1828个样本(包括DCIS、原发性和转移性病变)进行统一的生物信息学分析,识别了单核苷酸变异(SNVs)、拷贝数异常(CNAs)、结构变异(SVs)、环状染色体外DNA(ecDNA)和突变特征。结合METABRIC队列的1894个原发性浸润性肿瘤样本和约20年的临床随访数据,该研究开发了一种名为Ensemble Integrative Clustering(ENiClust)的新方法,能够从全外显子测序或全基因组测序(WGS)数据中准确推断IC亚型(图b展示了开发流程)。从图c、d可以看出,ENiClust的预测结果优于现有的方法,能够更好地对患者进行分层。通过ENiClust分析,发现不同疾病阶段IC亚型的分布存在差异,DCIS中IC5亚型较为丰富,而转移性肿瘤中ER+高风险亚型更为常见。此外,从原位到转移,IC亚型基本保持稳定,这表明乳腺癌亚型的演变可能在肿瘤发生的早期阶段就已经确定。
早期IC特异性结构变异推动肿瘤进展
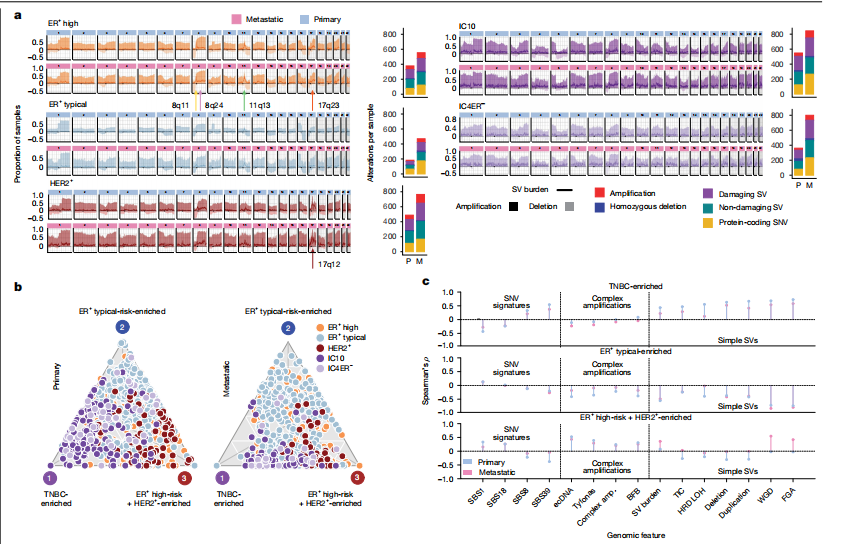
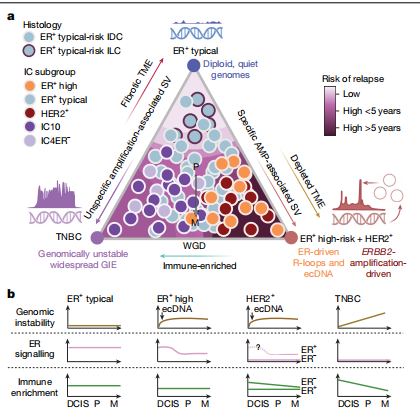
研究利用ENiClust分析揭示了乳腺癌IC亚型在疾病进展中具有独特的SV和CNA特征,图a显示HER2+和ER+高危原发性及转移性肿瘤在特定扩增位点如17q12的ERBB2区域SV负担显著增加,表明复杂结构变异如ecDNA可能是ERBB2扩增的驱动因素,而ER+典型风险肿瘤在转移阶段的突变负担因治疗而增加。IC10和IC4ER−肿瘤表现出全基因组不稳定性及SV负担增加,但IC4ER−肿瘤在致病性SV和DNA修复通路改变上相对较少,这些亚型特异性改变在DCIS阶段就已存在,强调了早期癌基因成瘾和恶性转化机制的重要性。进一步分析702例原发性乳腺癌的CNA和SV特征,发现RS3、RS5和CN17在IC10肿瘤中富集,而RS4、RS6和CN7在ER+高危和HER2+肿瘤中富集,ER+典型风险肿瘤则富集CN1,图b显示这些肿瘤的基因组特征在二维平面上形成一个连续体,映射出三个主要的基因组原型:TNBC富集型、ER+典型风险富集型和ER+高危+HER2+富集型,其中TNBC富集型与基因组不稳定性、HRD和APOBEC编辑SNV呈正相关,ER+高危+HER2+富集型与复杂扩增、活性氧和APOBEC相关SNV呈正相关,而ER+典型风险富集型与大多数基因组特征呈负相关。图c显示这些基因组原型在2229例原发性肿瘤的独立队列中得到验证,并在转移瘤中得以保留,表明这些复杂结构变异在疾病早期发生并贯穿整个转移过程。尽管ER+典型风险肿瘤预后较好,但仍有29%的患者出现远处复发,且研究发现基因组原型可改善风险分层,复发肿瘤更接近ER+高危+HER2+原型,伴有更高的HRD杂合性缺失评分、浸润性小叶癌(ILC)组织学和增殖增加,在METABRIC队列中,ILC在ER+典型风险肿瘤中富集,且与更高的复发风险相关。
ER诱导的R环促进ecDNA的形成
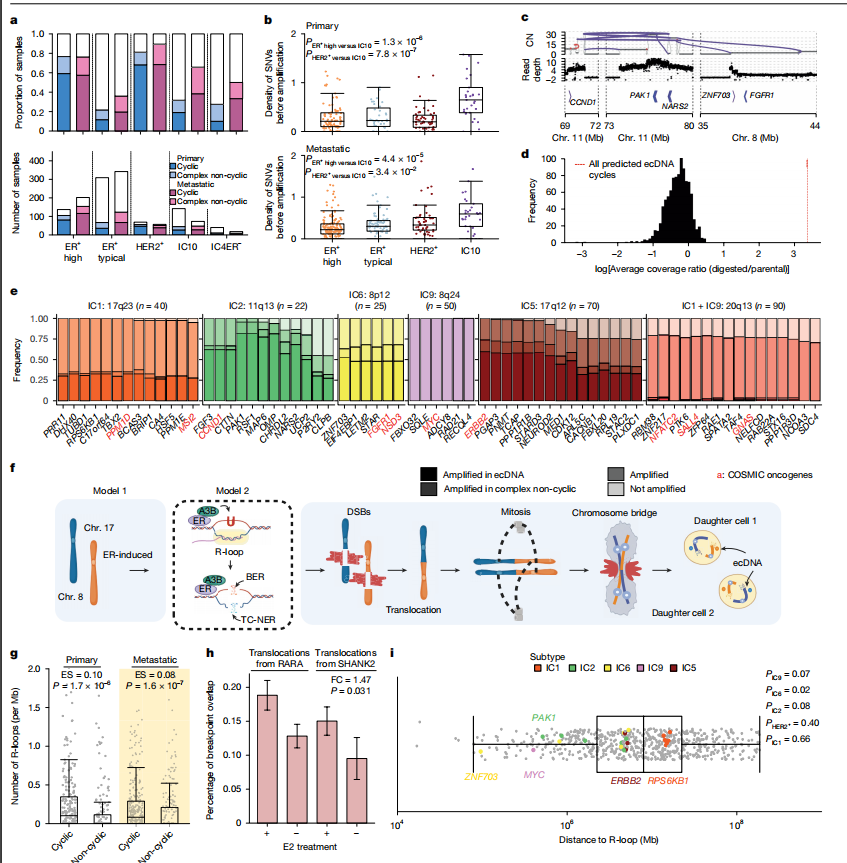
ER+高危和HER2+乳腺癌肿瘤在两个独立队列中均表现出复杂扩增的富集现象,这促使研究者进一步探究其起源和特性。利用两种独立的ecDNA推断方法,预测43-67%的原发性ER+高危和HER2+病例携带ecDNA。部分HER2+原发性肿瘤在ER+高危亚组特异的位点上表现出扩增,其中8.57%预测为ecDNA。此外,研究还观察到在原发性肿瘤中11q13位点的倒位有适度的富集。在原发性ER+高危和IC10肿瘤中,HRD和ecDNA是互斥的。通过浅层全基因组测序(WGS)分析了406例原位导管癌(DCIS),预测出35个循环和205个复杂非循环扩增,这些扩增在ER+高危+HER2+肿瘤中富集。这些数据表明,ER激活通过R环形成和A3B编辑促进了循环扩增,强调了它们在肿瘤早期发生中的作用。
IC亚型具有独特的肿瘤微环境
研究通过分析转录组数据,对原发性和转移性肿瘤的肿瘤微环境(TME)进行了特征化,识别出四种由免疫浸润和基质组成定义的亚型:免疫富集纤维化型、免疫富集非纤维化型、纤维化型和耗竭型。研究结果表明,IC10和IC4ER-亚型肿瘤富含免疫富集型TME,而ER+高危和HER2+原发性肿瘤则表现出免疫耗竭型TME。相比之下,基因组稳定的ER+典型风险和IC4ER-原发性肿瘤则富含纤维化特征。此外,研究发现43.86%的原发性和47.67%的转移性肿瘤表现出遗传性免疫逃逸(GIE),其中20%的肿瘤携带结构变异(SVs)或复杂扩增。HER2+肿瘤在原发和转移病变间GIE的增加最为显著,这可能与逃避抗HER2疗法的压力有关。这些数据揭示了复杂结构变异在免疫逃逸和肿瘤免疫共同进化中的作用。
讨论:
研究深入探讨了乳腺癌的三种主要基因组原型,这些原型由不同的突变过程驱动,并与临床乳腺癌亚型存在显著关联。ER+高风险和HER2+亚型的肿瘤表现出与HER2+肿瘤相似的突变特征,这些肿瘤可能对针对其致癌基因扩增的药物或利用其共有脆弱性的治疗方法有反应。此外,ER+高风险+HER2+亚型的一个关键特征是通过ER诱导的R环和A3B编辑产生的局部扩增的环状DNA(ecDNA),这一过程可能在肿瘤进展早期发生,并与肿瘤免疫逃逸机制相关。研究结果揭示了结构变异在乳腺癌免疫逃逸中的作用,并强调了针对不同乳腺癌亚型的潜在治疗靶点,如PARP抑制剂对HRD样肿瘤的敏感性,以及针对复制压力途径的新药物对局部扩增的ER+高风险肿瘤的潜在效果。这些发现为乳腺癌的个性化治疗提供了新的策略,并为未来的临床前和转化研究指明了方向。

汇报人:徐凡淇
导师:唐玥玓
审核:吴婷婷、任建君



