精读分享│【Advance Science】:Conditional Overexpression of Serpine2 Promotes Hair Cell Regeneration from Lgr5+ Progenitors in the Neonatal Mouse Cochlea
英文题目:Conditional Overexpression of Serpine2 Promotes Hair Cell Regeneration from Lgr5+ Progenitors in the Neonatal Mouse Cochlea
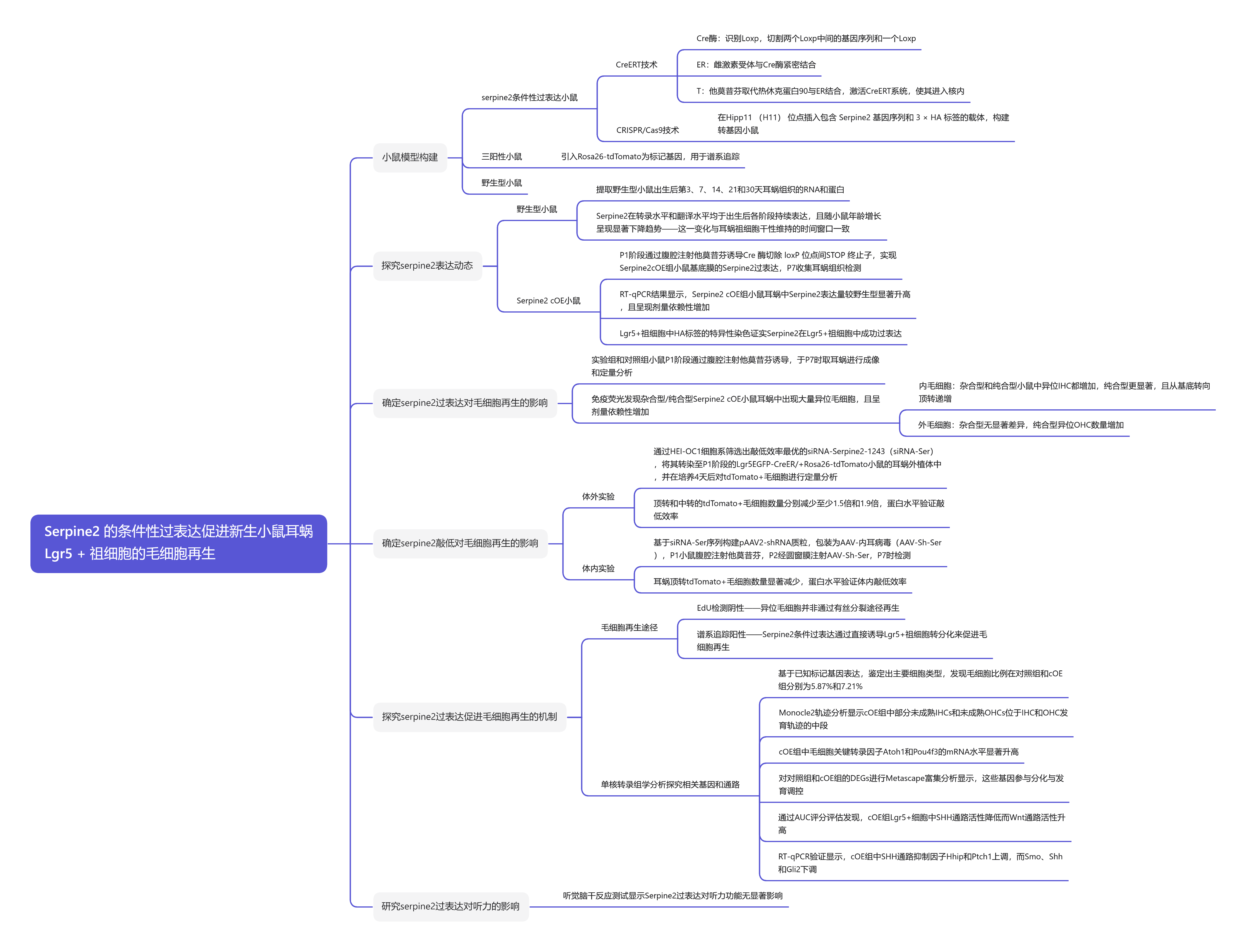
中文题目:Serpine2 的条件性过表达促进新生小鼠耳蜗 Lgr5 + 祖细胞的毛细胞再生
期 刊:Advanced Science (IF=14.1)
单 位:东南大学柴人杰团队
时 间:2025年3月17日

摘要
研究背景:
新生儿耳蜗Lgr5+祖细胞保留有限的毛细胞(HC)再生能力,但其调控网络尚未完全阐明。前期体外研究表明,丝氨酸蛋白酶抑制剂E成员2(Serpine2)参与调控耳蜗Lgr5+祖细胞的增殖与分化,但其在体内的表达模式及功能尚不明确。
研究发现:
表达模式:Serpine2在小鼠出生后耳蜗中呈年龄相关性下降表达;
功能验证:在新生儿耳蜗Lgr5+祖细胞中条件性过表达Serpine2,观察到剂量依赖性的异位毛细胞数量增加;体外和体内Serpine2敲除实验能抑制毛细胞再生;
机制探究:EdU检测和谱系追踪实验证实这些异位毛细胞更可能源自Lgr5+祖细胞的直接转分化而非有丝分裂再生;单核RNA测序分析和mRNA水平验证表明,条件性过表达的Serpine2可能通过抑制音猬因子(SHH)信号通路、激活Atoh1和Pou4f3转录因子来诱导毛细胞再生。
结论:
该研究揭示了Serpine2在新生儿耳蜗Lgr5+祖细胞毛细胞再生中的关键作用,为毛细胞再生研究提供了新思路。
引言
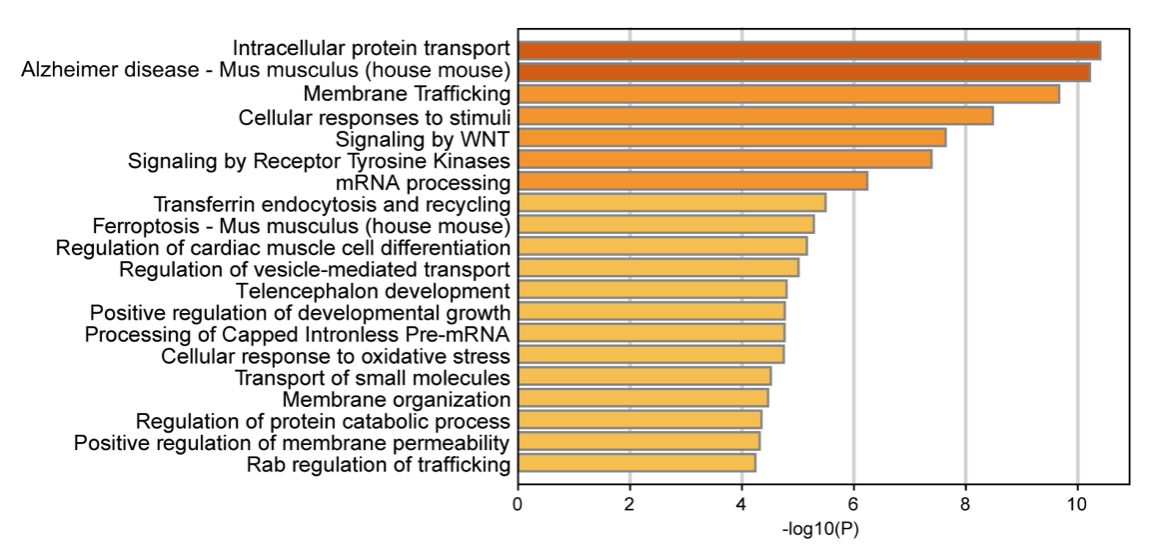
感音神经性耳聋(SNHL)主要致病机制是耳蜗毛细胞(HCs)的缺失或损伤。成年哺乳动物毛细胞损伤不可逆,但鱼类和鸟类支持细胞(SCs)具有再生为毛细胞的能力。已有研究表明,新生小鼠内耳具有短暂的毛细胞再生能力,但该能力在出生后迅速丧失。因此,阐明毛细胞再生的分子机制以开发SNHL治疗策略具有迫切需求。
Lgr5作为Wnt通路靶基因,标记多种组织(如耳蜗)中的祖细胞。小鼠耳蜗内指细胞、第三排Deiters细胞、内柱细胞及部分大上皮嵴细胞等特定支持细胞亚群表达Lgr5,具有内耳祖细胞特性。耳蜗支持细胞或祖细胞可能通过Atoh1、Gfi1、Pou4f3、Foxg1等转录因子及Wnt、Notch、Hippo等信号通路调控毛细胞再生。但成年哺乳动物毛细胞再生效率仍有限,需探索新的调控因子。
前期研究通过分析不同再生条件下Lgr5+祖细胞的转录组,筛选出多个潜在参与毛细胞再生的新基因,其中丝氨酸蛋白酶抑制剂E成员2(Serpine2)在体外实验中显示出调控毛细胞再生的潜力。但其是否在体内调控耳蜗Lgr5+祖细胞增殖分化从而影响毛细胞再生尚不清楚。
研究思路
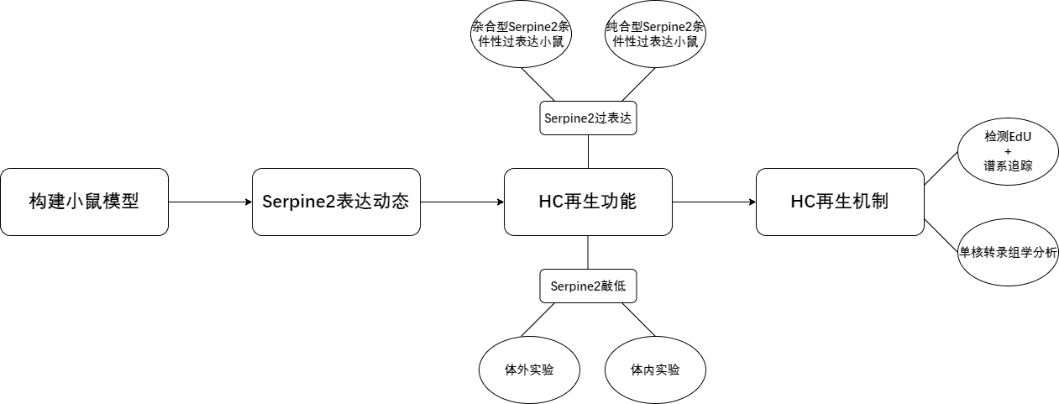
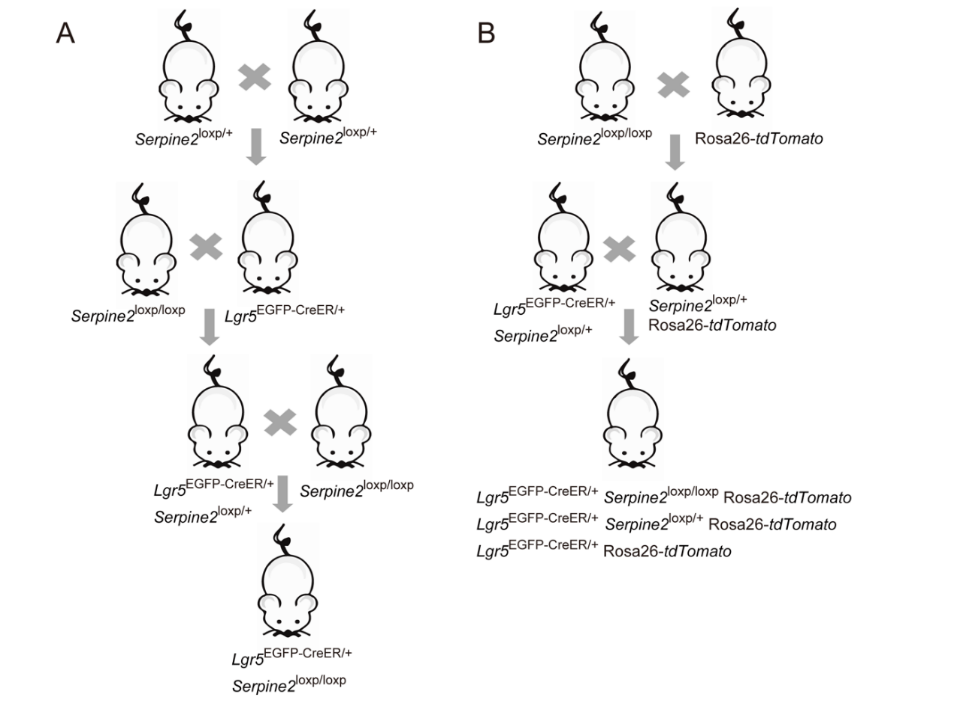
模型构建
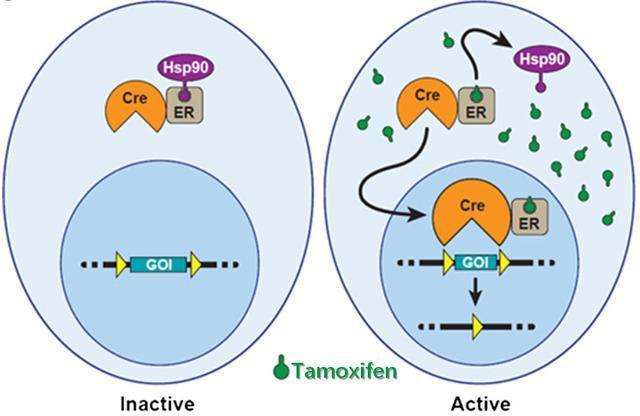
CreERT系统
Cre重组酶(cyclization recombinase)可识别一段名为Loxp的特定基因序列:Loxp序列长34个碱基,包括中间8碱基的不对称序列,以及两侧反向回文的13碱基序列。中间的8碱基决定了Loxp序列的方向,而Loxp序列的方向决定了Cre酶的剪切方式。通常,Loxp序列会成对出现。如果两个Loxp的方向相同,当Cre酶结合两个Loxp位点后,会删除两个Loxp之间的基因序列,以及一个Loxp序列;如果两个Loxp序列方向相反,Cre重组酶则会将两个Loxp之间的基因序列反转、左右颠倒,这种重组反应处于动态平衡中。
雌激素受体(ER):在没有雌激素的情况下,核雌激素受体跟热休克蛋白90(HSP90)结合在一起,无法进入细胞核,只能游荡于细胞质内。雌激素出现后,雌激素会跟核雌激素受体结合,并将热休克蛋白90从雌激素受体上排挤走,雌激素受体便可进入细胞核,调控位于核内的基因的表达。
将雌激素受体的配体结合域和Cre酶融合在一起,并突变雌激素受体,使其不再结合体内雌激素,只对他莫昔芬(Tamoxifen)这种外源药物有亲和力——只有当他莫昔芬出现时,Cre酶才能入核调控基因表达。同时,由于与Cre酶融合的只是雌激素受体的配体结合域,因此不会触发雌激素受体相应的基因调控。
通过CRISPR/Cas9技术在Hipp11(H11)位点插入包含Serpine2基因序列和3×HA标签的载体,构建Serpine2loxp/+转基因小鼠(图1D),并鉴定基因型(图1E),P1阶段通过腹腔注射他莫昔芬诱导Cre 酶切除loxP位点间STOP 终止子,实现Serpine2 cOE组小鼠基底膜(BM)的Serpine2过表达(图1F)。
杂合型Serpine2过表达:仅一个等位基因被loxP序列修饰,另一个等位基因保持野生型(未编辑)(图A)。
纯和型Serpine2过表达:两个等位基因都被loxP序列修饰(条件性可完全敲除)(图A)。
两种三阳性小鼠模型(图B)。
研究发现
Serpine2在野生型小鼠和Serpine2条件过表达(cOE)小鼠中的表达
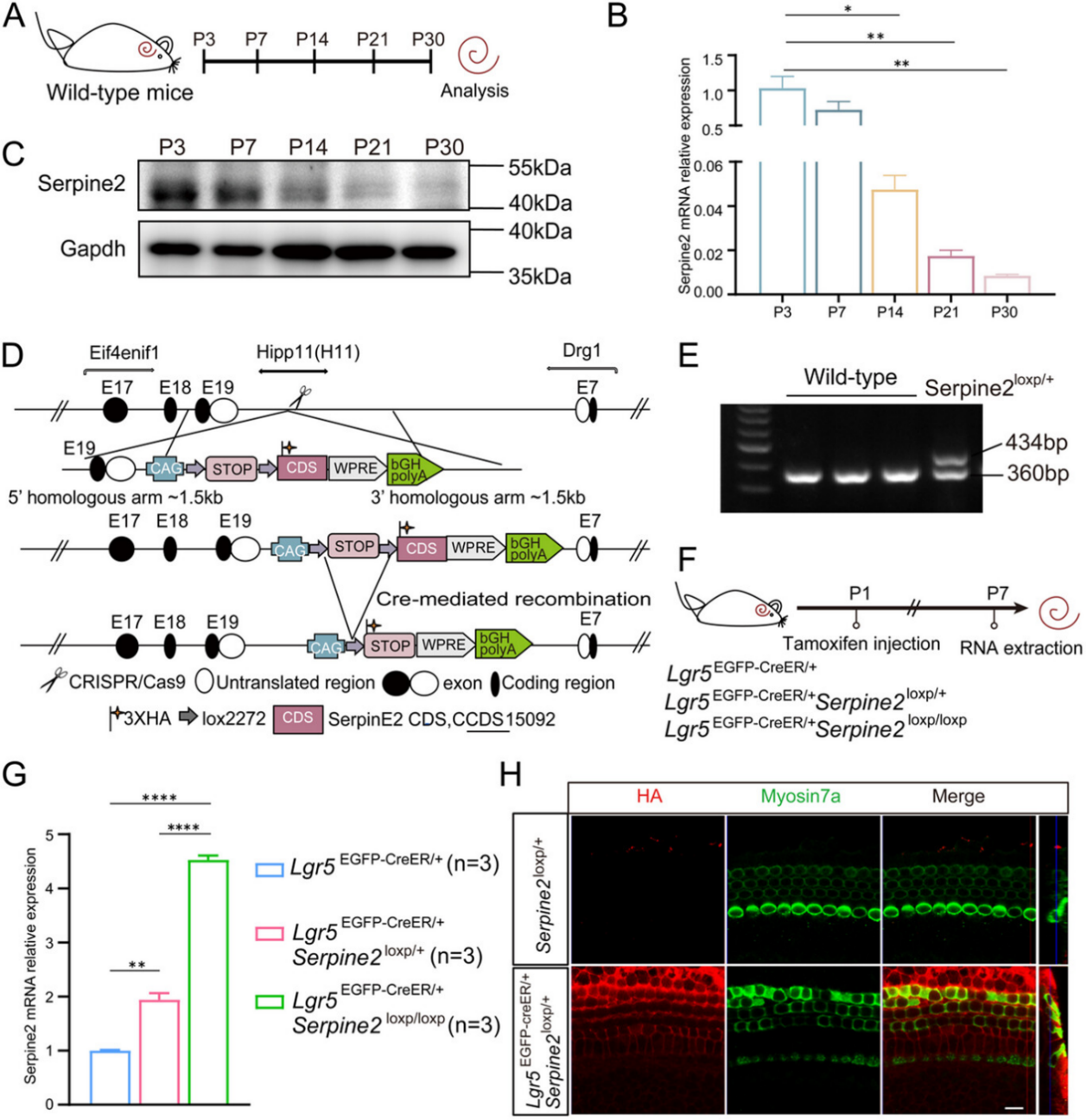
图1
检测野生型小鼠出生后耳蜗发育过程中Serpine2的表达动态:
提取野生型小鼠出生后第3、7、14、21和30天耳蜗组织的RNA和蛋白(图1A)。
Serpine2在转录水平(图1B)和翻译水平(图1C)均于出生后各阶段持续表达,且随小鼠年龄增长呈现显著下降趋势,这一变化与耳蜗祖细胞干性维持的时间窗口一致。
探究Serpine2是否在体内影响毛细胞再生:
通过 CRISPR/Cas9 技术在Hipp11(H11)位点插入包含Serpine2基因序列和3×HA标签的载体,构建Serpine2loxp/+转基因小鼠(图1D),并鉴定基因型(图1E),P1阶段通过腹腔注射他莫昔芬诱导Cre酶切除loxP位点间STOP终止子,实现Serpine2 cOE组小鼠基底膜(BM)的Serpine2过表达(图1F)。
RT-qPCR结果显示,与对照组相比,Serpine2 cOE组小鼠耳蜗中Serpine2表达量显著升高,且呈现剂量依赖性增加(图1G)。Lgr5+祖细胞中HA标签的特异性染色证实Serpine2在Lgr5+祖细胞中成功过表达(图1H,Myosin7a 用作 HC 标记)。
杂合型Serpine2 cOE小鼠的异位IHCs增加
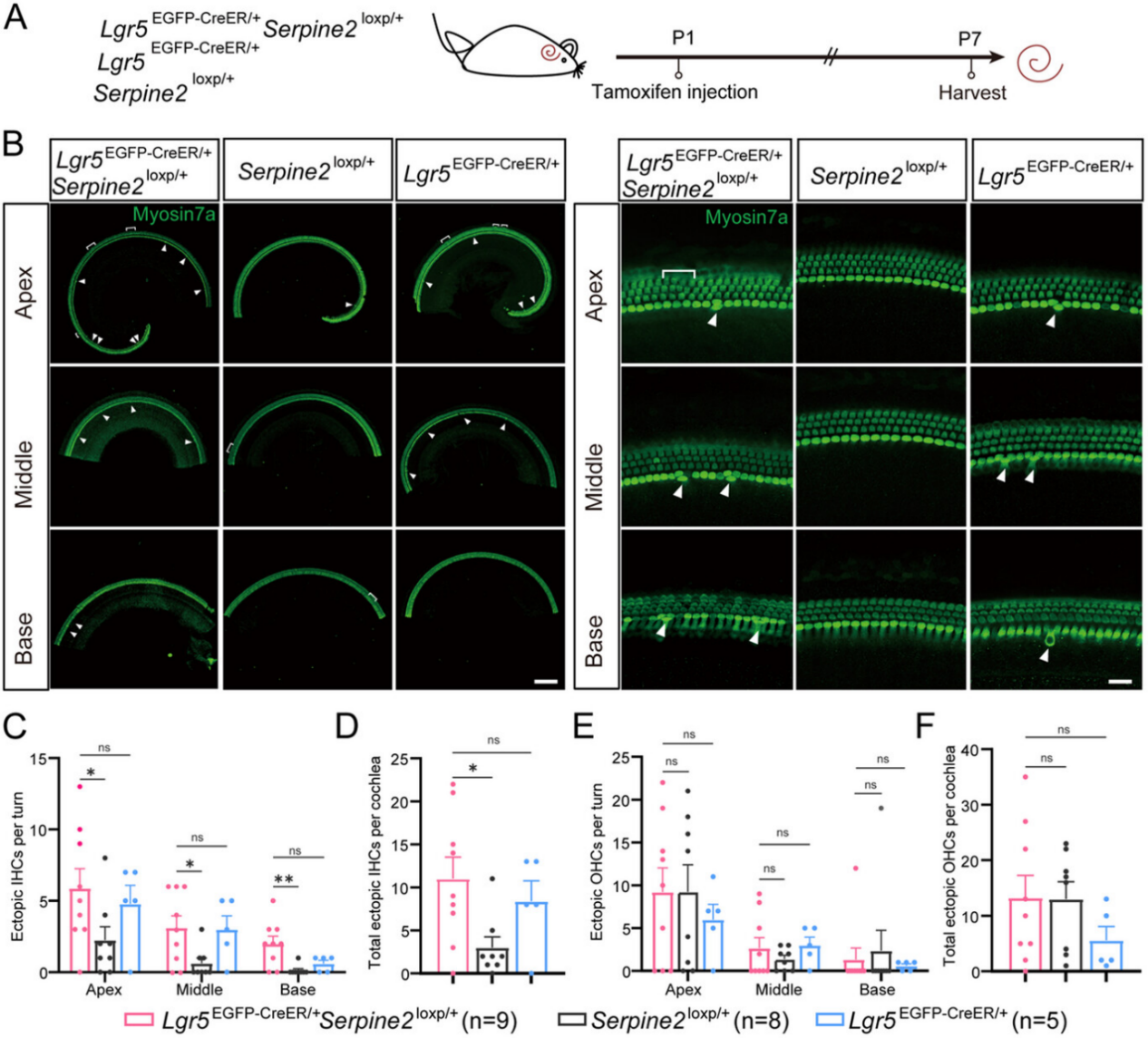
图2
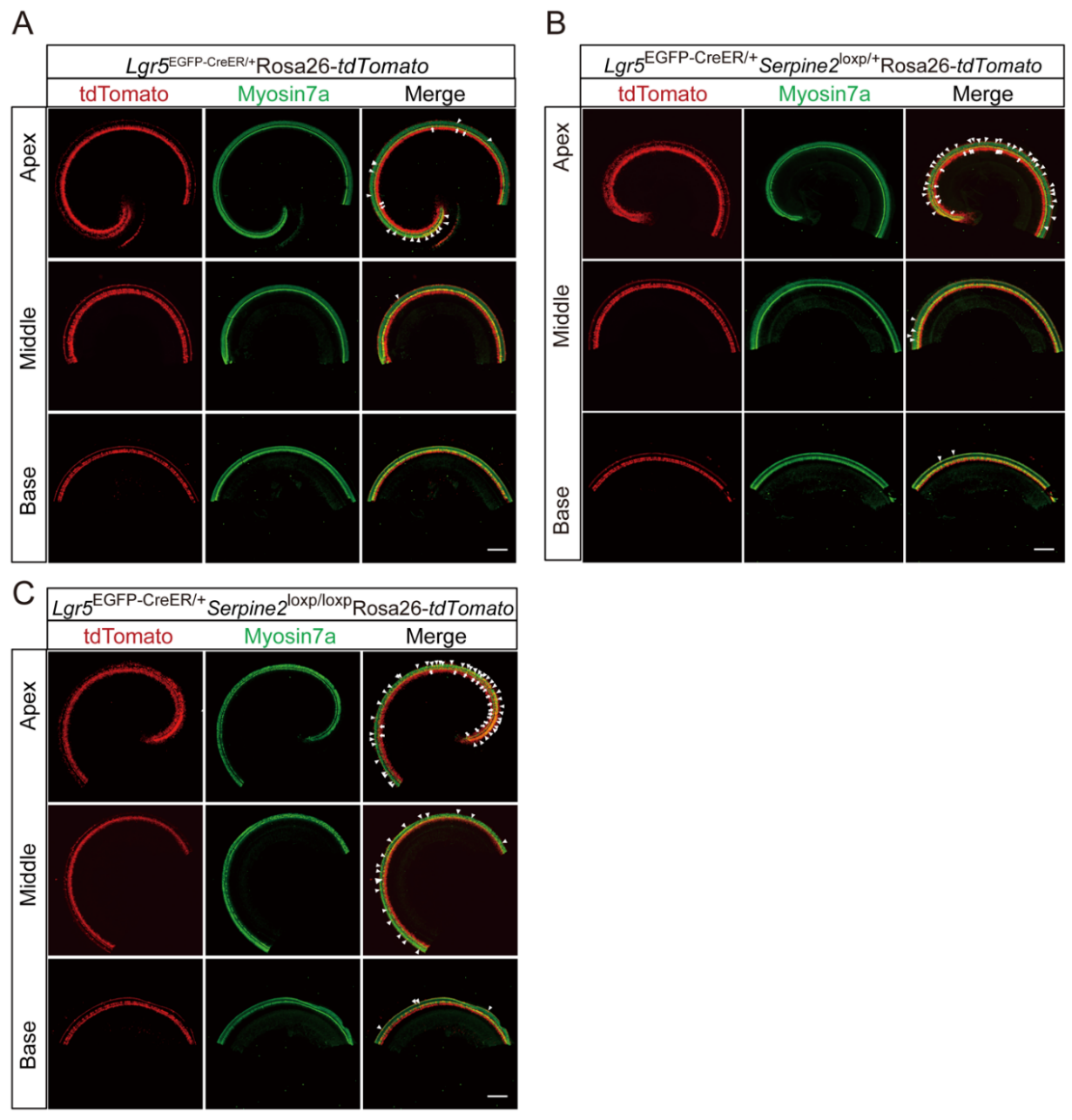
以杂合型Serpine2条件过表达小鼠(Lgr5EGFP-CreER/+Serpine2loxp/+)作为实验组,以Lgr5EGFP-CreER/+小鼠(排除 CreER 和他莫昔芬的影响)和Serpine2loxp/+小鼠(排除 loxP 插入和他莫昔芬的非特异性效应)作为对照组,小鼠耳蜗于P7时取材进行成像分析(图2A)。
在杂合型Serpine2 cOE小鼠耳蜗中观察到大量异位毛细胞(图2B,用箭头表示IHC,方括号表示OHC)。
内毛细胞(IHCs):杂合型Serpine2 cOE小鼠耳蜗中异位IHCs总数较Serpine2loxp/+对照组增加超过3倍,与Lgr5EGFP-CreER/+对照组无显著差异(图2C-D);从基底转向顶端转呈现递增趋势,三个耳蜗转的异位IHCs数量分别达到Serpine2loxp/+对照组的2倍、4倍和16倍(图2B-C)
外毛细胞(OHCs):杂合型Serpine2 cOE小鼠的异位HCs数量与两个对照组均无显著差异(图2E-F)
纯合型Serpine2 cOE小鼠的异位 HCs 显著增加
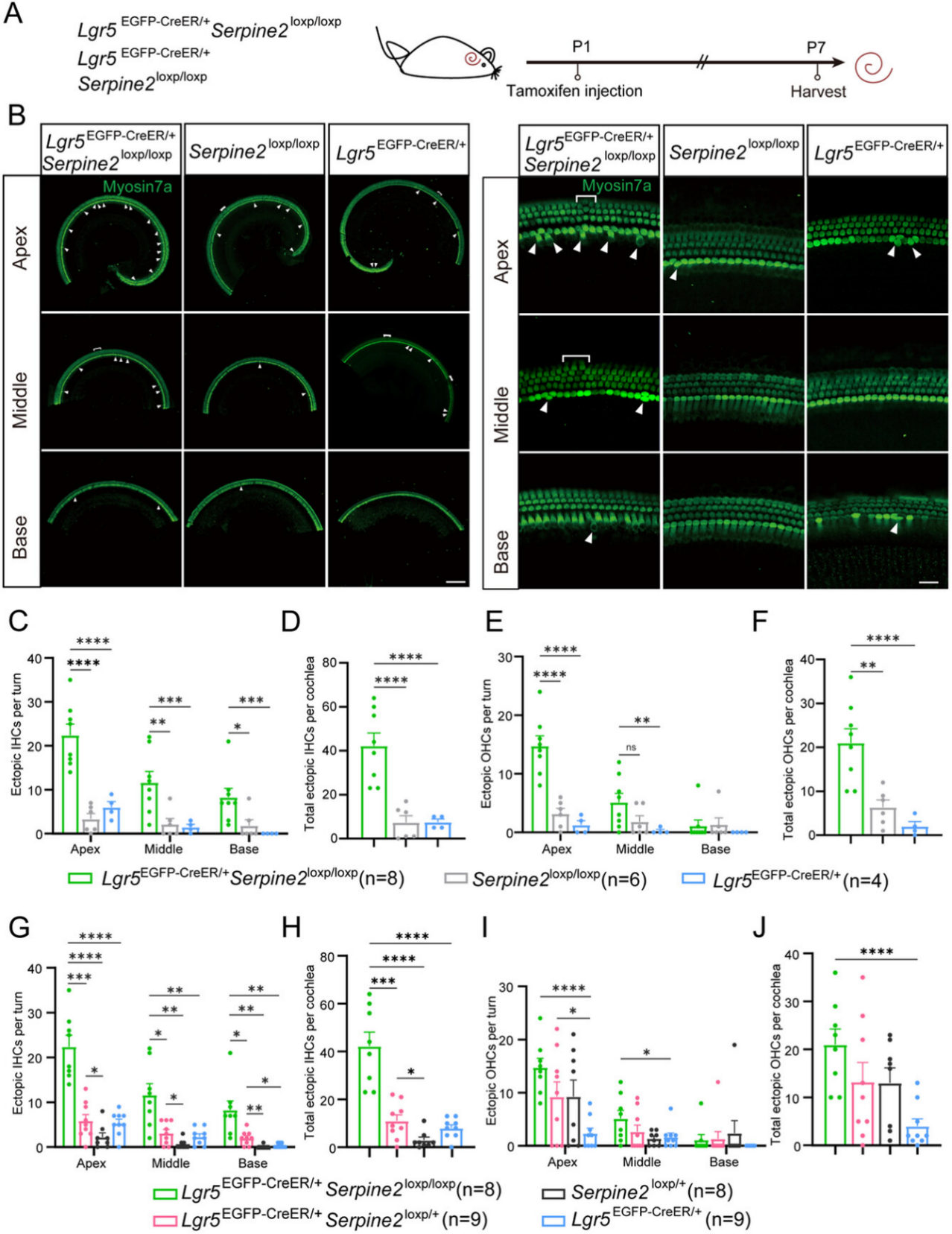
图3
将Serpine2loxp/loxp小鼠与杂合型Serpine2 cOE小鼠交配获得纯合型Serpine2 cOE小鼠(Lgr5EGFP-CreER/+Serpine2loxp/loxp),以Lgr5EGFP-CreER/+小鼠和Serpine2loxp/+小鼠作为对照组,小鼠耳蜗于P7时取材进行成像分析(图2A)。
内毛细胞(IHCs):与Lgr5EGFP-CreER/+及Serpine2loxp/loxp对照组相比,纯合型Serpine2 cOE小鼠的异位内毛细胞(IHCs)数量显著增加超5倍(图3B-D);在 Serpine2loxp/+小鼠、杂合型Serpine2 cOE小鼠、纯合型Serpine2 cOE小鼠中,异位IHCs数量呈现梯度增长(基底转→中转→顶转递增趋势)(图3G-H)。
外毛细胞(OHCs):纯合型cOE小鼠异位OHCs数量较两个对照组均显著增加,总量提升至少3倍(图3B,E,F);在Lgr5EGFP-CreER/+小鼠、杂合型Serpine2 cOE小鼠、纯合型Serpine2 cOE小鼠中,顶转异位 OHC 的数量有增加趋势(图3I-J)。
异位OHCs与IHCs数量随Serpine2表达水平升高而增加,证实Serpine2通过剂量依赖性方式促进毛细胞再生。
在 Serpine2 cOE 小鼠中未观察到 lgR5 + 祖细胞的增殖
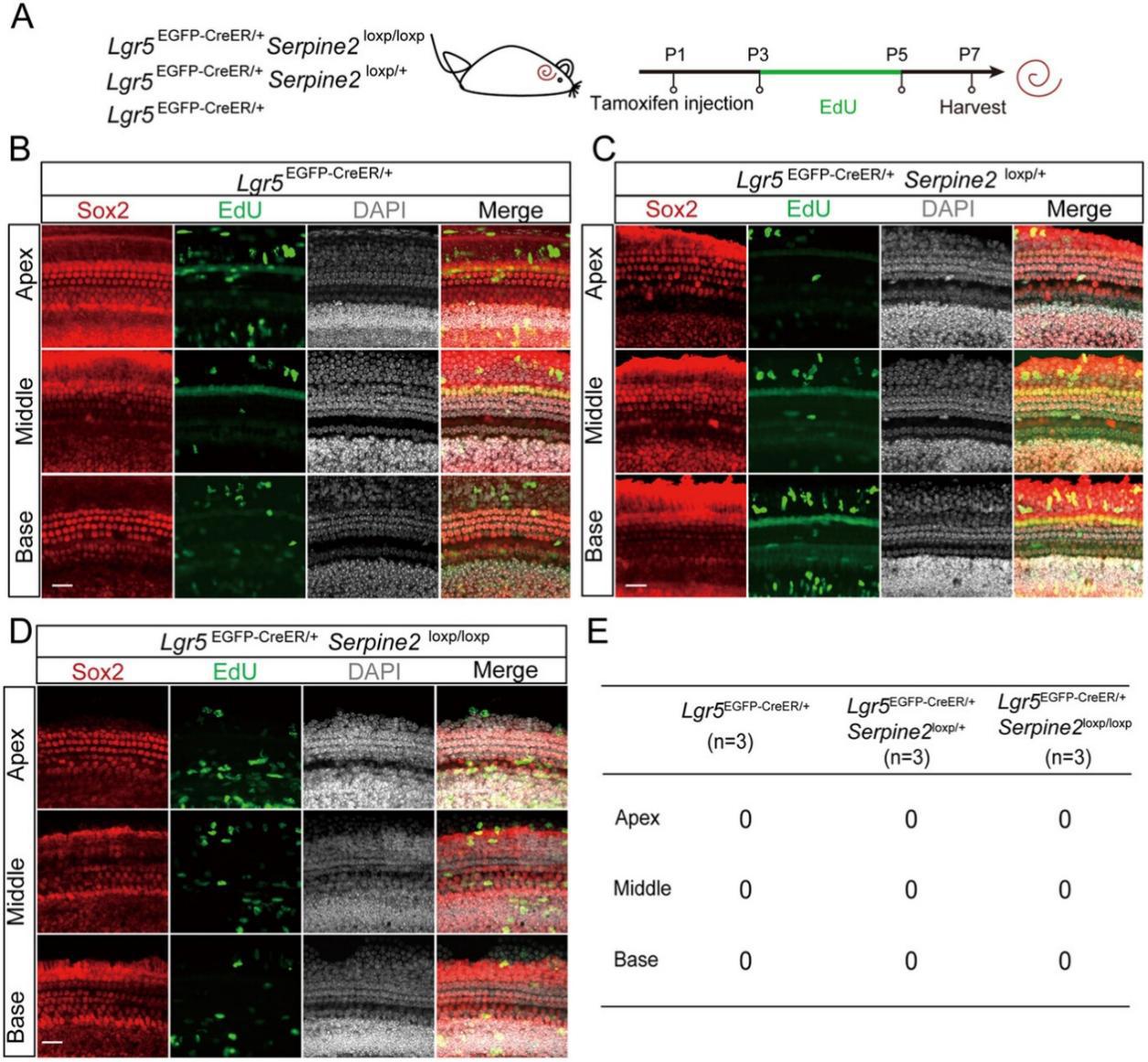
图4
杂合型和纯合型Serpine2 cOE小鼠于P1时腹腔注射他莫昔芬,并于P3-P5连续注射EdU(标记增殖细胞),Lgr5EGFP-CreER/+小鼠作为对照组(图4A)。
在杂合/纯合型Serpine2 cOE小鼠及对照组耳蜗中,均未检测到EdU+支持细胞(图4B-E,Sox2 用作支持细胞标记物)。
异位毛细胞并非通过有丝分裂途径再生,提示Serpine2可能通过直接转分化机制驱动毛细胞再生。
Serpine2 cOE 通过诱导 Lgr5+ 祖细胞的直接转分化促进 HC 再生
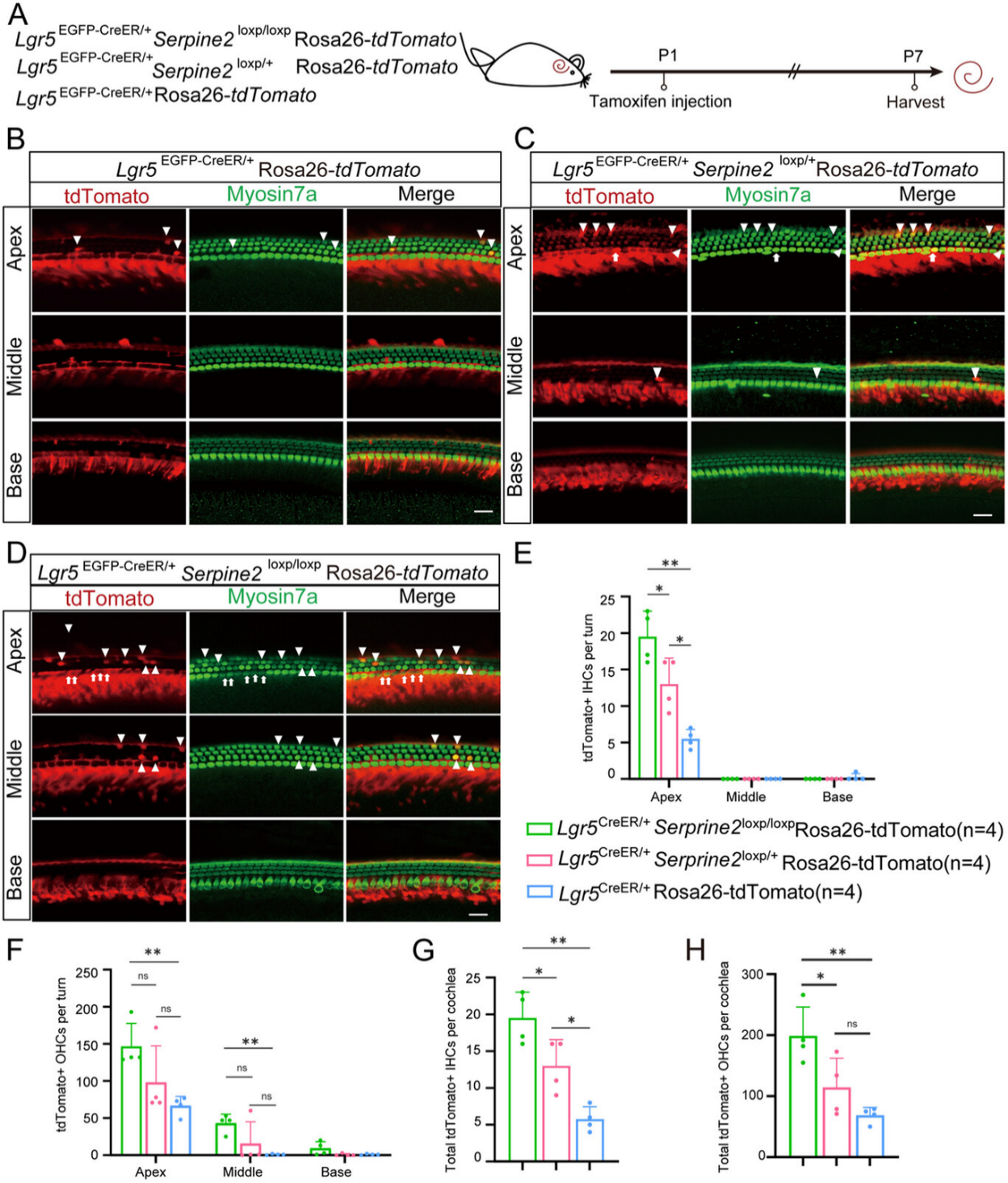
图5
图S2
图S3
构建两种三阳性小鼠模型(Lgr5EGFP-CreER/+Serpine2loxp/+Rosa26-tdTomato和 Lgr5EGFP-CreER/+Serpine2loxp/loxpRosa26-tdTomato)用于谱系追踪,Lgr5EGFP-CreER/+Rosa26-tdTomato 小鼠作为对照组,P1腹腔注射他莫昔芬激活Cre酶,P7观察并定量 Myosin7a+tdTomato+双阳性毛细胞(图5A)。
EdU阴性和谱系追踪阳性双重验证Serpine2条件过表达通过直接诱导Lgr5+祖细胞转分化而非有丝分裂再生来促进毛细胞再生(尤其是内毛细胞):与对照组相比,杂合型三阳性小鼠耳蜗顶转tdTomato+IHCs数量较对照组增加至少2倍,纯合型三阳性小鼠耳蜗顶转tdTomato+IHCs数量较对照组增加至少3倍,仅在纯合型小鼠中观察顶转和中转tdTomato+OHCs数量明显高于对照组(图5B-H及图S2A-C)。
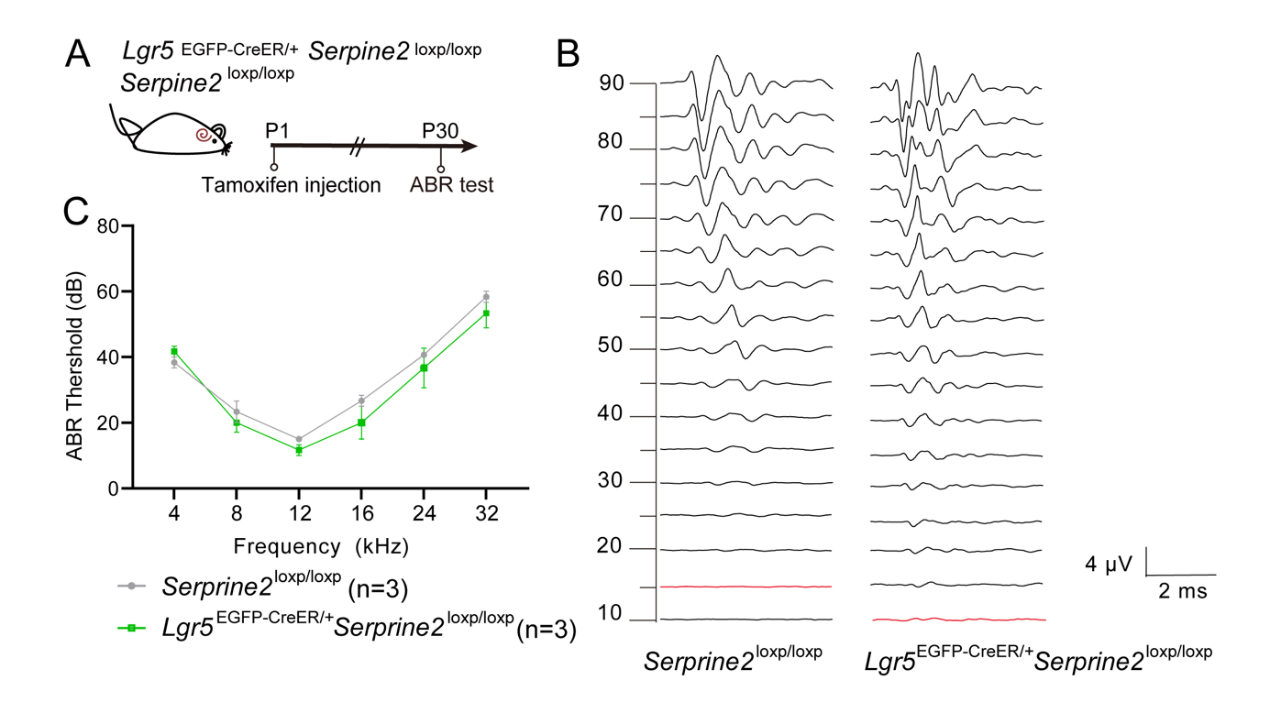
P30小鼠的听觉脑干反应测试显示,Serpine2过表达对听力功能无显著影响(图S3A-C)。
Serpine2敲低在体外和体内实验中均能抑制新生小鼠毛细胞再生
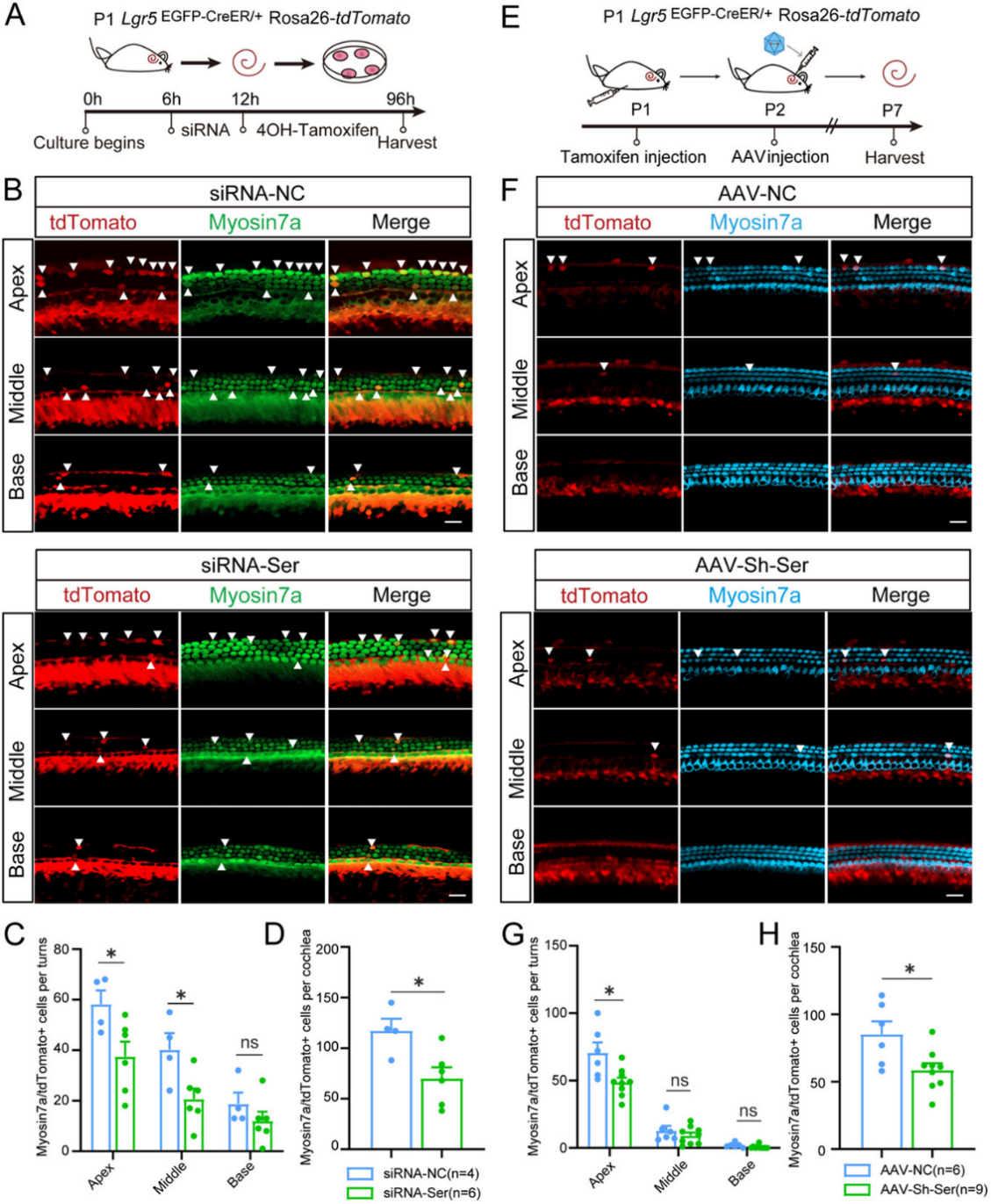
图6
图S4
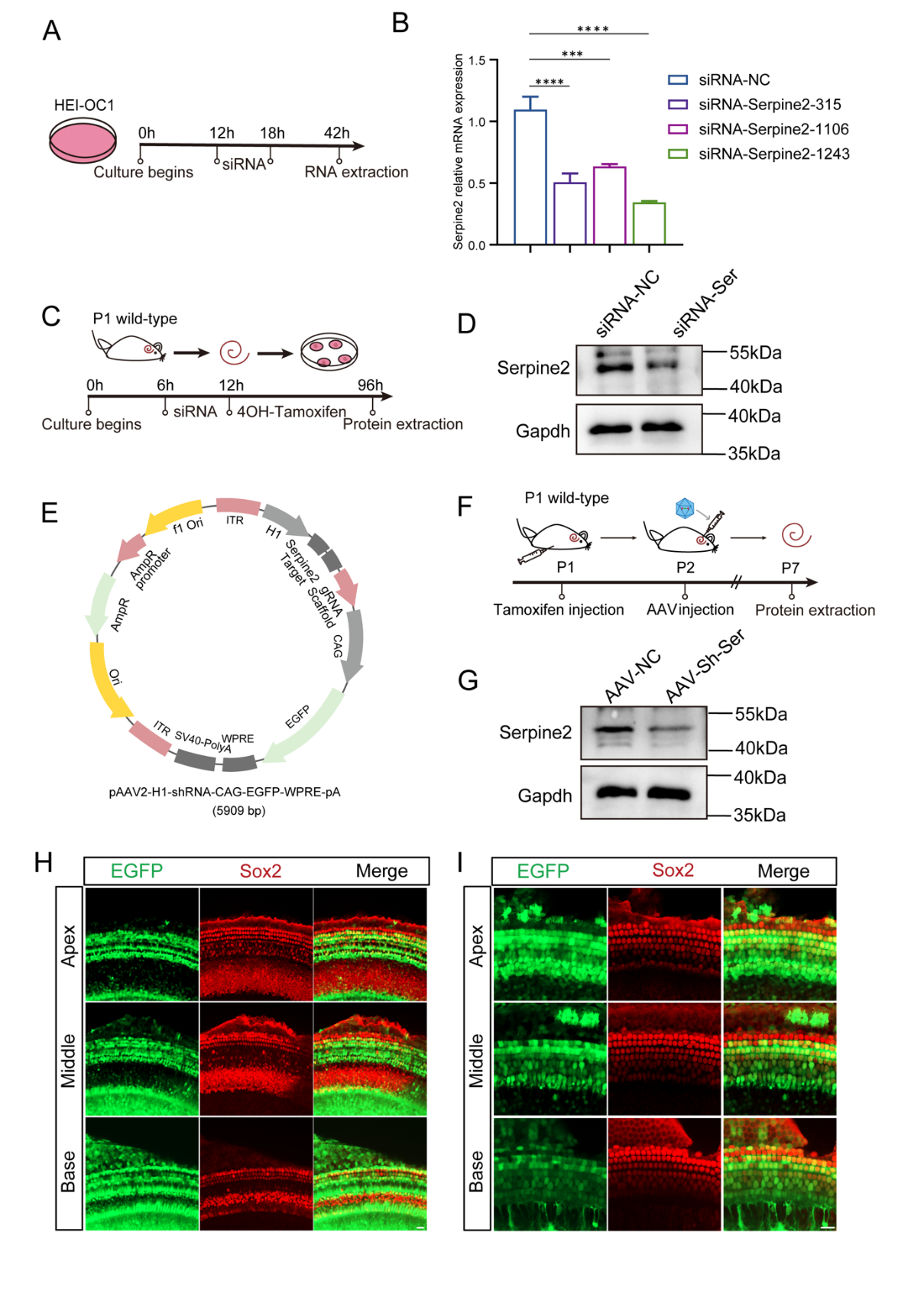
体外实验:
通过HEI-OC1细胞系筛选出敲低效率最优的siRNA-Serpine2-1243(siRNA-Ser)(图S4A-B),将siRNA-Ser转染至P1阶段的Lgr5EGFP-CreER/+Rosa26-tdTomato小鼠的耳蜗外植体中,并在培养4天后对tdTomato+毛细胞进行定量分析(图6A)。
顶转和中转的tdTomato+毛细胞数量分别减少至少1.5倍和1.9倍(图6B-D);蛋白水平验证敲低效率(图S4C-D)。
体内实验:
基于siRNA-Ser序列构建pAAV2-shRNA质粒(图S4E),包装为AAV-内耳病毒(AAV-Sh-Ser),P1小鼠腹腔注射他莫昔芬,P2经圆窗膜注射AAV-Sh-Ser,P7检测(图6E)。
耳蜗顶转tdTomato+毛细胞数量显著减少(图6F-H);蛋白水平(图S4F-G)和免疫荧光(图S4H-I)验证体内敲低效率。
Serpine2 cOE 小鼠耳蜗的单核转录组学分析
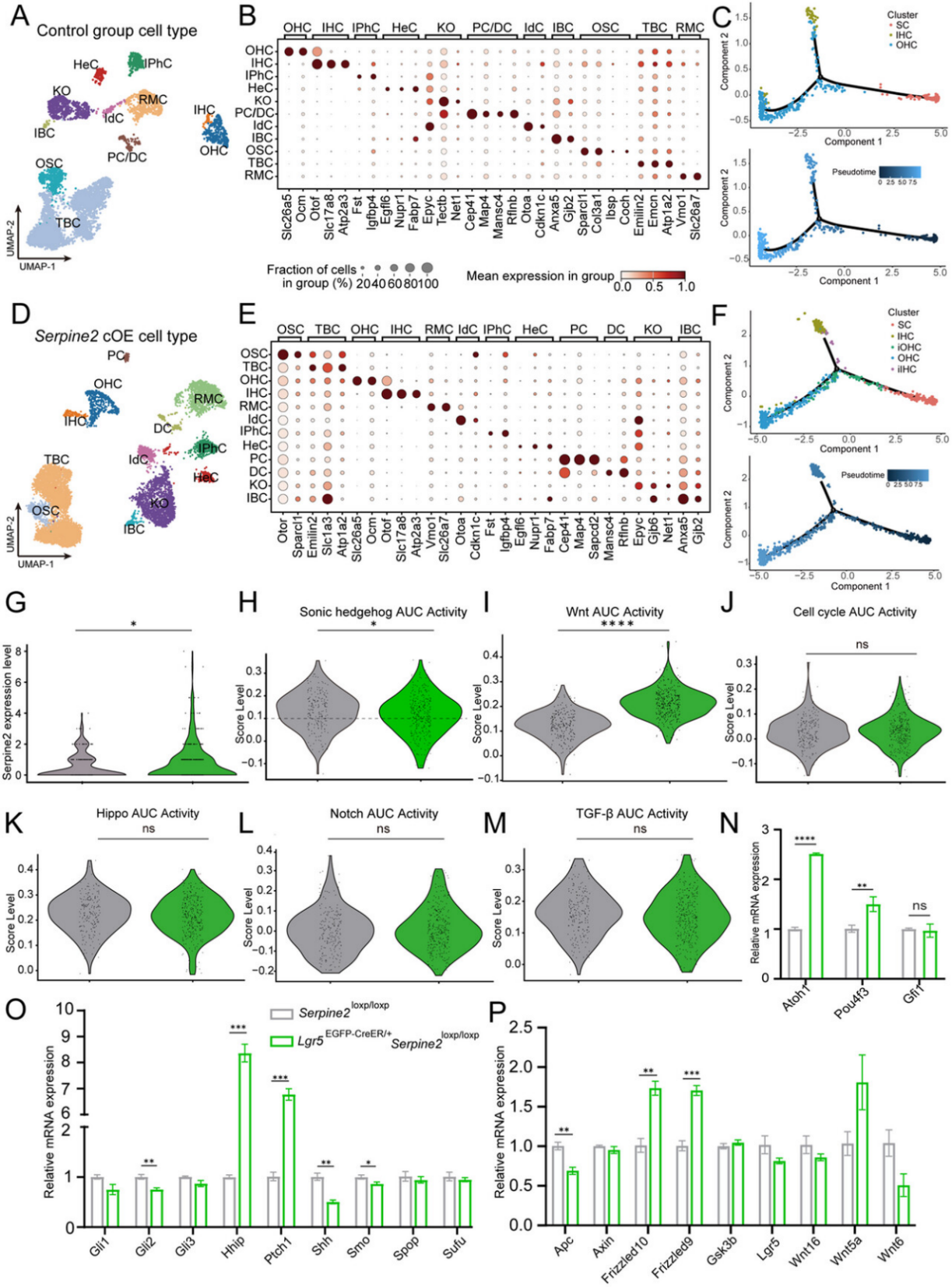
图7
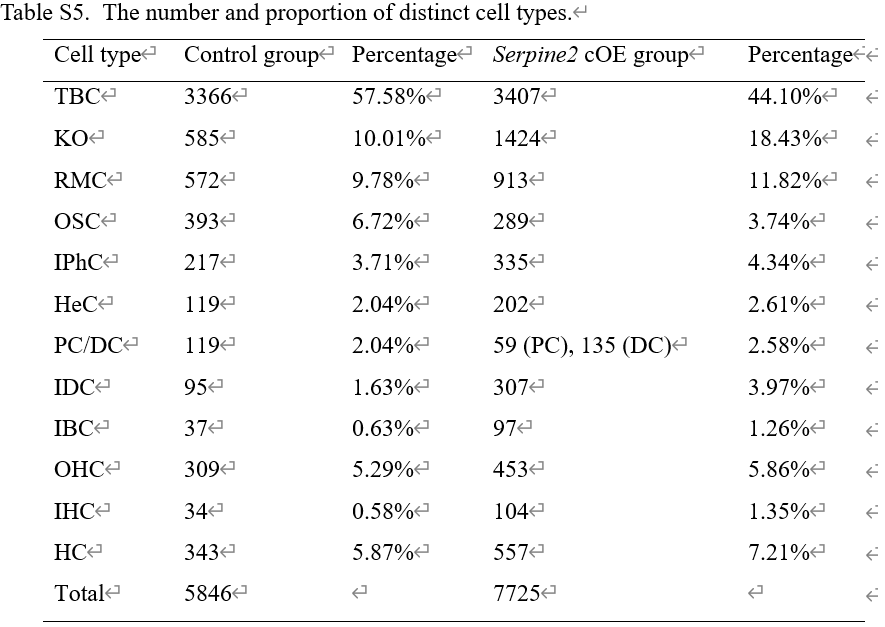
表S5
图S5
单核转录组分析表明Serpine2 cOE可能通过抑制SHH通路并激活Atoh1和Pou4f3诱导毛细胞再生:
细胞类型鉴定:
成功捕获对照组(Serpine2loxp/loxp)5,846个和Serpine2 cOE组(Lgr5EGFP-CreER/+Serpine2loxp/loxp)7,725个单核转录组。基于已知标记基因表达,鉴定出两组中的主要细胞类型,包括外毛细胞(标志基因Slc26a5)、内毛细胞(标志基因Slc17a8/Atp2a3/Otof)及各类支持细胞(图7A,B,D,E)。毛细胞比例在对照组和cOE组分别为5.87%和7.21%(表S5),与表型观察中Serpine2 cOE增加毛细胞数量的结果一致。
将一类高表达Lgr5及部分支持细胞标志的毛细胞亚群定义为未成熟毛细胞(iHCs)。Monocle2轨迹分析显示,cOE组中部分未成熟IHCs(iIHCs)和未成熟OHCs(iOHCs)位于IHC和OHC发育轨迹的中段(图7C,F),进一步支持Serpine2 cOE诱导毛细胞再生的结论。
基因与通路分析
针对目标Lgr5+细胞群(毛细胞、Deiters细胞、柱细胞、Hensen细胞、内缘细胞)的基因表达分析表明,cOE组Lgr5+细胞中Serpine2表达显著高于对照组(图7G)。对两组中的Lgr5+细胞进行了差异表达基因(DEGs)排序,对DEGs进行Metascape富集分析显示,这些基因参与分化与发育调控(如心肌细胞分化、Wnt通路等)(图S5)。通过regulon活性(AUC)评分评估发现,cOE组Lgr5+细胞中SHH通路活性降低而Wnt通路活性升高(图7H-M)。
结果验证:
RT-qPCR验证显示,cOE组中SHH通路抑制因子Hhip和Ptch1上调,而Smo、Shh和Gli2下调(图7O),与测序结果一致;但Wnt通路基因表达无显著差异(图7P)。此外,cOE组中毛细胞关键转录因子Atoh1和Pou4f3的mRNA水平显著升高(图7N)。
测序方法及数据分析:
单核转录组学分析(snRNA-seq)是一种基于单细胞分辨率的转录组测序技术,通过捕获单个细胞核的RNA来解析组织或细胞群体的基因表达异质性,克服了传统单细胞RNA测序(scRNA-seq)对活细胞样本的依赖,尤其适用于难以解离的固体组织(如脑、心脏、骨骼肌)或冷冻保存的样本。
Monocle2轨迹分析:一种通过单细胞RNA测序数据推断细胞发育轨迹或动态变化过程的生物信息学方法。Monocle2通过算法模拟细胞在“拟时间轴”上的变化顺序,推断其发育轨迹或状态转换路径。基于基因表达模式的相似性,将细胞按发育阶段排序,构建连续的分化轨迹,轨迹可能呈线性、分支或多分支结构,反映细胞亚型的分化命运。
差异表达基因(Differentially Expressed Genes, DEGs):指在两组样本(如对照组 vs. 实验组)中表达水平显著不同的基因。
富集分析(Enrichment Analysis):将差异表达基因与已知功能数据库(如GO、KEGG、Reactome)比对,识别基因集在特定生物学过程、通路或细胞组分中的富集情况。
Regulon活性(AUC)评分:单细胞转录组分析中用于量化转录因子调控网络(Regulon)在单个细胞中活跃程度的指标。通过计算Regulon中所有基因在细胞中的表达量排序累积曲线下的面积,量化该调控网络在细胞中的活跃程度。
讨论
突破
创新性发现:首次证实Serpine2是毛细胞再生的新型调控因子,其过表达通过剂量依赖性方式增加异位毛细胞。
技术严谨:条件性过表达和敲低Serpine2,从正反两个方面探究机制;结合EdU实验、谱系追踪实验、snRNA-seq分析等多种技术手段;离体(siRNA)与体内(AAV-shRNA)实验结合。
转化潜力:Serpine2过表达未影响听力(ABR正常),AAV-ie载体已证明可用于内耳基因治疗,为临床提供潜在靶点。
局限性
机制深度不足:Serpine2与SHH通路的具体互作(如是否直接调控Gli2)需进一步验证;未解析Serpine2如何协同Atoh1/Pou4f3(共激活或间接调控?)。
模型限制:仅在新生小鼠中验证,成年哺乳动物毛细胞再生能力是否可被Serpine2激活尚不明确;未评估再生毛细胞的功能成熟度(如电生理特性)。
技术挑战:AAV递送效率在耳蜗不同区域存在差异(顶转>基转),需优化靶向性。

汇报人:肖瑶
导师:赵宇
审核:程丹妮、任建君