
精读分享│【Nature】:染色体外DNA的起源与影响
英文题目:Origins and impact of extrachromosomal DNA
中文题目:染色体外DNA的起源与影响
期刊:Nature(IF=50.5)


Abstract
Extrachromosomal DNA (ecDNA) is a major contributor to treatment resistance and poor outcome for patients with cancer. Here we examine the diversity of ecDNA elements across cancer, revealing the associated tissue, genetic and mutational contexts. By analysing data from 14,778 patients with 39 tumour types from the 100,000 Genomes Project, we demonstrate that 17.1% of tumour samples contain ecDNA. We reveal a pattern highly indicative of tissue-context-based selection for ecDNAs, linking their genomic content to their tissue of origin. We show that not only is ecDNA a mechanism for amplification of driver oncogenes, but it also a mechanism that frequently amplifies immunomodulatory and inflammatory genes, such as those that modulate lymphocyte-mediated immunity and immune effector processes. Moreover, ecDNAs carrying immunomodulatory genes are associated with reduced tumour T cell infiltration. We identify ecDNAs bearing only enhancers, promoters and lncRNA elements, suggesting the combinatorial power of interactions between ecDNAs in trans. We also identify intrinsic and environmental mutational processes linked to ecDNA, including those linked to its formation, such as tobacco exposure, and progression, such as homologous recombination repair deficiency. Clinically, ecDNA detection was associated with tumour stage, more prevalent after targeted therapy and cytotoxic treatments, and associated with metastases and shorter overall survival. These results shed light on why ecDNA is a substantial clinical problem that can cooperatively drive tumour growth signals, alter transcriptional landscapes and suppress the immune system.
摘要
染色体外DNA(extrachromosomal DNA,ecDNA)是导致癌症患者治疗耐药性和预后不良的重要因素之一。该研究系统分析了癌症中ecDNA的多样性,揭示了其在组织类型、遗传背景和突变环境中的特定分布和作用机制。研究团队利用英国“10万基因组计划”的数据——涵盖14,778名患者、39种肿瘤类型,发现17.1% 的肿瘤样本中存在ecDNA。结果显示,ecDNA的组成呈现出明显的组织特异性选择模式,其基因组内容与肿瘤的组织来源密切相关。研究进一步发现,ecDNA不仅通过扩增驱动基因来促进肿瘤生长,还频繁扩增调节免疫和炎症反应的基因,特别是与淋巴细胞介导的免疫应答和免疫效应过程相关。携带免疫调节基因的ecDNA与肿瘤组织中T细胞浸润减少有密切联系,提示其可能在免疫逃逸中发挥作用。
此外,研究还鉴定出仅包含增强子、启动子和长链非编码RNA(lncRNA)元件的ecDNA,暗示不同ecDNA可能通过转作用(in trans)形成协同的调控网络。研究还揭示了多种与ecDNA形成、发展相关的内在和环境突变机制,其中包括烟草暴露(与形成相关)和同源重组修复缺陷(与进展相关)。在临床层面,ecDNA的存在与肿瘤分期、靶向治疗反应、细胞毒治疗效果、转移发生以及总体生存期缩短显著相关。综上所述,该研究揭示了ecDNA在驱动肿瘤信号通路激活、重塑转录图谱以及抑制抗肿瘤免疫反应中的重要作用,进一步凸显了其作为临床关键信号的重要性。
研究背景:
ecDNA是人类癌症中扩增癌基因最常见的来源之一。单个ecDNA通常较大(一般超过500 kb),为含有基因和调控区域的环状DNA颗粒,可在多种癌细胞核中发现。ecDNA不遵循常规染色体的遗传方式,在细胞分裂过程中会随机分配进入子细胞,促进癌基因拷贝数的急剧增加和肿瘤内遗传异质性的升高,进而引发基因组的迅速变化,导致耐药性的产生。另外,ecDNA含有环状结构,使其具有染色质高度开放的特点,同时还易于聚集形成“中心结构(hub)”,促进分子间协同作用,从而驱动高度的癌基因转录表达,助力肿瘤发生。ecDNA可以在肿瘤发生早期产生,例如ecDNA从Barrett食管高级别上皮内瘤变转化为食管腺癌的早期就已经存在,在疾病进展的后期阶段也能检测到。由于ecDNA能通过快速的基因组重构机制驱动治疗耐药,从而加速疾病恶化,因此区分ecDNA与其他类型的局灶性扩增具有重要意义。目前可以借助计算机算法识别扩增基因是否来源于ecDNA,并解析其结构与序列,使得在癌症中系统研究ecDNA成为可能。
该研究借助英国Genomics England主导的“10万基因组计划”(100kGP)所提供的机会,描绘了人类癌症中ecDNA的全貌,揭示其形成过程中的分子机制,并进一步深入探索其在临床中的影响。
研究方法和思路:

研究结果:
(1)ecDNA的图谱
研究基于Genomics England“十万基因组计划”(GEL 100kGP)的第12版数据发布(GEL v12),分析了来自英国13家国家卫生署基因组医学中心、共计14,778名患者的15,832份癌症全基因组测序样本。研究采用已被证实能有效识别ecDNA的Amplicon Architect和Amplicon Classifier工具,对样本的WGS数据进行分析(图1a)。为了验证WGS的预测结果,研究对队列中的部分样本(6例去分化脂肪肉瘤、4例骨肉瘤和1例血管肉瘤)进行了荧光原位杂交(FISH)实验,使用MDM2、CDK4、PDGFRA和MYC等癌基因作为探针标记ecDNA(图1a)。
研究共在39种实体瘤和血液肿瘤样本中识别出局灶性扩增事件。局灶性扩增被定义为基因组中长度在50 kb至20 Mb之间,拷贝数至少为4.5且不低于肿瘤估计倍性(ploidy)两倍的区域。肿瘤纯度范围介于10%至95%之间,平均为50.1%。此项大规模分析提供了ecDNA在不同人体部位肿瘤中的发生频率及结构的丰富图谱(图1c),并揭示了ecDNA在多种癌症中的突变过程、基因组背景及其临床意义。
总体上,研究者在17.1%的肿瘤样本中检测到ecDNA,包括2,532个ecDNA阳性肿瘤和4,716个独特的ecDNA。不同癌种中ecDNA的发生频率、拷贝数和大小差异显著(图1c)。具体来说,ecDNA检出率在脂肪肉瘤(54.9%,n = 82)、胶质母细胞瘤(49.1%、n = 291)和HER2阳性乳腺癌(46.4%、n = 196)中较高。这一结果得到了FISH实验的证实。相比之下,部分肿瘤类型(如少突胶质瘤,n=57)几乎未检测到ecDNA(图1d)。
不同癌种中癌基因扩增模式也存在明显差异,表明肿瘤组织来源显著影响ecDNA的频率和结构。在检测到ecDNA的37种肿瘤类型中,有36种类型ecDNA来源扩增的估计拷贝数普遍高于染色体来源扩增。大多数ecDNA(89.9%,n = 3,705)携带源自单条染色体的基因片段。然而,部分ecDNA(主要见于肉瘤和乳腺癌)由来自多条染色体的基因组成。值得注意的是,46%的ecDNA中包含一个以上的癌基因,这主要由原始染色体上癌基因之间的相对位置决定。研究还发现某些肿瘤中存在具有不同拷贝数和携带不同癌基因的多种ecDNA。
由于ecDNA的非染色体遗传特性能促进肿瘤内遗传异质性的形成,研究对578名患者同一肿瘤的多个区域进行了取样分析,其中151例(26.1%)肿瘤中检测到ecDNA。在控制肿瘤类型的前提下,对两个及以上取样部位检测,可使ecDNA检出率提高到单一区域取样的2.6倍。此外,在进行多区域测序的肿瘤中,超过60%的样本仅在部分区域检测到ecDNA。
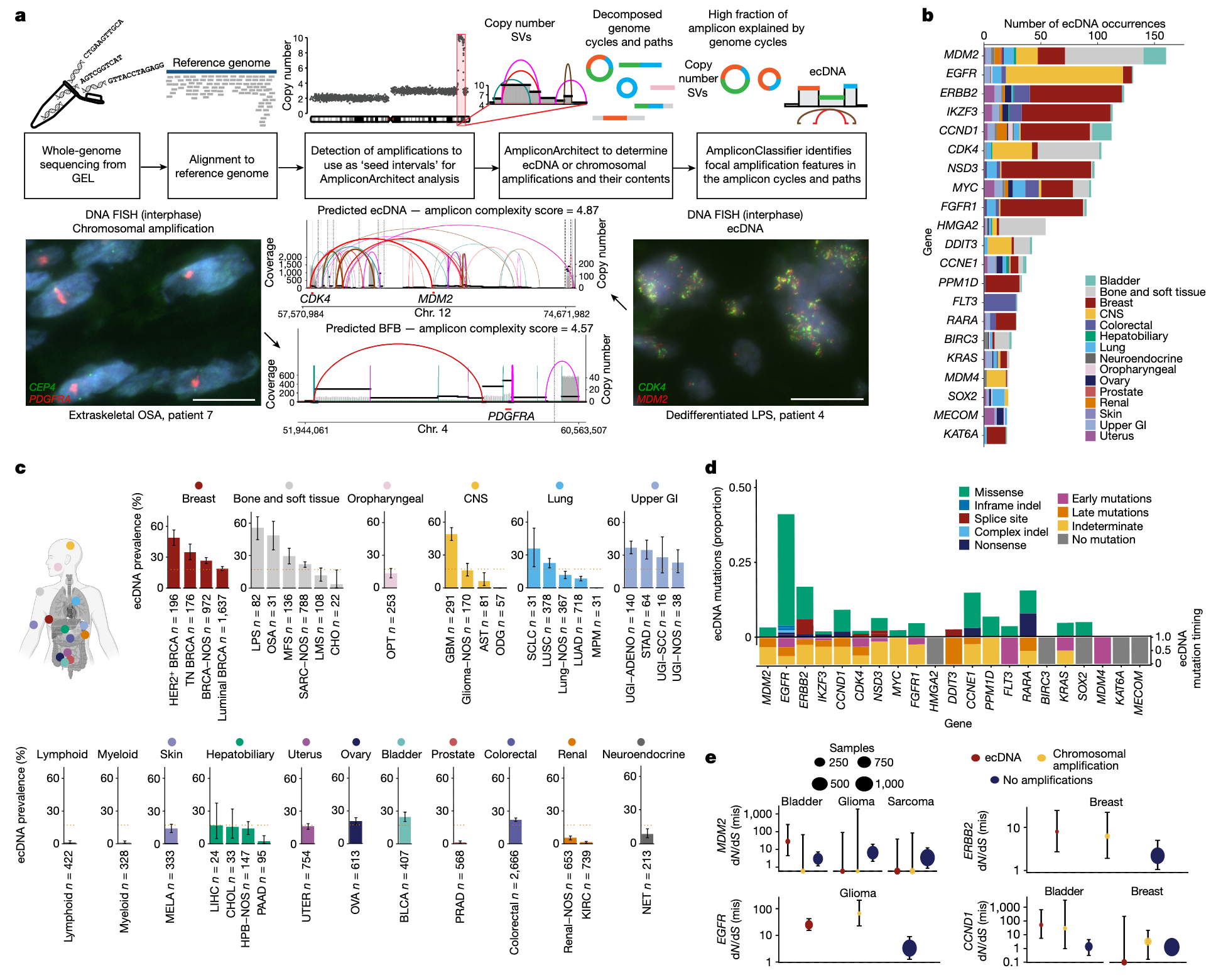
图1. 39 种肿瘤中ecDNA的分布图谱
(2)ecDNA相关癌基因
研究发现,ecDNA上显示出显著的癌基因富集,表明相较于线性染色体扩增,ecDNA更倾向于扩增癌基因。即使在拷贝数匹配的情况下,每个ecDNA上包含的癌基因数量也更高。此外,在扩增区域大小匹配的前提下,在ecDNA上重复扩增的基因更可能是癌基因,而非染色体扩增中的基因。这些发现,结合ecDNA在细胞分裂过程中非染色体遗传特点,共同支持了“ecDNA负载癌基因而受到进化选择”的观点。
研究观察到多个明确的驱动癌基因在ecDNA上的扩增频率高于染色体扩增,例如:FGFR2(ecDNA扩增比例0.63,中位拷贝数 = 16.0),MDM2(比例0.58,拷贝数 = 13.7),CDK4(比例0.56,拷贝数 = 14.0)。在所有肿瘤类型中,RTK–RAS通路(如EGFR、ERBB2和FGFR1)、TP53通路(如MDM2)以及细胞周期通路(如CCND1和CDK4)中的癌基因是最常见的ecDNA扩增靶点。值得注意的是,一些驱动基因扩增还伴随着错义突变,例如CDK4和EGFR的突变可能在ecDNA形成前已发生(图1d)。
为了进一步评估癌基因的选择强度,研究分析了非同义(dN)与同义(dS)替代的比率(dN/dS),以研究错义突变、无义突变和关键剪接位点突变的进化压力。高dN/dS比值提示基因处于正向选择状态。研究将GEL队列中基因扩增的频率与dN/dS比率反映的突变正选择信号进行关联分析,并进一步比较非扩增、ecDNA扩增和染色体扩增的基因之间的突变选择信号差异。结果发现,EGFR和ERBB2的突变在被扩增时表现出更强的正选择压力(图1e),进一步证实携带癌基因突变的ecDNA受到强烈进化选择驱动。
研究发现,在所有ecDNA阳性的肿瘤中,65.7%的ecDNA上携带来自Bushman癌基因列表(http://www.bushmanlab.org/links/genelists)中的癌基因(图2a-c)。如果使用更保守的癌症基因目录Cancer Gene Census数据库(https://www.sanger.ac.uk/data/cancer-gene-census/),携带癌基因的比例为51%,这一差异反映了两份癌基因列表定义的广度差异。
(3)ecDNA携带免疫调节基因
既往研究表明,ecDNA阳性的肿瘤患者对免疫检查点抑制剂的反应率较低,可能与其呈现免疫抑制相关转录模式有关。然而,导致这种免疫抑制的机制尚未完全阐明。先前研究曾在一例由Barrett食管高级别上皮内瘤变进展为食管腺癌患者的活检组织中,发现ecDNA携带免疫调节基因。
为进一步探究这一现象,本研究分析了免疫调节基因在ecDNA上的扩增频率、组织背景以及是否存在富集。结果发现,在ecDNA阳性的肿瘤中,有34%的样本携带已知的免疫调节基因,且这些基因大多与附近的癌基因共同扩增(图2b, 2c)。但值得注意的是,在这些携带免疫调节基因的ecDNA中,有41.5%的样本并未同时携带癌基因,提示这些免疫调节基因可能具备独立的功能意义(图2b, 2c)。这些富集于ecDNA的免疫调节基因涉及多种免疫调控过程,包括免疫效应过程的负调控(Gene Ontology代码GO:0002698),白细胞介导的细胞毒性作用(GO:0001909)以及淋巴细胞激活的负调控(GO:0051250)(图2d)。
为评估这些免疫调节基因扩增的潜在影响,研究比较了肿瘤中T细胞比例的估计值。结果显示,在控制肿瘤纯度后,携带免疫调节基因的ecDNA样本中T细胞比例显著降低(OR = 0.86,95% CI:0.74–0.99;图2f);若ecDNA同时携带免疫调节基因与癌基因,T细胞耗竭现象更为显著(OR = 0.78,95% CI:0.66–0.92)。这可能部分解释了ecDNA阳性肿瘤对免疫治疗反应较差的原因。
尽管不携带癌基因的ecDNA中免疫调节基因的扩增倍数低于承载癌基因的ecDNA的扩增水平,但相较于其他同样缺乏癌基因的ecDNA,其扩增倍数仍显著升高(图2g)。
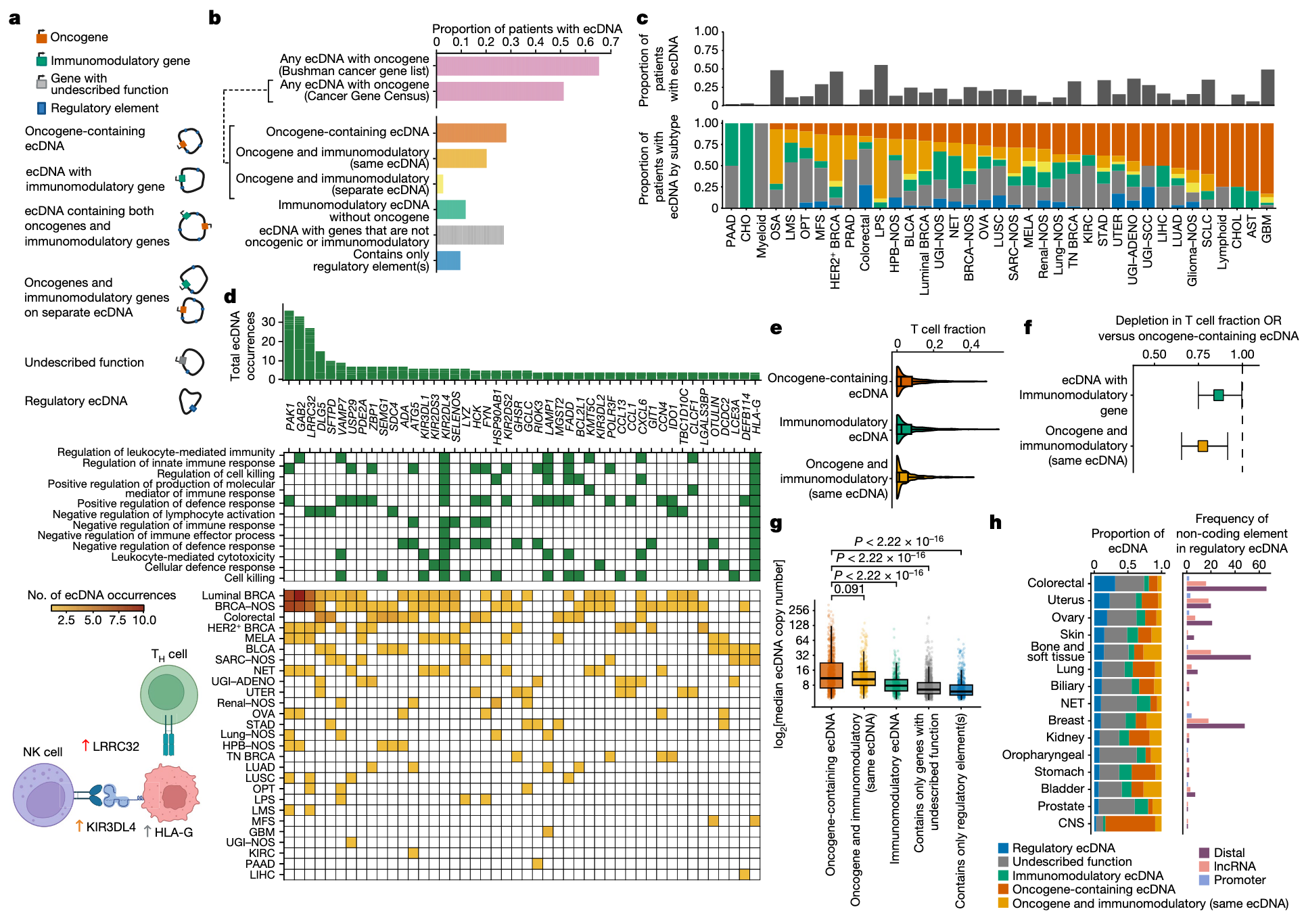
图2. 免疫调节性和调控性ecDNA
(4)调控性ecDNA与基因组不稳定性的关系
ecDNA生物学的一个关键特征在于不同功能元件的ecDNA能够发生空间互作,形成所谓的“ecDNA枢纽(ecDNA hub)”结构。这种结构可实现组合式调控,即一个ecDNA上的增强子可与另一个ecDNA上的启动子协同作用,从而驱动基因表达。据此,研究人员推测,肿瘤样本中也可能存在仅包含调控元件(如启动子、增强子和lncRNA)的ecDNA,这类ecDNA被称为调控性ecDNA。为验证这一假设,研究者使用肿瘤增强子、启动子和lncRNA注释数据库对已识别的ecDNA序列进行了功能注释。
结果显示,与携带编码基因的ecDNA相比,调控性ecDNA单位长度内富集更多远端增强子和启动子。这些仅含增强子的ecDNA在多个样本中经常与携带癌基因的ecDNA共扩增(n = 140),且具有体积较小,拷贝数较低的特征。此外,研究人员通过AmpliconArchitect评估发现,仅含增强子的ecDNA的复杂度(即结构片段数及其多样性)显著低于携带癌基因的ecDNA。然而,当与癌基因ecDNA共扩增时,其拷贝数则显著升高。这些结果表明,调控性元件是ecDNA中常见组分,且往往以小型、低复杂度结构的形式被扩增。
(5)ecDNA与基因组不稳定性
尽管既往研究提示ecDNA与肿瘤基因组不稳定性相关,但两者在不同癌种中的具体关联模式仍不清楚。本研究进一步探讨了ecDNA与抑癌基因突变、染色体不稳定性,以及全基因组倍增(WGD)之间的关系。校正癌症类型后发现,TP53基因突变与ecDNA的存在显示出最强的关联性(图3a)。另外,在某些肿瘤类型中,TP53功能缺失突变(包括无义突变和错义突变)与ecDNA中编码的MDM2呈现互斥模式(图3b)。
进一步分析显示,ecDNA的存在与特定组织类型的关键肿瘤抑制通路基因突变高度相关。例如,在子宫内膜癌、肾癌以及雌激素受体阳性的乳腺癌中,ecDNA显著富集于TP53突变样本。此外,在肉瘤中ecDNA与NF1突变相关,在肾癌中与ARID1A突变相关,在膀胱癌中则与RB1突变相关(图3c)。基于dN/dS分析,在这些ecDNA相关的癌症类型中,TP53基因通常表现出强烈的正向选择压力。
为评估ecDNA与其他基因组不稳定性指标的关系,研究考察了以下参数:全基因组倍增(WGD,定义为样本平均倍性>2.7)、结构变异负荷(每Mb结构变异数),以及加权基因组不稳定指数(wGII,反映倍性校正后的染色体拷贝数变异)。与此同时,研究者还为每个ecDNA计算了扩增子复杂度分数,推测低复杂度结构可能源于ecDNA的染色体外形成过程,而高复杂度结构更可能源于灾难性重排事件,如染色体碎裂(chromothripsis)。
结果显示,ecDNA的存在与WGD、wGII和结构变异负担均呈正相关,且相关性具有癌种特异性。例如,肉瘤中富集高复杂度ecDNA扩增子,并伴有显著升高的结构变异负荷;而结直肠癌则富集低复杂度ecDNA,同时表现出高倍性和高wGII,但结构变异负荷并无明显上升(图3c)。这提示,不同分子机制可能参与不同癌症的进展或导致不同类型的ecDNA形成。
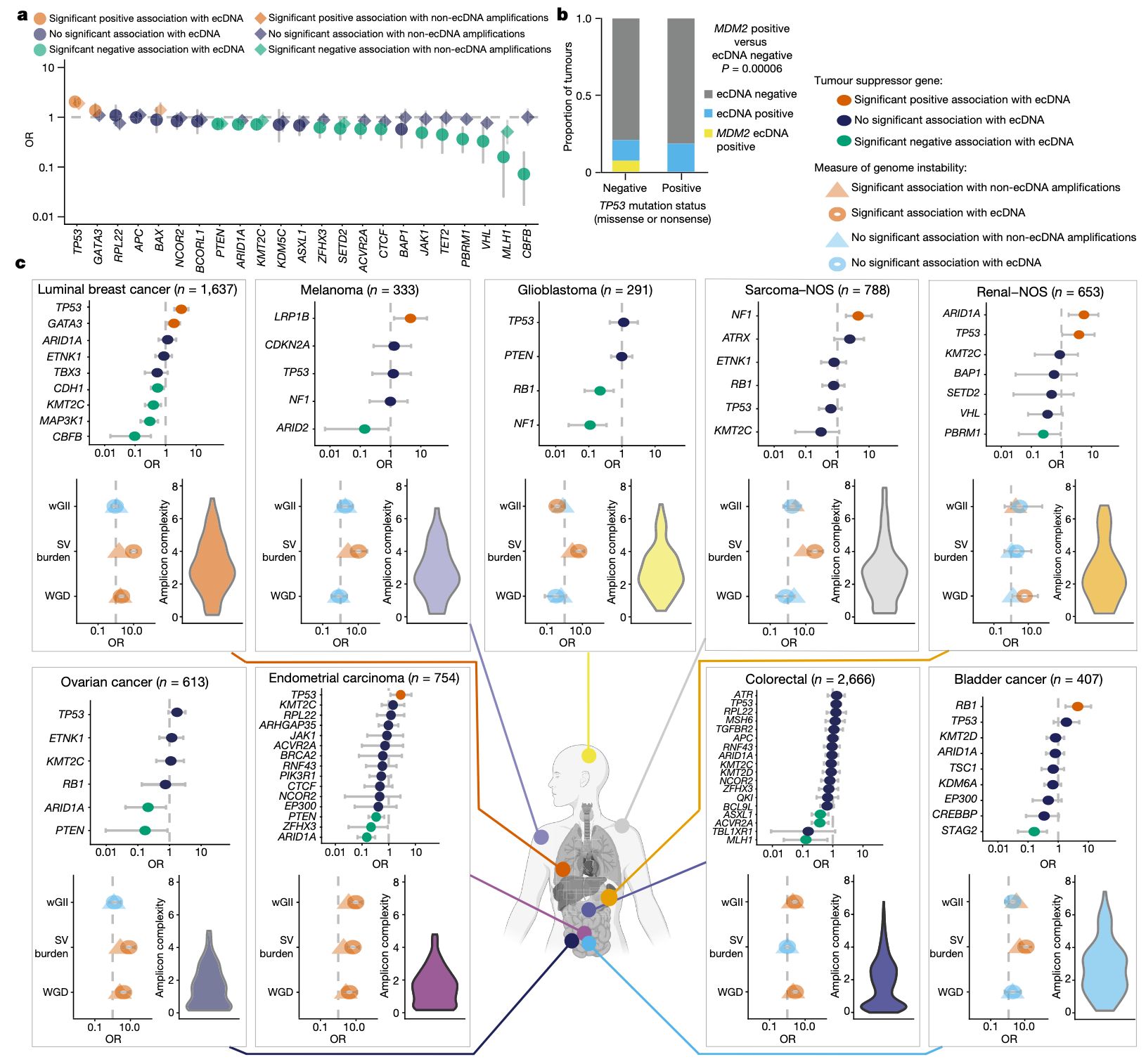
图3. 基因组不稳定性和 ecDNA 的相关性
(6)ecDNA与肿瘤单碱基突变
GEL数据集的规模使得检测稀有突变特征成为可能。因此,研究利用已发表的突变特征数据,识别可能在ecDNA阳性肿瘤中富集的广泛突变谱。结果显示,与仅存在线性染色体扩增或无局灶性扩增的肿瘤样本相比,携带ecDNA的样本表现出更高的肿瘤突变负荷(TMB)。该相关性在校正年龄、肿瘤类型和肿瘤纯度等因素后依然显著(图4a),但仅存在于非高突变表型肿瘤中(图4b)。
在控制肿瘤类型的前提下,研究分析了全基因组单碱基替换(SBS)突变特征与ecDNA的关联,发现 SBS1(脱氨反应)、SBS4(烟草暴露)、SBS8(未知机制)和 SBS13(APOBEC胞苷脱氨酶)等特征与ecDNA的存在显著正相关,且该相较其他局灶性扩增类型更为显著。相反,错配修复缺陷(MMRd)相关特征(SBS6、SBS15、SBS26 和 SBS44)及DNA聚合酶δ/ε缺陷联合 MMRd(SBS10a、SBS10b、SBS14 和 SBS20)特征则与ecDNA的形成呈负相关(图 4b)。研究还发现,ecDNA与高突变状态呈负相关,这一现象主要由POLE/POLD1缺陷型结直肠癌与子宫内膜癌中ecDNA缺失的强关联所驱动(图4b)。
通过分析 ecDNA 预测区域内的突变分布模式,研究得以推断某些突变相对于ecDNA形成事件的时间顺序:若所有ecDNA拷贝均携带某突变,则推测该突变发生于ecDNA形成之前;反之,若仅部分ecDNA携带该突变,则可能发生于其形成之后。在控制肿瘤类型后,研究发现ecDNA形成前主要的突变过程包括烟草暴露(SBS4与SBS92)、紫外线辐射(SBS7a)及时钟式脱氨(SBS1);而同源重组修复缺陷特征(SBS3)更可能在ecDNA形成后发生。
此外,治疗干预也可能影响ecDNA的进化。在一例接受替莫唑胺(TMZ)治疗的胶质母细胞瘤患者中,研究在其67个ecDNA拷贝中均检测到EGFRc.3106A>T突变。进一步检测显示,这些EGFR突变型ecDNA上还携带TMZ诱导的MMRd超突变特征SBS11,并伴有大量TMZ治疗相关的新突变,有些突变的等位基因频率极高,提示其可能经历了强烈的正向选择过程。综上所述,这些数据表明TMZ治疗可通过诱导突变及后续选择性进化,驱动 ecDNA 的适应性演化。
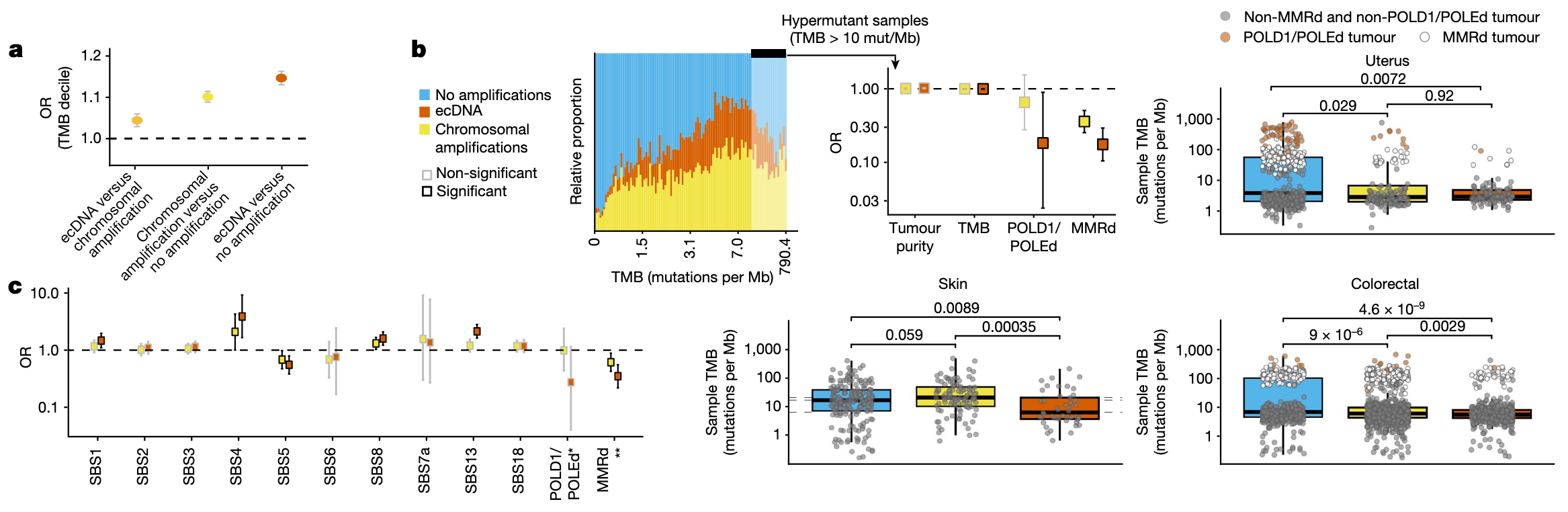
图4. 肿瘤碱基突变和ecDNA形成的关系
(7)ecDNA 的预后相关性
在控制年龄、性别与肿瘤类型后,研究发现ecDNA的存在与肿瘤分期升高显著相关(第2期vs第1期:OR=1.46,95%CI:1.24–1.68;第3期vs第1期:OR=1.79,95%CI:1.49–2.08;第4期vs第1期:OR=2.18,95%CI:1.81–2.54;图5a),表明 ecDNA 阳性率随肿瘤分期进展而升高。此外,在控制肿瘤类型后,研究还发现ecDNA在转移样本中显著富集(非配对样本:OR=1.56,95%CI:1.24–1.96;图5b),提示ecDNA可能在肿瘤进展及转移过程中发挥作用。
研究进一步探讨了ecDNA与既往治疗史的关系。通过校正年龄、肿瘤分期、纯度及肿瘤类型的逻辑回归模型分析发现,ecDNA的检出与患者既往接受化疗(OR=2.38,95%CI:1.73–3.27)及靶向治疗(OR=2.87,95%CI:1.12–6.43)显著相关(图5c)。
在一项控制肿瘤类型、分期、年龄、性别及全基因组不稳定性指数(wGII)的Cox比例风险模型中,研究检测到ecDNA阳性的患者显示出显著缩短的总体生存期(HR=1.44,95%CI:1.25–1.66),相比之下,仅存在线性染色体内扩增但无ecDNA的患者风险较低(HR=1.18,95%CI:1.05–1.33),而无局灶性扩增的患者生存期则更长(图5d,e)。
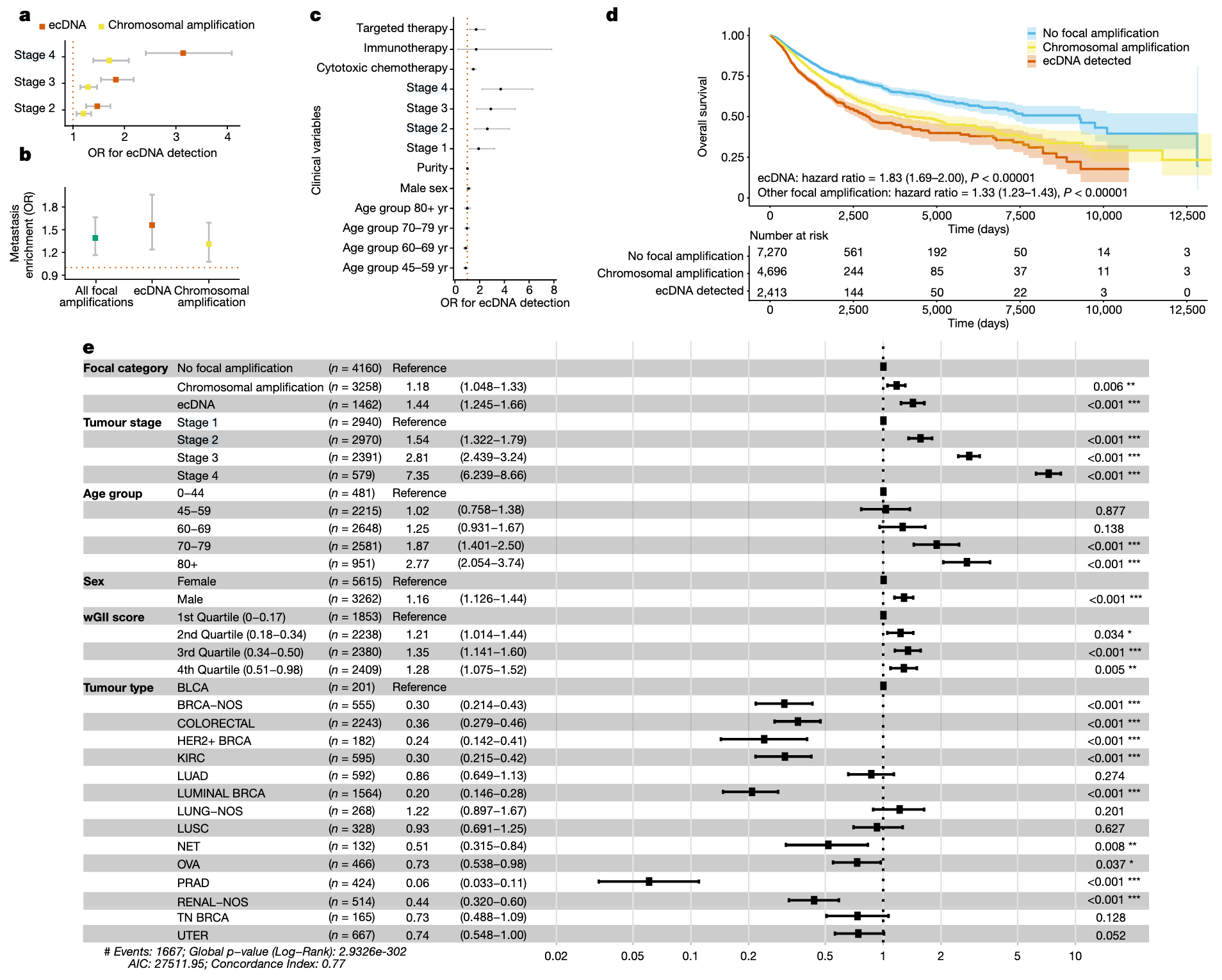
图5. ecDNA与临床结局
讨论:
ecDNA作为肿瘤研究中的非染色体遗传元件,其非孟德尔遗传特性驱动了肿瘤内遗传异质性的快速演化,加速肿瘤适应性进化并赋予治疗耐受性。ecDNA高度开放的染色质结构可重塑基因调控网络,并促进不同ecDNA分子之间的组合式互作。基于迄今最大规模的癌症患者全基因组测序(WGS)队列的分析,本研究揭示了癌症中ecDNA元件的多样性,深入描述了其组织来源、遗传背景,并阐明了相关的突变机制。
研究结果阐明了ecDNA的促癌机制。ecDNA通过高拷贝数扩增关键癌基因驱动肿瘤生长,通过仅含调控元件(增强子/启动子)的ecDNA改变转录调控网络,以及其可能通过免疫调节基因扩增来影响肿瘤免疫微环境。研究还发现了ecDNA的动态演化规律。ecDNA形成前主要受烟草暴露(SBS4)、紫外线(SBS7a)等外源突变驱动;形成后则易发生同源重组修复缺陷(SBS3),这些结果表明ecDNA在肿瘤进展中持续积累遗传变异,为理解ecDNA的形成及其在肿瘤进展中的作用提供了新视角。鉴于有研究表明ecDNA可在高级别异型增生阶段形成并促进肿瘤发生,这一点尤为重要。
此外,研究还发现ecDNA的治疗关联性,在接受细胞毒性或靶向治疗后,肿瘤中的ecDNA水平可能升高,提示将ecDNA靶向治疗与传统或精准治疗策略联合使用具有潜在的临床价值。本研究亦揭示了一些意料之外的现象,例如HER2阳性乳腺癌中ecDNA的检出率高达39.3%–53.7%,其中26%存在ERBB2基因的ecDNA扩增。考虑到ecDNA在驱动细胞间异质性中的作用,这一发现值得重视,特别是HER2拷贝数异质性升高与疾病无进展生存期缩短之间的关联。未来亟需明确HER2异质性在多大程度上由ecDNA所驱动,并全面解析HER2阳性癌症中ecDNA所携带的全部遗传信息及其功能。
尽管研究所用的WGS数据可用于生物信息学层面上检测ecDNA,但该方法仍存在局限性。其中一些局限性与肿瘤样本因素有关,如肿瘤纯度及ecDNA拷贝数对检出率的影响;另一些则属于技术因素,包括重复序列区域中结构变异的识别难度、测序深度的限制,以及区分不同类型局灶性扩增的算法挑战。尽管当前所用的ecDNA检测算法已被证明具有较高的稳健性,但未来随着测序技术的进步和检测方法的优化,预计将对各类癌症中ecDNA的频率做出更精确的估计。
最后,研究指出,ecDNA是独立的不良预后因子,即使在控制了全基因组不稳定性(wGII)等变量之后,仍与总生存期缩短显著相关(HR = 1.44),表明ecDNA可能通过特有机制影响患者生存结局。随着ecDNA在调控肿瘤异质性、耐药性及生存率下降方面作用的日益明确,如何识别ecDNA的治疗靶点并开发抑制其形成与维持的药物,将成为癌症治疗中亟需攻克的重要课题。

汇报人:夏晓旭
导师:赵宇、任建君
审核:代一冯、任建君



