阅读最新文献,紧跟前沿进展,这是一名研究者必须具备的习惯和要求。我们华西医院耳鼻咽喉头颈外科的硕士、博士研究生和博士后们自2019年以来,每周开展一次文献泛读和文献精读分享会,至今已累计开展了200多次。2023年9月13日开始,本科室陆续将其进行整理,同步推出在线前沿速递和文献解读板块。通过这种学习和分享的方式,使汇报者和大家都能对近期权威期刊发表的高质量研究有所了解,同时也是学习其他优秀研究者思路、方法和理论的良好手段。希望通过这种形式,把科内的分享扩大到所有的读者,一起学习,共同进步!
华西医院耳鼻咽喉头颈外科

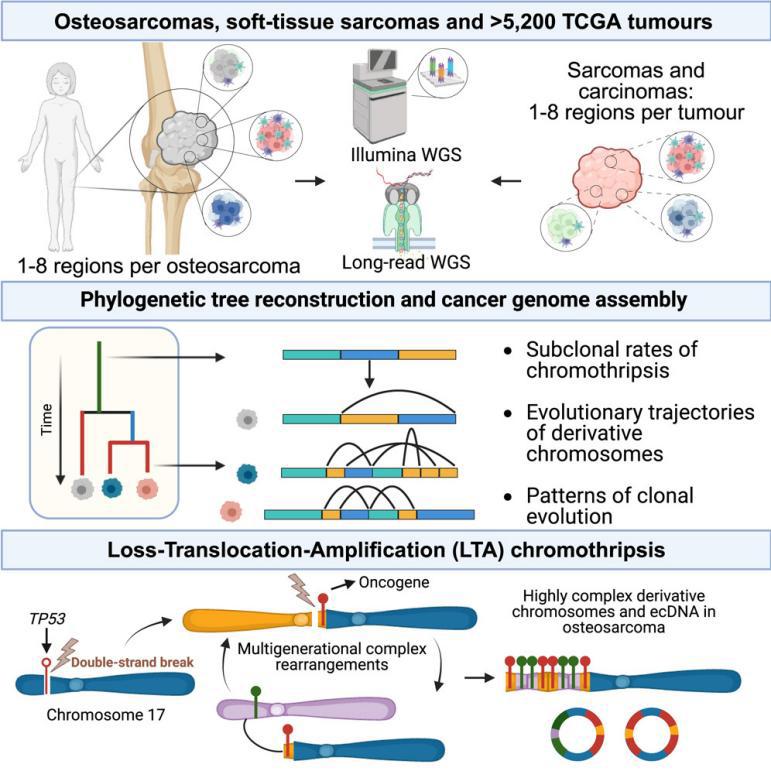
精读分享│【Cell】:持续的染色体碎裂是骨肉瘤基因组复杂性和克隆进化的基础
英文题目:Ongoing chromothripsis underpins osteosarcoma genome complexity and clonal evolution
中文题目:持续的染色体碎裂是骨肉瘤基因组复杂性和克隆进化的基础
发表期刊:Cell(IF: 64.8)
发表单位:1.欧洲分子生物学实验室,欧洲生物信息学研究所
2.伦敦大学学院癌症研究所病理学研究系
发表时间:2025年01月


摘要:
骨肉瘤是最常见的原发性骨癌,在儿童和年轻人中发病率最高。该研究通过多区域全基因组测序(WGS)表征染色体碎裂,发现染色体碎裂是一个持续的突变过程,在74%的骨肉瘤中以亚克隆形式发生。染色体碎裂会产生高度不稳定的衍生染色体,其持续进化推动了不同肉瘤和癌症中致癌突变、克隆多样化和肿瘤内异质性的获得。此外,该研究表征了一种称为丢失-易位-扩增(LTA)染色体碎裂的新机制,它介导了大约一半的儿童和成人高级别骨肉瘤的间断进化。LTA染色体碎裂发生在单个双链断裂触发TP53失活和通过断裂-融合-桥接循环引发致癌基因扩增的情况下。这种现象在骨肉瘤中特别普遍,但在TP53 突变驱动的其他癌症中未检测到。最后,该研究确定全基因组杂合性缺失水平是高级别骨肉瘤的强有力预后指标。
图形摘要:
思维导图:
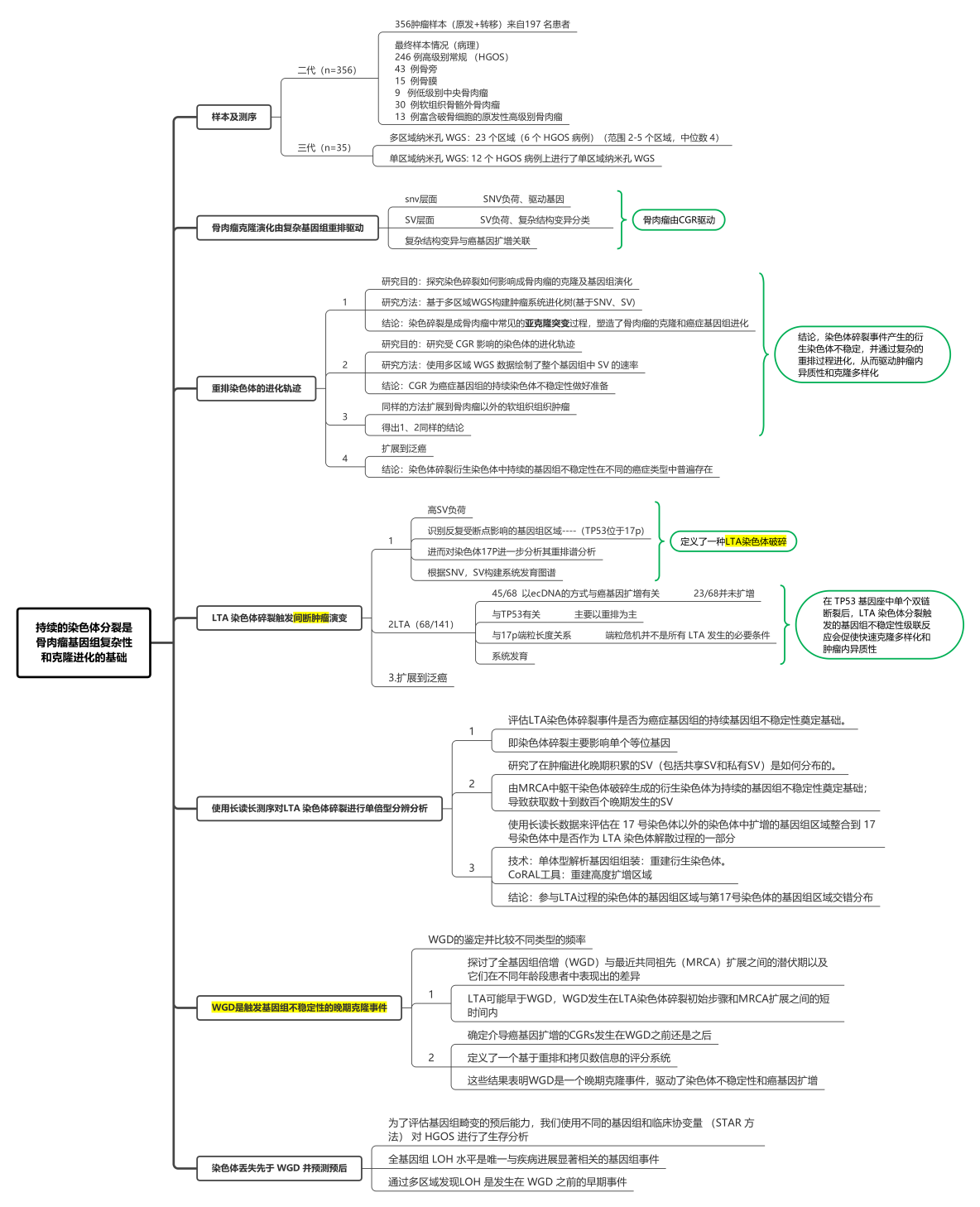
研究背景:
肿瘤WGS分析发现,大多数人类癌症都受到复杂形式的结构变异的影响,其中一个是染色体碎裂。
染色体碎裂:
1)定义:在一条或少数几条染色体上发生数十至数百个成簇的重排。
2)发生机制:这些重排通常由微核中的染色体破碎或通过双着丝粒染色体在细胞分裂后期的桥接断裂所引起。
3)发生率及作用:多种癌症类型中普遍存在,并且它通常介导恶性转化和耐药性。
4)以染色体碎裂为特征的癌症的一个显着例子是骨肉瘤,这是最常见的原发性骨骼恶性肿瘤,其治疗选择和存活率四十多年来一直未改善。
5)骨肉瘤中的研究空白:尽管骨肉瘤显着的染色体组型(以染色体的数目和形态来表示染色体组的特性,称为染色体组型)复杂性早已确定,支撑骨肉瘤基因组复杂性的机制以及染色体碎裂对肿瘤进展过程中癌症基因组进化和克隆异质性的影响仍然难以捉摸。
3. 染色体碎裂的重排特征:是交错结构变异(SV),具有不同程度的杂合性丢失(LOH),这反映了染色体片段化后DNA片段的随机重新连接。
在骨肉瘤中的研究空白:在骨肉瘤中,染色体碎裂事件通常涉及>10条染色体,并与其他基因组畸变共定位,例如全基因组倍增(WGD)和节段扩增,其获得不能用已经描述的重排机制来完全解释。
样本信息:二代(356)+三代(35)(Fig1A)
二代WGS:356肿瘤样本(原发+转移)来自197名患者
1)已发表数据:包括128个肿瘤样本的已发表数据
2)新数据:85名骨肉瘤患者的228个肿瘤区域的高深度多区域Illumina WGS
3)新数据:来自原发性骨肉瘤不常见组织学变异的13个样本
4)最终样本病理情况:246例高级别常规骨肉瘤(HGOS),43例骨旁骨肉瘤,15例骨膜骨肉瘤,9例低级别中央骨肉瘤,30例软组织骨骼外骨肉瘤,13例富含破骨细胞的原发性高级别骨肉瘤
2.三代基因组测序:
1)多区域纳米孔WGS:23个区域(6个HGOS病例)(范围2-5个区域,中位数4)
2)单区域纳米孔WGS:12个HGOS病例上进行了单区域纳米孔WGS。
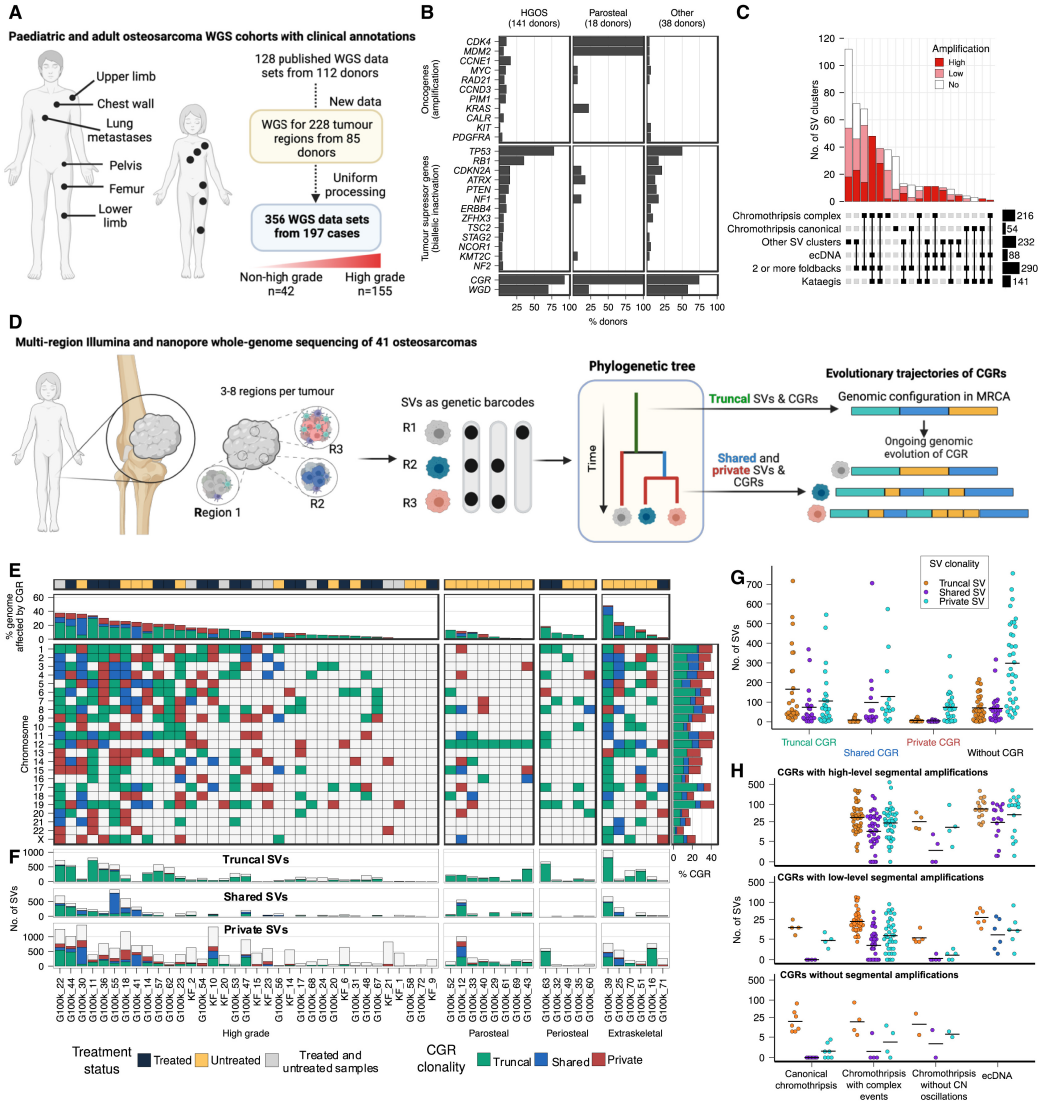
Figure1.Intra-tumor heterogeneity and evolutionary trajectories of chromothriptic chromosomes
结果
骨肉瘤的克隆进化是由复杂的基因组重排驱动的
①单核苷酸变异(SNV)层面:
1)驱动基因分析:确定了已知参与骨肉瘤进化的基因,包括 TP53(在136/197个肿瘤中改变,69%,主要通过内含子1的重排)、RB1(58/197,29%)和 CDKN2A(32/197,16%)(Fig1B和Fig S1)。估计平均负担为每Mb1.85SNV(Fig S1),这与先前报道的骨肉瘤点突变的低负担一致。 然而,在74%的肿瘤中检测到kataegis事件(145/197),表明突变积累的间断爆发(Fig1C、FigS1 和 FigS2)。
2)ALT通路:在53%(104/197)的肿瘤中检测到与端粒替代延长(ALT)通路激活相关的基因组特征,表明该通路在驱动骨肉瘤复制性永生中起主要作用。
3)在HGOS病例中,15%的病例没有 TP53 通路基因(即 TP53 和 MDM2)的改变。与 TP53 突变的HGOS相比,这些病例没有显示其他驱动改变突变的富集,但显示染色体外环状DNA(ecDNA)、kataegis和统称为复杂基因组重排(CGR)的复杂SV簇的发生率显着降低。
4)平均而言,55%的SNV是亚克隆的(中位数53%),表明高水平的肿瘤内异质性。然而,大多数驱动突变是克隆的,没有在亚克隆突变中检测到阳性选择,表明在点突变水平上是中性亚克隆进化。
5)对单碱基替换(SBSs)进行的denova突变特征分析显示,除与铂类治疗相关的特征(SBS31和SBS35)外,所有检测到的突变特征对克隆和亚克隆突变的贡献程度均相当。铂类治疗相关突变特征揭示了复发和转移样本中由单一化疗耐药克隆驱动的克隆扩增,以及治疗后原发肿瘤中多个亚克隆的存活和增殖。
②SV层面:
与SNV相比,SV负荷很高,每个肿瘤的中位数为414个SV(Fig S1)。
仅11%(54/502例)为经典的染色体碎裂事件,余与ecDNA(如MDM2/CDK4共扩增)或片段扩增共现(Fig1c,Fig S1)。
3)HGOS肿瘤中:CGR和WGD很高。
4)高水平的癌基因扩增通常发生在CGR的背景下(Fig1c):骨旁骨肉瘤MDM2和CDK4的共扩增都映射到ecDNA事件;在HGOS肿瘤中57%(81/141)的肿瘤携带至少一种高水平的癌基因扩增;这些在具有CGR的染色体臂中显着富集,并与折返倒位相关—表明HGOS中的癌基因扩增是由断裂-融合桥(BFB)循环驱动的(Fig1c,Fig S1)。
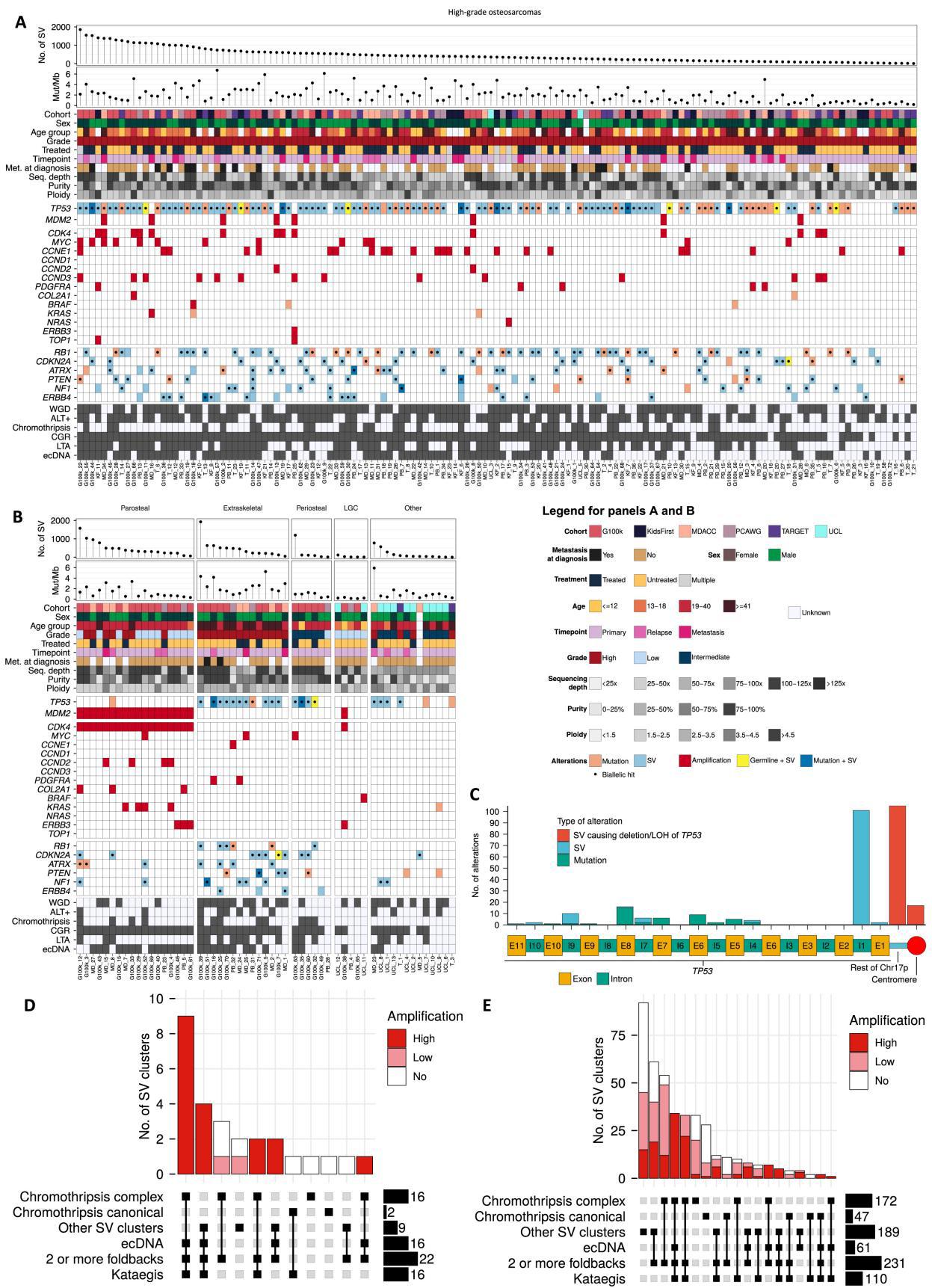
Figure S1. Genomic and clinical landscape of the osteosarcoma samples analyzed in this study, related to Figure 1
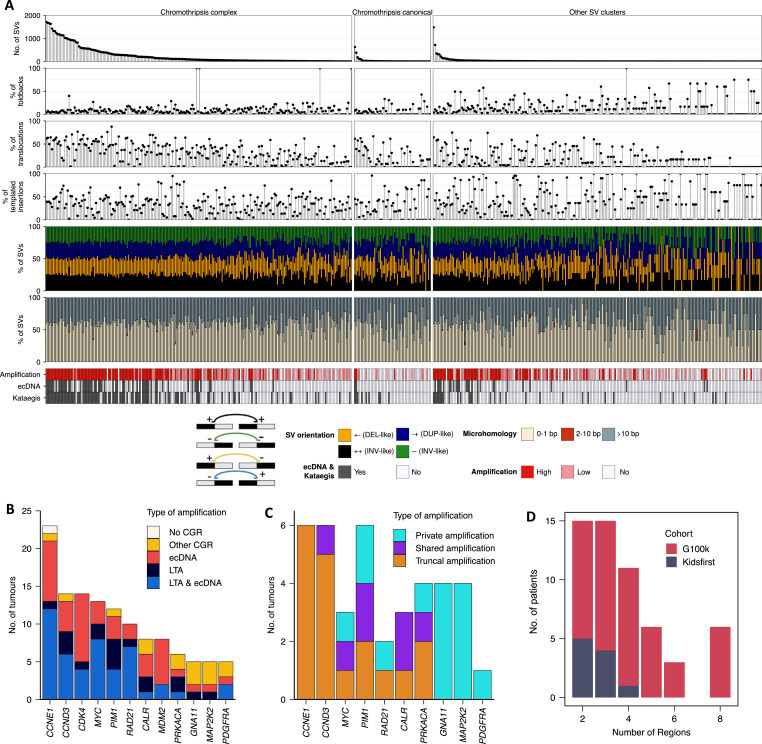
Figure S2 Analysis of the distribution of complex genomic rearrangements and amplifications across high-grade and non-high-grade osteosarcomas, related to Figure 1
重排染色体的进化轨迹
①为了探讨染色碎裂如何影响成骨肉瘤的克隆及基因组演化,该研究使用46个肿瘤的多区域WGS数据及10名患者的多个肿瘤样本WGS数据构建肿瘤系统进化树(Fig1D),按SV出现范围,将SV分为躯干、共享和私有,具体取决于它们是在所有、一个子集还是单独分析的肿瘤区域中检测到,发现62%(130/210)的肿瘤区域和74%(40/54)的肿瘤存在共享或私有的染色体碎裂,通常导致高度分化的染色体组型 (Fig1E,Fig2),因此,这些结果表明,染色体碎裂是一种常见的亚克隆突变过程,它塑造了骨肉瘤的克隆和癌症基因组进化。
②既往研究:染色体碎裂可能先于或紧随其他突变过程,且重排后的染色体会经历持续的基因组不稳定。但由于bulkWGS测序难以检测亚克隆结构变异(SV),且缺乏多区域/单细胞WGS数据,研究染色体重排的演化过程一直具有挑战性。
为了研究受CGR影响的染色体的进化轨迹使用多区域WGS数据绘制了整个基因组中SV的速率,主要发现躯干CGRs在和私有SV显著富集(p<0.001),表明CGR为癌症基因组的持续染色体不稳定性做好准备(Fig1F,Fig1G)
标准染色体碎裂本身不再累积SV(Fig1H),但带区段扩增的躯干染色体碎裂会产生大量共享或私有SV(Fig1E,Fig1F)。高水平扩增可出现跨多条染色体的易位,类似ecDNA驱动的癌症那种。——研究揭示了染色体碎裂与后续区段扩增的相互作用会不断引发更多基因组重排,从而推动肿瘤基因组的持续进化。
③为了进一步研究染色体碎裂是否是骨肉瘤以外肿瘤进化过程中的一个持续过程,该研究对43种软组织和其他骨肉瘤亚型的136个区域进行了多区域WGS,这些区域的特点是基因组复杂性水平不同(每个肿瘤中位数3个区域)具体包含16个黏液纤维肉瘤的43个区域、10个软骨肉瘤29个区域、10个恶性周围神经鞘瘤(MPNST)的39个区域。使用这个数据集,该研究证实了染色体碎裂以高速率在亚克隆下发生(Fig S3A-S3C),发现74%(32/43)的肿瘤表现出共享或私有的染色体碎裂事件。此外,该研究在66%(90/136)的肿瘤区域检测到共享或私有的染色体碎裂事件。总之,这些结果表明,染色体碎裂在多种软组织和骨肉瘤中广泛存在,持续塑造癌症基因组并推动亚克隆层面的肿瘤进化。
④研究目的:由MRCA(最近的共同祖先)触发的染色体碎裂产生的衍生染色体基因组不稳定的现象是否也发生在骨肉瘤以外的软组织和骨肉瘤中,采用与多区域骨肉瘤WGS相同的分析策略,对多区域软组织肉瘤进行WGS研究,主要发现受到躯干性染色体碎裂影响的基因组区域存在数十至数百个共享或私有SV(Fig3)
——结论:躯性染色体碎裂事件可在多种肉瘤中引发并维持基因组不稳定,驱动肿瘤向更复杂的演化方向发展。
⑤这些结果表明,染色体碎裂事件产生的衍生染色体不稳定,并通过复杂的重排过程进化,从而驱动肿瘤内异质性和克隆多样化。
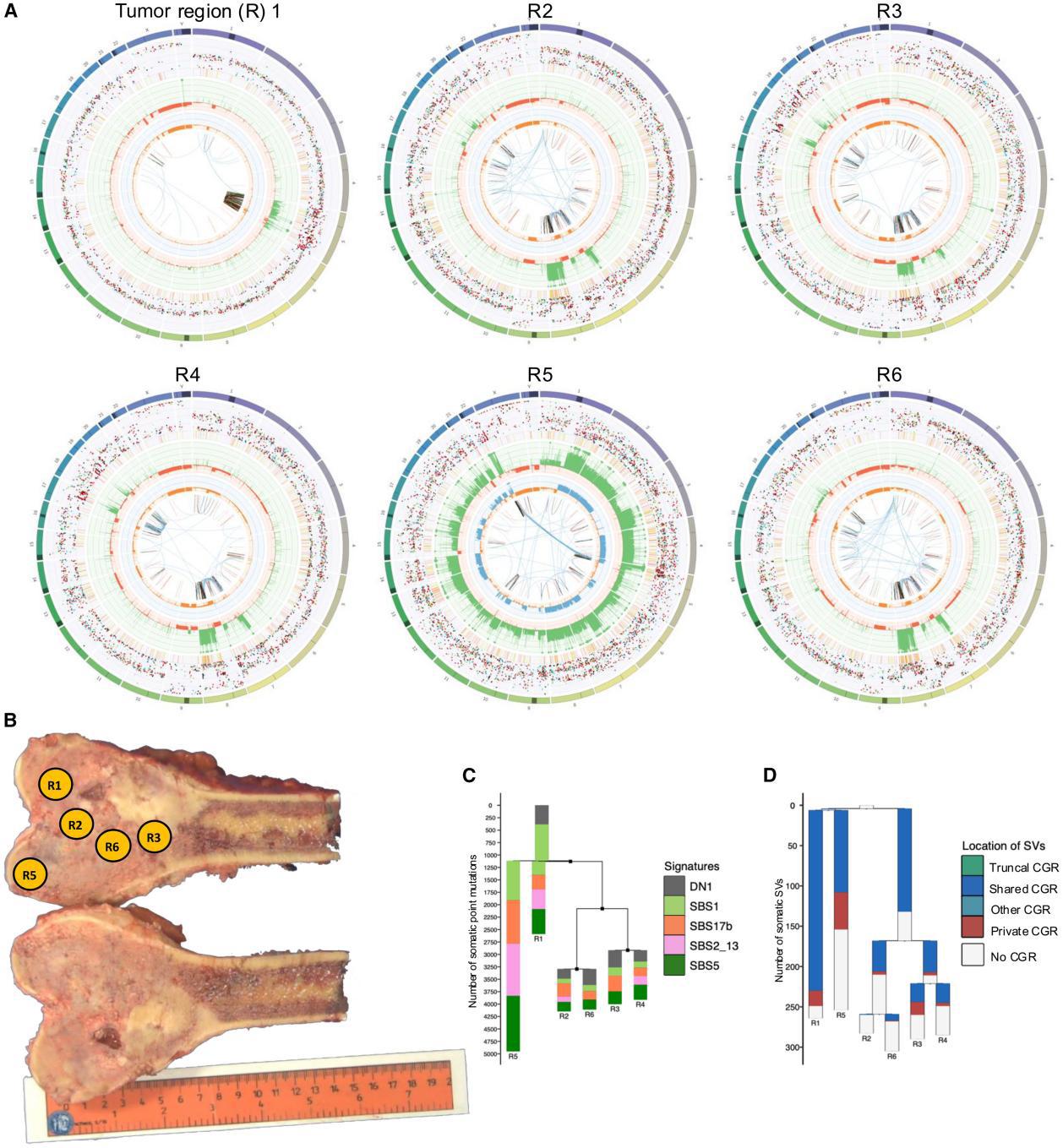
Figure2 Chromothripsis drives clonal diversification and karyotypic heterogeneity in osteosarcoma
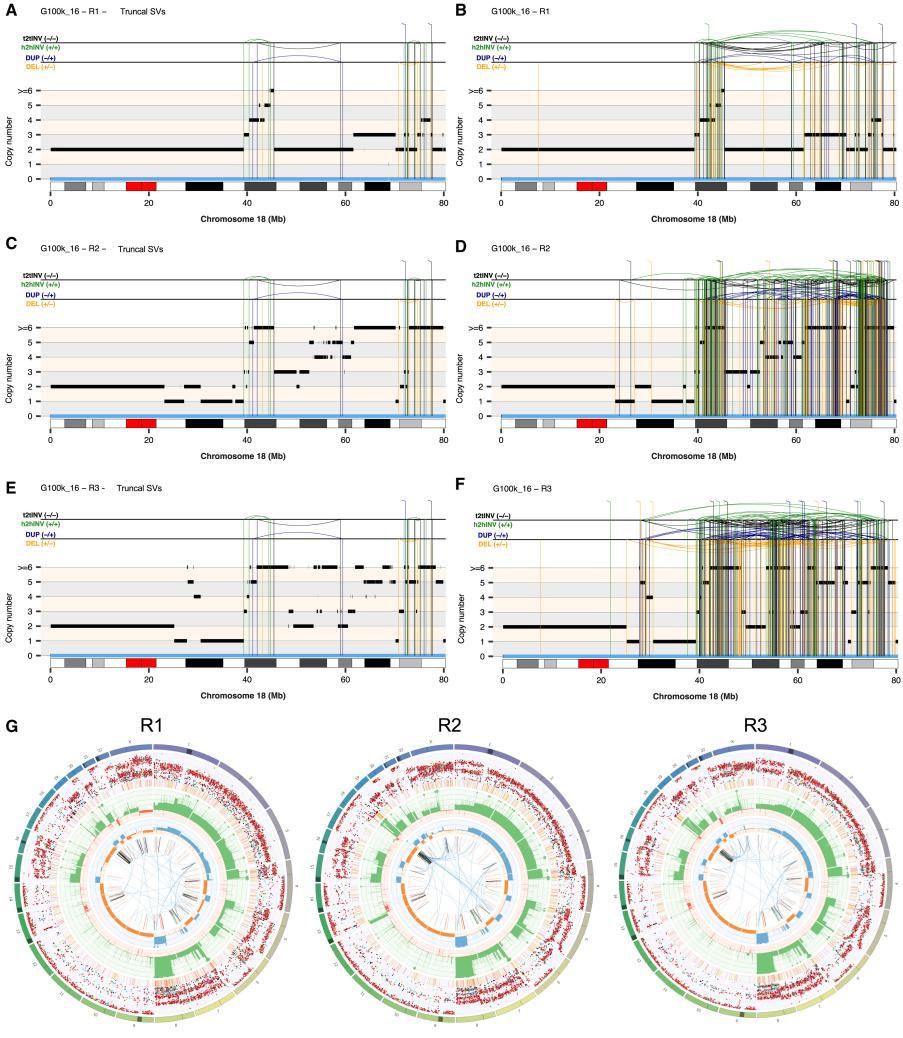
Figure 3 Evolutionary trajectories of chromosomes affected by CGRs in osteosarcoma G100k_16
分析5239例TCGA肿瘤的持续基因组不稳定性
①该研究试图研究染色体碎裂事件产生的衍生染色体在肉瘤以外的癌症类型中是否在基因组上不稳定。为此,统一分析了TCGA的5239对肿瘤-正常对的WGS数据,跨越不同的癌症类型。使用shatterSeek检测复杂基因组重排(CGRs)。在17%的肿瘤(878/5239)中发现了典型的染色体碎裂事件,在33%的肿瘤中发现了具有其他复杂重排的染色体碎裂事件(1743/5239),并且44%CGR被归类为非典型CGRS(2321/5239;FigS3D)
②接下来通过识别受染色体碎裂或CGR影响的基因组区域中的晚期和亚克隆SV来研究持续基因组不稳定性的存在,主要发现与骨肉瘤一致,在泛癌水平上,染色体碎裂伴随其他复杂事件时,基因组不稳定性更为常见(47%),经典染色体碎裂事件中的基因组不稳定性较低(5%),其他复杂基因组重排中也有31%表现出持续的基因组不稳定性。
——染色体碎裂衍生的染色体不稳定性普遍存在于多种癌症,在染色体碎裂事件中观察到的节段扩增的复杂模式,是由衍生染色体的持续基因组不稳定性产生的,这是无法用当前的染色体碎裂模型完全解释。
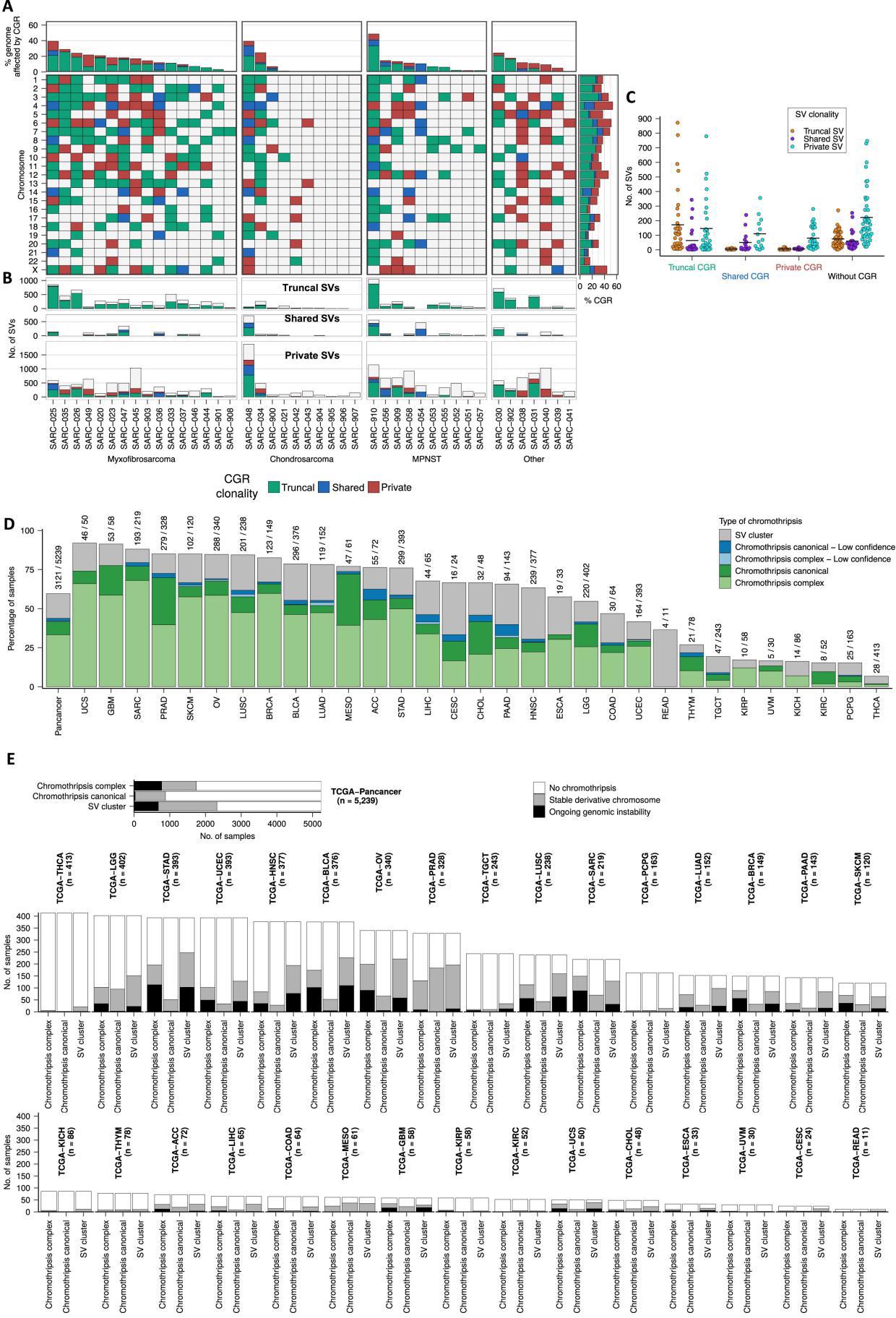
Figure S3 Intra-tumor heterogeneity and evolutionary trajectories of chromosomes affected by truncal CGRs in soft-tissue and bone sarcomas other than osteosarcoma, related to Figures 1, 3, and 4
LTA染色体碎裂触发间断肿瘤演变
①在高级别骨肉瘤(HGOS)中,研究者首先观察到非常高的结构变异(SV)负担(FigS1)。该研究试图去识别反复受断点影响的基因组区域,发现研究在成人和儿童HGOS中,TP53基因座是一个极其常见的重排发生点——与既往文献一致。
②查看染色体17的重排谱(Fig4A),在17P臂端部位(包括TP53基因座)经常发生末端丢失(terminalloss),在下游部分(位于TP53基因之后的一段17p区域),以及其他染色体上的某些基因组区域,会出现节段扩增。
②使用在多区域WGS数据中检测到的SNV和SV重建的肿瘤系统发育分析(treeUPGMA)(Fig4b):染色体17p(常常是TP53内含子1)出现 双链断裂;这个“裸露端”在细胞分裂过程中跨染色体或与姐妹染色单体结合,形成双着丝粒染色体(dicentricchromosome);双着丝粒染色体在后续分裂时易发生“拉扯”或“撕裂”,启动BFB(breakage-fusion-bridge)循环;BFB循环反复进行,累积了多次断裂与融合,进而产生节段扩增,定义了LTA(失活-易位-扩增)染色体碎裂。
③LTA染色体碎裂的鉴定及其特点:141例高等级骨肉瘤中,48%(68/141)呈现这一模式,无论有无WGD,LTA染色体碎裂的发生率都接近48%,带有LTA事件的骨肉瘤SV数量更多,且涉及染色体数量显著增多(Fig4CD);在66%(45/68)的LTA染色体分裂的HGOS中(占所有HGOS的32%,45/141),扩增区域包含癌基因,通常以ecDNA的形式存在,表明LTA染色体碎裂是HGOS中癌基因扩增的常见机制(Fig4CD)其他23例(23/68)致癌基因并未出现反复扩增,与其他LTA病例相比,这23例的衍生染色体同样呈现出极其复杂的结构重排。它们所引发的节段扩增并未覆盖常见的高频扩增致癌基因。在68例样本中,LTA引发的染色体碎裂均伴随TP53等位基因失活,失活方式包括:体细胞点突变(24%(16/68),体细胞重排(71%,48/68)种系突变(6%病例,4/68;4/6个肿瘤来自Li-Fraumeni个体)。说明LTA重排通常发生在TP53部分功能已丧失的细胞环境中。
④既往研究:17p的端粒长度在所有人类染色体中最短,提出假设:端粒危机可能导致姐妹染色单体的末端融合,形成二着丝粒染色体;随后,二着丝粒染色体在细胞分裂过程中断裂,从而触发了LTA染色体碎裂。为了验证:在肿瘤及匹配的血液样本中量化了端粒长度,发现无论是肿瘤样本还是正常血液样本,在有LTA和无LTA的病例中,端粒长度并无统计学上的显著差异。得出结论:虽然难以完全排除端粒缩短(telomereattrition)在某些个案中诱发二着丝粒染色体的可能性,但总体数据说明:端粒危机并不是所有LTA发生的必要条件。那些带有野生型染色体17p的细胞,可能并不必然通过简单的端粒融合途径就触发LTA。
⑤从肿瘤系统发育推断出具有LTA染色体碎裂的HGOS中的克隆动力学模式与间断进化模型一致(即进化过程中长期稳定与短期快速变化交替的模式)。具体表现在:1)远距离肿瘤区域间共享突变极少:宏观上相距数厘米的不同肿瘤区域仅共享少量点突变和引发LTA染色体碎裂的初始重排事件,这些重排显示出高等位基因分数,表明它们是早期克隆事件的一部分(Fig2、Fig4G、Fig5)
2)快速克隆多样化:除主干SNV外,区域间缺乏共享突变,且后续亚克隆分支间无中间过渡分支,表明克隆分化是快速发生的。TP53基因座单次双链断裂触发的LTA染色体碎裂,通过级联基因组不稳定事件驱动快速的克隆分化和肿瘤内异质性——这种模式与快速克隆多样化的模型一致。
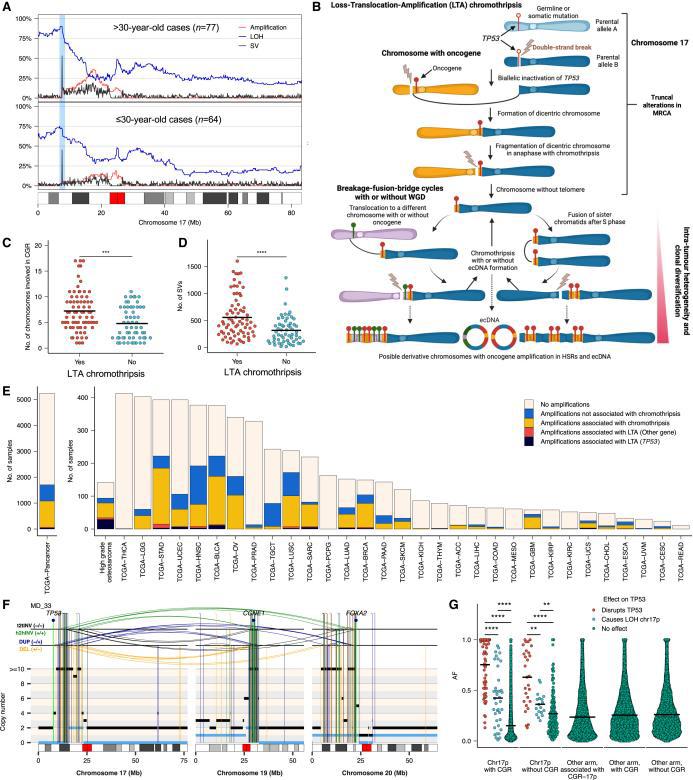
Figure 4 Mechanism of LTA chromothripsis in high-grade osteosarcoma
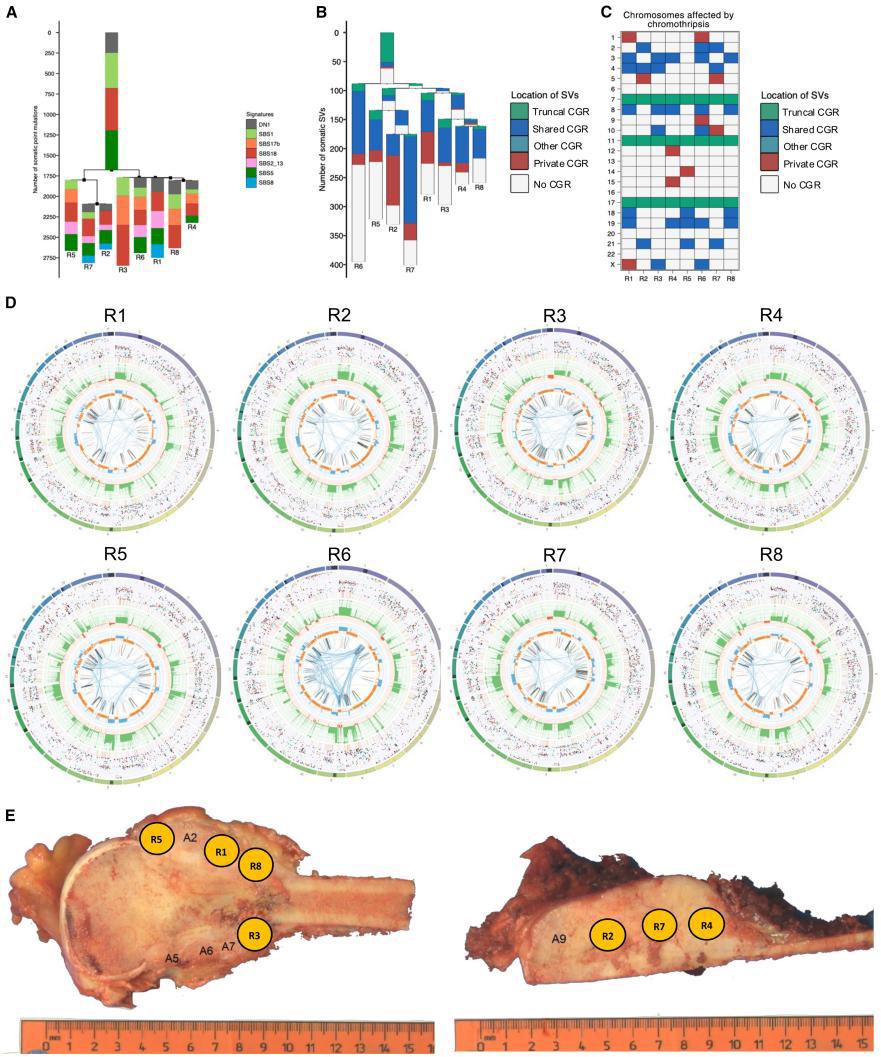
Figure 5 Intra-tumor heterogeneity and phylogenetic analysis for the high-grade osteosarcoma G100k_30
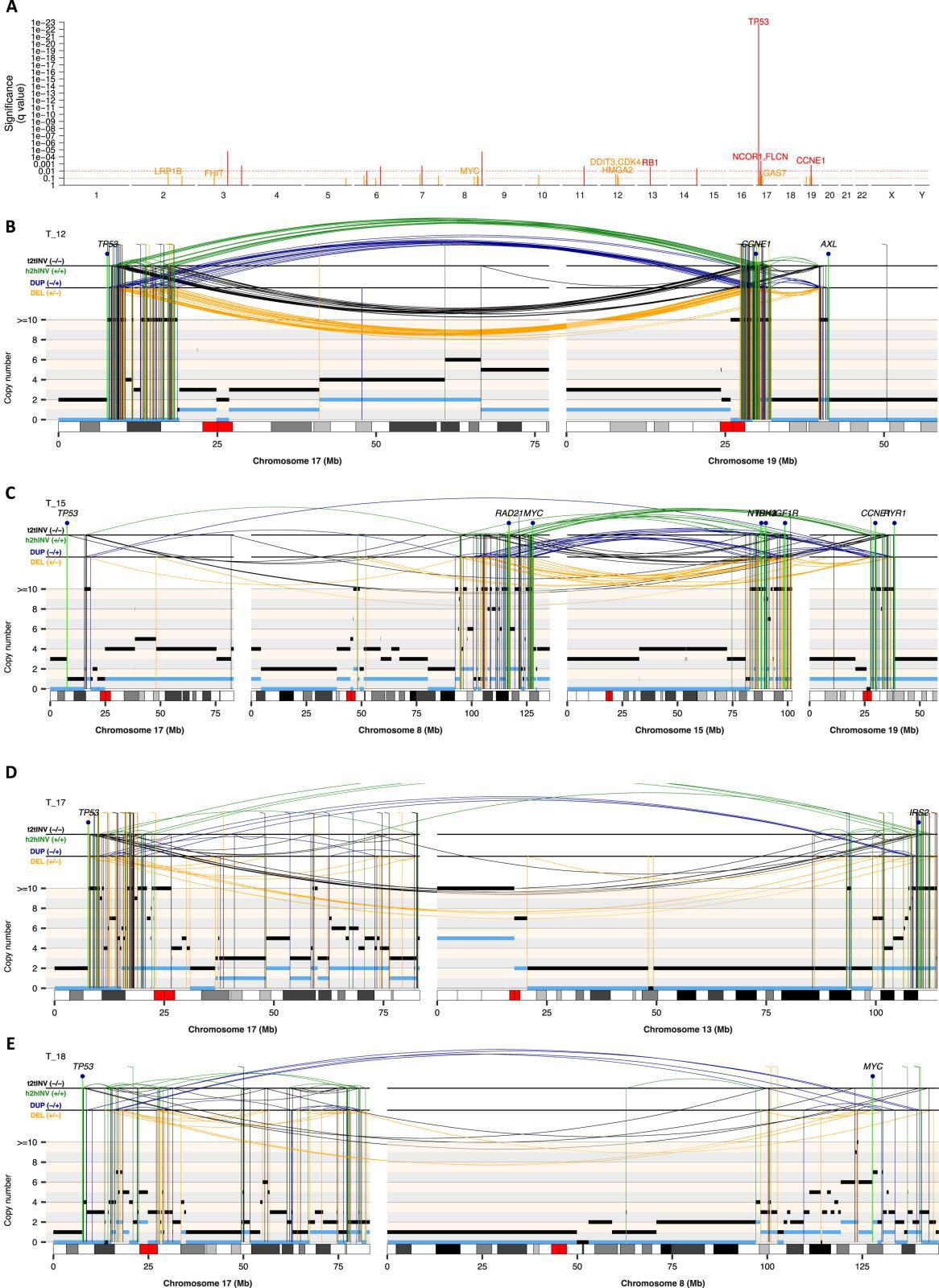
Figure S4 Genome-wide analysis of breakpoint enrichment and examples of LTA chromothripsis events, related to Figure 4
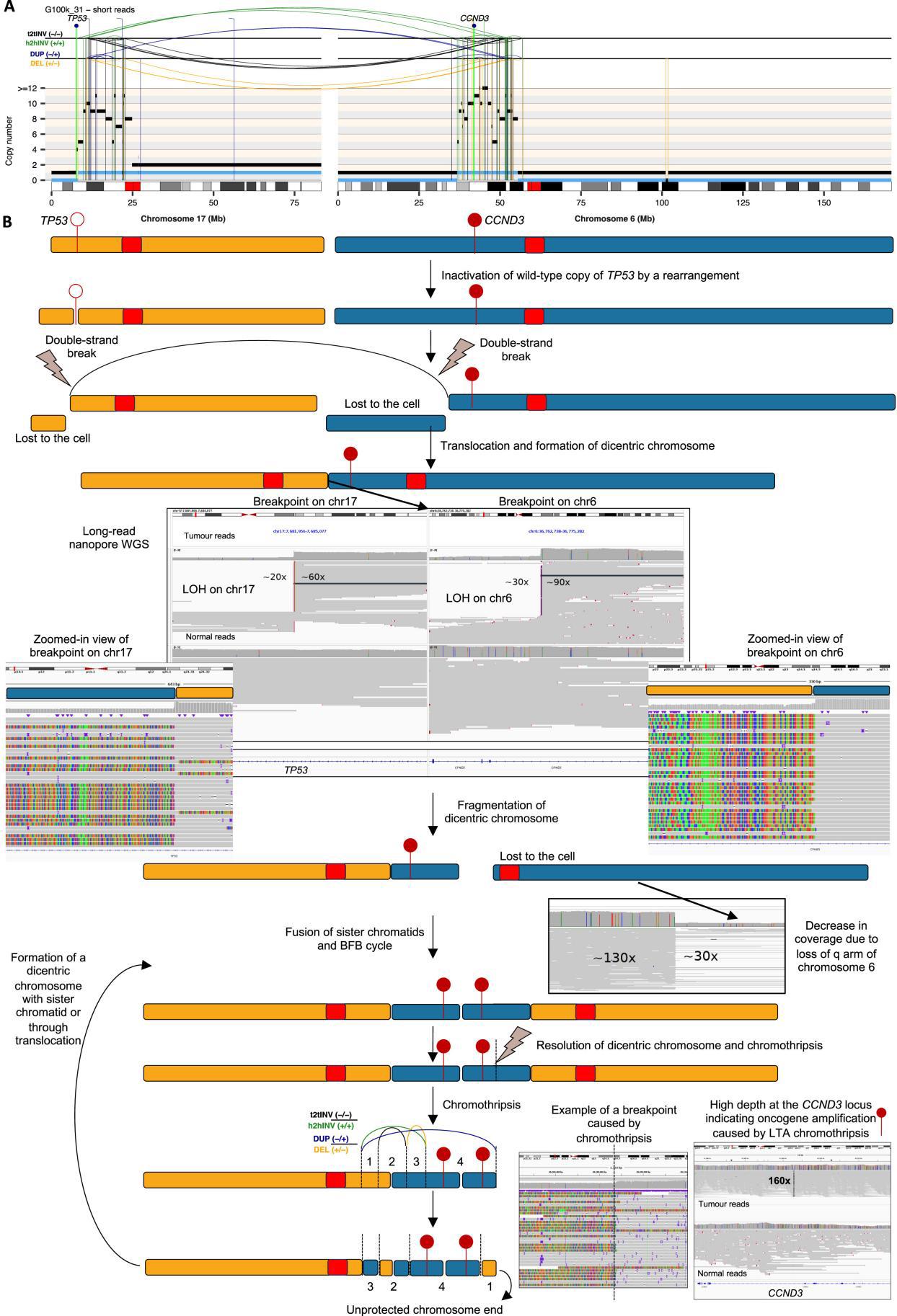
Figure S5 LTA chromothripsis, related to Figure 4
使用长读长测序对LTA染色体碎裂进行单倍型感知分析
①为了评估LTA染色体碎裂事件是否为癌症基因组的持续基因组不稳定性奠定基础。采用多区域纳米孔WGS进行结构变异(SV)的单体型解析分析。
提出假设:若两个亲本等位基因均受影响:主干LTA同源断裂事件将导致均匀分布的SV。若仅一个亲本等位基因受影响:相关SV的测序读数将聚焦于同一亲本等位基因。
研究结果:在最近共同祖先(MRCA)中,仅有一个亲本等位基因受到同源断裂的影响。大多数映射到主干染色体碎裂区域的SV都集中在同一个亲本等位基因上。(FigS6)即染色体碎裂主要影响单个等位基因(提示染色体碎裂的单克隆起源)
②研究了在肿瘤进化晚期积累的SV(包括共享SV和私有SV)是如何分布的。(具体来说,想知道这些SV是发生在受染色体碎裂影响的染色体拷贝上,还是均匀分布于两个亲本等位基因中。若这些SVs显著富集于受累等位基因,则表明染色体碎裂使衍生染色体更易积累后续变异。)
结果:发现受主干同源断裂影响的亲本等位基因中,SV数量显著更高。多数私有和共享的SV映射到受躯干染色体碎裂影响的亲本等位基因通过多区域长读数测序基因组组装验证确认主干和非主干SV都会影响同一个亲本等位基因。(Fig 6A–6D, FigS6B, and S6C)。
结论:由MRCA中躯干染色体破碎生成的衍生染色体为持续的基因组不稳定性奠定基础;导致获取数十到数百个晚期发生的SV。
③该研究的目的是通过长读长测序数据,进一步验证LTA染色体碎裂过程中,除了17号染色体之外的其他染色体上被扩增的基因组区域是否被整合到了17号染色体中,通过以下分析技术:单体型解析基因组组装:重建衍生染色体。CoRAL工具:重建长读长数据中的高度扩增区域。分析结果显示,参与LTA过程的染色体的基因组区域与第17号染色体的基因组区域交错分布——这意味着在LTA染色体碎裂过程中,不仅17号染色体上的基因组区域发生了重排和扩增,其他染色体上的基因组区域也被整合到了17号染色体中(Figures 6C–6F)——此发现与LTA染色体碎裂模型(Fig4B)一致。
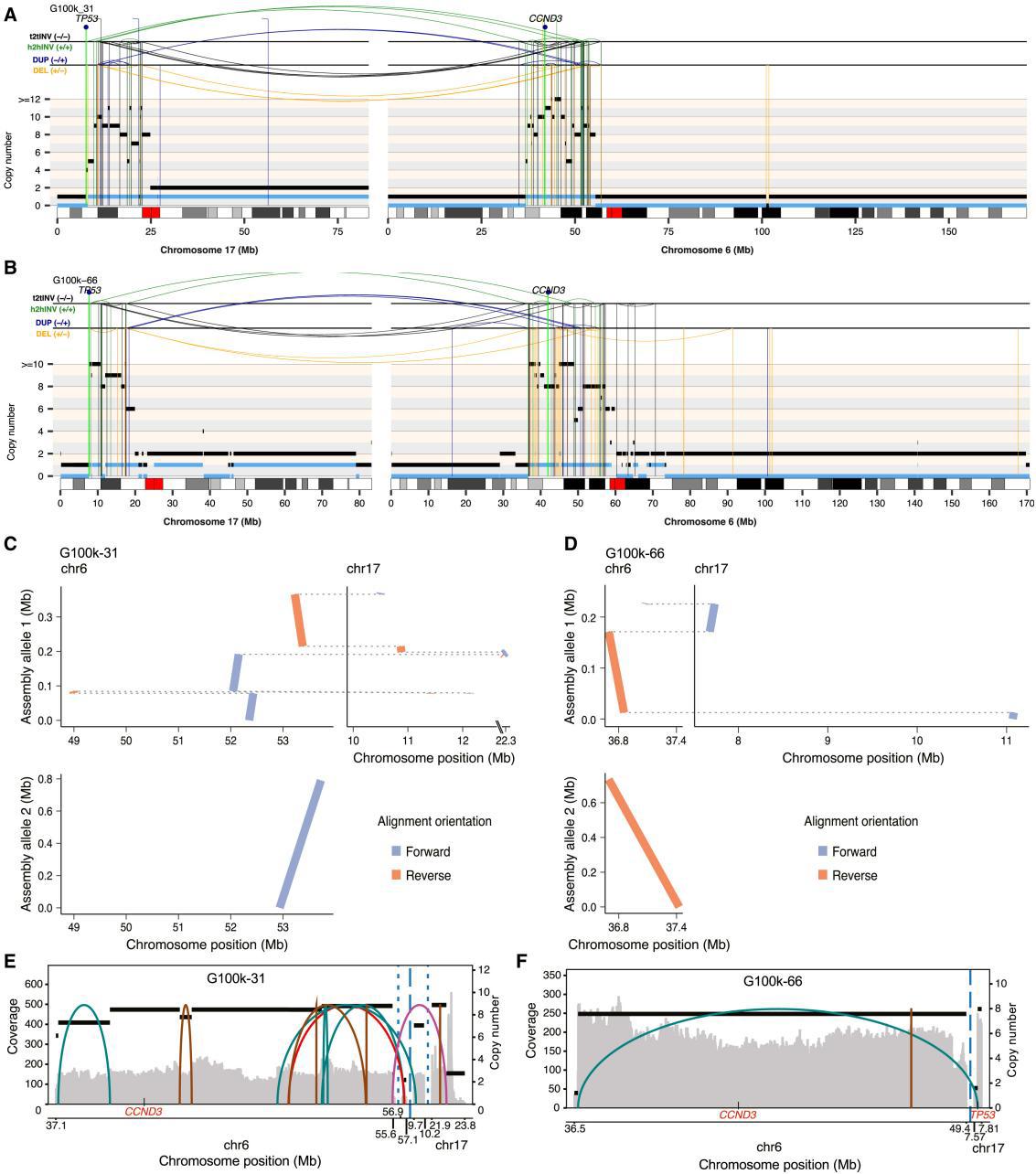
Figure6 Reconstruction and assembly of multi-chromosomal LTA chromothripsis events in high-grade osteosarcomas
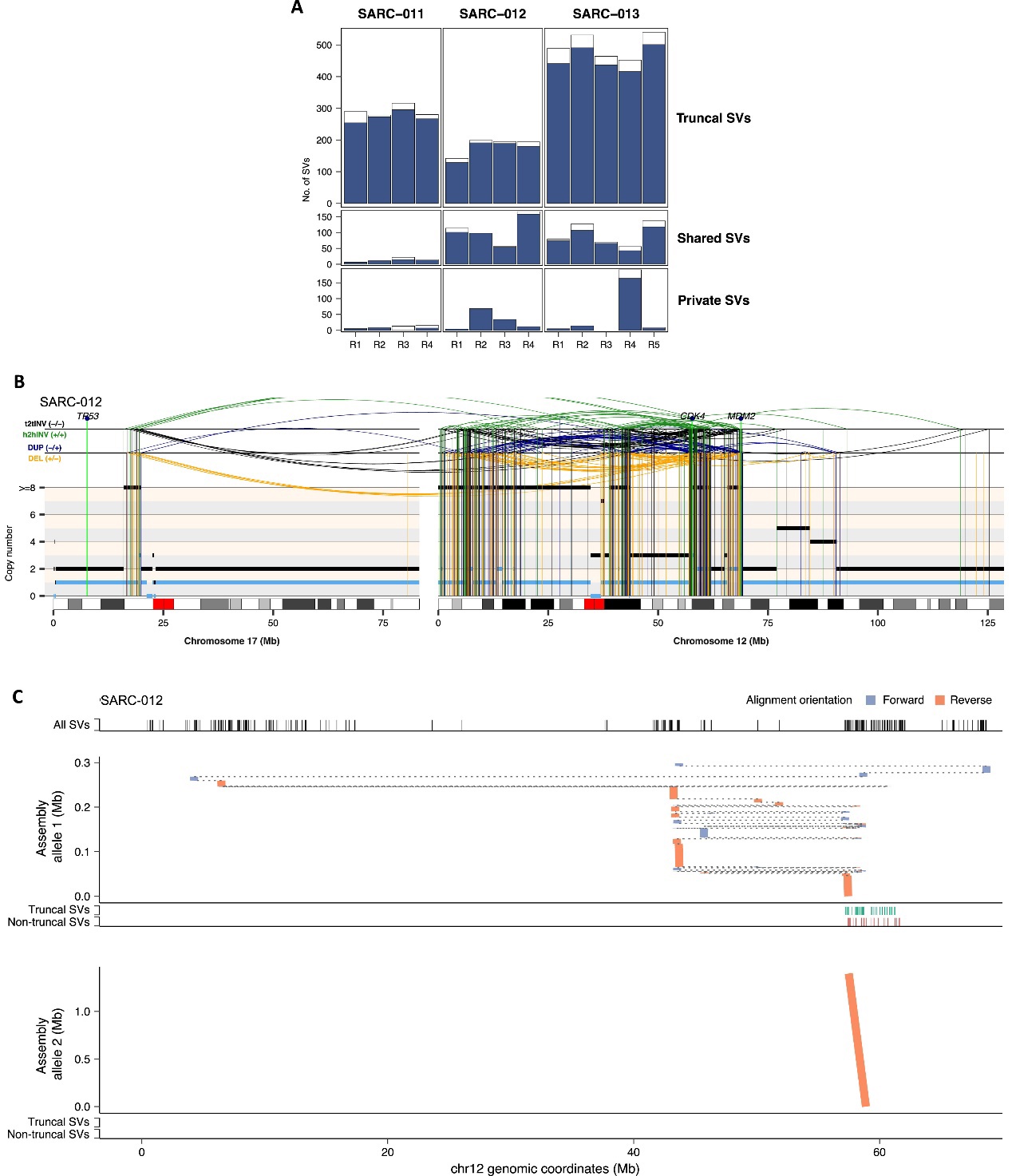
Figure S6. Genome assembly analysis of complex genomic rearrangements using long-read nanopore WGS data, related to Figure 6
5239例TCGA肿瘤中LTA染色体碎裂的分析
①调查LTA染色体碎裂在其他肉瘤和癌症中的频率。
数据来源:TCGA的5329个肿瘤,WGS数据,涵盖31种癌症类型。
研究结果:具体来说,检测到LTA染色体碎裂事件破坏了TP53并导致0.7%的肿瘤中癌基因扩增,LTA染色体碎裂在大多数人类肿瘤中是稀有事件,除了骨肉瘤(图4G)。
检测到0.7%的肿瘤(38/5239)发生了扰动TP53并导致癌基因扩增的LTA同源断裂事件。多数肿瘤中未检测到LTA的证据,包括TP53突变频繁的癌症,如卵巢癌和食道癌(Fig4G和FigS7)。在子宫癌肉瘤(UCS,4%,2/50)、膀胱尿路上皮癌(BLCA,2.9%,11/376)和软组织肉瘤(SARCs,2.3%,5/219)中观察到涉及 TP53 的LTA染色体碎裂率最高(Fig4G)。
②将分析扩展到检测涉及TP53以外的肿瘤抑制基因的LTA染色体碎裂事件。
研究结果:在0.6%的肿瘤(33/5239)中存在不涉及TP53的LTA染色体碎裂,并导致癌基因的扩增,其中胃腺癌(STAD,3%,12/393)、食管癌(ESCA,3%,1/30)和肺鳞状细胞癌(LUSC,2%,5/238)的发生率最高。在TCGA队列中,最常被LTA染色体碎裂破坏的肿瘤抑制基因是TP53(38/5,239,0.73%)、CDKN2A(12/5239,0.23%)和CSMD1(4/5239,0.08%)。
研究结论:这表明LTA染色体碎裂在除骨肉瘤以外的癌症中是罕见的,并且LTA并不是导致多种人类癌症中常见突变的肿瘤抑制基因失活的主要机制。
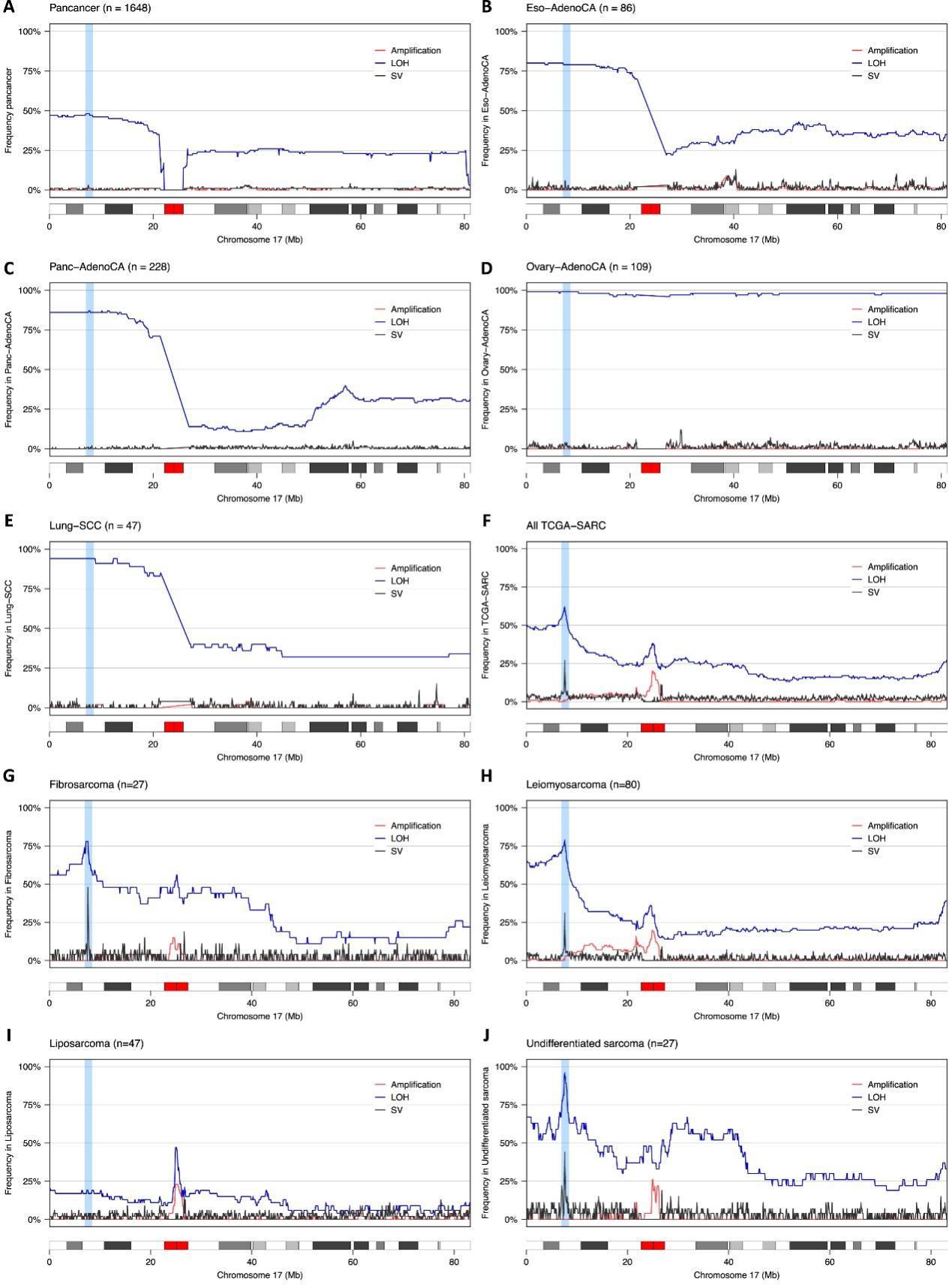
Figure S7. Pan-cancer analysis of rearrangements and copy-number aberrations in chromosome 17, related to Figure 4
WGD 是触发基因组不稳定性的晚期克隆事件
①研究背景:观察到骨肉瘤中WGD的高频率(如Fig1B和FigS1)。
研究目标:确定基因组异常(如体细胞SNV)与WGD之间的时间关系。
研究方法:1)统计WGD前累积的SNVs比例,这些变异需至少存在于两个染色体拷贝中。2)由于SNV负担较低,只有44%的WGD肿瘤(125个样本中的55个)具备时钟样突变(clock-like)用于WGD时机分析。研究结果:1)WGD在96%的肿瘤中为晚期事件,平均发生在突变时间的80%时(图7A)。2)比较HGOS与其他骨肉瘤亚型的WGD时机:无显著差异(见图7B)。3)探讨了全基因组倍增(WGD)出现的时间与最近共同祖先(MRCA)扩增之间的潜伏期以及它们在不同年龄段患者中表现出的差异:儿童与成人HGOS病例在WGD时机及其与MRCA扩展之间的潜伏期显著不同(见图7C和7D),提示生物学差异, 40岁以下患者的平均潜伏期为0.6年,40岁以上患者为1.7年(见图7A)。——与既往PCAWG结果一致4)在具有LTA同源断裂的肿瘤中,检测到17p末端区域的缺失杂合性(LOH),包括TP53位点(这意味着在WGD发生之前,17p末端区域已经发生了基因组重排,导致TP53基因的失活)。
研究结论:LTA可能早于WGD,WGD发生在LTA染色体碎裂初始步骤和MRCA扩增之间的短时间内(FigS4)。
②研究目的:确定介导癌基因扩增的CGRs发生在WGD之前还是之后。
研究方法:定义了一个基于重排和拷贝数信息的评分系统(该研究使用了断点两侧的拷贝数值、由每个重排连接的基因组片段之间的拷贝数跳跃,以及重排断点的等位基因分数)。
研究结果:1)CGRs的时机:99%(815/825)的CGR中,大多数染色体臂的断裂点发生在WGD之后。2)WGD前的重排事件:在11%的CGRs中,至少有5个断点发生在WGD之前,表明存在一个初始的WGD前重排事件。(在WGD发生之前,肿瘤基因组已经经历了一些重排。这些早期重排可能为WGD的发生奠定了基础。3)重排水平上:与癌基因扩增相关的回头倒置中,仅有0.4%(7/1,863)被预测发生在WGD之前(FIg7E–7H)。这些结果表明WGD导致:染色质重塑及基因组不稳定性。4)与肿瘤抑制基因丢失相关的结构变异(SV)始终发生在WGD之前。
研究结论:这些结果表明 WGD 是驱动染色体不稳定和癌基因扩增的晚期克隆事件。
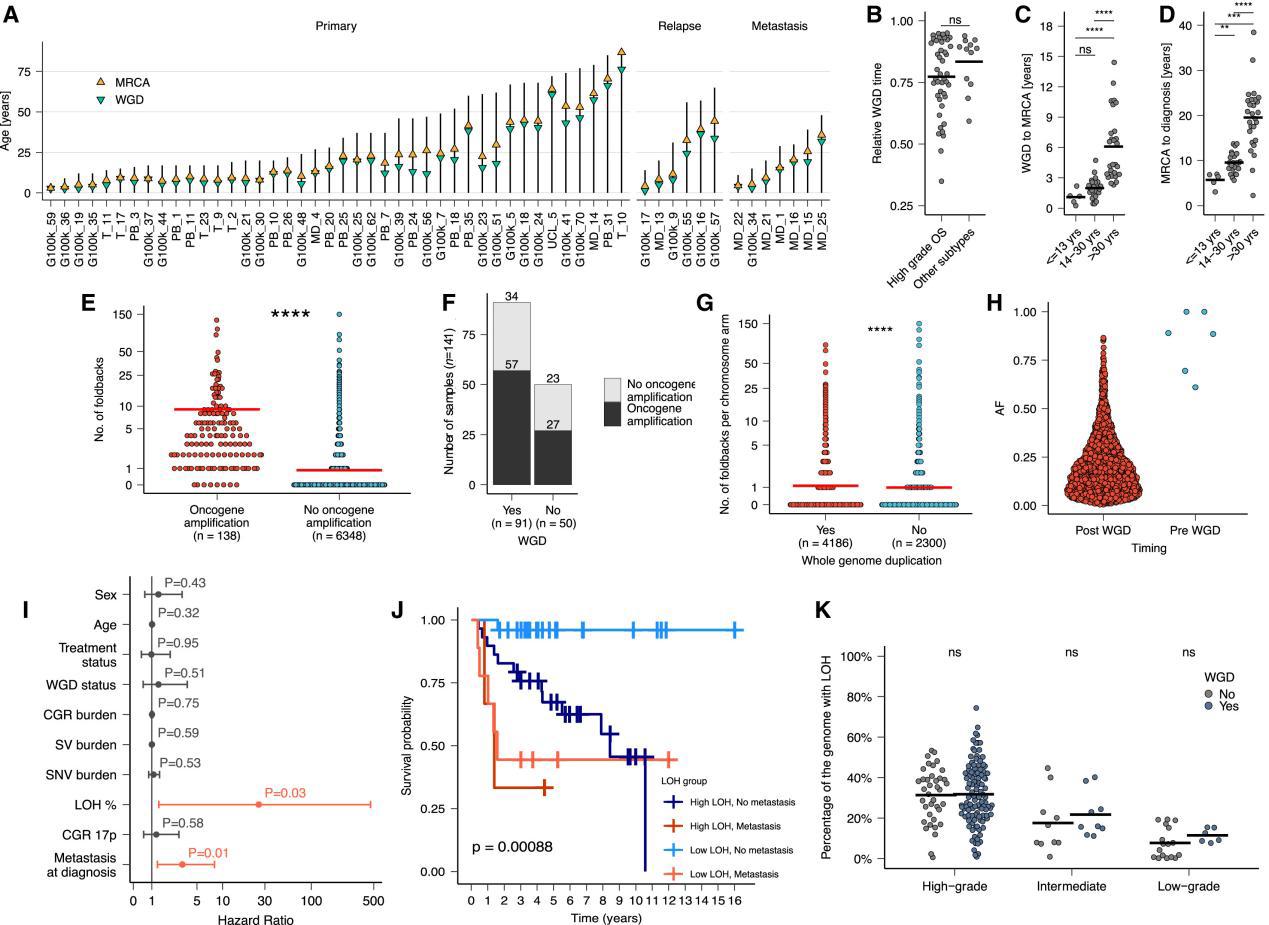
Figure 7 Analysis of whole-genome doubling, oncogene amplification, and genome-wide LOH in high-grade osteosarcoma
染色体丢失先于 WGD 并预测预后
①研究目的:为了评估基因组畸变的预后能力,该研究使用不同的基因组和临床协变量对 HGOS 进行了生存分析。
研究结果:在单变量和多变量分析中,全基因组 LOH 水平是唯一与疾病进展显著相关的基因组事件,(校正了影响生存的已知协变量,例如诊断时的转移)(Fig7I-7K)研究背景。
②据报道,在胰腺导管腺癌小鼠模型中,TP53 失活后的染色体丢失先于 WGD。
主要发现:通过多区域WGS数据,估计60%(95%置信区间:52%-68%)的LOH区域在肿瘤的所有区域中均存在,表明LOH是发生在WGD之前的早期事件。高级别骨肉瘤(HGOS)病例的LOH水平显著高于低级别病例(平均32% vs. 14%;p < 0.001,Wilcoxon秩和检验)。与其他癌症类型不同,检测到高水平的全基因组LOH,且与WGD状态无关。——这意味着即使在没有WGD的情况下,LOH也可能发生,并且可能对肿瘤的进化和预后产生影响 (Figure S1)。
讨论
本文新发现:
持续的染色体碎裂驱动各种肉瘤和癌症的肿瘤进化
染色体碎裂亚克隆性发生在大多数骨和软组织肉瘤
LTA(丢失-易位-扩增)染色体碎裂在骨肉瘤中普遍存在
全基因组杂合性缺失对高级别骨肉瘤具有预后潜力
本文局限:
文中阐述由于该研究对每个肿瘤进行了3-8个肿瘤区域的WGS,无法重建高分辨率的系统发育树(phylogenies),也无法进行适合于系统动力学分析(phylodynamic analysis)的工作,以推断携带不同复杂基因组重排(CGRs)的癌细胞适应性的定量估计。
尽管LTA染色体碎裂是一种在约一半的高级别骨肉瘤(HGOSs)中检测到的重复现象,但由于缺乏骨骼正常细胞中这些核型配置的背景发生率数据,以及缺乏能够反映细胞适应性的表型数据,该研究无法确定LTA染色体碎裂和其他CGRs产生的多种核型配置所面临的自然选择压力。

汇报人:李朔
导师:任建君
审核:胥飞宇、吴婷婷、任建君



