原创 李婧媛 华西医院耳鼻喉科
阅读最新文献,紧跟前沿进展,这是一名研究者必须具备的习惯和要求。我们华西医院耳鼻咽喉头颈外科的硕士、博士研究生和博士后们自2019年以来,每周开展一次文献泛读和文献精读分享会,至今已累计开展了200多次。2023年9月13日开始,本科室陆续将其进行整理,同步推出在线前沿速递和文献解读板块。通过这种学习和分享的方式,使汇报者和大家都能对近期权威期刊发表的高质量研究有所了解,同时也是学习其他优秀研究者思路、方法和理论的良好手段。希望通过这种形式,把科内的分享扩大到所有的读者,一起学习,共同进步!
华西医院耳鼻咽喉头颈外科

精读分享│【Advanced Science】:通过定制的耳蜗外刺激逆转耳蜗核非适应性可塑性:一项治疗耳鸣的新方法
英文题目:Reversing Cochlear Nucleus Maladaptive Plasticity via Customized Extracochlear Stimulation: A New Approach for Tinnitus Treatment
中文题目:通过定制的耳蜗外刺激逆转耳蜗核非适应性可塑性:一项治疗耳鸣的新方法
期刊:Advanced Science(IF: 15.1)
单位:复旦大学附属眼耳鼻喉科医院、复旦大学听力医学研究重点实验室
发表时间:2025年1月


摘要:
耳鸣是一种常见的疾病,在全球范围内影响广泛,由于缺乏有效的治疗手段,仍然是一个重大的临床挑战。有趣的是,人工耳蜗( cochlear implant,CI )使用者的耳鸣症状常常能显著缓解,但其机制尚不清楚,且CI植入可能引发耳蜗损伤和听力损失。本研究通过噪声性听力损失豚鼠模型发现,耳蜗内电刺激( ES )可以逆转耳蜗核( CN )中和耳鸣相关的非适应性可塑性,表现为听觉神经支配减少,躯体感觉神经支配增加,及抑制性神经网络减少。此外,通过新设计的耳蜗外电极阵列向水杨酸钠诱导的耳鸣豚鼠递送定制的耳蜗外刺电刺激,可同样逆转上述的不适应可塑性,减轻了耳鸣,且不会引起额外的耳蜗损伤或听力损失。这些发现表明,CI介导的耳蜗内电刺激可能通过逆转适应不良的耳蜗核可塑性来缓解耳鸣。此外,耳蜗外电刺激策略提供了一种有前景的耳鸣治疗方法,并且对听力损伤的风险极小。
研究思路及方法:
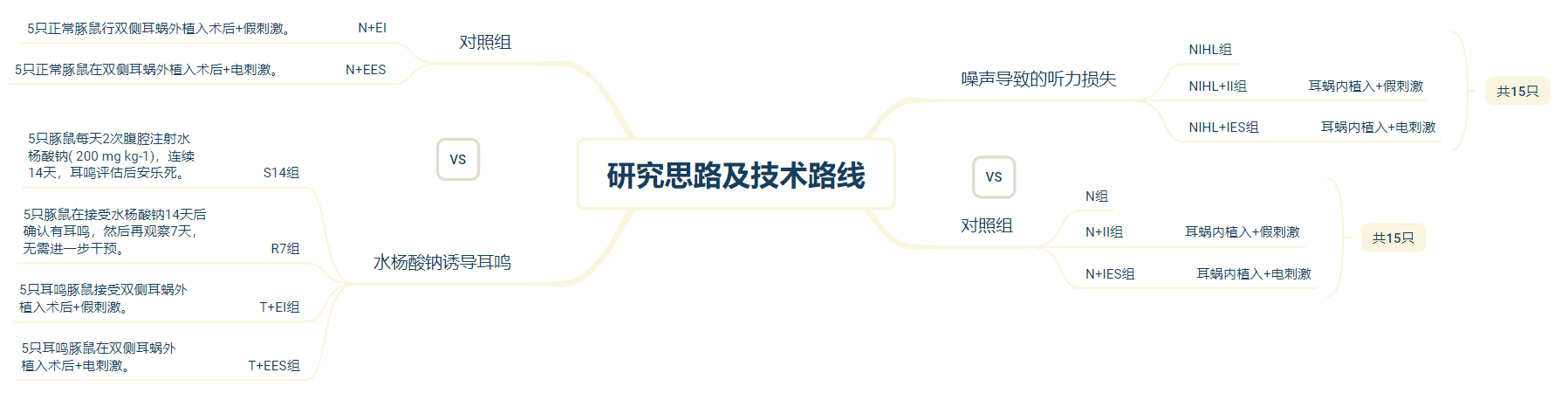
主要结果:
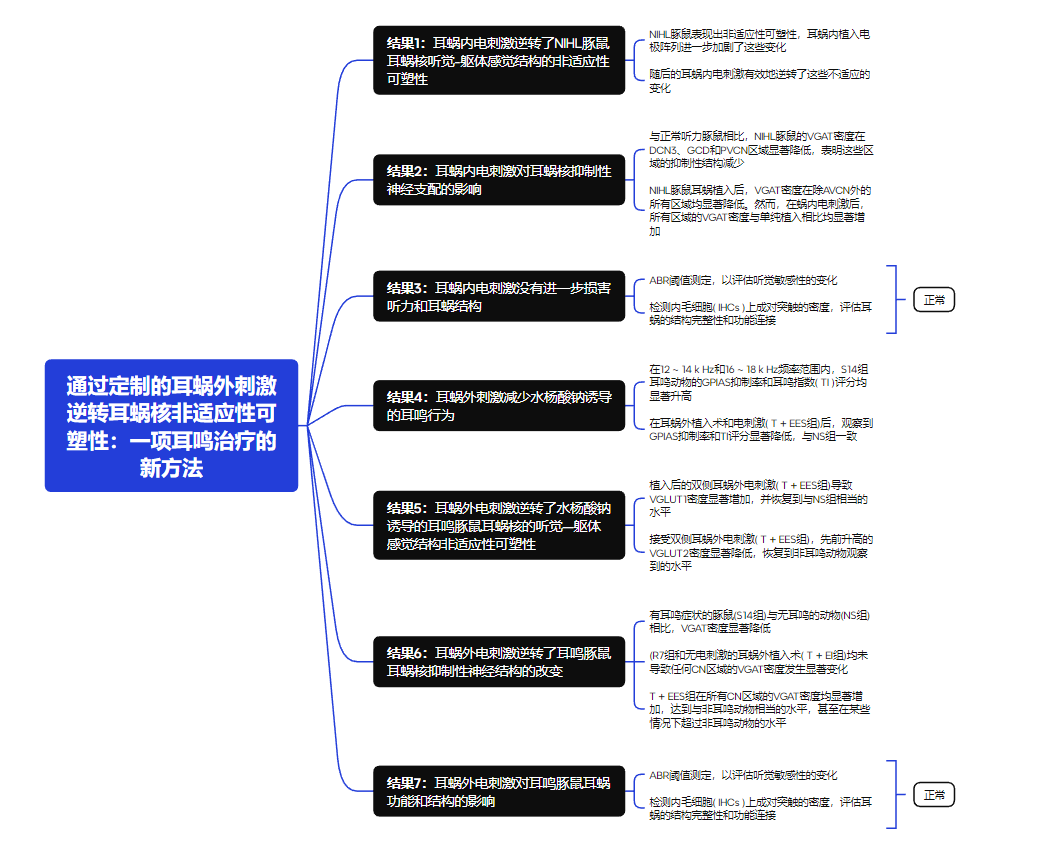
1.耳蜗内电刺激逆转了NIHL豚鼠耳蜗核听觉-躯体感觉结构的非适应性可塑性
NIHL豚鼠在8-32 kHz的ABR阈值下降45-60 dB,在2和4 kHz的ABR阈值接近正常(Figure 1A)。在耳蜗鼓阶植入电极阵列,以进行耳蜗内电刺激。电刺激采用CI接受者常用的电荷平衡双相脉冲,其强度等于频率为3kHz的电诱发复合动作电位( ECAP )阈值(Figure 1B)。将耳蜗核划分为5个不同的区域进行后续研究。这些区域包括DCN (命名为DCN1)的分子层,DCN (统称为DCN3)的深层结构,后部VCN ( PVCN ),前部VCN ( AVCN )和GCD(Figure 2A)。研究表明,CN内VGLUT1点的密度主要反映听觉神经纤维终末的密度,而VGLUT2点的密度对应躯体感觉神经纤维终末。
与正常听力对照组( N组)相比,NIHL豚鼠VGLUT1密度显著降低。在接受电极阵列耳蜗内植入但接受假电刺激的动物(NIHL + II组)中,这种减少进一步加剧。然而,在耳蜗内电刺激后,NIHL + IES组VGLUT1密度显著增加,在所有区域达到与DCN3相当或超过N组的水平(Figure 2C-G)。相反,与N组相比,VGLUT2的密度在NIHL组显著增加。重要的是,这种升高在NIHL + II组的所有区域都有所增强。然而,在耳蜗内电刺激后,NIHL + IES组的VGLUT2密度在所有区域都经历了下降,在大多数区域恢复到与N组相当的水平。除此之外,在DCN1区域,VGLUT2的密度仍然高于正常水平,这表明在该特定区域对电刺激的反应不同(Figure 2H-L)。
结果表明,NIHL豚鼠表现出非适应性可塑性,其特征是听觉传入的减少和投射到CN的躯体感觉传入的增加。耳蜗内植入电极阵列进一步加剧了这些变化。值得注意的是,随后的耳蜗内电刺激有效地逆转了非适应性可塑性,突出了其作为缓解NIHL有害影响的潜力。
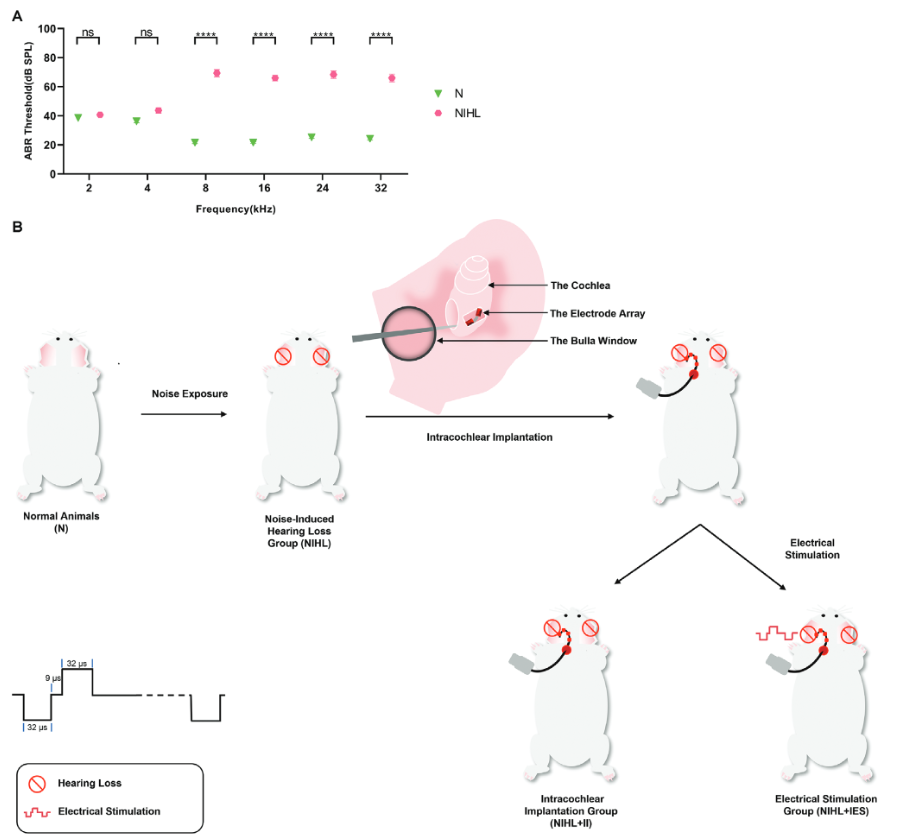
Figure 1. Modeling of noise-induced hearing loss (NIHL) and experimental design of intracochlear electrical stimulation.
Figure 2. Effects of intracochlear electrical stimulation on vesicular glutamate transporter 1 (VGLUT1) and VGLUT2 density in the cochlear nucleus (CN).
2.耳蜗内电刺激对耳蜗核抑制性神经支配的影响
研究人员进一步研究了耳蜗内电刺激诱导的耳蜗核( cochlear nucleus,CN )内抑制性神经结构的变化。与正常听力豚鼠相比,噪声性损伤(NIHL)豚鼠的VGAT密度在DCN3、GCD和PVCN区域显著降低,表明这些区域的抑制性结构减少。相比之下,DCN1和AVCN的VGAT密度基本保持不变。NIHL豚鼠耳蜗植入后,VGAT密度在除AVCN外的所有区域均显著降低。然而,在蜗内电刺激后,所有区域的VGAT密度与单纯植入相比均显著增加。值得注意的是,NIHL动物的DCN3和GCD中的VGAT密度恢复到与正常听力动物相似的水平。虽然PVCN中的VGAT水平有所改善,但仅恢复到植入前水平,与正常听力动物的VGAT水平不完全匹配(Figure 3)。
在正常听力豚鼠中,蜗内植入导致DCN3、GCD和PVCN内VGAT密度显著降低。植入后电刺激的应用有效地逆转了这一趋势,DCN3和PVCN的VGAT密度恢复到与未植入对照相似的水平。在GCD中,虽然VGAT密度较大地升高了,它们仍低于正常听力动物。耳蜗内植入并没有显著改变DCN1的VGAT密度,但电刺激引起了明显的增加,甚至超过了正常听力豚鼠的水平。
Figure 3. Effects of intracochlear electrical stimulation on vesicular GABA transporter (VGAT) density in the CN.
3.耳蜗内电刺激没有进一步损害听力和耳蜗结构
为了评估蜗内电刺激对NIHL豚鼠残余听力和耳蜗结构的影响,研究人员进行了ABR阈值测定,以评估听觉敏感性的变化。此外他们还检测了内毛细胞( IHCs )上成对突触的密度,评估耳蜗的结构完整性和功能连接。耳蜗植入后,NIHL豚鼠各频率ABR阈值均发生了约20dB的偏移,而听力正常动物的(8-32 kHz)偏移更明显(Figure 4)。尽管有这些变化,但在整个频谱范围内,两组植入后ABR阈值之间的差异没有统计学意义。此外,接受耳蜗内电刺激的动物与接受假手术的动物之间的ABR阈值没有显著差异,不论其听力状态(NIHL或听力正常)和所有测试频率。这些结果表明,虽然手术植入损害了听力,特别是在频率敏感性较高的正常听力豚鼠中,但耳蜗内电刺激并没有加剧这两组豚鼠的听力损失。
为了准确评估IHC突触数量,将基底膜分为三个部分——顶端、中部和底部,每个部分分别进行分析,以捕获跨频率表征的突触密度的潜在变化。在NIHL豚鼠中,与正常听力动物相比(Figure 4A-B),每个IHC中配对突触的数量在所有区域都显著减少。在NIHL、NIHL + II和NIHL + IES组,除了在中间区域,NIHL + IES组相比NIHL组有显著下降外,每个IHC配对的突触密度在不同区域之间没有显著差异。这些结果表明,无论是耳蜗内植入还是单独的电刺激都没有导致NIHL动物耳蜗任何区域的突触丢失。然而,它们的联合应用特异性地导致了中间区域IHC突触的丢失。
在正常听力动物中,耳蜗内植入导致耳蜗所有区域配IHC突触的显著丢失。然而,在电刺激组中,与仅植入相比,没有观察到进一步的突触丢失(Figure 4C-E)。在耳蜗顶端,电刺激组与单纯植入组相比,突触密度显著增加。这些发现表明,虽然耳蜗植入降低了所有区域的配对IHC突触密度,但电刺激并没有加剧这种降低,在某些区域(如顶点),它甚至可以促进突触恢复。
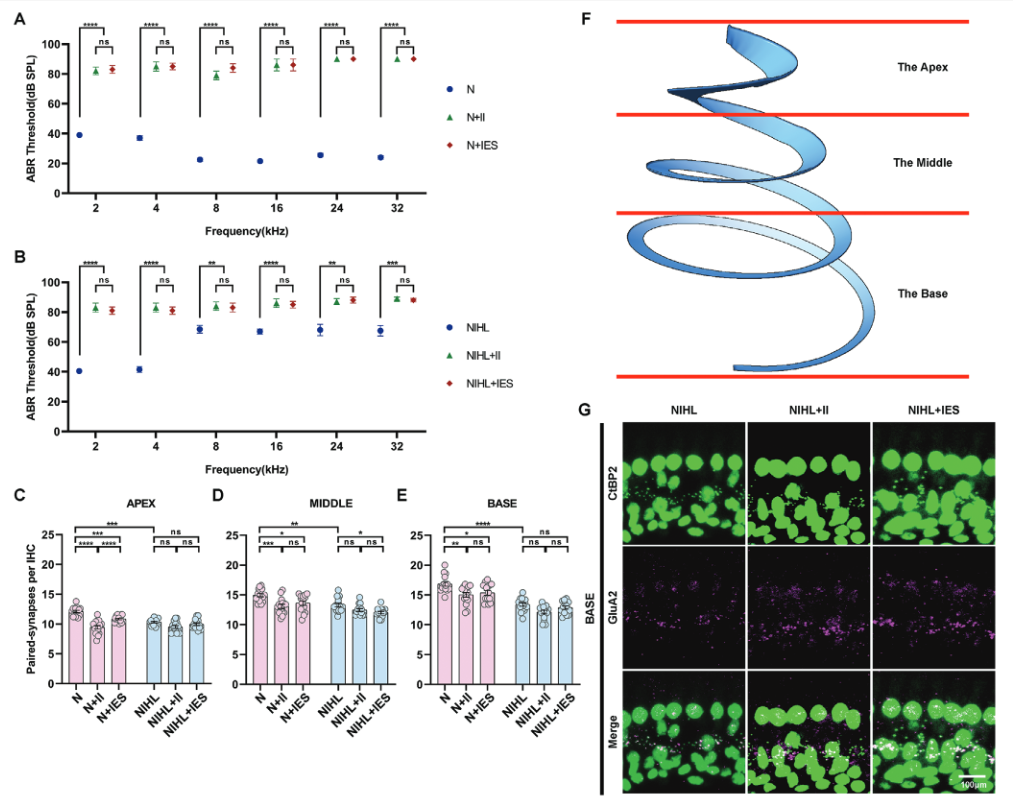
Figure 4. Effects of intracochlear electrical stimulation on hearing and paired synapse density in inner hair cells (IHCs) of normal and NIHL guinea pigs.
4.耳蜗外电刺激减弱水杨酸钠诱导的耳鸣行为
将20只耳鸣豚鼠随机分为4组:S14组(给予水杨酸盐后立即实施安乐死,并进行耳鸣评估),R7组(监测7天,不干预),T + EI组(双侧耳蜗外植入术不予电刺激),T + EES组(电刺激双侧耳蜗外植入术)。此外,5只对照组动物接受14天的腹腔注射生理盐水(NS组)。在12-14 kHz和16-18 kHz频率范围内,S14组耳鸣动物的GPIAS抑制率和耳鸣指数(TI)评分均显著升高。然而,与NS组相比,在8-10 kHz以及对宽带噪声的反应中没有观察到显著的差异。R7组在停止水杨酸钠治疗后观察7天,显示出与S14组相似的GPIAS抑制率和TI评分,表明持续的耳鸣行为(Figure 5B-C)。
在耳蜗外植入术和电刺激(T + EES组)后,观察到GPIAS抑制率和TI评分显著降低,与NS组一致。相反,在没有电刺激的情况下进行植入的T + EI组,与耳鸣诱导的S14组相比,GPIAS抑制或TI评分没有显著变化。以上结果表明,耳蜗外电刺激可明显减弱水杨酸盐诱导的豚鼠耳鸣行为。
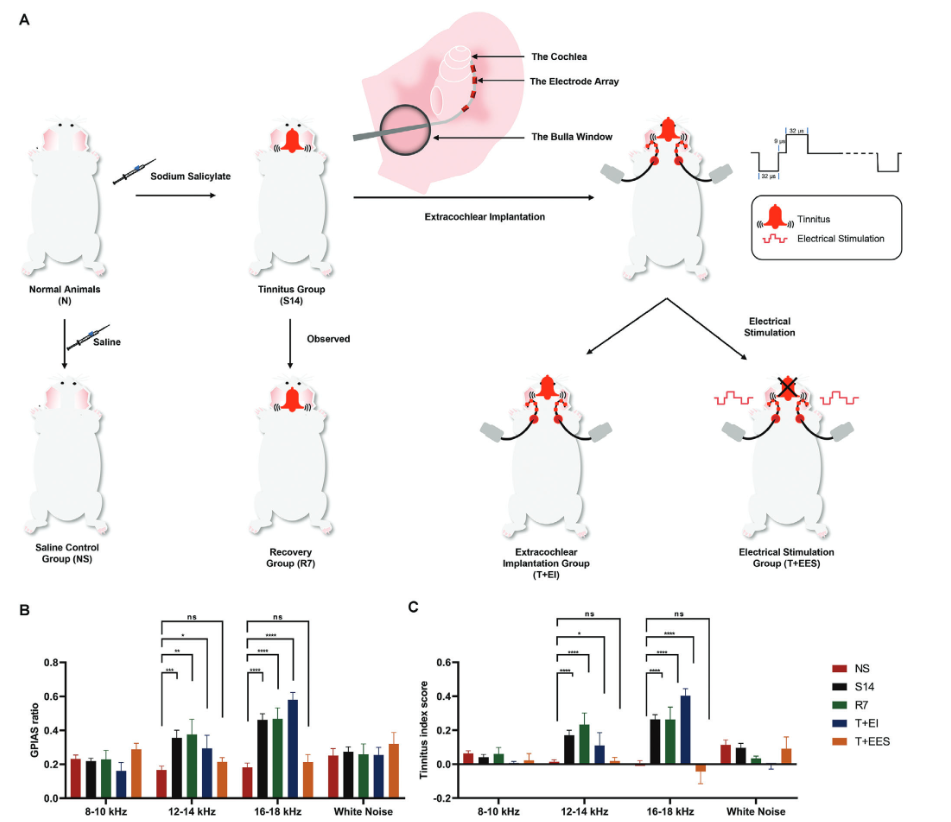
Figure 5. Effects of extracochlear electrical stimulation on tinnitus behaviors.
5.耳蜗外电刺激逆转了水杨酸钠诱导的耳鸣豚鼠耳蜗核听觉-躯体感觉结构非适应性可塑性
与无耳鸣对照组(NS组)相比,有耳鸣症状的豚鼠(S14组)耳蜗核(CN)中除DCN1外的所有区域的VGLUT1密度均显著降低。在R7组中,这些密度降低在7天内保持稳定。同样,双侧耳蜗外植入术单独处理(T + EI组)对VGLUT1密度无显著影响。然而,植入后的双侧耳蜗外电刺激(T + EES组)导致VGLUT1密度显著增加,并恢复到与NS组相当的水平(Figure 6A-F)。相反,与NS组相比,耳鸣豚鼠(S14组) CN区域的VGLUT2密度显著升高。这种升高在R7组以及T + EI组中持续存在,表明这些升高水平的稳定性。然而接受双侧耳蜗外电刺激( T + EES组),先前升高的VGLUT2密度显著降低,恢复到非耳鸣动物(Figure 6G - L)观察到的水平。
这些发现表明,水杨酸钠诱导的耳鸣逆转了耳蜗核内的非适应性可塑性,表现为听觉神经支配减少( VGLUT1 )和体感神经支配增加( VGLUT2 )。值得注意的是,耳蜗外电刺激有效地逆转了非适应性可塑性,这与耳鸣相关行为的显著减少有关。
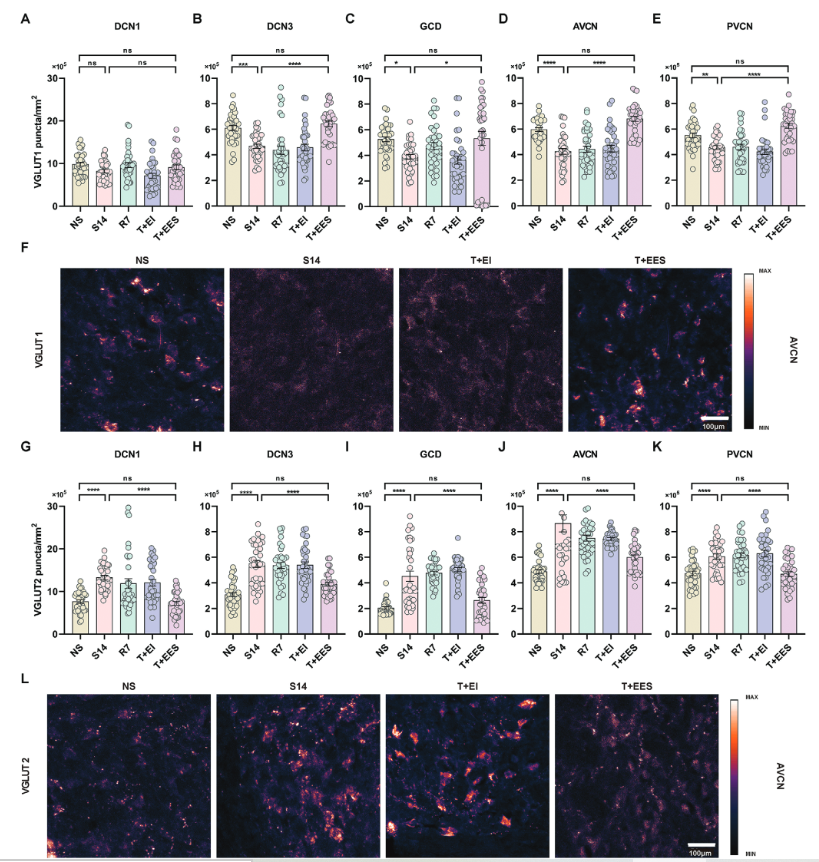
Figure 6. Effects of extracochlear electrical stimulation on VGLUT1/2 density in the CN.
6.耳蜗外电刺激逆转了耳鸣豚鼠耳蜗核抑制性神经结构的改变
在耳蜗核的所有区域,有耳鸣症状的豚鼠(S14组)与无耳鸣的动物(NS组)相比,VGAT密度显著降低。值得注意的是,无干预的7天观察期(R7组)和无电刺激的耳蜗外植入术(T + EI组)均未导致任何CN区域的VGAT密度发生显著变化。值得注意的是,接受耳蜗外电刺激的耳鸣动物(T + EES组)在所有CN区域的VGAT密度均显著增加,达到与非耳鸣动物相当的水平,甚至在某些情况下超过非耳鸣动物的水平,特别是在DCN1区域 (Figure 7)。
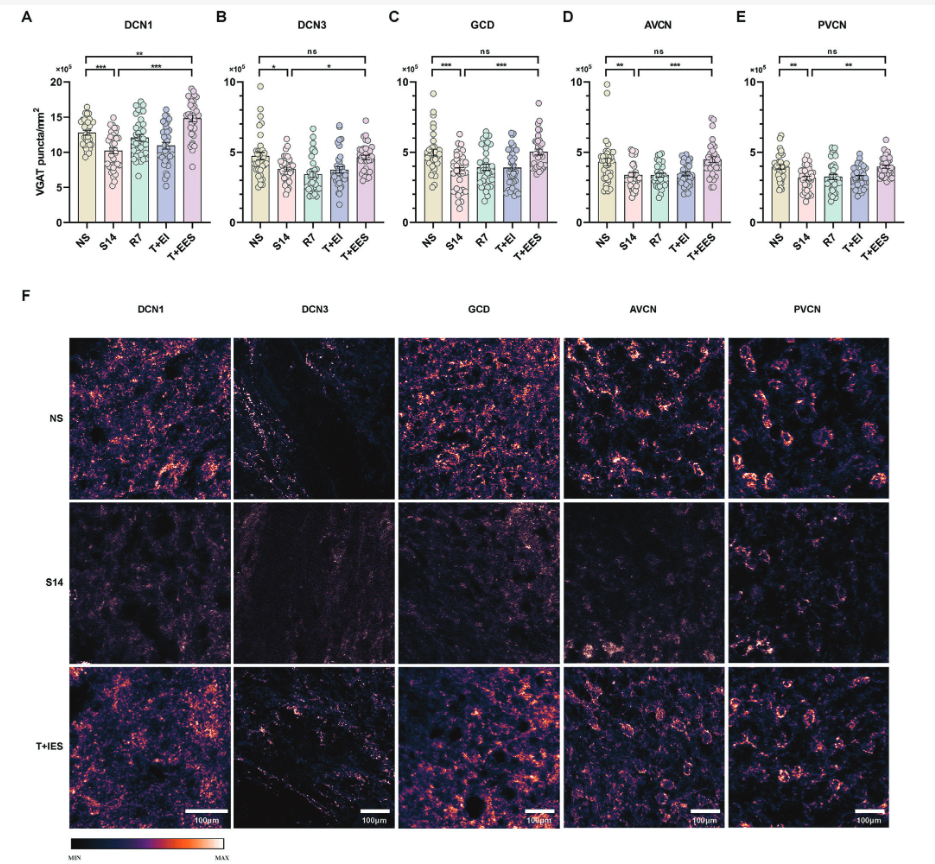
Figure 7. Effects of extracochlear electrical stimulation on VGAT density in the CN.
7.耳蜗外电刺激对耳鸣豚鼠耳蜗功能和结构的影响
测量ABR阈值和配对IHC突触的密度,以评估耳鸣诱导、耳蜗外植入术和电刺激后听觉功能和耳蜗微结构的变化。水杨酸钠给药14天后,除16 kHz外,其余各频率的ABR阈值均有不同程度的升高,但差异均有统计学意义。耳蜗外植入术后,比较植入前后ABR阈值发现,2和4 k Hz时无明显变化,8和16 k Hz时略有升高,24和32 k Hz时升高更明显。值得注意的是,T+EI组和T+EES组的ABR阈值在所有频率上的差异均无统计学意义,表明电刺激并没有加剧听力损失(Figure 8A-B)。在S14组中,与NS组相比,耳蜗基底部区域的配对IHC突触显著减少,而在耳蜗顶部和中部区域没有观察到显著变化。 在T+EI和T+EES组,顶区、中区和基底区的配对IHC突触数量与S14组相比均无显著性差异。这些发现表明,耳蜗外植入术和电刺激都没有对IHC突触造成额外的损伤。
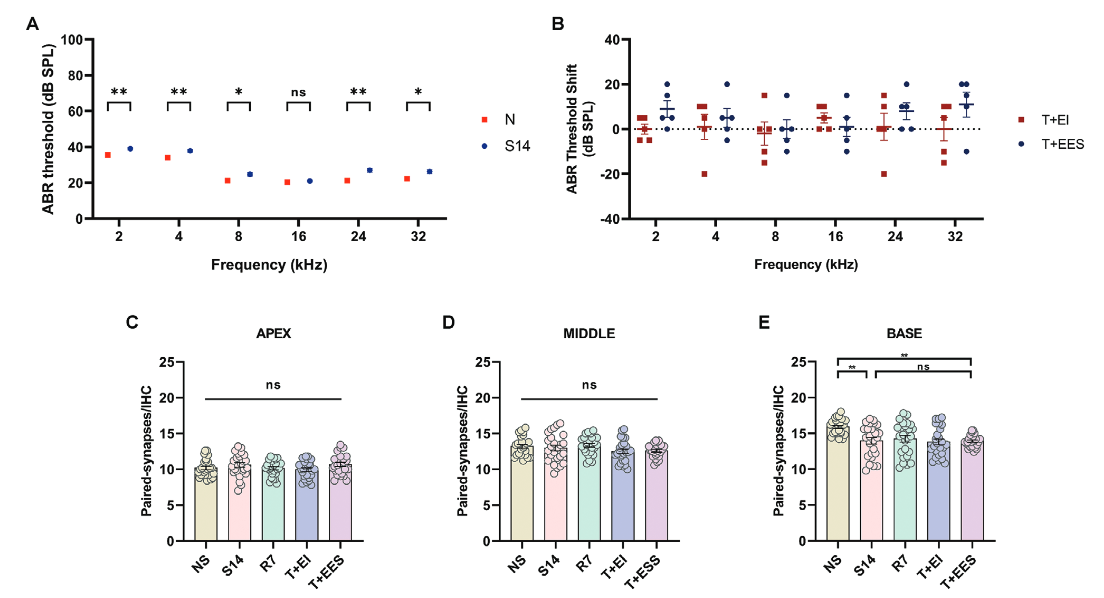
Figure 8. Effects of extracochlear electrical stimulation on hearing and the number of paired synapses per IHCs.

汇报人:李婧媛
导师:郑芸
审核:张子妍、夏晓旭、任建君



