原创 饶预芳 华西医院耳鼻喉科
华西耳鼻喉学术前沿速递——文献精读(第70期)
精读分享│【Cell】:联合阻断LAG-3和PD-1在CD8+ T细胞中诱导细胞毒性与耗竭基因模块共表达,增强抗肿瘤免疫
英文题目:Blockade of LAG-3 and PD-1 leads to co-expression of cytotoxic and exhaustion gene modules in CD8+ T cells to promote antitumor immunity
中文题目:联合阻断LAG-3和PD-1在CD8+ T细胞中诱导细胞毒性与耗竭基因模块共表达,增强抗肿瘤免疫
期刊:Cell(IF=45.6)
单位:美国宾夕法尼亚州匹兹堡大学医学院免疫学系
发表时间:2024年8月


摘要
Relatlimab(rela;抗 LAG-3)联合纳武利尤单抗(nivo;抗 PD-1)在晚期黑色素瘤的治疗中显示出一定的安全性和有效性。本研究开展了一项临床试验(NCT03743766),在该试验中,晚期黑色素瘤患者分别接受 rela、nivo 或 rela+nivo 治疗,以探究 rela+nivo 联合治疗的免疫学机制。对这项临床试验的生物样本分析表明,rela+nivo联合治疗增强了CD8+ T细胞受体信号传导能力,并改变了 CD8+ T 细胞的分化状态,尽管接受治疗的CD8+T细胞保留了其耗竭特征,但其细胞毒性显著增强。这种细胞毒性和耗竭特征的共表达由 PRDM1、BATF、ETV7 和 TOX 驱动。此外,rela+nivo治疗促进了克隆扩增的 CD8+ T 细胞产生,其效应功能显著上调。并且,rela+nivo 治疗后的肿瘤内 CD8+ T 细胞特征与良好的预后相关。这一肿瘤内 rela+nivo 特征在外周血中也得到了验证,表现为 CD38+TIM3+CD8+ T 细胞频率的升高。总体而言,本研究发现了CD8+T细胞在保留耗竭特征的同时仍可增强细胞毒性的现象,这一发现将为未来的治疗策略提供重要参考。
引言
对癌症和慢性病毒感染的免疫反应受到 CD8+ T 细胞耗竭的限制。耗竭的 CD8+ T 细胞表面表达的抑制性受体(IRs)会激活下游分子通路,导致细胞增殖减少、代谢功能障碍、细胞因子产生减少以及细胞毒性效应活性降低。针对抑制性受体细胞毒性 T 淋巴细胞相关蛋白 4(CTLA4)或程序性细胞死亡蛋白 1(PD-1)通路的阻断在癌症治疗中取得了显著成效,但并非所有患者都能从中获益。基于不同抑制性受体通过非冗余机制导致 CD8+ T 细胞耗竭的前提,针对多个抑制性受体的联合治疗可能会改善 CD8+ T 细胞功能。事实上,CTLA4 和 PD-1 的双重阻断在超过 50% 的黑色素瘤患者中带来了长期生存获益,但也导致了更高频率的严重免疫相关不良事件。为了克服 CD8+ T 细胞耗竭并改善临床结果,无论是在黑色素瘤还是其他实体瘤中,都需要更有效且更安全的免疫治疗组合。许多针对抑制性受体的治疗组合已被提出,以恢复对癌症和慢性病毒感染的细胞免疫。针对 CTLA4 和 PD-1 或其配体 PD-L1 的抗体是最早进入临床并最早被用于联合治疗的药物。LAG-3 是另一种在慢性抗原刺激环境下表达于 CD8+ T 细胞上的抑制性受体。从功能上看,LAG-3 抑制 T 细胞的扩增以及进入记忆 T 细胞亚群的细胞数量。在慢性病毒感染和癌症的小鼠模型中的临床前数据显示,同时阻断抑制性受体 LAG-3 和 PD-1 能够协同重振 CD8+ T 细胞介导的免疫反应,表明这些抑制性受体通过不同的通路发挥作用。
最近,这一假设已在临床试验中得到验证。在晚期黑色素瘤患者中,固定剂量的抗 LAG-3(relatlimab [rela])联合抗 PD-1(纳武利尤单抗 [nivo])治疗方案相较于单独使用 nivo 显著改善了无进展生存期。这些结果促使 FDA 于 2022 年初批准了该联合疗法。类似的临床疗效也在既往接受过 PD-(L)1 治疗后病情进展的晚期黑色素瘤患者中观察到。进一步的证据来自可切除 III 期黑色素瘤的新辅助治疗研究,其中 70% 的患者达到了病理学缓解,且在达到病理学缓解的患者中,92% 的患者在 2 年内无复发生存。总体而言,临床证据表明,rela+nivo 联合治疗在不同疾病状态和分期的黑色素瘤患者中均能改善治疗效果。
尽管在临床上有效,rela+nivo 联合治疗后观察到的增强抗肿瘤免疫的机制尚不明确。理解联合治疗的分子效应以及这些效应是否与单一治疗有所不同,对未来组合免疫疗法的开发具有重要意义。在阻断PD-1或PD-L1后,表达CXCR5的一部分CD8+ T细胞会经历爆发增殖。与此一致的是,在黑色素瘤患者中,阻断PD-1通路后观察到循环CD8+ T细胞的频率增加,且CD8+ T细胞的重振与肿瘤负荷的比例与预后相关。尽管对阻断PD-1通路后细胞抗肿瘤免疫重振的分子机制已有部分理解,但仍需深入了解联合治疗后增强抗肿瘤免疫或产生耐药性的机制,以指导未来的免疫治疗策略和组合方案。
为了解决这一问题,研究团队设计了一项随机、开放标签的2期研究(NCT03743766),在该研究中,患者被随机分配接受为期4周的rela单药治疗、nivo单药治疗或rela+nivo联合治疗的导入阶段。该试验有两个主要目标:(1)从机制上解析PD-1和LAG-3双重阻断后免疫细胞群的转录变化;(2)确定在晚期黑色素瘤中增强LAG-3和PD-1阻断抗肿瘤疗效的机制。rela+nivo联合阻断的临床疗效已在3期试验和新辅助治疗中报道,但其在患者细胞和分子水平上调控疗效的机制尚不清楚。作为本研究的一部分,在基线和治疗4周后采集了血液和肿瘤活检样本(包括在16周时进行后续血液采集和自愿的肿瘤活检)。在4周的导入阶段后,所有患者开始接受rela+nivo联合治疗。尽管这种试验设计使我们无法评估临床疗效(因为所有患者在治疗早期均接受了rela+nivo联合治疗),但它使我们能够获得关于单药和联合治疗机制的独特见解,尤其是包括rela单药治疗在内的机制信息。这种独特的试验设计使得研究团队能够获取生物样本,用于从机制上解析LAG-3和PD-1单独阻断及联合阻断对免疫细胞群的影响。理解联合免疫治疗后免疫细胞群的变化仍然是一个重要课题,这将为临床前和临床组合免疫治疗策略提供重要信息。评估抗肿瘤活性仍然是这项正在进行中的试验的一个独立目标。
本文中,研究人员对来自血液和肿瘤免疫细胞的单细胞RNA测序(scRNA-seq)数据分析显示,尽管肿瘤浸润性CD8+ T细胞中仍存在终末耗竭特征,rela+nivo治疗促进了T细胞的活化。分析还表明,rela+nivo治疗后,CD8+ T细胞对T细胞受体(TCR)信号的反应增强。联合治疗的一个独特之处在于,观察到CD8+ T细胞分化的调控导致细胞毒性和耗竭模块的共表达。结果还发现,治疗前无法检测到但在治疗后新“出现”的CD8+ TCR克隆富集了这些功能特征,包括干扰素γ(IFN-γ)反应和T细胞活化,尽管这些细胞仍保留了耗竭的转录特征。基因调控网络推断显示,转录因子(TFs)PRDM1、BATF、ETV7和TOX共同调控了同一细胞内与细胞毒性和耗竭相关的基因模块。研究鉴定出了rela+nivo治疗的瘤内转录特征,该特征在多个外部队列中被证实与良好的预后相关。CD38和HAVCR2(TIM3的编码基因)被确定为这一rela+nivo特征的关键组成部分,并且在rela+nivo治疗后,血液中CD38+TIM3+CD8+ T细胞的频率升高,这为前述的转录特征提供了蛋白质水平的验证。
总体而言,研究揭示了LAG-3和PD-1联合阻断的复杂分子机制,这一机制与单独使用任一单药治疗的预期效果不同。该机制依赖于对TCR信号反应的增强、CD8+ T细胞分化的调控以及细胞毒性和耗竭基因模块的共表达。这些发现对理解联合免疫治疗以及设计比现有疗法更安全、更有效的未来免疫治疗策略具有重要意义。
研究总体思维导图
关键结果
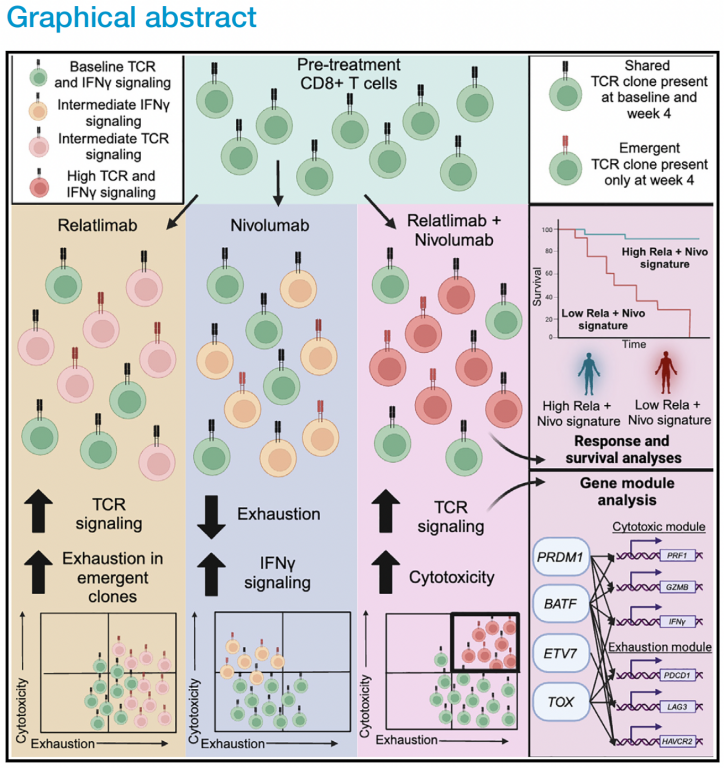
Rela-Nivo增强CD8+ T细胞的TCR和IFN-γ信号响应
联合治疗后,细胞毒性与耗竭基因模块共表达
PROM1、BATF、ETV7和TOX驱动Rela-Nivo的细胞毒性与耗竭特征
细胞毒性和耗竭情况与临床获益有关
结果1:Nivo、Rela及联合治疗对转移性黑色素瘤患者CD8+ T细胞的内在影响
通过对纳入样本的单细胞测序数据进行分析,确认了CD8+ T细胞是LAG-3和PD-1阻断的主要靶细胞,为后续机制解析奠定了基础。
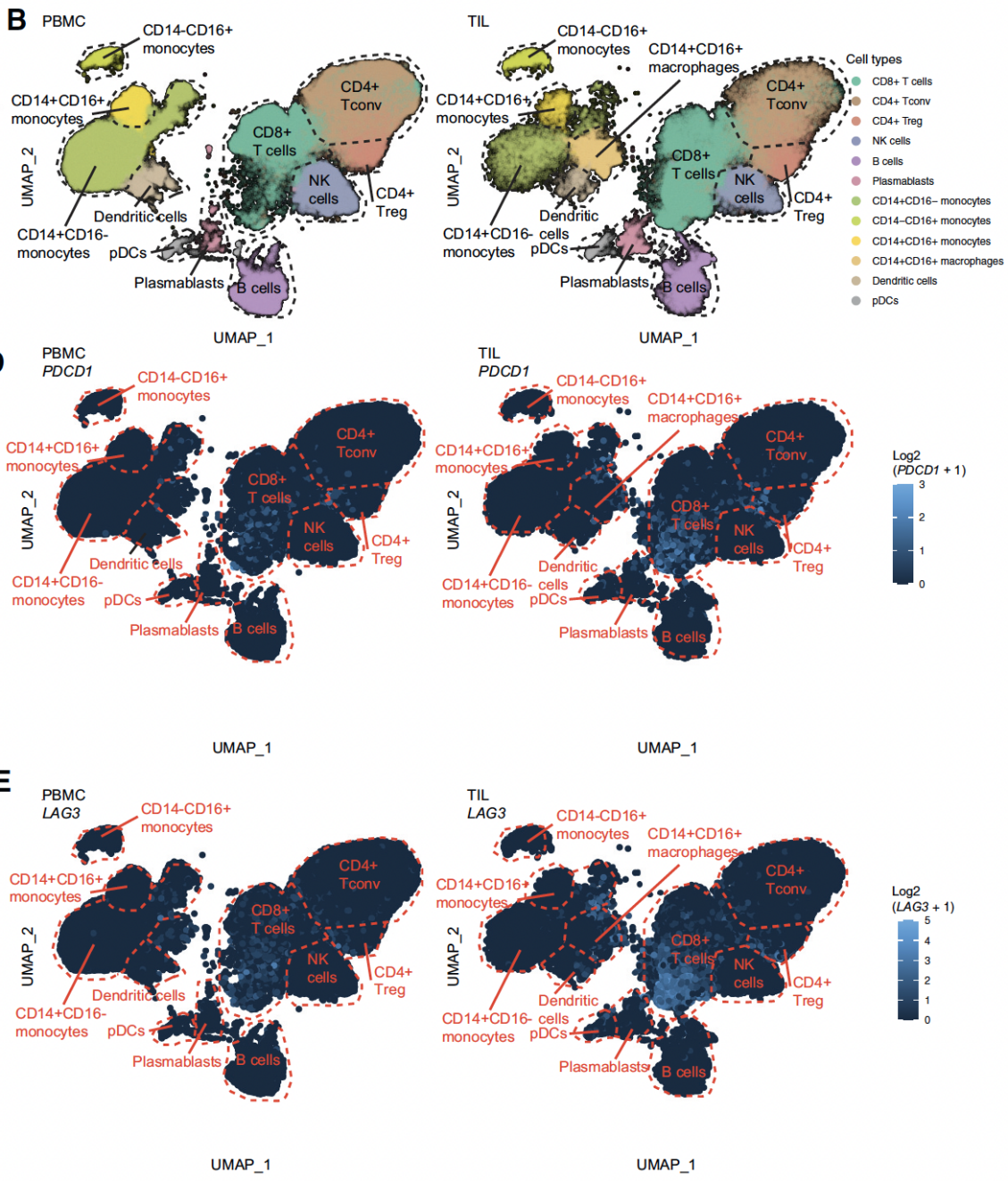
图1: Nivo、Rela及联合治疗对转移性黑色素瘤患者CD8+ T细胞的内在影响:免疫细胞类型鉴定(B)、PBMC及TIL中LAG3和PDCD1的表达情况(C-E)。
结果2:Rela、Nivo及联合治疗对CD8+ T细胞状态的影响
通过对CD8+T细胞进行单独聚类分群注释分析,得到9个细胞亚群,在PBMC中以簇1、3、4富集,在TIL中以簇6、7、8、9富集明显;其中,簇3和5在PBMC和TIL共有。使用已知CD8+ T细胞状态和生物学过程的基因集对簇进行分类。簇1--初始/记忆状态;簇3、4 -- 效应状态;簇7、8 -- 终末衰竭状态;簇9 -- 细胞周期相关(图2 A-B)。
对比不同治疗对CD8+T细胞状态的影响,结果显示,PBMC中,T细胞激活和IFN-γ响应以及TCR信号传导在联合治疗后都显著增强。在TIL中,终末耗竭在Nivo单药治疗后减少,而Rela单药和联合治疗无显著影响;TCR信号传导在Rela单药和联合治疗后显著增强(图2 C-D)。
通过使用抗CD3和抗CD28抗体刺激T细胞,评估磷酸化SLP76(pSLP76)水平,以验证TCR信号传导。结果显示,联合治疗组中,pSLP76水平显著升高(p=0.019),表明TCR信号传导增强;然而,在单药治疗组中无显著变化(图2 E-F)。
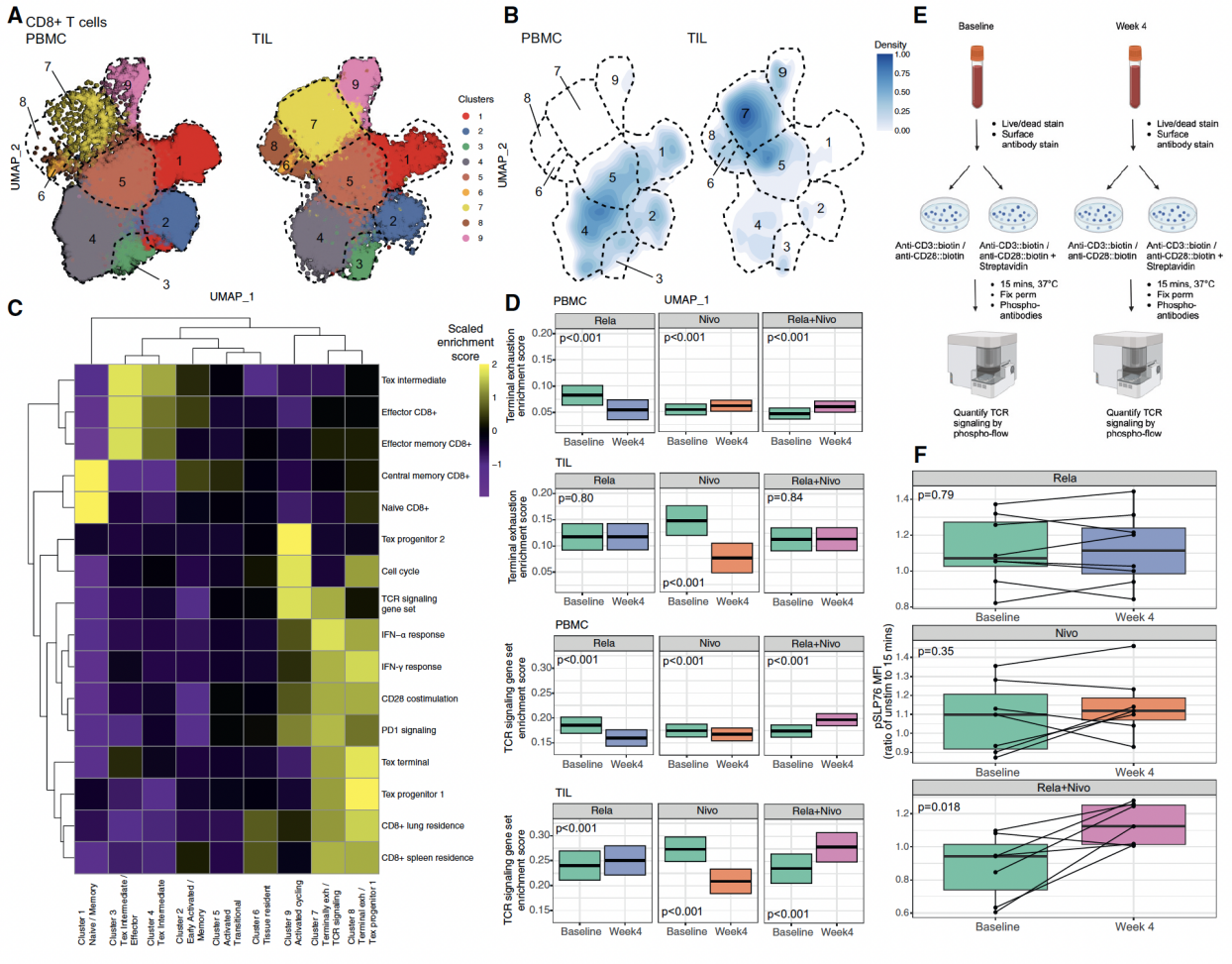
图2 Rela、Nivo及联合治疗对CD8+ T细胞状态的影响
结果3: Rela+Nivo调控CD8+T细胞分化,促进细胞毒性和耗竭功能状态
基于未剪接/剪接转录本比例推断CD8+ T细胞分化方向。构建了细胞分化轨迹,识别从初始/记忆状态向终末分化状态的转变。结果显示,终末衰竭模块在Rela和联合治疗后显著升高。细胞毒性模块在联合治疗后显著升高,尤其在分化后期。联合治疗组中,38%的CD8+ T细胞同时高表达细胞毒性和耗竭模块,显著高于其他组。
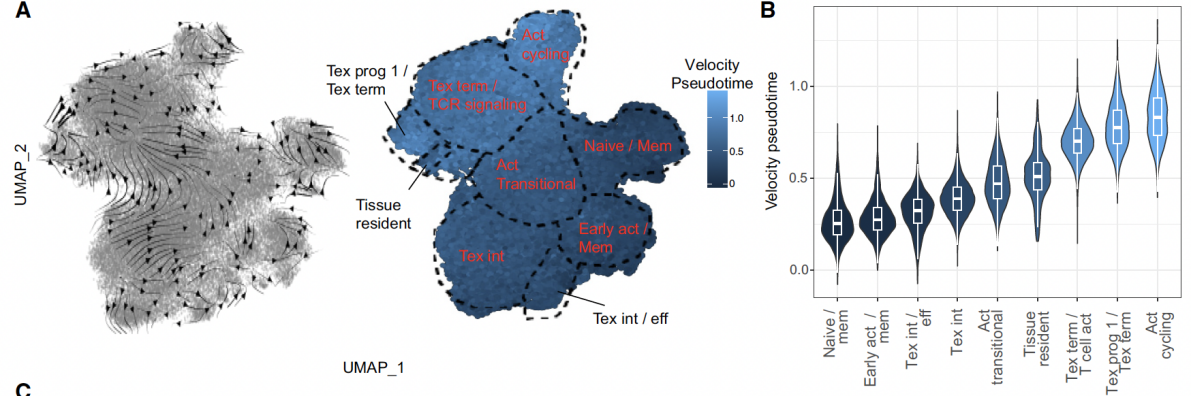
图3 不同治疗对于CD8+T细胞分化状态的影响
此外,联合治疗推动CD8+ T细胞分化为“细胞毒性-衰竭共表达”状态,新发克隆富集功能基因(IFN-γ响应)但保留耗竭标志(PD-1、LAG-3)。
结果4:免疫治疗后,CD8+ T细胞的新发克隆具有丰富的功能特征
接下来,研究人员评估了PBMCs和TILs中克隆扩增的CD8+ T细胞的转录特征。基于TCRβ CDR3序列计数≥3的克隆视为扩增克隆,将克隆按扩增程度分为四个四分位数。在PBMC中,扩增克隆主要分布在中间耗竭、激活过渡和终末耗竭簇。在TIL中,扩增克隆分布因治疗状态而异,联合治疗后显著富集于终末耗竭和激活簇。新发克隆在PBMC中主要分布在早期激活和激活过渡簇;在TIL中,Rela和Nivo单药治疗的新发克隆分布较分散。联合治疗中显著富集于终末耗竭和激活簇。此外,通过对新发克隆的功能特征进行解析,发现新发克隆在联合治疗组中显著富集干扰素反应和T细胞激活基因(如IFNG、GZMB)。综上,通过TCR克隆追踪和功能基因分析,揭示了Rela + Nivo联合治疗后新发CD8+ T细胞克隆的功能优势及其在免疫微环境中的广泛调控作用,为理解联合治疗的免疫机制提供了重要线索(图4)。
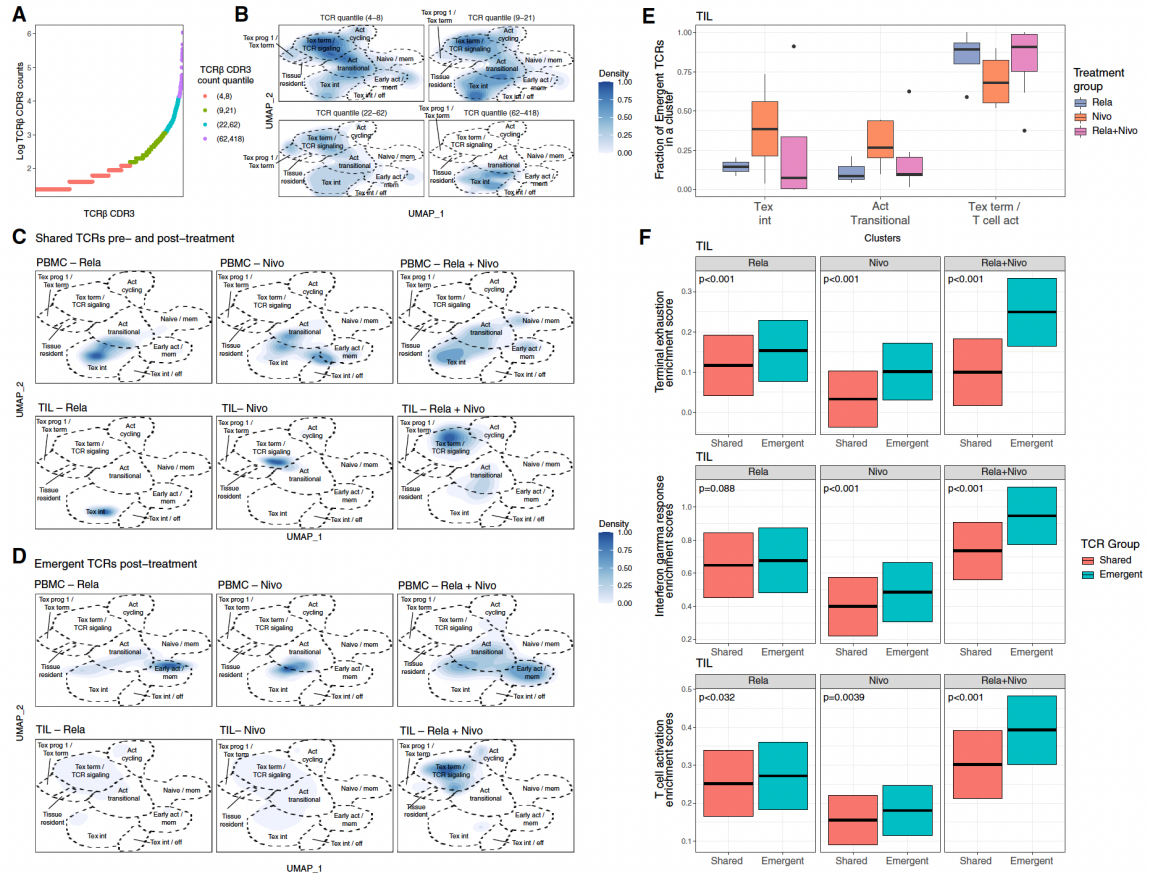
图4 新发克隆在CD8+ T细胞免疫治疗后的功能特征
结果5:PRDM1、BATF、ETV7和TOX等转录因子驱动瘤内CD8+ T细胞的细胞毒性与耗竭共表达
接下来,研究人员试图评估不同的转录因子(TF)是否对每次治疗后观察到的基因表达谱产生影响。使用SCENIC以及miloR分析CD8+ T细胞的转录因子调控网络。基于基因表达谱构建图网络,识别与治疗组相关的细胞邻域。共识别出8个细胞邻域,分别与Rela单药(邻域6显著富集)、Nivo单药(邻域5和8显著富集)和联合治疗组相关(邻域5、7和8显著富集)(图5 A)。同时,差异基因表达分析显示,联合治疗组的独特基因表达表现为效应分子:GZMB、IFNG显著上调。trafficking分子:CXCR6显著上调。抑制性受体:PDCD1、LAG3、TIGIT、CTLA4显著上调。干扰素反应:IFNG、ISG15、IFI27显著上调。联合治疗组与单药治疗组的差异基因重叠较少,表明联合治疗具有独特的转录特征(图5 B)。此外,转录因子驱动的基因模块结果显示,联合治疗组中PRDM1:驱动IFNG、HAVCR2等基因表达。BATF:调控GZMB、IFNG和LAG3表达。ETV7:调控干扰素反应基因。TOX:支持终末分化但维持细胞存活(图5 C)。通过构建转录因子调控网络,发现联合治疗组表现为:PRDM1模块:驱动IFNG、PPFIA1、HAVCR2等基因。BATF模块:驱动GZMB、IFNG、LAG3等基因。ZBED2模块:驱动IFNG、HAVCR2等基因。ID2模块:驱动GZMB、IFNG等基因,但不涉及抑制性受体(图5 D)。
总体而言,通过转录因子调控网络分析,揭示了Rela + Nivo联合治疗后CD8+ T细胞中细胞毒性与衰竭模块共表达的分子机制,明确了PRDM1、BATF、ETV7和TOX等关键转录因子的协同作用,为理解联合治疗的免疫机制提供了重要线索。
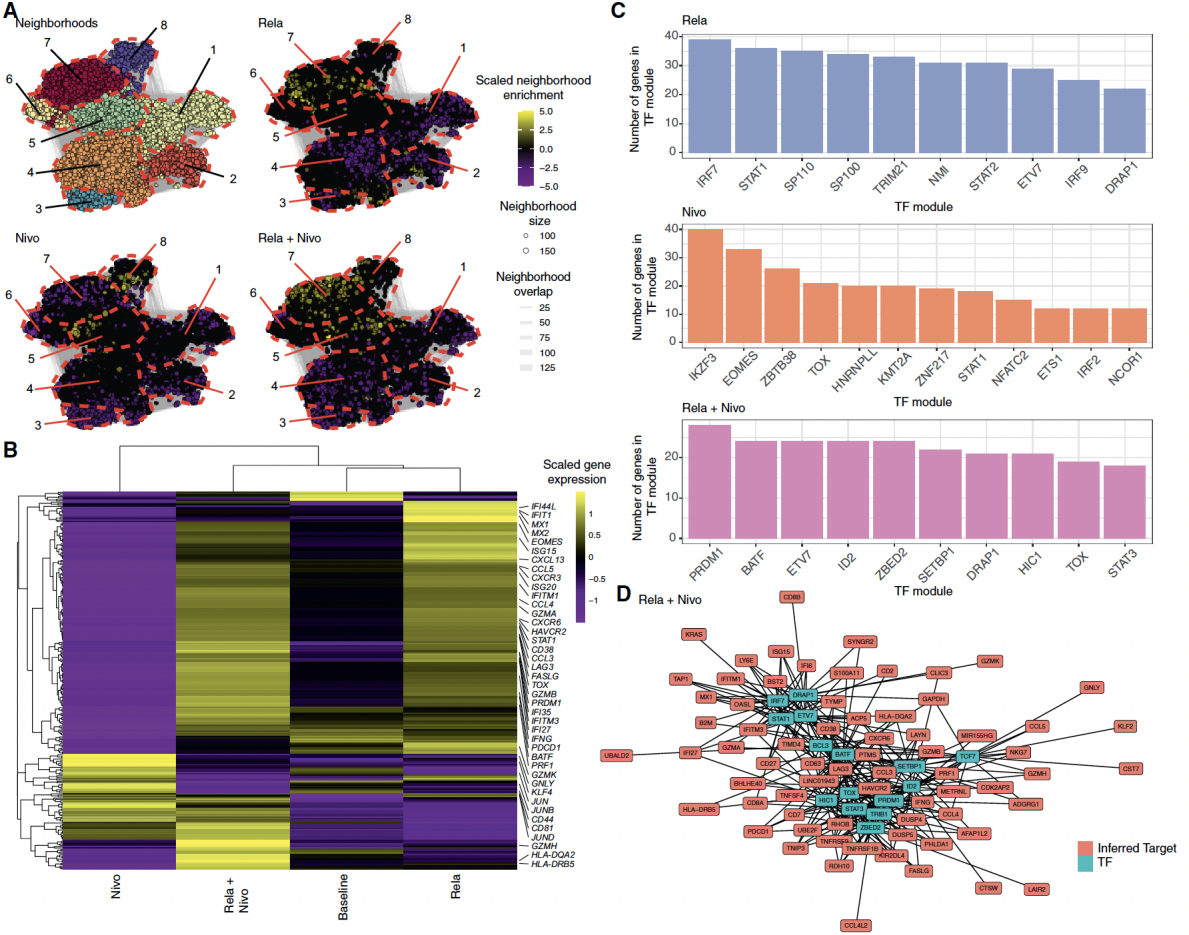
图5 转录因子驱动瘤内CD8+ T细胞的细胞毒性与耗竭模块共表达
结果6:Rela+Nivo治疗相关基因特征与良好预后相关
为进一步探究联合治疗相关的基因特征,研究人员使用公开的scRNA-seq数据(Huuhtanen et al.)和TCGA中的黑色素瘤数据集。基于瘤内Rela+Nivo治疗相关基因特征(前100个差异表达基因),计算基因集富集分数。结果显示,scRNA-seq队列中,临床获益患者CD8+ T细胞中Rela+Nivo特征显著升高(p<0.001)。TCGA队列:生存分析:Rela+Nivo特征与更好的总生存期显著相关(HR=0.69,p=0.035)。免疫浸润:高免疫浸润与良好预后相关。接着,又通过使用4个免疫治疗队列(Hugo et al., Riaz et al., Gide et al., Liu et al.),计算Rela、Nivo和Rela+Nivo特征的基因集富集分数。进行Cox回归分析,评估基因特征与总生存期的关系。结果表明Rela+Nivo特征:与更好的总生存期显著相关(HR=0.35,p<0.0001)。Rela特征:与更好的总生存期显著相关(HR=0.42,p=0.00017)。Nivo特征:与更好的总生存期显著相关(HR=0.45,p=0.00024)。为进一步探究是否存在联合治疗相关的基因能够与预后进行关联,研究人员使用弹性网络回归(10折交叉验证)筛选关键基因,结果发现Rela+Nivo特征中筛选出CD38和HAVCR2(编码TIM3)作为关键基因,基于CD38和HAVCR2的简化模型能够准确预测基因集富集分数。同时,使用流式细胞术检测基线及第4周外周血中CD38+TIM3+ CD8+ T细胞的频率,来验证联合治疗后,外周血CD38+TIM3+ CD8+ T细胞频率显著升高,可作为治疗响应的早期指标。
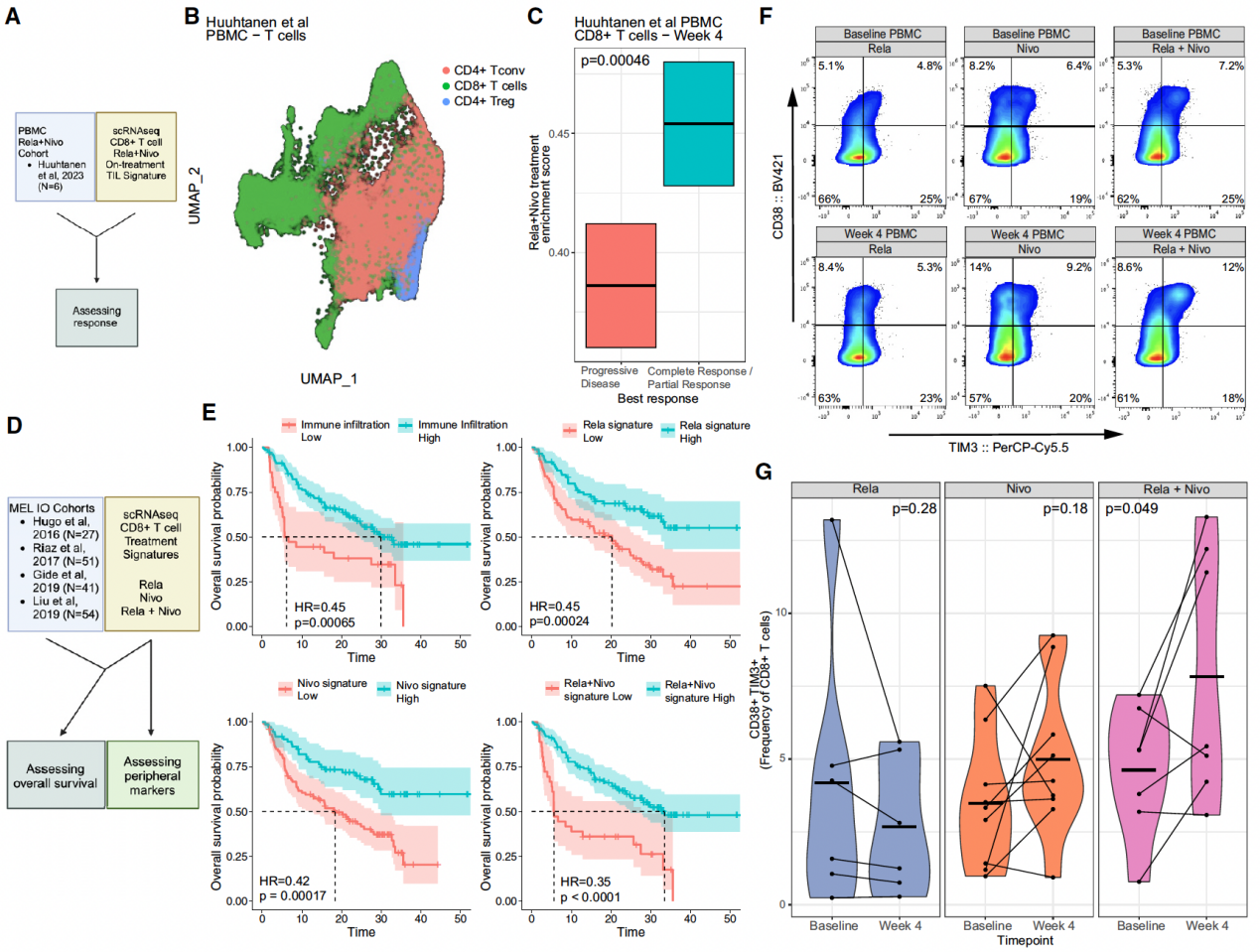
图6 Rela+Nivo治疗相关基因特征与良好预后相关,并在外周血中表现为CD38+TIM3+ CD8+ T细胞频率升高
讨论
Rela+Nivo联合治疗增强了CD8+ T细胞对TCR信号的响应
联合治疗调节了CD8+ T细胞的分化,导致细胞毒性和耗竭基因模块的共表达。尽管CD8+ T细胞保留了耗竭的转录特征,但其细胞毒性功能得到了增强。
Rela+Nivo治疗导致CD8+ T细胞向一种独特的分化状态转变,这种状态同时表达细胞毒性和耗竭相关基因
PRDM1、BATF、ETV7、ID2和ZBED2等转录因子在联合治疗后调控了细胞毒性和耗竭相关基因的表达。这些转录因子共同作用,促进了CD8+ T细胞的效应功能和耗竭状态。
Rela+Nivo治疗后的CD8+ T细胞转录特征与良好的临床预后相关。特别是在外周血中,CD38+TIM3+CD8+ T细胞的频率显著增加,这可能是rela+nivo治疗的早期生物标志物。
该研究为理解组合免疫治疗的机制提供了新的见解,并为未来设计更有效的免疫治疗策略奠定了基础。
局限性:
样本量小:由于患者队列较小,统计效力有限。
交叉设计:所有患者在早期都接受了联合治疗,因此无法完全评估单一治疗的长期效果。
时间点限制:最大免疫反应可能不在治疗后的第4周,因此可能需要更早或更晚的时间点来评估治疗效果。

汇报人:饶郁芳
导师:李为民、赵宇
审核:夏晓旭、任建君



