原创 周菁 华西医院耳鼻喉科
华西耳鼻喉学术前沿速递——文献精读(第61期)
精读分享│【JOURNAL OF CLINICAL INVESTIGATION】:
特定皮肤上皮细胞的铁死亡触发并维持慢性系统性免疫介导的银屑病
英文题目:Ferroptosis of select skin epithelial cells initiates and maintains chronic systemic immune-mediated psoriatic disease
中文题目:特定皮肤上皮细胞的铁死亡触发并维持慢性系统性免疫介导的银屑病
期刊:JOURNAL OF CLINICAL INVESTIGATION(IF: 13.3)
单位:美国匹兹堡大学皮肤科
发表时间:2024年11月


摘要:
上皮-免疫互作失调常常导致皮肤、肺部、肾脏和消化道慢性炎症疾病的发生。然而,这些器官中引发和持续炎症的上皮内过程尚不清楚。该研究通过利用氧化还原脂质组学分析发现,哮喘、囊性纤维化、银屑病和肾衰竭患者的病变上皮细胞均存在铁死亡相关的多不饱和脂肪酸磷脂酰乙醇胺过氧化现象。以银屑病作为疾病模型,作者使用高分辨率质谱成像技术,识别了表达角蛋白14(K14)的角质形成细胞在人银屑病皮肤中执行铁死亡程序。通过构建特异性诱导部分K14+谷胱甘肽过氧化物酶4(Gpx4)缺陷的表皮角质形成细胞发生铁死亡的小鼠模型,成功诱导并维持了具有特征性Th1/Th17皮肤和体外免疫反应的银屑病表型。重要的是,铁死亡抑制剂Liproxstatin-1在完全消除银屑病的分子、生化和形态特征方面,与临床上相关的生物制剂IL-12/IL-23/TNFα靶向治疗或T细胞耗竭同样有效。由于特定表皮角质形成细胞中的铁死亡触发并维持了病理性银屑病多器官炎症回路,研究人员建议针对铁死亡或其诱因的干预策略可能有效预防或改善多种慢性炎症疾病。
结果:
1.在皮肤和其他器官的炎症性疾病中,上皮细胞经历了脂质过氧化和铁死亡
为了全面分析涉及上皮组织的几种人类炎症性疾病的氧化脂质组学,研究人员对来自哮喘、囊性纤维化、急性肾损伤和银屑病患者的肺呼吸道上皮、尿液细胞沉淀物和皮肤进行了液相色谱-质谱分析(LC-MS)。在这些疾病中,研究人员发现氧化磷脂(oxPLs)的水平显著增加,特别是铁死亡特异性的过氧化物oxPE死亡信号,如PE(36:4)+2O和PE(38:4)+2O,这些是临床样本中含量最丰富的oxPL物种之一(图1A)。由于上皮细胞在分析的支气管、尿液和皮肤样本中占大多数,研究人员推断上皮细胞的铁死亡可能在这些条件下驱动炎症反应。银屑病影响上皮组织,在皮肤上有局部表现,同时也涉及其他器官的系统性参与,所以研究人员进一步将银屑病作为一种模型研究慢性炎症性疾病。
为了检测银屑病中铁死亡的基因表达特征,研究人员对银屑病皮肤与患者匹配的皮损邻近非病变皮肤进行了RNA测序,并将差异转录谱与铁死亡数据库FerrDb进行了比较。结果显示银屑病中3个铁死亡标记物(Chac1、Slc40a1、Fth1)和29个铁死亡驱动因子(包括Alox12B和Alox15B-编码的15-LOX-2)上调,以及7个铁死亡抑制因子下调(图1B)。Ingenuity 通路分析揭示了银屑病患者病变皮肤与非病变皮肤相比,铁死亡信号通路出现富集(p=0.0013,Z评分=2.04)(图1C)。综上结果表明了铁死亡特异性oxPE在累计皮肤、肺部和肾脏的炎症性疾病的上皮细胞中的累积,并揭示了银屑病表皮中铁死亡的转录谱。
2.银屑病中促铁死亡信号在K14+的角质形成细胞(KCs)中富集
研究人员猜测在银屑病中可能有特定的KCs亚群发生了铁死亡。结果显示与患者匹配的健康表皮比,银屑病患者表皮中Gpx4表达下调(图1D)。在健康表皮中,基底/表基底层的K14hi KCs比更表层的棘层的K14low KCs产生更多的Gpx4,而表皮脊尖端的K19+ KCs含有最多的Gpx4,免疫荧光结果显示与对照表皮相比,Gpx4水平在银屑病表皮中显著降低,这与之前的报道一致(图1,E和F),此外还证实,在银屑病表皮中,EGFR+CD104hiCD49fhi基底KC亚群的Gpx4表达和蛋白水平相对于对照非病变皮肤显著降低(图1,G-I)。
除了失调的谷胱甘肽-Gpx4氧化还原系统外,铁死亡的执行还依赖于多不饱和脂肪酸磷脂(PUFA-PLs)的过氧化。这些磷脂在表皮的基底层和下棘状基底层中最丰富,因此它们可能最容易受到铁死亡的影响。其他关于人类皮肤的研究也表明,基底和表基底KCs也是健康表皮中Alox15B(编码15-LOX-2)的主要生产者。此外,在银屑病中Alox15B被基底KCs上调。共聚焦显微镜显示,与非病变邻近皮肤相比,银屑病表皮中15-LOX-2水平增加,特别是在K5hi基底/棘状上皮基底层KCs相对于K5low浅层棘状层KCs中观察到更显著的上调(图1,J和K)。因此,银屑病表皮中PUFA-P1氢过氧化物的酶促生成(通过15-LOX-2)和还原(通过Gpx4)之间的不平衡导致可测量的氧化脂质的积累,这在基底和深层棘状层的K5/14hiKCs中最明显(图1,L和M),这表明了一条可能的KCs通向铁死亡的路径。
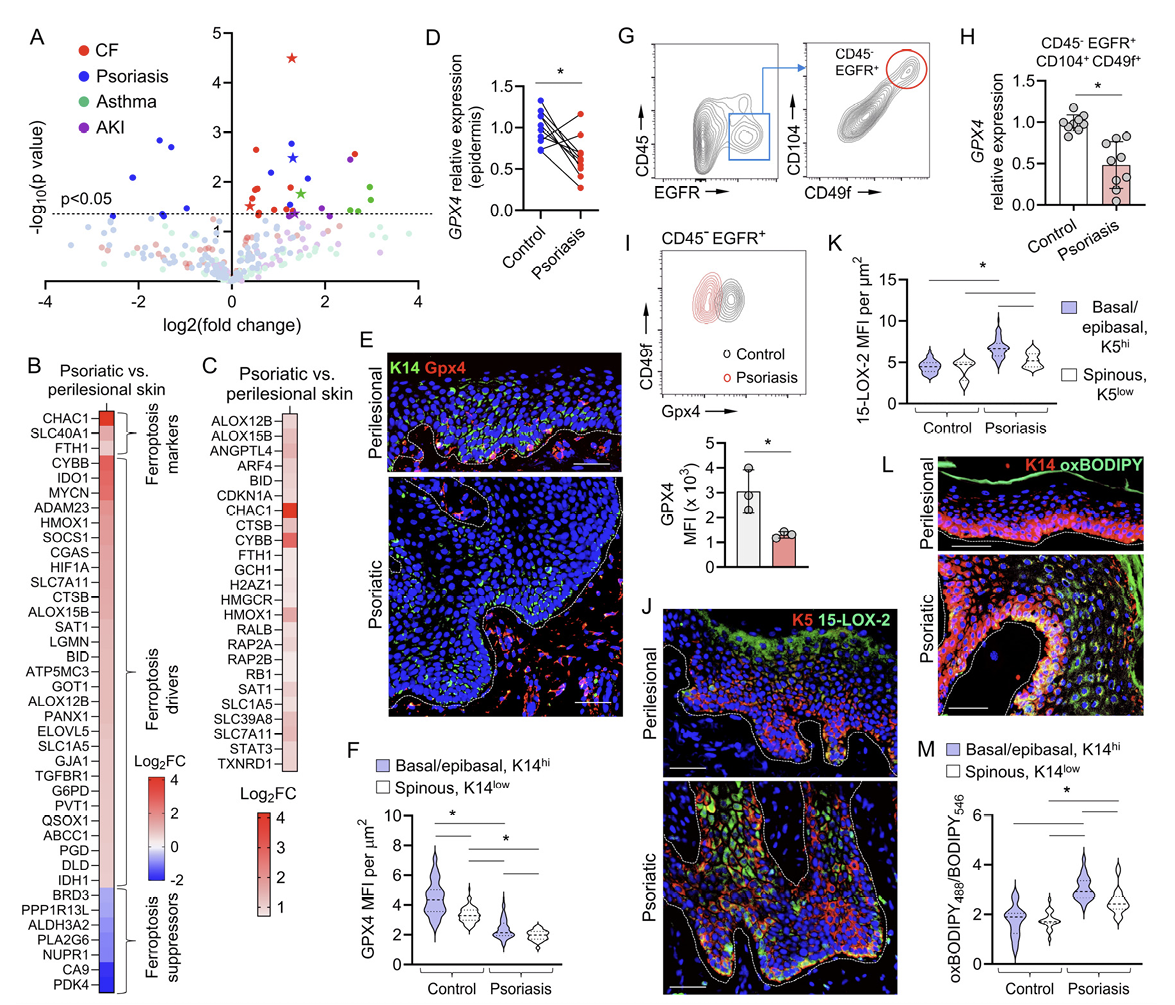
图1:银屑病中促铁死亡的表皮氧化磷脂酰乙醇胺(oxPE)信号与谷胱甘肽过氧化物酶4(Gpx4)水平降低和及15-脂氧合酶2(15-Lox-2)水平升高有关。
由于基于LC-MS的氧化还原脂质组学不能提供分析物的空间分布信息,因此无法识别单个铁死亡细胞,研究人员采用了现代质谱成像技术来绘制银屑病表皮中oxPE的分布图。最初,研究人员使用基质辅助激光解吸/电离质谱(MALDI-MS)成像方案,该方案允许检测多不饱和脂肪酸磷脂(PUFA-PL)过氧化的底物和产物。为了定位表皮内的磷脂信号,在MALDI-MS成像后用抗泛角蛋白和抗K14抗体对皮肤切片进行染色。通过MALDI-MS/免疫荧光显微镜(IFM)比较银屑病和非病变表皮KCs时,发现在银屑病的K14+KCs中,相对于其非氧化前体,促铁死亡的oxPE物种的丰度增加(图2,A和B)。MALDI-MS成像方法的空间分辨率限制在约20微米,不足以区分单个细胞。因此,研究人员利用他们最近开发的多组学双二次离子质谱(SIMS)成像技术,该技术具有高空间分辨率(1-3微米),使用水气团簇离子束((H2O)n(n>24,000)-GCIB)来定位脂质及其过氧化产物,随后使用C60束在相同组织切片上对感兴趣的蛋白质进行空间分析(图2,C和D)。这些研究的结果证实,在银屑病中,存在K14+KCs亚群的富集,其促铁死亡的oxPE产物水平显著升高(图2,D和E)。
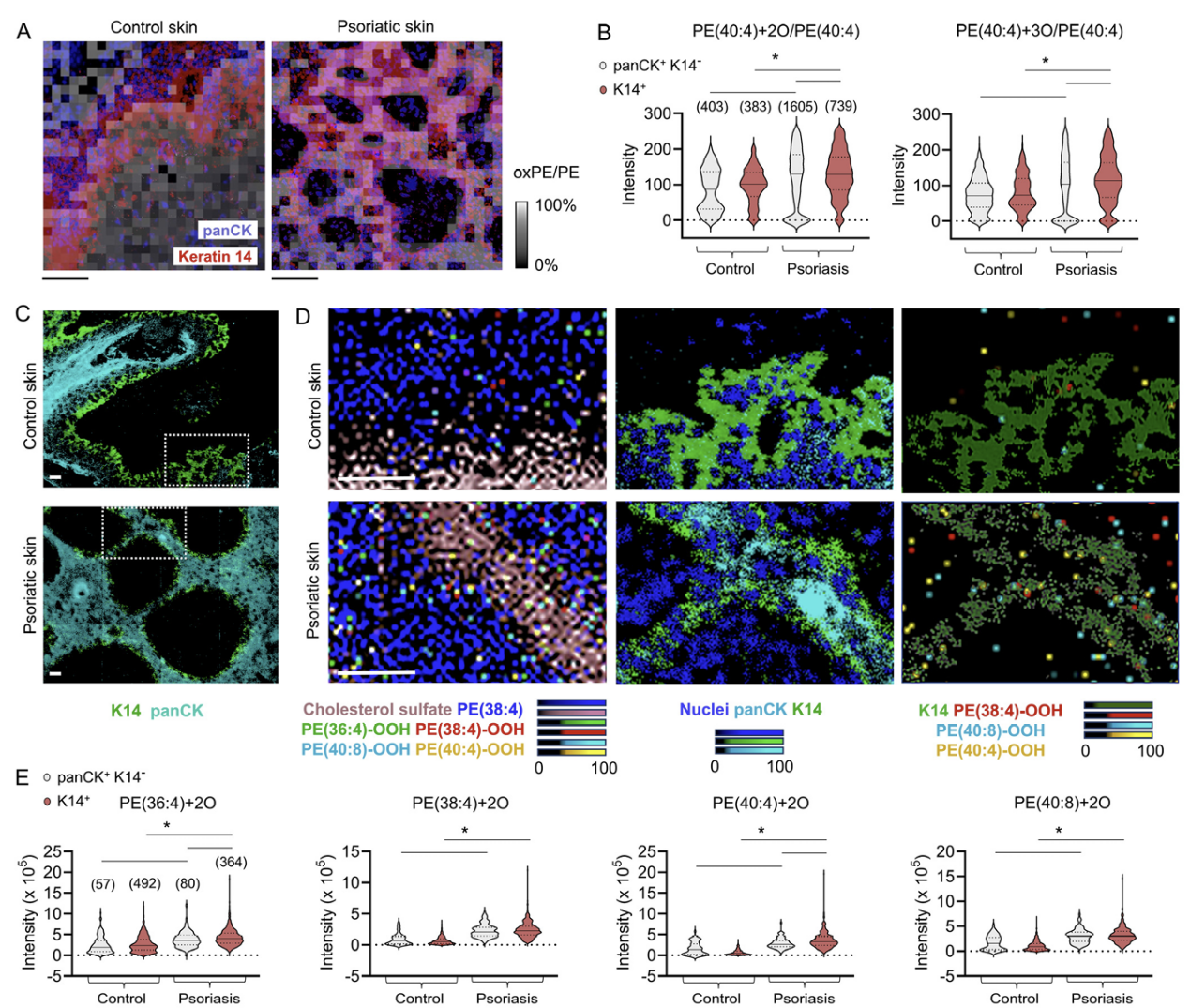
图2:银屑病表皮中升高的oxPE铁死亡信号在K14+ KCs中呈现显著富集。
3. K14+KCs亚群中Gpx4的缺失会引发小鼠银屑病样疾病
为了更清晰地界定K14+KCs铁死亡在银屑病中的作用,研究人员构建了一个他莫昔芬(TMX)诱导遗传小鼠模型,K14-CreERT+/+Gpx4f/f(以下称为K14/Gpx4),该模型在表达K14的KCs中清除Gpx4(图3A)。在K14/Gpx4小鼠中,产生 Cre的K14+KCs约占表皮细胞总数的15%(图3,A和B)。研究人员使用末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)来识别铁死亡细胞。研究发现,K14/Gpx4小鼠的KCs中约有7.6%为TUNEL+,而对照小鼠中TUNEL+KCs的比例约为0.31%(图3C)。所有的铁死亡TUNEL+KCs都是Cre+,而约44%的Cre+细胞为TUNEL+(图3D)。脂质过氧化的指标,如oxBODIPY和4-HNE,以及细胞增殖指数(Ki67+KCs)在K14/Gpx4小鼠的表皮中均显著增加(图3E)。
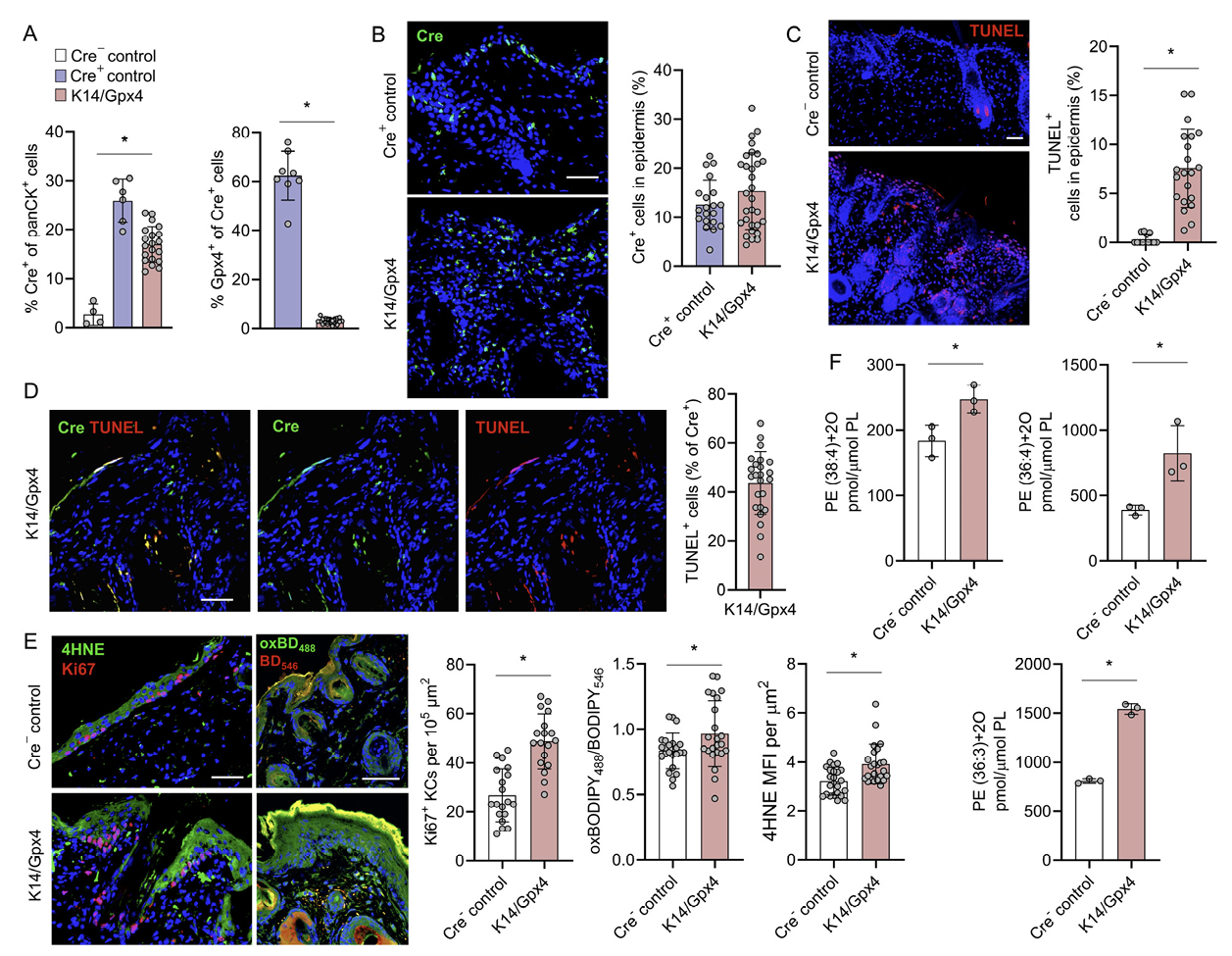
图3:在K14/Gpx4小鼠的K14+表皮KCs中,Gpx4缺失会导致其铁死亡。
研究人员发现K14/Gpx4小鼠表现出与银屑病高度相似的表型。在TMX治疗开始后大约第10-12天,皮肤上首先出现了类似银屑病的变化,并在继续TMX治疗的同时,逐渐扩展到包括耳朵、尾巴和爪子在内的大部分皮肤表面(图4,A和B)。维持Gpx4的耗尽需要TMX。当在第14天停止TMX时,K14/Gpx4表皮中的Gpx4水平回到了对照小鼠的水平,银屑病表型逐渐消失(图4,C和D)。这表明,一部分K14+KCs的铁死亡是维持新的表皮稳态所必需的,这一过程中KCs的死亡和增殖率同时增加。K14/Gpx4小鼠还发展出了与银屑病相关的全身性炎症迹象——血清促炎细胞因子水平升高(例如:IL-6,图4E)。对K14/Gpx4小鼠皮肤的分析显示角化不全和棘皮症,表皮增殖指数升高,包括T淋巴细胞在内的混合性真皮免疫细胞浸润,表皮中的中性粒细胞团以及与银屑病相关的细胞因子和脂质介质的上调(图4,F-I)。在K14/Gpx4表皮中检测到了与银屑病有关的Stat3、Erk和Akt信号通路的激活,这些信号通路提示KCs的增殖(图4J)。重要的是,通过抗体介导的T细胞耗竭阻止了TMX诱导的K14/Gpx4小鼠的银屑病表型(图4K)。综合这些结果,研究人员认为,由Gpx4缺乏引起的K14+KCs亚群的铁死亡足以在K14/Gpx4模型中触发和维持T细胞依赖的银屑病样表型。
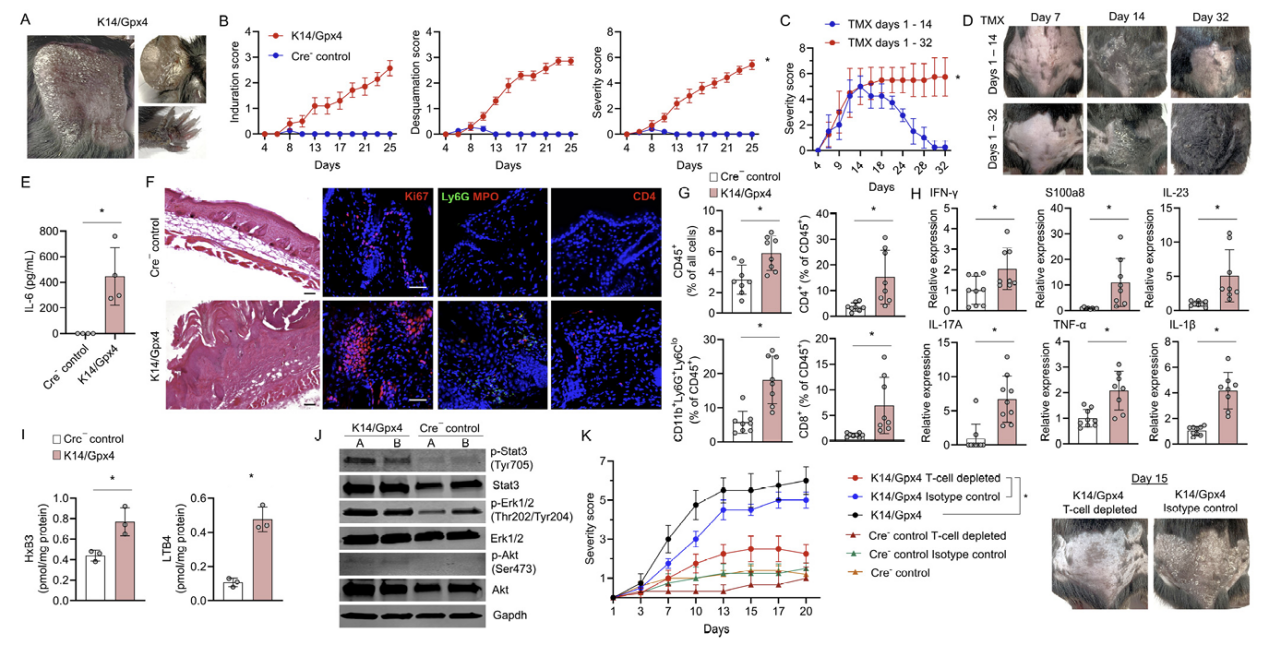
图4:特定K14+KCs中Gpx4的缺失可触发T细胞依赖性银屑病样炎症
4.K14/Gpx4模型与人类银屑病之间的转录谱具有一致性
接下来,研究人员探究了K14/Gpx4模型是否能够重现银屑病的基因表达谱,并对K14/Gpx4病变皮肤与Cre- 对照皮肤进行了RNA测序。将K14/Gpx4的转录谱与人类银屑病皮肤进行比较,发现了531个共有的差异表达基因(DEGs),其中426个显示出正相关(图5A),包括与银屑病和铁死亡相关的基因(图5,B和C)。在Krt14/Gpx4模型中也检测到多个丰富的银屑病相关信号通路(图5D)。此外,Gpx4耗尽的小鼠皮肤转录组显示出与KCs增殖(GO:0050679, FC=1.7, p = 2.91E-04, FDR=6.14E-03)和KCs分化(GO:0030216, FC=2.9, p=1.15E-10, FDR=8.65E-09)相关的信号通路的富集,与人类疾病一致(图5E)。
研究人员还比较了K14/Gpx4模型与已发表的人类疾病研究以及其他银屑病小鼠模型(包括局部伊马克莫德(IMQ)、K14-AREG、K5-Stat3C和皮下IL-23(idIL-23))的基因表达模式,这些模型在转录相似性上有所不同。基于19个选定的典型银屑病相关通路的z评分,K14/Gpx4与人类银屑病数据集(r=0.75-0.96)以及K5-Stat3C(r=0.94)和idIL-23(r=0.89)模型显示出最强的相关性,与K14-AREG(r=0.62)和IMQ(r=0.17-0.56)模型的相关性较弱(图5F)。使用Fisher精确检验对K14/Gpx4与已发表数据集之间的重叠DEGs进行配对相关性分析,揭示K14/Gpx4转录谱与idIL-23模型最为接近(图5G)。在考虑的小鼠模型中,K14/Gpx4和idIL-23与人类银屑病转录组显示出最显著的相关性(图5H)。总体而言,这些结果表明K14/Gpx4小鼠模型的皮肤和人类银屑病的转录变化是一致的。
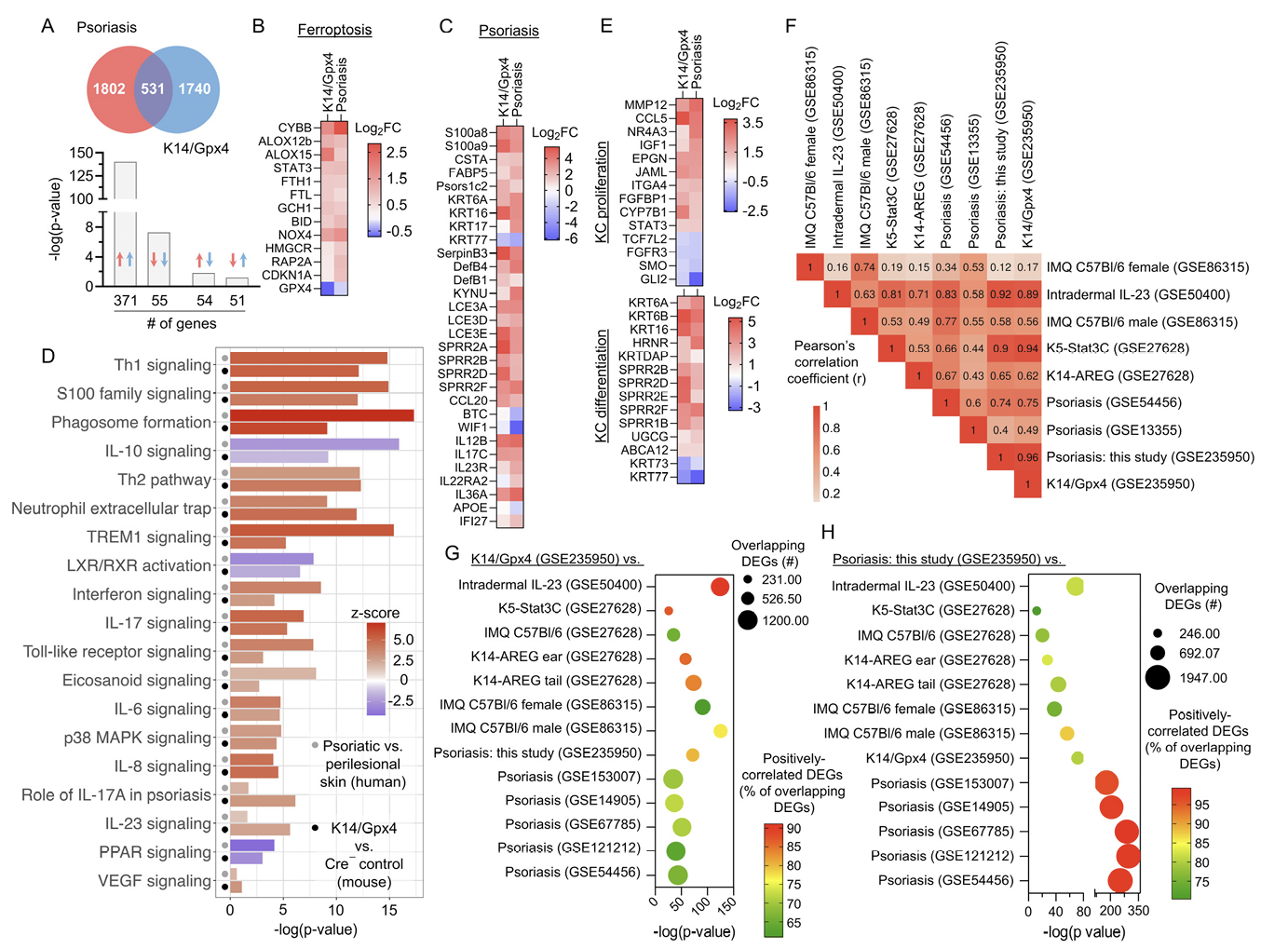
图5:K14/Gpx4模型重现了银屑病的转录组特征。
5. K14/Gpx4模型的银屑病样皮炎可通过单抗药物和铁死亡抑制剂有效治疗
银屑病是一种依赖T细胞的疾病,通常通过抑制IL-12/IL-23/IL-17和TNF-α轴的治疗来治疗。因此研究人员接下来评估了这些基于免疫球蛋白的抗银屑病治疗方法在K14/Gpx4小鼠中的疗效。与TMX联合使用的针对IL-12p40、IL-23p19和TNF-α的靶向抗体,有效地逆转了K14/Gpx4小鼠早期的银屑病样皮肤变化,并在治疗期间保持低严重程度评分(图6,A和B)。在基于免疫球蛋白的治疗开始一个月后,与对照组相比,K14/Gpx4小鼠皮肤中的银屑病炎症标志物显著减少(图6,C和D)。接受治疗性抗体的小鼠在TMX治疗开始两个月后没有显示出系统性炎症或不适的迹象,与接受同型对照抗体的小鼠相比显得更健康。此外,铁死亡抑制剂Lip-1的给药不仅预防了银屑病的发生,而且成功治疗了接受TMX的K14/Gpx4小鼠已建立的银屑病样皮炎和系统性炎症(图6,E-H)。总的来说,这些数据表明,在一部分K14+KCs中的铁死亡过程涉及了银屑病发病机制中的炎症机制。此外, K14/Gpx4模型展示了一些KCs的铁死亡和随后的T细胞介导的免疫反应对于维持银屑病的表皮脂质氧化还原失调和慢性炎症是必需的。
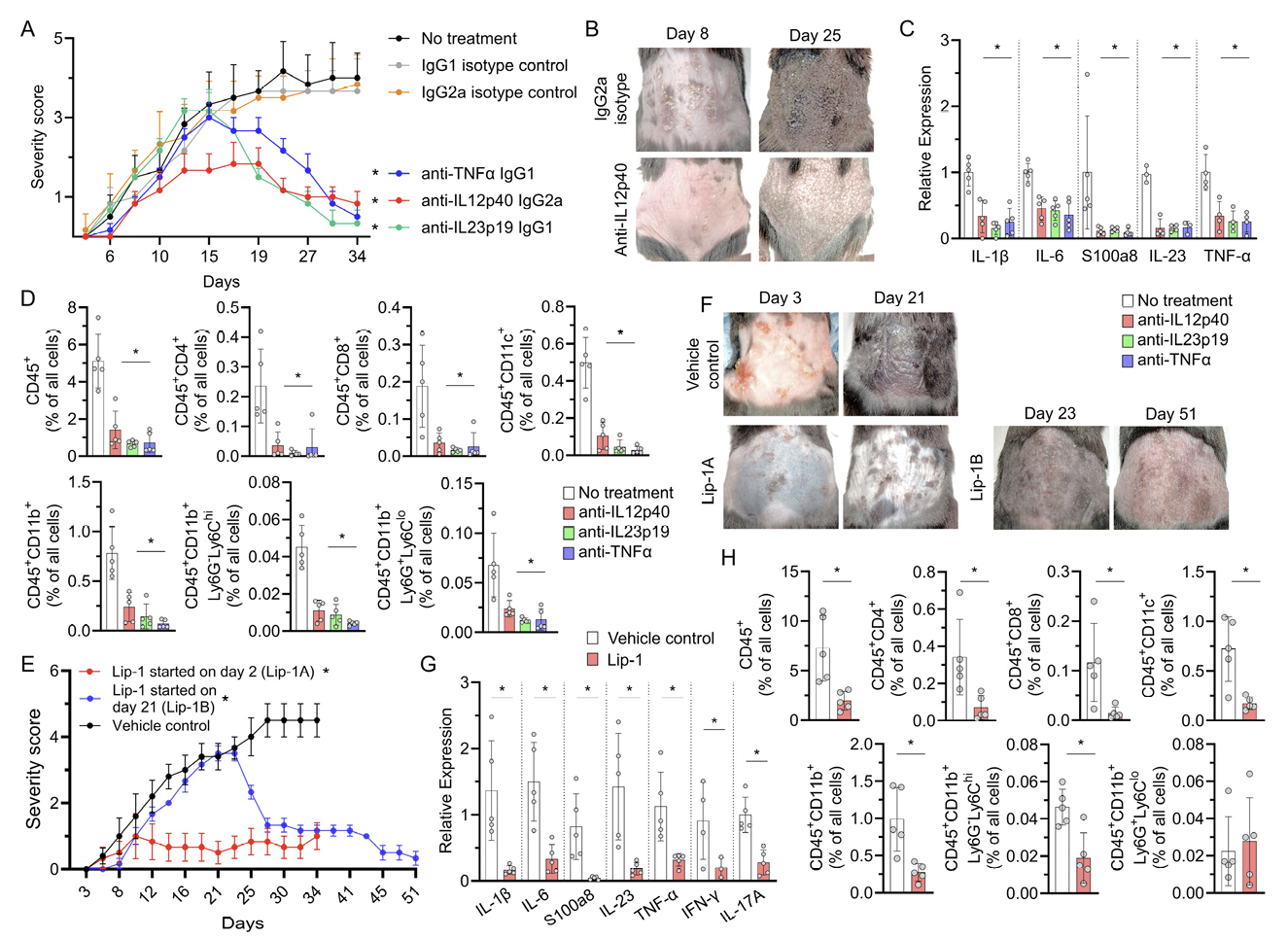
图6:K14/Gpx4模型的银屑病样炎症表型对抗 IL12/IL23/TNFα和抗铁死亡疗法有反应。
结论:
该研究以银屑病为疾病模型,发现银屑病可能是由K14+KCs亚群中氧化磷脂失调引起的,在表皮K14+KCs中特异性敲除Gpx4的小鼠铁死亡模型中观察到了明显的银屑病表型。同时抗铁死亡治疗可以有效逆转银屑病的表型,包括皮肤形态、细胞因子水平、免疫细胞浸润等。因此针对上皮细胞抑制铁死亡的治疗策略可能为慢性炎症疾病的有效预防和治疗方法提供了新的机会。
研究思路、方法
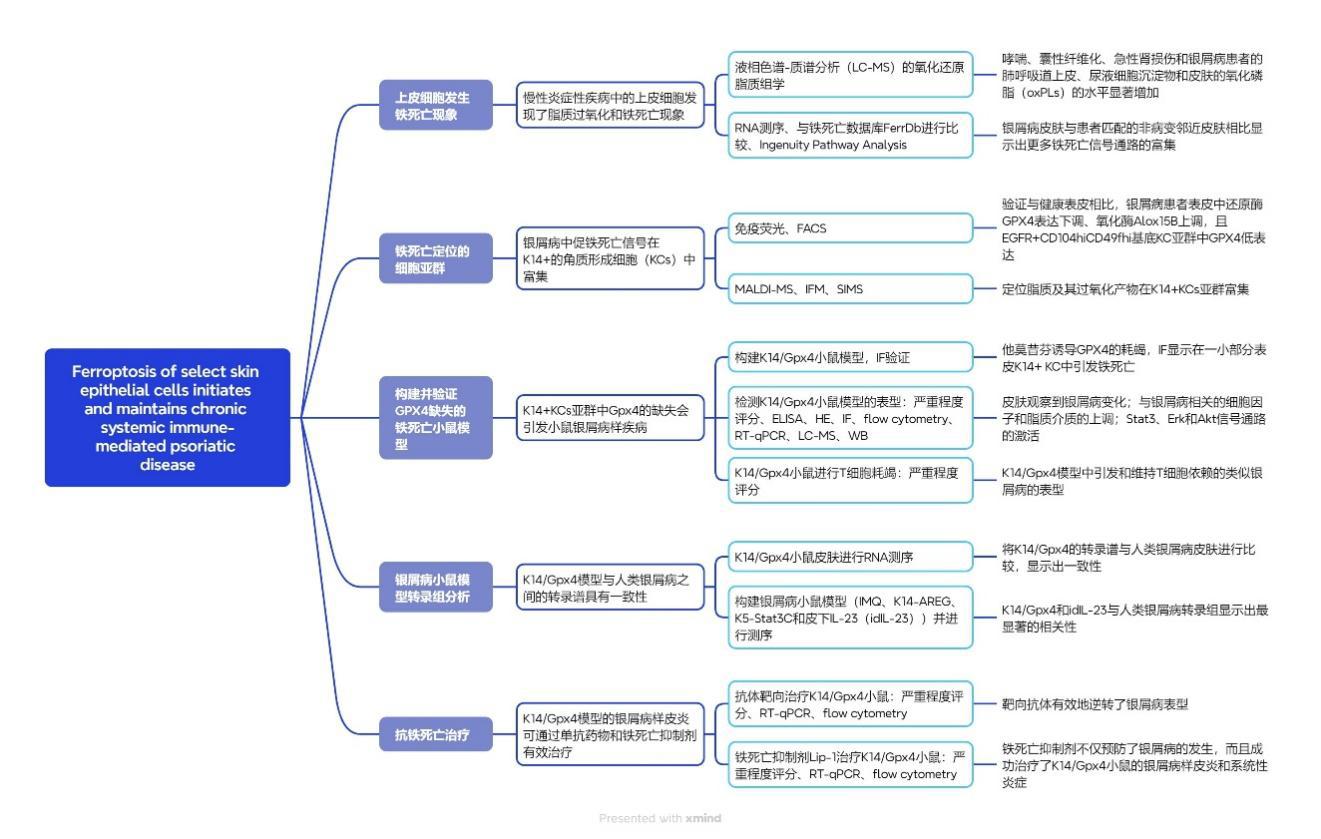

汇报人:周菁
导师:刘世喜
审核:毛敏姿、任建君



