华西耳鼻喉学术前沿速递——文献精读(第54期)
精读分享│【Nature】:具有自体组织驻留免疫区室的人体类器官
英文题目:Human organoids with an autologous
tissue-resident immune compartment
中文题目:具有自体组织驻留免疫区室的人体类器官
期刊:Nature(IF: 50.5)
单位:意大利圣拉斐尔科学研究医院
发表时间:2024年9月



摘要:
上皮和免疫系统之间的密切关系对于维持组织稳态至关重要,其中的扰动与自身免疫性疾病和癌症有关。虽然干细胞衍生的类器官是模拟上皮功能的强有力模型,但它们缺乏捕获器官水平过程所必需的组织驻留免疫细胞。研究者描述了人类肠道免疫类器官(IIO),通过上皮类器官和自体组织驻留记忆T(TRM)细胞的自组织形成,其中一部分整合在上皮细胞内并发挥屏障作用。TRM细胞迁移和与上皮细胞的相互作用是由控制细胞运动和粘附的TRM细胞富集转录组程序精心协调的。研究者将IIO和单细胞转录组学相结合,以研究癌症靶向生物制剂在患者中引发的肠道炎症的过程。炎症与逐渐获得上皮内和细胞毒性特征的活化的CD8+ T细胞群体的出现相关。这种效应群体出现在T辅助细胞-1样CD4+群体之前并由TH1细胞增强,其最初产生细胞因子,随后变成自身也具有细胞毒性。作为一个易于直接扰动的系统,IIO使研究者能够将Rho通路确定为减轻免疫治疗相关肠道炎症的新靶点。鉴于它们概括了表型结果和潜在的谱系间免疫的相互作用,IIO可用于研究肿瘤发生和感染性及自身免疫性疾病背景下的组织驻留免疫应答。
思维导图:

研究背景:
来自成体干细胞的类器官模拟了人类生理学的重要方面,并应用在了与基因疾病、传染性疾病、癌症、再生医学和药物发现相关的研究中。然而,它们仅仅只有上皮结构,而原生器官包括多个其他区室,包括在稳态和疾病中具有重要作用的特殊免疫细胞。例如,肠黏膜免疫系统——人体最大的免疫细胞池——通过持续把控肠道屏障和管腔内容物之间的交界面来维持稳态。肠道免疫功能的破坏会导致许多病理状态,包括持续感染、自身免疫性疾病甚至恶性肿瘤。虽然肠道类器官可以准确地模拟上皮细胞类型的分化和功能,但由于缺乏组织特异性免疫区室,它们无法重现肠道(病理)生理的关键方面。
为了克服这些缺点,研究者们将成体或诱导多能干细胞来源的类器官与血液来源的先天或适应性免疫细胞共同培养。然而,要合并淋巴细胞区室,却是难以实现的。最近的一项研究描述了诱导多能干细胞衍生的人肠道类器官在人源化小鼠移植后产生肠道相关淋巴组织。尽管这是一个重要的进步,但体内免疫组织的形成却不具有类器官在体外系统中可控制的优势。类似地,已经有研究将胎儿肠道类器官与效应记忆T细胞共同培养,但目前还没有模型能包含一个具有在人类寿命过程中获得的记忆特征的真正的成人组织驻留淋巴细胞区室。本文研究者从现成的成人组织样本开始,创建了一个易处理的肠道免疫类器官(IIO)模型,其中包含一个组织驻留和自身免疫区室(图1a)。研究者通过使用单细胞转录组与参考图谱进行比较,对IIO中的细胞状态进行基准测试,并使用IIO来概括和研究药物诱导的肠道炎症。
主要结果:
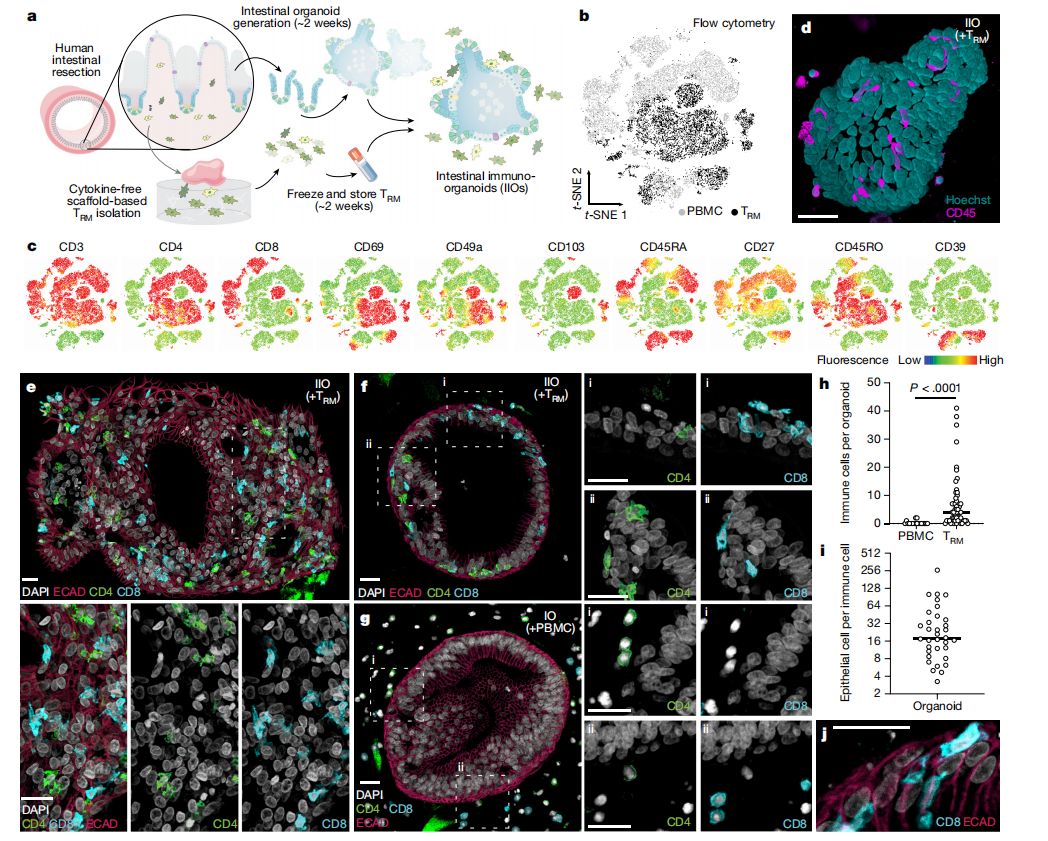
1.构建IIO并验证其结构和细胞类型
在将相关淋巴细胞区室引入类器官时,研究者聚焦于组织驻留记忆T(TRM)细胞-接触过抗原的T细胞群,它们永久留存在肠道黏膜中,提供抵抗病原体的第一线防御。由于缺乏再循环,它们是一种可以稳定地纳入类器官模型的合适的淋巴细胞类型。此外,它们的记忆特性确保了其在缺乏抗原呈递细胞、淋巴样结构和剩余免疫细胞再循环系统的情况下的功能。由于人TRM细胞在酶从组织中去除后生存能力较差,很难纳入体外系统,研究者采用了一种无酶、基于支架的爬出方案来分离大量肠道免疫细胞(图1a)。即使在完全没有细胞因子或T细胞受体(TCR)刺激的情况下,研究者的方法也比基于酶消化的方案释放了更多的细胞,同时保留了相似比例的免疫细胞类型(扩展数据图1a,b)。流式细胞术分析显示,分离的细胞表达与肠相关的TRM细胞标志物,包括CD161(IL-17A产生)和CD117 (Notch信号),由KIT编码;扩展数据图1c),以及与组织保留(CD69)、细胞外基质关联(CD49a,由ITGA1编码)和上皮细胞整合相关的表面分子(CD103,由ITGAE编码),所有这些在血液来源T细胞上几乎检测不到(图1b,c)。研究者认为缺乏细胞因子暴露对于保留肠源性淋巴细胞的组织样生理特性至关重要,暴露于IL-2和IL-15后关键激活标记物的变化证明了这一点(扩展数据图1d)。研究者的肠道来源的T细胞完全是记忆细胞(CD45RO+CD45RA-),淋巴结归巢能力有限(CCR7-),并且这些细胞表达了高水平的IL-7受体CD127(扩展数据图1e)。最终分离的免疫细胞池有时含有骨髓细胞和B淋巴细胞,这在很大程度上取决于组织标本本身(扩展数据图1b)。尽管如此,由于绝大多数(平均84.5%)是TRM细胞,研究者使用缩写TRM细胞来指代从人类肠道样本中收获的免疫细胞池。
研究者从人类肠道标本中生成了类器官细胞和TRM细胞,此外还从同一供体收集了匹配的外周血单核细胞(PBMC)。一旦建立类器官,在生理相关的细胞浓度以及没有外部刺激的情况下,TRM细胞或PBMC就与之结合在三维细胞外基质(ECM)中。共聚焦显微镜显示,在共培养后,TRM细胞是有活力的,并且与类器官密切相关(图1d和补充视频1)。为了详细检查类器官-TRM细胞的相互作用,研究者生成了模型的组织学切片,并将上皮细胞和免疫细胞可视化(图1e-g)。研究者发现,尽管PBMC占据ECM空间而与上皮细胞没有明显的相互作用(图1g),但一种TRM细胞亚群在没有刺激的情况下浸润了类器官并整合在上皮屏障内,类似于肠上皮内淋巴细胞(IEL)的行为(图1e,f,h)。研究者估计,每一个免疫细胞中有16个上皮细胞的中位整合比(图1i),这与健康人肠道中的观察结果非常相似。IEL显示出长达约60µm的细长形态(图1j和扩展数据图1f),大约是幼稚血源性T细胞长度的10倍,让人想起小鼠IEL在体内成像时的“牙线”行为。在低水平细胞因子支持下,类免疫器官培养可维持至少14天(扩展数据图1g-j)。该模型提供了人类免疫细胞和上皮类器官之间自组织形成具有组织驻留免疫区室的类器官系统的一个例子。研究者称之为IIO;因此,研究者使用IIO来指代与自体肠道来源的TRM细胞共培养并含有整合IEL的类器官。

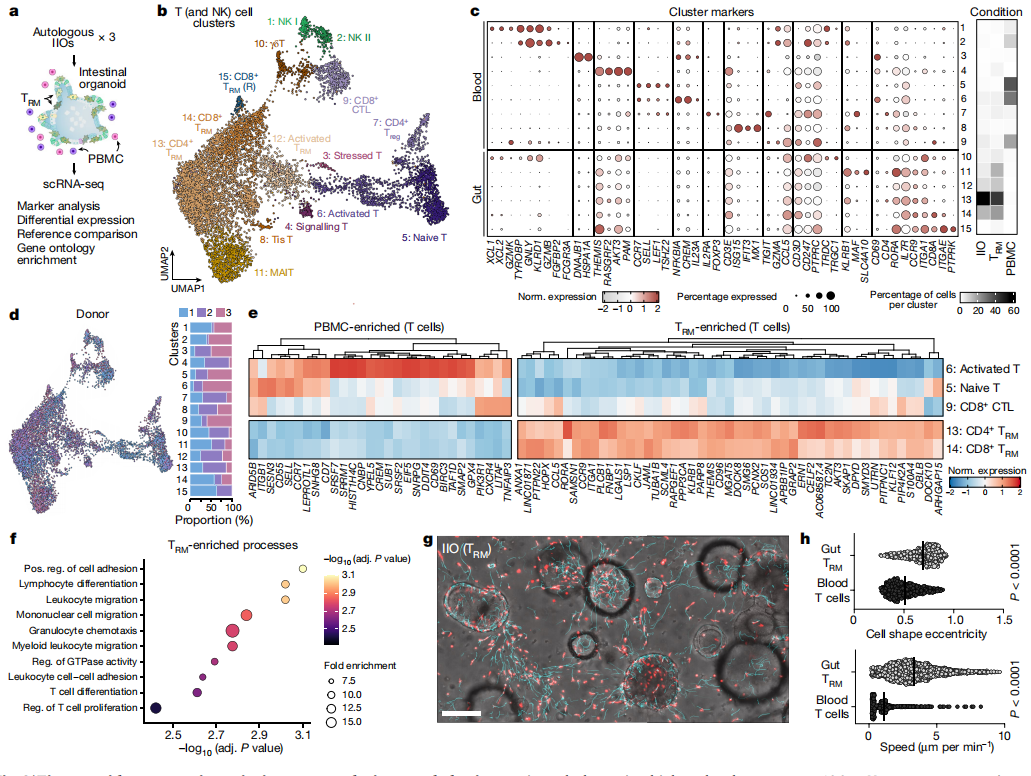
2.探究TRM细胞和IEL在体外与肠上皮细胞整合机制
大量的体内研究已经剖析了小鼠TCRγδ IEL的动力学及其与肠上皮的相互作用。由于它们在体外的存活率很低,针对人类IEL行为的类似研究被证明具有挑战性,并且驱动人类特异性IEL整合的机制尚不清楚。为了了解TRM细胞和IEL如何在体外与肠上皮细胞整合,以及它们在这方面与PBMC有何不同,研究者使用单细胞RNA测序(scRNA-seq)分析了来自三种不同小肠样本的IIO培养物。研究者在IIO建立后24小时后进行了scRNA测序,因为在这个时间点TRM细胞的整合已经完成(由纵向流式细胞术实验证明),在没有任何处理的情况下,共培养的前4天内TRM细胞组成和激活谱稳定(扩展数据图2a)。研究者将这些与类器官共培养的匹配PBMC进行了比较,并将单独在Matrigel中培养的肠道来源的TRM细胞作为额外的对照(图2a)。使用均匀流形近似和投影(UMAP)嵌入的异质性分析和可视化显示,在所有三个供体中存在10个上皮细胞簇和14个免疫细胞簇(扩展数据图2b-e)。尽管研究者观察到,TRM细胞的存在导致IIO上皮干细胞中ID3和HES1、以及与肠道干细胞维持和微生物防御相关的基因的显著上调(扩展数据图2f,g),但IIO上皮干细胞和PBMC培养的类器官之间的上皮细胞比例和基因表达总体上是稳定的。鉴于T细胞(以及密切相关的自然杀伤(NK)细胞)在组织来源群体中的优势地位,研究者将分析重点放在了它们身上,并确定了三个不同的群体,代表了15个血源性幼稚细胞、血源性和肠源性效应细胞以及肠源性TRM细胞(图2b,c,扩展数据图2h和补充表1)。基于先前发表的标记物,对T细胞群进行的进一步研究表明,与匹配的血液来源细胞不同,单独培养或在IIO内培养的TRM细胞的转录组有以下特征:(1)缺乏淋巴结归巢所需的受体(SELL, CCR7),(2)肠道归巢和整合因子(ITGA1, CCR9, JAML)内在高表达,(3)完全缺乏细胞毒性颗粒(GZMB, GZMK, GNLY)(图2c和补充表2)。研究者观察了来自所有三个供体的每个集群的代表性,证明了不同免疫状态的一致性和可重复性(图2d)。为了确定TRM细胞和PBMC之间的主要功能差异,研究者考虑了TRM细胞基因的最高级差异调节(图2e)。基因本体分析表明,与PBMC相比,TRM细胞中与免疫细胞趋化性和迁移相关的转录组程序富集(图2f),这可能解释了它们在上皮内整合的倾向。事实上,在实时成像实验中,对供体匹配的肠道TRM细胞和血液T细胞进行了跟踪(图2g和补充视频2 (TRM细胞)和3(血液T细胞)),显示了两个细胞种群在形态和迁移行为上的显著差异。然而,血液T细胞大部分是静态和圆形的(补充视频3),而TRM细胞表现出细长的形状,并在上皮层和ECM内动态迁移(图2g,h和补充视频2)。研究者注意到,肠道类器官是一个无菌系统,如小鼠体内研究所描述的,肠道微生物的引入可能导致迁移模式和与上皮相互作用的改变。
为了评估上皮对IIO内TRM细胞的影响,相对于单独培养的TRM细胞,研究者基于典型相关分析空间中的连通性,重建了T细胞的邻域富集评分(整合指数)。将几乎完全由IIO来源的TRM细胞(bin 5)与单独培养的TRM细胞(bin 3)组成的区域进行比较,发现与细胞运动和细胞骨架重排相关的基因(ANXA1, ANXA2, LGALS3, S100A6, S100A10, S100A11)表达富集(扩展数据图2i-k)。相反,单独培养的TRM细胞显示进入肠道和ECM周围所需的基因(JAML, SOS1, CD96, ITGA1)的表达增加,但整合到上皮的基因并没有(扩展数据图2k)。这表明上皮增强和放大了TRM细胞的上皮内特征,可能是通过研究者在图1中观察和描述的频繁的细胞间接触实现的。以上结果表明组织驻留转录组特征和迁移行为是TRM细胞上皮插入和IIO形成的基础。

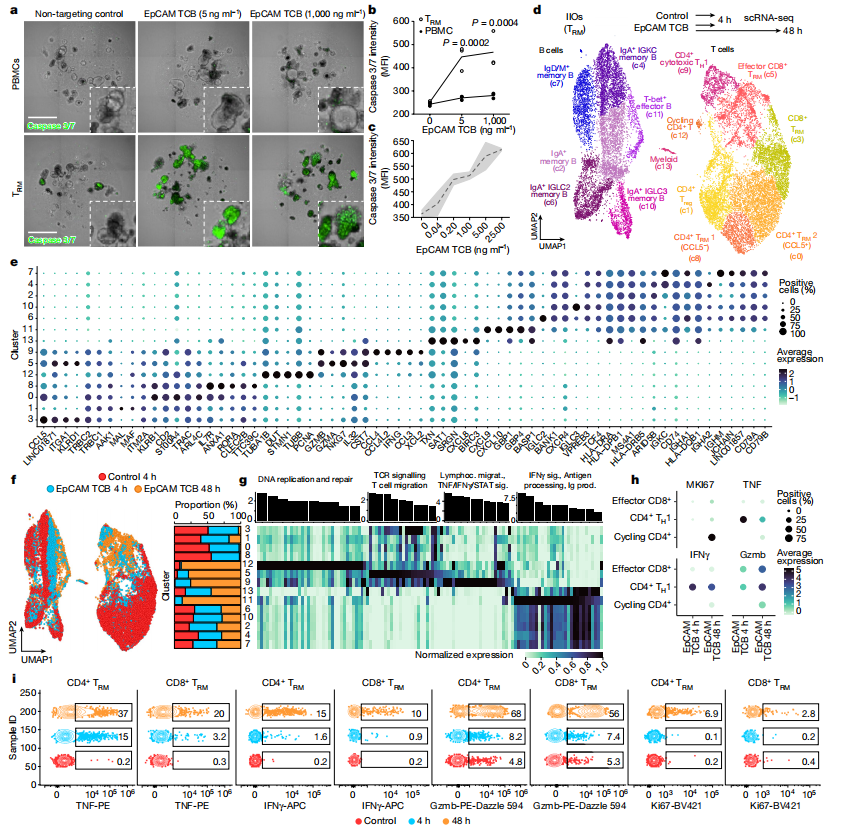
3.探究IIO是否可以重现与癌症免疫治疗相关临床毒性
研究者接下来测试了TRM细胞和PBMC之间的差异性转录组和迁移行为是否会导致效应功能的不同。特别是,研究者研究了IIO是否能够重现与癌症免疫疗法相关的严重肠道炎症。研究者重点关注了solitomab,这是一种旨在通过上皮细胞黏附分子(EpCAM)将激活的T细胞与实体瘤结合的双特异性T细胞激活剂,它在患者中引起了强烈的、非预期的肠道炎症,阻止了剂量的增加并最终导致治疗终止。鉴于副作用的快速发生,人们推测位于基底膜连接处的IEL引发了这种损伤。为了评估含有IEL的IIO是否能够预测对健康上皮组织的靶向,研究者用一种针对EpCAM的T细胞双特异性(TCB)分子在临床相关浓度下处理了IIO。与用PBMC培养的类器官不同,IIO是以TCB剂量依赖的方式被靶向的,在浓度低至40 pg/ml且治疗后仅8小时时即可检测到caspase 3/7(如图3a-c和补充图3a所示)。研究者通过对IIO进行表面和细胞内标记物的消化和染色来评估T细胞在早期(5小时)、中期(24小时)和晚期(48小时)的行为(补充图3b)。基于TNF、IFNγ和颗粒酶B(Gzmb)的表达,对效应群体的识别显示90%以上的应答细胞为肠TRM细胞(扩展数据图3c)。此外,研究者观察到TRM细胞开始表达CD38、HLA-DR和ki67-在体内驱动结肠炎样病理的细胞中发现的激活和增殖标志物(扩展数据图3d)。上清分析印证了这些发现,关键细胞因子TNF、IFNγ、Gzmb、IL-2和GM-CSF在TRM细胞IIO培养中都更容易检测到(扩展数据图3e)。
研究者发现,尽管循环记忆细胞比原始记忆细胞更有效,但反应明显弱于匹配的TRM细胞(扩展数据图3f)。在TRM细胞中,CD103-(固有层)和CD103+(上皮内)部分触发了等效的上皮靶向(扩展数据图3g,h),在共培养后10天添加TCB的长期IIO培养中也保持了这种靶向(扩展数据图3i)。
为了研究TRM细胞介导的炎症反应是否会影响循环免疫细胞,研究者将PBMC加入IIO,并用TCB处理它们(扩展数据图4a)。与没有TRM细胞培养的类器官+PBMC相比,TRM细胞的存在导致PBMC在类器官内的整合增强(扩展数据图4b)。此外,研究者注意到了骨髓相关细胞因子IL-1β、IL-6和IL-8在添加PBMC的IIO培养物中的协同诱导作用,这表明组织驻留免疫区室可以增强系统内外周免疫细胞的反应(扩展数据图4b-d)。
T细胞靶向治疗引起的严重快速毒性的机制尚不清楚,因为经历这些毒性的患者在急性期没有进行活组织检查。IIO可以概括临床结果的各个方面,为深入分析潜在的免疫事件提供了机会。研究者使用scRNA-seq来探究TCB依赖性TRM细胞在上皮细胞靶向开始(4小时)和峰值(48小时)时活性的转录组动力学。使用差异基因表达连同先前发表的特征和表面标记对整合数据集中的淋巴细胞群进行注释,表明在该特定标本中主要是T细胞,但也有巨噬细胞和B细胞群体(图3d,e和补充表1和2)。相对于非靶向对照,由于在两个时间点出现了几个效应种群,TCB处理诱导了T和B细胞状态的比例发生变化(图3f)。在第4小时特别突出的是CD4+ T辅助1样(TH1)群体(c9)(图3d-f),其特征是TNF和IFNG信号的快速诱导,随着时间的推移而下调(图3g,h)。在48 h时,研究者观察到一个活化的CD8+ IEL群体(c5)(图3d-f)的出现,表达与细胞毒性(如GZMB)、TCR信号传导和T细胞迁移相关的基因(图3g,h)。同时,出现了循环(表达MKI67的)CD4+ T细胞群(c12)和激活的B细胞群(c11),而调节性T细胞群(c1)减少(图3d-g)。重要的是,通过流式细胞术的记录,scRNA-seq检测到的关键基因表达变化反映了蛋白质水平的变化(图3i)。研究者观察到CD4+细胞在4小时(对应于c9)早期诱导TNF,而细胞毒性Gzmb在48小时上调,与c5的表现一致。同样,在48h时,Ki67在CD4+细胞的一个亚群中被显著上调,在scRNA-seq分析中与c12的出现共同发生。IIO细胞异质性动力学与从经历自发和免疫检查点抑制剂(ICI)诱导的肠道炎症的患者中观察到的原始样本具有惊人的相似性。例如,细胞毒性CD8+T细胞群的出现是ICI诱导结肠炎患者的主要特征之一。同样,调节性T细胞向致病性细胞因子产生的转变和活化的IFNγ-应答B细胞群的出现是结肠炎病理生理的良好特征。这些相似之处表明IIO可以作为一个易于处理的体外模型用于概括和研究肠道炎症。
接下来,研究者绘制了临床相关CD8+ T细胞群的激活动力学图谱。使用Diffusion Maps,研究者计算了种群c3和c5的伪时间排序(图4a和扩展数据图5a),并观察到它们与实验时间的显著相关性(图4b和扩展数据图5b)。这种重建的激活轨迹能表征CD8+ TRM细胞激活的转录动力学(扩展数据图5c)。研究者观察到糖酵解调节因子ENO1和HIF1A的诱导以及可能促进相应代谢谱充分激活的TCF7和ZBTB32的抑制。同时,CCL5(对免疫细胞募集很重要)和IL7R(介导细胞毒性激活)与细胞毒性基因GZMA、GZMB和NKG7的诱导相关。药物性结肠炎患者的活检测序显示细胞毒性(CTL)和IEL CD8+ T细胞群的存在。通过将经TCB处理的IIO与该数据集交叉对照,研究者发现IIO CD8+ T细胞获得了与细胞毒性和IEL状态相关的基因特征,与临床样本中观察到的结果相一致(扩展数据图5d,e)。淋巴细胞-上皮关联和细胞毒性的同时增加可能是这些分子引发的严重临床不良事件的基础。
除了CD8+ CTL外,其他人群也表现出早期与晚期转录特征的临床相关动力学。与临床报告一致,TH1群体(c9)从细胞因子产生状态转变为细胞毒性状态(图4c和扩展数据图5f)。同样,早期IFN应答的B细胞群(c11)显示出与晚期激活状态不同的转录图谱(图4d和扩展数据图5g)。研究者进行了受体-配体配对分析,并研究了活化表型如何通过细胞间信号传导出现的(图4e)。研究者的模型暗示TH1细胞(c9)是一个主要的组织中心,通过分泌许多信号因子来指导B细胞(c11)和CD8+ T细胞(c5)(图4f和扩展数据图5h,i)。同时,CD4+ T细胞(c9)中TNF的表达与活化CD8+ IEL中CALM1表达的增加相对应(c5),潜在地增强了TCR诱导的钙信号传导和T细胞成熟(图4f和扩展数据图5j)。配体-靶标信号模型和网络传播分析印证了这些观察结果,表明TH1产生的IFNG可能介导B细胞活化,而TNF和IL2协同协调细胞毒性CD8+细胞成熟(扩展数据图5h,i)。

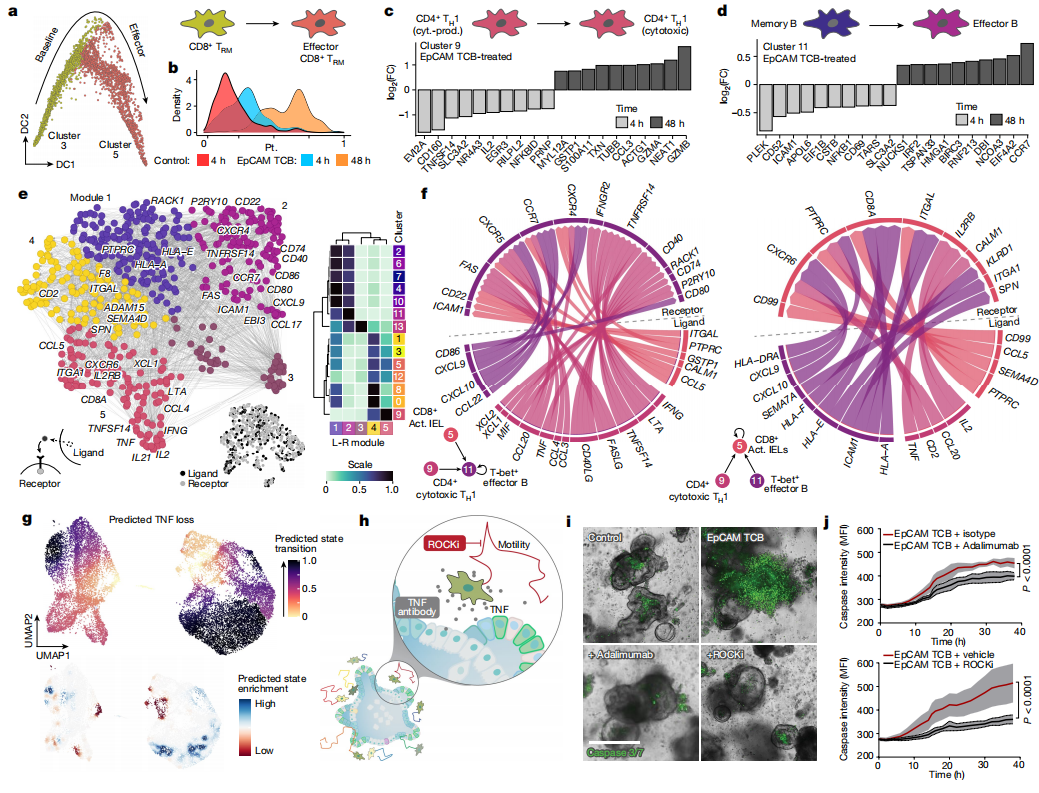
4.在IIO模型中寻找免疫疗法相关炎症反应的靶点
人体模型系统的一个主要优势是其易于实验操作,是确定推定调节因子作用的一种手段。鉴于TNF阻断抗体在自身免疫性疾病治疗中的有效性,以及在研究者的模型中TNF的早期诱导(图3h,i),他们研究了其在促进分化和激活中的作用。通过计算机干扰分析预测发现,从IIO中完全去除TNF将阻止TRM细胞活化(图4)。TCB治疗后在IIO中使用阿达木单抗对TNF进行抗体中和证实了这一预测,显著降低了TRM细胞中关键激活和分化标志物ICAM-1,4-1BB, CD25和Gzmb的表达(扩展数据图6a)。此外,上皮在炎症反应中表达的趋化因子CCL2以及上皮细胞凋亡本身的表达均显著降低(图4h-j和扩展数据图6b)。这种作用似乎是由TNF对TRM细胞的作用介导的,而不是直接对上皮细胞的细胞毒性,因为直接暴露于重组TNF的类器官对上皮caspase信号没有影响(扩展数据图6c,d)。在证实了中和临床验证途径的影响后,研究者利用定义TRM细胞特征的转录组数据(图 2)提出了可用于控制炎症的新因素。鉴于TRM细胞在ECM内的快速运动,研究者假设T细胞的运动在一定程度上可能导致了此结果。为了验证这一假设,研究者使用ROCK1/2抑制剂(ROCKi) Y-27632来抑制TBC处理的IIO细胞的运动。引人注意的是,研究者发现ROCK抑制比TNF阻断更有效地减少了上皮细胞凋亡(图4h-j),同时抑制了TRM细胞运动(补充视频4和扩展数据图6e)以及T细胞激活标记物和细胞溶解分子的诱导(如穿孔素和Gzmb)(扩展数据图6f)。细胞内染色显示TNF的诱导也被抑制,但总体T细胞活力不变(扩展数据图6g,h)。除了TNF和 Rho介导的信号外,转录组和配体受体分析还提供了一系列管理炎症的假定目标,值得在今后的研究中加以探讨。
抗 CTLA-4 和抗-PD-1 等免疫检查点抑制剂可对多种人类癌症产生持久反应,但同时也会因同时存在的肠道微生物或病毒感染免疫反应加剧而引发 10-15% 的患者出现肠结肠炎症状。由于CD8+ TRM细胞被描述为这种病理的关键驱动因素,研究者测试了IIO培养是否可以再现这一现象。研究者在存在或不存在抗CTLA-4(易普利姆单抗)和抗PD-1(纳武单抗)的情况下,用同种异体树突状细胞预处理TRM细胞或匹配PBMC对照,重现其对抗原呈递细胞的作用,然后将其纳入类器官。虽然研究者没有检测到casepase信号通路的变化,更敏感的乳酸脱氢酶(LDH)检测显示,在使用ICI处理的两个TRM细胞生物复制中,其中一个的信号增加具有统计学意义(扩展数据图7b)。这种反应与表达CD38、Gzmb和Ki67的CD8+ TRM细胞的增加有关(扩展数据图7c,d),类似于患者中描述的疾病驱动群体。有趣的是,ICI 处理后,来自任一供体的PBMC和TRM细胞都显示出活化增强(扩展数据图 7e),但LDH信号的增加仅出现在致病性CD8+ T细胞数量增加的TRM细胞条件下(扩展数据图 7c,d),这表明损伤可能需要与上皮细胞紧密结合。

讨论
本文研究者描述了由人类肠上皮细胞和自体TRM细胞组成的人类IIO,其中一个亚群直接整合在IIO上皮屏障内,由TRM细胞丰富的转录组程序控制细胞的运动性和粘附性。重要的是,IIO是在与TRM细胞共同培养后形成的,而不是与血液衍生的淋巴细胞共同培养,后者不能迁移并与器官组织相互作用。虽然上皮细胞特性在TRM细胞整合后没有明显改变,但研究者假设TRM细胞会影响上皮屏障的完整性、防御和再生。考虑到这些变化可能在挑战条件下显现,他们正在积极研究如何调整模型,以允许肠腔进入和常规引入肠道病原体。
加入与组织相适应的免疫区室,使器官组织的用途超出了以上皮细胞为中心的问题研究。研究者利用IIO再现由TCB引起的肠道炎症。经TCB处理的IIO会迅速凋亡,这与患者早期出现的腹泻和上皮病变一致。重要的是,虽然与PBMC共同培养也能获得类似的结果,但在浓度比临床剂量高1000倍的情况下才会产生影响,而且即使在这种情况下,影响也会延迟发生。通过分析TCB治疗诱导的转录组变化,研究者发现不良后果的基础是动态的线间免疫相互作用,这种相互作用与检查点抑制剂诱导的肠道炎症和炎症性肠病的相关机制相似。
本文模型具有直接扰动和假设检验的优势。虽然对原发性患者样本进行的多组学分析提供了正常状态与患病状态之间差异的丰富目录,但差异调控参数的确切作用却难以确定。在证明了IIO对临床有效的缓解策略做出反应后,研究者利用IIO确定了治疗TCB介导的毒性的新方法。他们发现,通过Rho通路阻断TRM细胞的运动有助于抑制炎症。有趣的是,针对这一途径的小分子药物正被开发为炎症性肠病的纤维化抑制剂。这个简单模型可以重现表型结果和介导这些结果的细胞相互作用,因此IIO可以帮助研究组织驻留免疫反应,其范围远远超出药物诱导的炎症,包括肿瘤发生、传染病和自身免疫性疾病。

汇报人:胥飞宇
导师:刘世喜
审核:吴桂曦、任建君



