华西耳鼻喉学术前沿速递——文献精读(第53期)
精读分享│【Nature】:Tbx2是内毛细胞和外毛细胞分化过程中重要的调控因子
英文题目:Tbx2 is a master regulator of inner versus outer hair cell differentiation
中文题目:Tbx2是内毛细胞和外毛细胞分化过程中重要的调控因子
期刊:Nature(IF: 50.5)
单位:美国芝加哥西北大学范伯格医学院麻醉学,神经科学,休·诺尔斯听力及其疾病临床和基础科学中心。
发表时间:2022年5月


摘要:
耳蜗利用两种类型的机械感觉细胞来感知声音。一排内毛细胞(IHCs)通过与神经元形成突触,将感觉信息传递给大脑,而三排外毛细胞(OHCs)则选择性地放大听觉输入。到目前为止,已有两个转录因子被证实在OHCs的特定分化中起重要作用,然而尚未有转录因子被证实参与IHCs的分化。其中INSM1是OHCs的一种转录因子,在关键的胚胎期起作用,以巩固OHC的命运,防止OHCs转分化为IHCs。在缺乏INSM1的情况下,胚胎期的OHCs错误表达一组IHC特异性基因,该研究预测这些基因参与IHC的分化。该研究发现,Tbx2是小鼠IHC与OHC分化的主要调控因子。在胚胎期IHCs中敲除Tbx2导致它们发育成OHCs,表达早期OHC标记物,如Insm1,并最终在IHCs的位置产生完全成熟的OHCs。此外,Tbx2对Insm1具有上位性:在这两个基因都缺失的情况下,耳蜗仅产生OHCs,这表明TBX2对于INSM1缺乏OHCs异常转分化为IHCs以及IHCs的正常分化都是必要的。在出生后、大部分已分化的IHCs中敲除Tbx2会使它们直接转分化为OHCs,用成熟而非胚胎期OHCs的特征取代IHCs的特征。最后,在OHCs中异位表达Tbx2导致它们转分化为IHCs。因此,Tbx2对于使IHCs与OHCs区分开来以及在整个发育过程中维持这种差异既是必要的也是充分的。
主要研究方法:
1. 模式动物:loxP-flanked Tbx2F mice. loxP-flanked Insm1F mice. Fgf8creER; Tbx2F/F; R26LSL-tdTomato/+ mice. Atoh1cre; Tbx2F/F; Insm1F/F mice.
2. 小鼠组织制备、RNA 位杂交以及免疫组织化学技术;
3. 基底膜外植体培养和AAV转染技术;
4. 听力测试和全细胞膜片钳记录技术。
主要研究思路导图(图1):
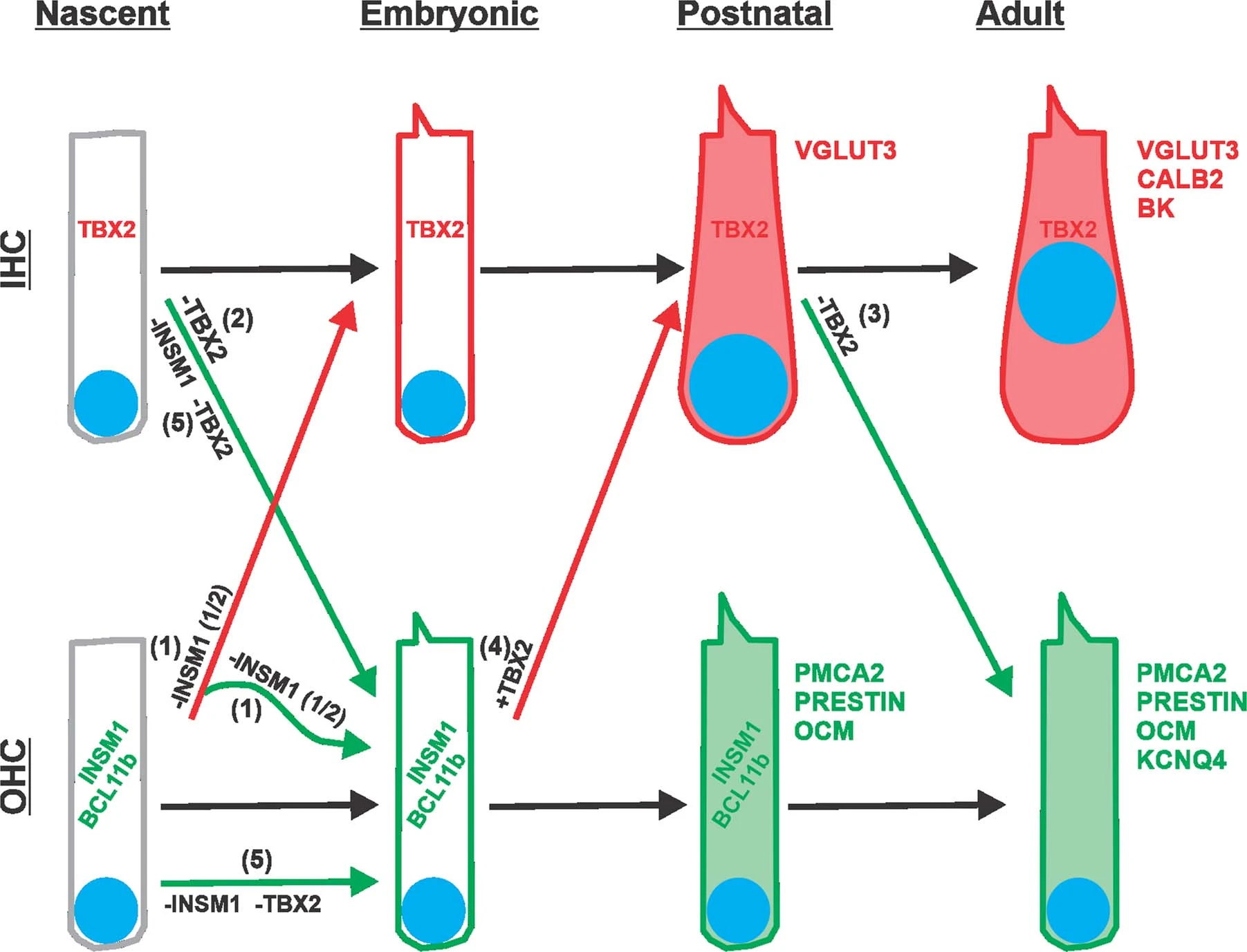 图 1:IHC和OHC之间不同干预下的转分化示意图。
图 1:IHC和OHC之间不同干预下的转分化示意图。
IHC(红色)和OHC(绿色)的分化从祖细胞增值停止后开始(E14.5),通过胎期(E15.5-E20.5)和出生后(P0-P9)阶段,直至分化为成熟状态。随着分化的进行,毛细胞获得越来越多的特征标记(正常发育的过程用黑色箭头表示)。IHC从一开始就表达TBX2,并贯穿其一生。OHC在胚胎和产后早期短暂表达INSM1和BCL11b。
(1) 从新生OHC中去除 INSM1 导致约一半表达TBX2并转分化为早期 IHC(红色箭头),然后继续分化为成熟IHC。缺乏OHC的INSM1的另一半不表达TBX2,并继续分化为成熟的OHC(绿色);
(2) 从 IHC 形成开始去除TBX2导致其像OHC样分化,瞬时表达早期标记INSM1和BCL11b,并最终成为OHC;
(3) 从出生后(直至P9)的IHC中去除TBX2导致其直接转分化为成熟的OHC,而不表达INSM1和BCL11b早期OHC标记,并且暂时共表达成熟IHC (VGLUT3) 和OHC(PMCA2和Prestin)的标记物;
(4) 晚期胚胎OHC中TBX2的异位表达导致其转分化为IHC(表达VGLUT3,但不表达PMCA2或Prestin);
(5) 在INSM1和TBX2均敲除的情况下,新生IHC转分化为OHC,而新生OHC不会转分化为IHC。
主要研究结果:
1、Tbx2 mRNA在耳蜗中的表达定位
通过原位杂交,发现Tbx2 mRNA在小鼠耳蜗中层的IHC和其他上皮细胞类型中表达,包括Corti器内测的支持细胞、Kölliker器官、齿间细胞螺旋缘、Reissner’s膜、血管纹、螺旋突和Claudius细胞。相比之下,在Corti器外侧的细胞(OHC、Deiters细胞以及Hensen细胞)中检测到很少或没有检测到Tbx2 mRNA(图1a、d、f)。在缺乏INSM1的情况下,胚胎OHC表达一小组IHC特异性基因,包括Tbx2。Tbx2仅在缺乏INSM1且转分化为 IHC 的那些OHC中错误表达(图1b、c、e、g)。在发育早期,所有表达Tbx2的缺乏INSM1的 OHC也表达功能性IHC标记物Vglut3(图1f–h)。基于早期Tbx2表达与IHC转分化之间的完全相关性,并且由于TBX2是参与各种细胞类型分化的转录调节因子,推测TBX2将是调节IHC分化的关键因素。
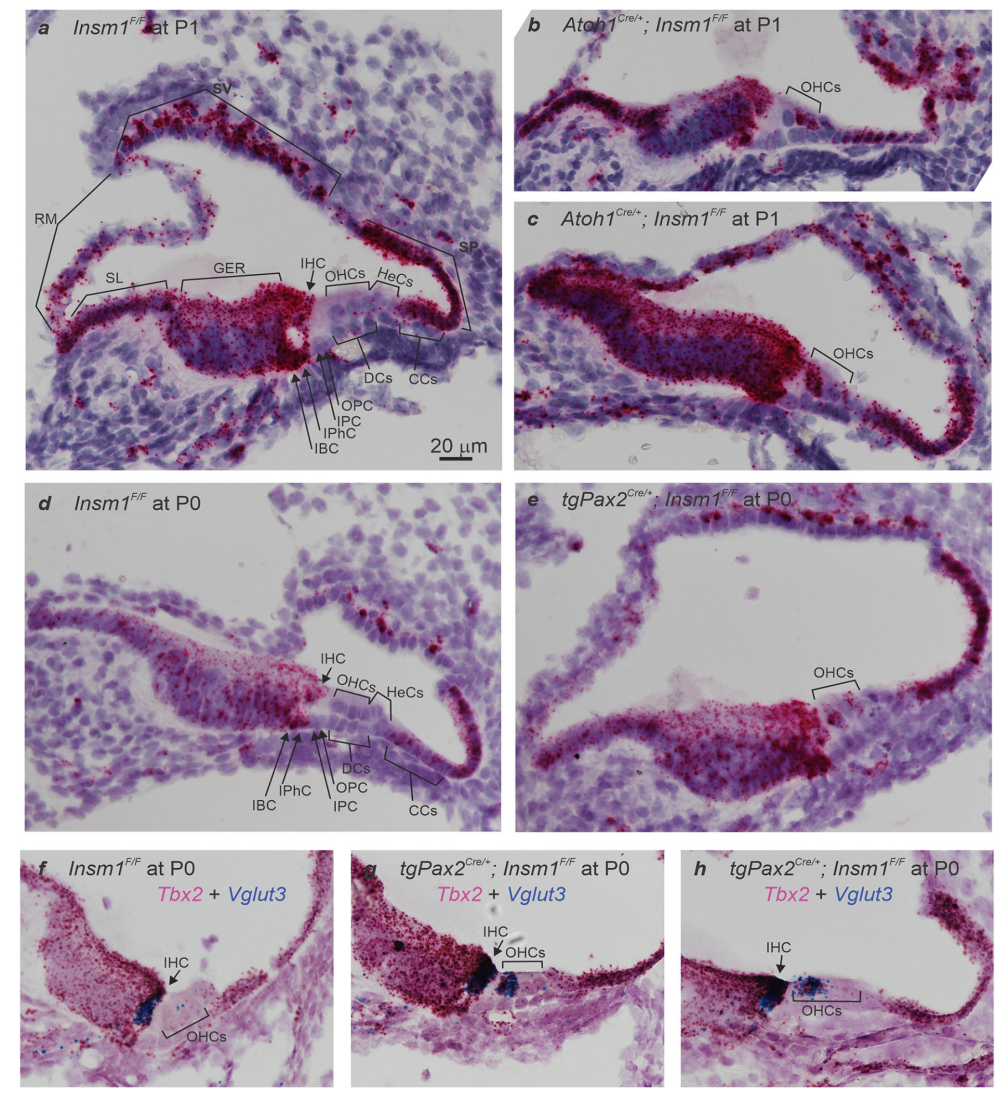
图 2: Tbx2 mRNA在耳蜗中的表达定位
2、胚胎期敲除Tbx2导致IHC发育为OHC
在胚胎第13.5天(E13.5),用Atoh1cre条件性敲除Tbx2,产生的胚胎中所有毛细胞在IHCs位置表达早期OHC标记物Insm1和Bcl11b以及早期IHC标记物Fgf8、Brip1和Msx1下调(图2a-e')。在成熟小鼠中,用Gfi1cre进行条件性敲除Tbx2,这些小鼠觉脑干反应(ABR)消失IHC(图 2f)。在这些小鼠中,IHC位置的耳蜗毛细胞显示出OHC的所有分子、解剖学以及生理特征,但没有IHC的任何特征。这些细胞表达OHC标记物,例如动力蛋白、OCM、 KCNQ4 以及 PMCA2。然而,它们缺乏IHC标记物,例如囊泡谷氨酸转运蛋白VGLUT3、钙缓冲液CALB2、大钾 (BK) 通道和核 CtBP2(图2g-p')。从解剖学上讲,这些细胞类似于OHC,具有圆柱形而不是烧瓶形状,静纤毛具有不太强烈的鬼笔环肽标记(图2o-p'),并且抗CtBP2标记的突触带数量减少抗体(图2n、n')。尽管这些毛细胞处于IHC的正常位置,但它们在分子和解剖学上表现为OHC;将它们称为ic-OHC。因此,在缺乏TBX2的情况下,在IHC位置产生的毛细胞分化为OHC,这表明IHC需要TBX2才能发育为与OHC不同的细胞。

图 3: Tbx2的敲除导致在IHC的位置产生OHC
为了确定 ic-OHC是否显示OHC而不是IHC的生理特征,作者通过Fgf8creER; Tbx2F/F; R26LSL-tdTomato/+ 小鼠获得荧光标记的ic-OHC,然后进行全细胞膜片钳记录。结果发现ic-OHC显示出OHC(KCNQ4介导的IK,n)的基底外侧电流特征,但不显示IHC(BK介导的IK,f)的基底外侧电流特征(图2q,r)。值得注意的是,电压变化表明ic-OHC具有OHC的电动性特性(图2s,t)。因此,结果表明,Tbx2基因敲除产生的ic-OHC是功能性OHC。
3、Tbx2对Insm1具有上位性
作者进一步研究了IHC到OHC的转换是否需要INSM1表达以及OHC到IHC的转换是否需要TBX2。作者在Atoh1cre; Tbx2F/F; Insm1F/F 小鼠中,发现Tbx2对Insm1具有上位性:没有一个OHC转分化为 IHC,且所有IHC都转分化为OHC(图3)。这一结果与INSM1在 OHC分化中的可有可无的性质一致:虽然去除INSM1会使OHC易于成为IHC,但这些细胞超过一半会分化为成熟的OHC。尽管INSM1被认为可以阻止胚胎OHC对IHC诱导信号做出反应,但它对OHC分化并不是必需的。相比之下,在正常IHC形成过程中以及通过缺乏INSM1的OHC进行异常转分化时,TBX2对于IHC分化是必需的。
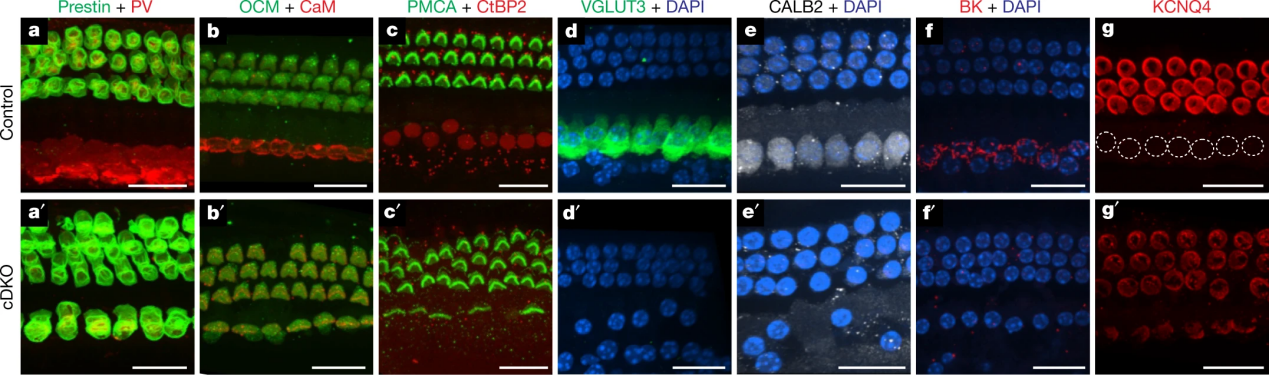
图4:Tbx2对Insm1的上位性
4、Tbx2对IHC的分化和维持都是必须的
出生时,IHC已处于分化的晚期阶段,表达功能成熟IHC的标记物,例如 VGLUT3。出生后敲除TBX2(图 1q-t)导致这些细胞变成OHC,表明为了使IHC继续分化并维持,TBX2不仅在IHC开始分化时是必需的,在随后的继续分化并维持也是必需的。在Fgf8creER; Tbx2F/F; R26LSL-tdTomato/+ P0时注射他莫昔芬,去除部分分化IHC中的TBX2;导致这些IHC转化为ic-OHC(图 4)。耳蜗切片的原位杂交显示(P1-P8),大多数IHC转化为OHC不表达早期OHC标记物Insm1和Bcl11b2。此外,SOX2在支持细胞中表达,也在正常胚胎发生过程中产生的新生毛细胞中短暂表达,同时也在出生后从支持细胞转分化的细胞中表达,但这些转分化细胞中却不表达SOX2。此外,同一阶段的免疫组织化学显示,在Tbx2敲除(P0)后的几天内,转化为OHC的IHC从P1开始表达OHC标记物 PMCA2,从P4开始表达动力蛋白,同时仍然表达IHC标记物VGLUT3,直到P8。因此,与胚胎时缺失TBX2的IHC分化为OHC(图2)不同,这些转分化细胞从IHC转换为OHC,而没有重现OHC分化。
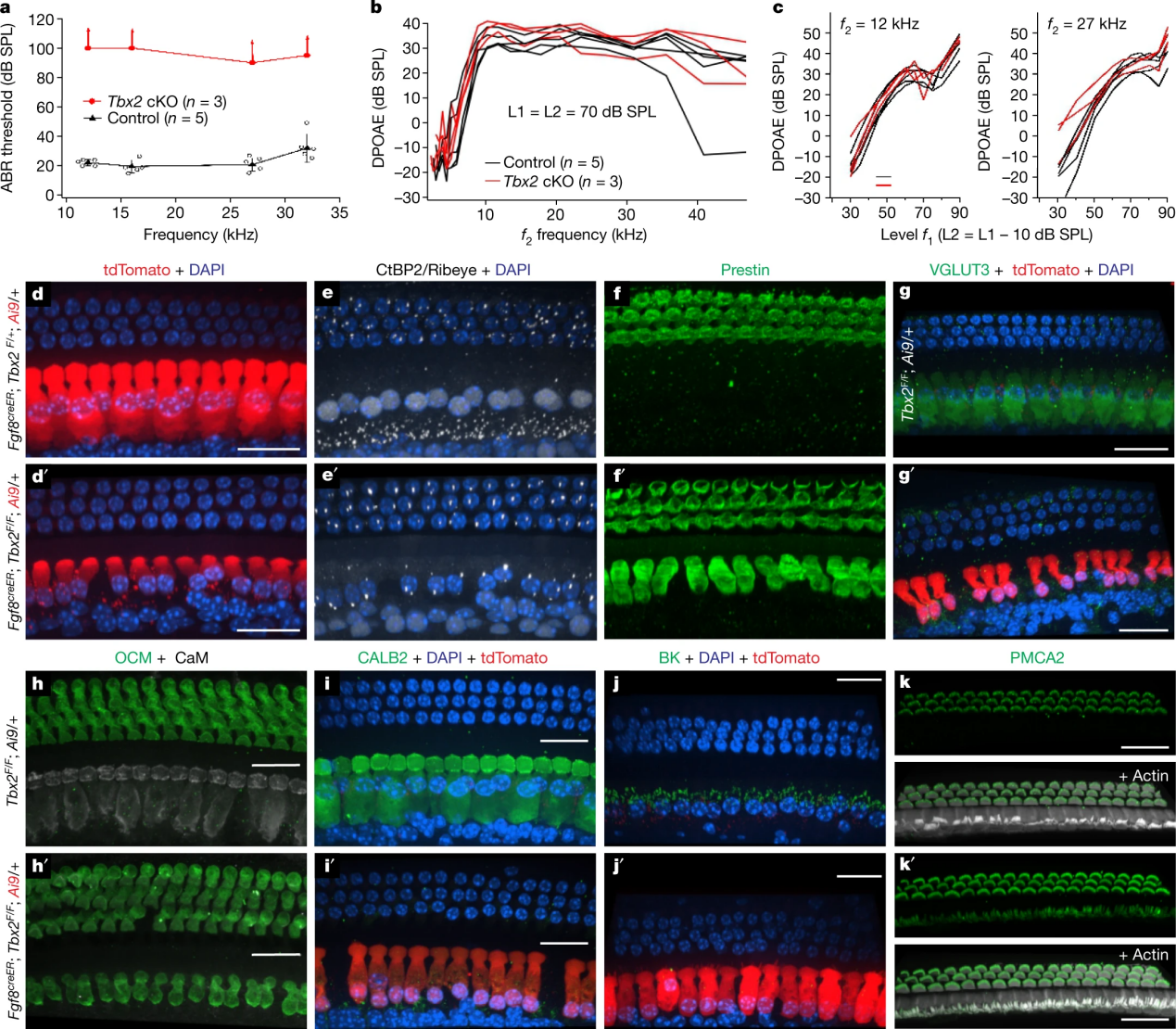
图 5: 胚胎晚期或出生后敲除Tbx2基因导致IHC转分化为OHC
由于IHC中TBX2表达是永久性的,作者进一步探究了IHC分化的后期阶段是否仍然需要TBX2。IHC在大约E15.5的胚胎中开始在耳蜗基底部分化,并在出生后继续分化。对 Fgf8creER; Tbx2F/F; R26LSL-tdTomato/+小鼠进行单次他莫昔芬给药;P0、P3、P7和P9的小鼠在1天后开始在所有IHC中导致tdTomato的Cre依赖性表达。Tbx2的敲除导致IHC几乎完全转分化为OHC。具体来说,细胞失去了IHC标记物VGLUT3、CALB2、BK 和核CtBP2的表达;获得OHC标记动力蛋白、oncommodulin和PMCA2的表达;与OHC一样,CtBP2+突触带很少;缺乏IHC的烧瓶形状特征,并显示与OHC一样位于毛细胞基底部的小核,而不是IHC位于细胞中部的较大核(图4d-k')。然而,这些出生后转分化的毛细胞在某一方面与OHC不同:尽管表达OHC标记物PMCA2,但它们的静纤毛具有IHC静纤毛的整体外观(图4k、k')。这可能是因为静纤毛一旦形成,其形状和排列便不可逆转。在小鼠耳蜗中,毛细胞静纤毛在胚胎到出生后早期的关键时期发育,并且一旦丢失,就不会重新形成。因此,一旦这些静纤毛形成,耳蜗毛细胞可能就无法改变它们的静纤毛大小和成束排列,与这种细胞器缺乏可塑性的情况相一致。然而,值得注意的是,出生后敲除Tbx2 后,IHC已经存在的特征会逐渐丢失,而OHC的特征逐渐增加。因此,除了在胚胎发生过程中启动IHC特异性分化所必需之外,TBX2在整个出生后阶段(至少到 P9)也是必需的,以便IHC继续表达其已获得的特征并阻止其表达OHC的分子特征;也就是说,IHC需要TBX2来维持其分化状态。
5、TBX2的异位表达导致OHC转化为IHC
前面作者已经证明从IHC中去除TBX2会将其转化为OHC,并且从缺乏INSM1的OHC中去除TBX2会阻止它们转化为IHC;作者进一步探索,向OHC中添加TBX2是否会使它们成为IHC。作者设计了表达TBX2-IRES-mCherry 的腺相关病毒(AAV;Anc80血清型)。从P1 Fgf8creER; Tbx2F/F; R26LSL-tdTomato/+小鼠中获得基底膜培养物;体外给予4-羟基他莫昔芬和AAV,并在7天后检查毛细胞。缺乏TBX2的未转染IHC分化为OHC并表达动力蛋白,而通过mCherry表达鉴定的转染IHC并未转分化,因为它们不表达动力蛋白(图5a,a')。因此,异位TBX2补偿了IHC中内源TBX2的去除。然后,作者又转染了野生型耳蜗外植体,发现表达mCherry(即TBX2)的OHC也表达IHC标记物VGLUT3(图5b,b')并下调OHC标记物prestin(图5c,c')和PMCA2(图5d)。总之,结果表明,TBX2对于耳蜗毛细胞分化为IHC是必要的,TBX2是IHC与OHC分化的主要调节因子。

图 6: TBX2的异位表达导致OHC转化为IHC
主要结论:
1. Tbx2是内毛细胞分化的必要且充分条件;
2. Tbx2的缺失导致内毛细胞转变为外毛细胞;
3. Tbx2在内毛细胞的发育和维持中持续起作用。
原文链接:https://doi.org/10.1038/ s41586-022-04668-3.

汇报人:张玉忠
导师:赵宇,袁慧军,程静
审核:胥飞宇、毛敏姿、任建君



