精读分享│【Clinical investigation】:来自终末期肾病或肾移植患者的体外扩增的天然调节性T细胞可用于自体细胞治疗
英文题目:Ex vivo expanded natural regulatory T cells from patients with end-stage renal disease or kidney transplantation are useful for autologous cell therapy
中文题目:来自终末期肾病或肾移植患者的体外扩增的天然调节性T细胞可用于自体细胞治疗
期刊:Clinical investigation(IF=14.8)
单位:柏林-勃兰登堡再生治疗中心,德国柏林查理特大学医学院
发表时间:2018-06

摘要
利用自体、体外扩增的天然调节性T细胞(natural regulatory T cells,nTreg)进行过继转移的新概念具有预防肾移植术后器官排斥反应的潜力。然而,透析和维持免疫抑制对nTreg表型和外周存活的影响尚不清楚,但在评估患者资格时至关重要。本研究探讨了透析和肾移植患者的调节性T细胞,以及从这些患者中产生临床有用的nTreg产品的可行性。对200例健康人、终末期肾病透析患者及肾移植术后1、5、10、15、20年患者的肝素抗凝血进行分析。采用流式细胞术检测nTregs的分化及成熟情况,以比较透析患者和接受肾移植并维持免疫抑制的患者与健康对照者之间的差异。在透析患者中,检测到表达CD127的CD4+CD25highFoxP3+ nTregs的频率增加,并且对nTreg终产物的质量和体外扩增的nTregs的治疗效果没有负面影响。此外,尽管免疫抑制轻微地改变了nTreg的成熟,但透析、药物免疫抑制或既往急性排斥反应并未阻碍nTreg在体内的存活。因此,制备自体的、高纯度的nTreg产品是可行的,并使等待或已接受同种异体肾移植的患者符合接受过继性nTreg治疗的标准。因此,本研究开发的新型治疗方法可能有助于减少器官排斥反应的发生率,并减少长期免疫抑制的需求。
研究背景
近几十年来,同种异体肾移植已成为终末期肾病(ESRD)患者的首选治疗方法。随着终身免疫抑制策略的实施,我们成功预防了早期排斥反应,并显著提高了患者的生活质量和短期生存率。然而,这些成就具有两面性,我们已经用短期利益换来了机会性感染、严重病毒感染、恶性肿瘤和与移植排斥相关的毒性移植物衰竭等重大风险,但未能有效地防止慢性排斥反应。
随着对调节性T细胞(regulatory T cells,Tregs)作为免疫稳态调节介质的认识迅速增加,人们越来越相信Tregs可以作为新一代免疫调节治疗的合理靶点。在过去的几年中,Tregs被认为是在自身炎症、感染、移植和实体肿瘤中耐受的关键介质。相反,传统T细胞(Tconv)相对于Tregs的绝对或相对优势与自身炎症和移植排斥有关。尽管已经取得了大量进展,且目前正在进行试点研究,但Tregs的广泛治疗应用尚未实现。
Tregs群体已经发展成为一个具有多个亚群的大家族。每个亚群都具有独特(尽管部分重叠)的表型标记组成,并显示特定的内源性细胞因子谱。然而,作为调节细胞的分类是基于共同的功能特征,包括T细胞受体(TCR)依赖性抑制Tconv的增殖和细胞因子的释放。在CD4 + T细胞中,有4个Treg细胞亚群:(i)天然Treg细胞(nTregs)先天存在,并在胸腺中发育成熟;(ii)诱导性Treg细胞,起源于Tconv,在特异性TCR激活后可发育成熟,并瞬时表达FoxP3和功能性Treg特征。(iii)分泌白细胞介素(IL)-10的1型Tregs和(iv)产生转化生长因子-β的T辅助细胞3型细胞来自于诱导性Tregs相同的祖细胞,表现出相当的抑制能力,但FoxP3表达为阴性。在接下来的讨论中,本研究将nTregs作为一个稳定的、胸腺来源的调节性T细胞群体进行重点讨论。
最近有几项研究关注ESRD患者和肾移植后(KTx)的nTregs。尽管有大量证据表明人类nTregs可以控制KTx中的同种异体反应性,但尚不清楚ESRD患者是否适合接受自体nTreg疗法;相应地,持续的同种异体激活和标准的维持免疫抑制对循环nTregs的表型和功能特征的影响仍有待阐明。
在干细胞移植情景下存在多种过继性nTreg治疗方案,通常有匹配的健康供者,可以作为合格的nTreg来源。相比之下,在实体器官移植中,通常没有匹配的健康Treg供体,为了从慢性病患者或免疫抑制患者中制造自体nTreg,还需要克服几个额外的障碍。最重要的是,虽然第三方的nTreg产品原则上可行,但找到人类白细胞抗原匹配的nTreg供体的可行性在结构上不能保证。因此,目前实体器官移植中nTreg的治疗方案是基于自体方案,使用体外扩增的nTreg。因此,本研究旨在研究慢性ESRD患者是否适合接受自体nTreg疗法,以及在免疫抑制治疗下nTreg的发育情况。后者对于评估过继性移植nTreg在免疫抑制宿主中的作用及移植后期自体nTreg治疗是否可行具有重要作用。为此,本研究首先研究了ESRD患者循环nTregs,并进一步探讨了免疫抑制状态下患者外周nTregs亚群的变化过程。未来,过继性nTreg治疗的实施可能使我们能够显著减少或完全撤销维持免疫抑制治疗,并最大限度地降低移植物排斥反应、药物毒性和感染易感性的风险。
研究设计流程图
研究结果
1.尽管ESRD和移植术后CD4+淋巴细胞增多,但CD4+CD25highFox P3+ nTreg频率在疾病期间和维持免疫抑制状态下保持稳定
对健康对照(HCs)、ESRD患者和18-87岁之间的KTx患者(图1和图2a-l)的新鲜收集的血液进行淋巴细胞分析。患者特征见表1。
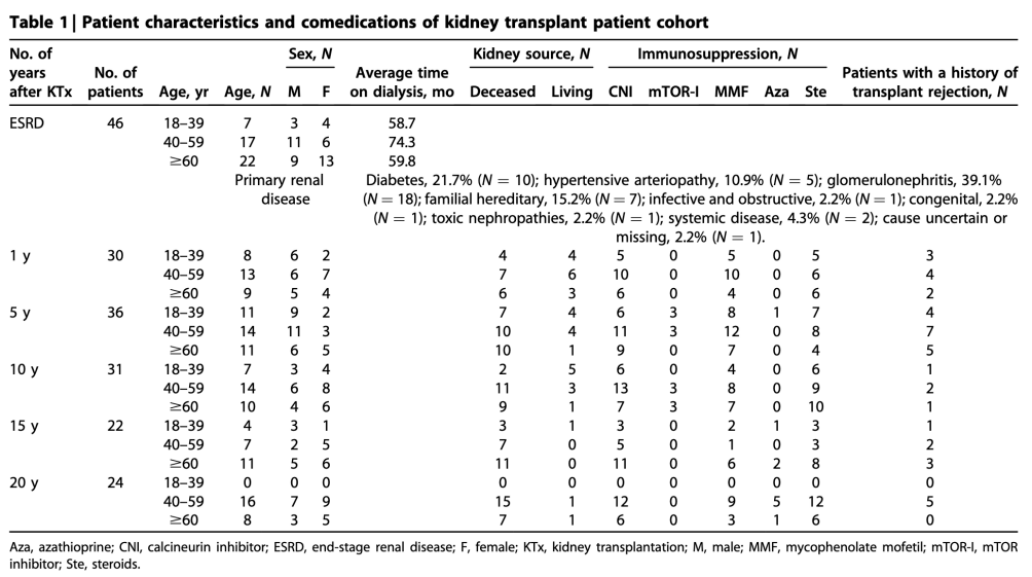
表1
所有KTx患者均接受长期维持免疫抑制的联合治疗。选择了两个具有代表性的患者作为例子以展示图2-4描述的结果所使用的门控策略(图1)。总CD3+淋巴细胞频率在正常对照和所有患者组之间相当(图2a),而ESRD和KTx患者均表现为轻度CD4+淋巴细胞减少(图2b)。nTreg频率在ESRD和KTx患者中似乎略有升高,尽管这种影响没有统计学意义(图2c)。由于mTOR抑制剂之前被认为可以增加循环nTregs的数量,本研究进一步探索了用于维持治疗的免疫抑制剂的药物特异性效应。有趣的是,没有观察到药物特异性的差异。特别地,无论是mTOR抑制剂还是钙调磷酸酶抑制剂,还是霉酚酸酯、类固醇和硫唑嘌呤,都没有改变体内CD3+(图2e)、CD4+(图2f)或调节性T细胞(图2)的频率。然后,本研究使用CD45RA作为由未接触其TCR特异性抗原的幼稚、无反应性T细胞表达的标记物来评估nTreg的成熟。在本研究中,接受维持免疫抑制的KTx患者的幼稚CD45RA+nTreg数量倾向于增加,这表明nTreg成熟部分受损(图2d)。这一现象再次独立于免疫抑制剂(图2h)和既往急性排斥反应发作次数(图2i-l)。
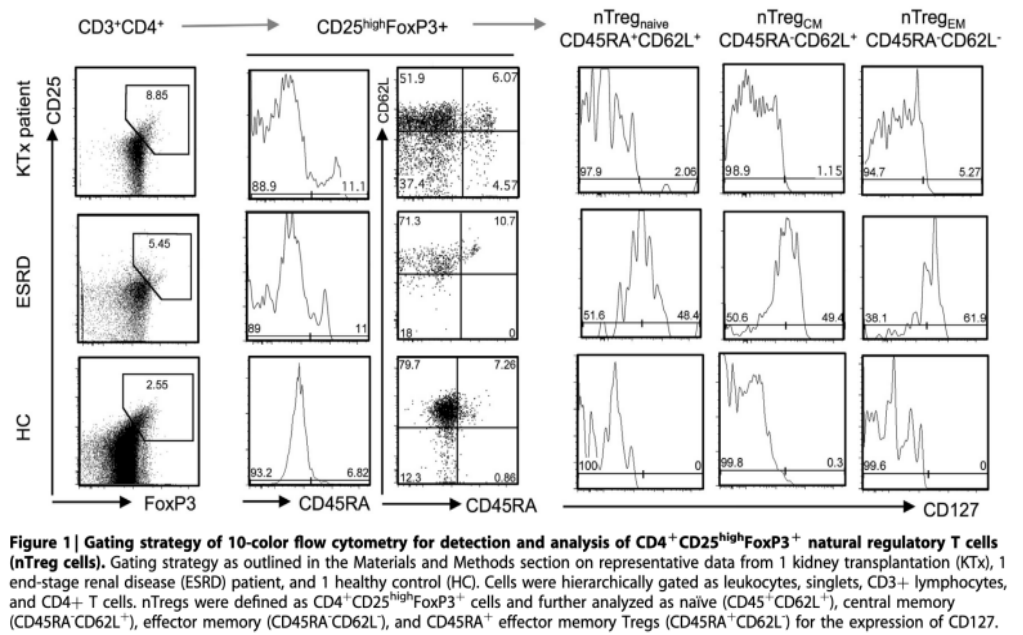
图1
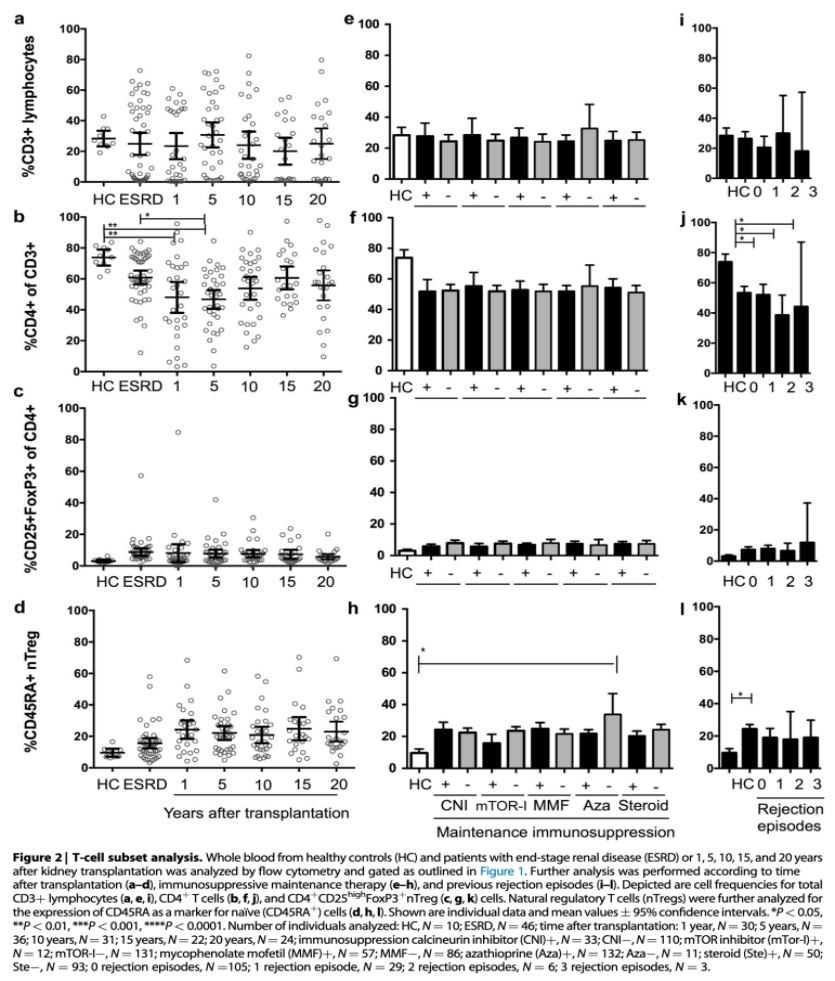
图2
2.KTx患者表现为原始记忆和效应记忆nTregs频率增加,而中枢记忆nTregs频率减少
为了进一步研究nTreg的成熟,本研究评估了额外的原始和记忆成熟状态(图3a-j)。CD62L表达于幼稚T细胞;激活后,CD62L通过高内皮小静脉介导T细胞募集到外周淋巴器官。随后,CD62L表达减弱,CD62L-细胞被视为“抗原经验丰富的”。相应地,无反应的幼稚细胞为CD45RA+CD62L+(TNAIVE),而中枢记忆性T细胞缺乏CD45RA表达,转变为CD45RA-CD62L+(TCM)表型。这些细胞可以被募集到淋巴结,在那里它们成熟为效应记忆T细胞,定义为CD45RA-CD62L-(TEM)。在本研究的KTx患者队列中,与正常对照和ESRD患者相比,nTregNAIVE (图3a)和nTregEM(图3c)升高,而nTregCM显著降低(图3b)。这些发现独立于维持免疫抑制方案(图3d-f)和先前的排斥反应(图3g-i)。没有观察到药物特异性的改变,虽然nTregEM的数量似乎与排斥反应的发生频率相关,但这种影响没有统计学意义(图3i)。图3j总结了T细胞亚群标记物和nTregNAIVE、nTregCM和nTregEM在本研究的队列中的具体分布。为了排除在KTx患者中观察到的nTreg亚群成熟偏移是继发于由在Tconv中持续的异体刺激和持续的外周FoxP3上调所致的移植相关效应,本研究继续评估了CD127在所有nTreg亚群中的表达。
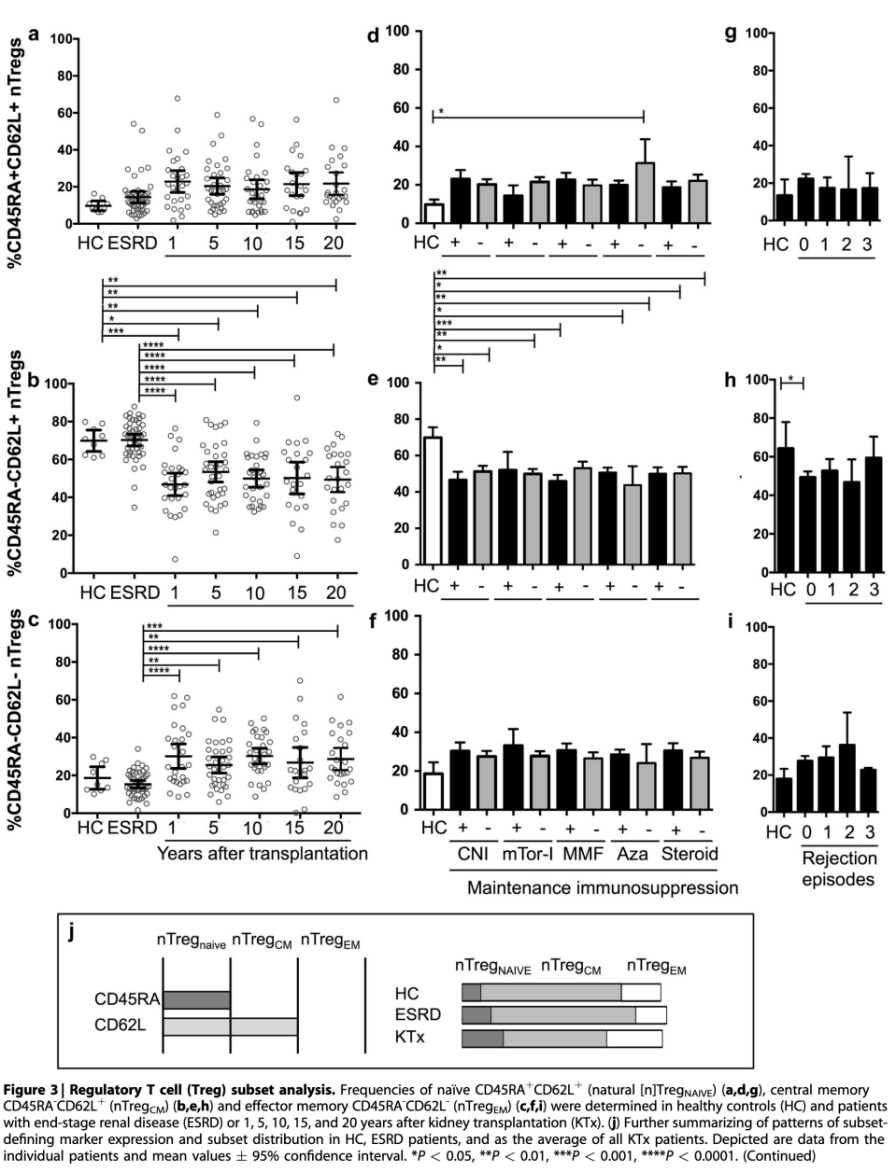
图3
3.ESRD患者表达缺乏效应细胞特征的CD127D+nTregs
2006年,低表达IL-7受体CD127被引入作为nTreg的特定特征,并与FoxP3在这些细胞中的表达相关,反之,CD127在CD3+中的高表达后来与KTx患者的活化T细胞和排斥反应相关,并且在Tconv中可以发生活化诱导的CD127和FoxP3的共表达。据此,本研究分析了幼稚型和记忆型nTreg亚群CD127的表达情况。有趣的是,与正常对照相比,CD127在KTx患者中的表达并没有升高(图4a-c)。这有力地表明,nTregEM增加并不是由于外周Tconv中激活依赖的FoxP3表达增加,而是由于nTregs从中央记忆向效应记忆表型的成熟增加。根据之前的排斥事件,本研究通过数据分析证实了这些观察结果(图4d-f)。尽管在KTx患者中,CD127表达增加的nTregs循环频率似乎与既往排斥反应次数相关,但这种影响并不具有统计学意义。然而,与预期相反,本研究观察到ESRD患者所有nTreg亚群(图1和4a-c)的CD127表达显著增加。因此,由于在针对过继性nTreg治疗时,CD127+细胞的耗竭被认为可以改善nTreg的产物,因此本研究进一步对ESRD中的CD127+细胞进行了表征。
CD154又被称为CD40配体,是表达于T、B细胞上的肿瘤坏死因子超家族成员。它可以与其抗原呈递细胞上的配体CD40结合,在TCR依赖的信号传导和T、B细胞成熟(在Grewal et al)中起共刺激分子的作用。在先前的研究中,CD154在TCR刺激下在Tconv上显著上调,并且对于抗原特异性CD4+效应T细胞的发育是必不可少的。此外,已经证明nTregs可以表达CD154,但与Tconv相比,这种表达几乎是不可诱导的。因此,本研究评估了CD154在静息和TCR特异性激活的细胞中的表达。原始数据在图4g中描述了每个队列的2个代表性供体,总结在图4h中:正常对照和ESRD患者的Tconv在刺激时CD154强烈上调,尽管CD154上调在正常对照中明显强于ESRD患者。相反,在ESRD和正常对照的CD4+CD25highFoxP3 +nTregs上几乎检测不到CD154的上调(图4h)。这证实了表达CD127的nTregs表型和功能的稳定性(图4a-c)。有趣的是,活化诱导的CD154在Tconv上的表达是可以检测到的,但在ESRD患者中与正常对照相比显著降低(图4h)。
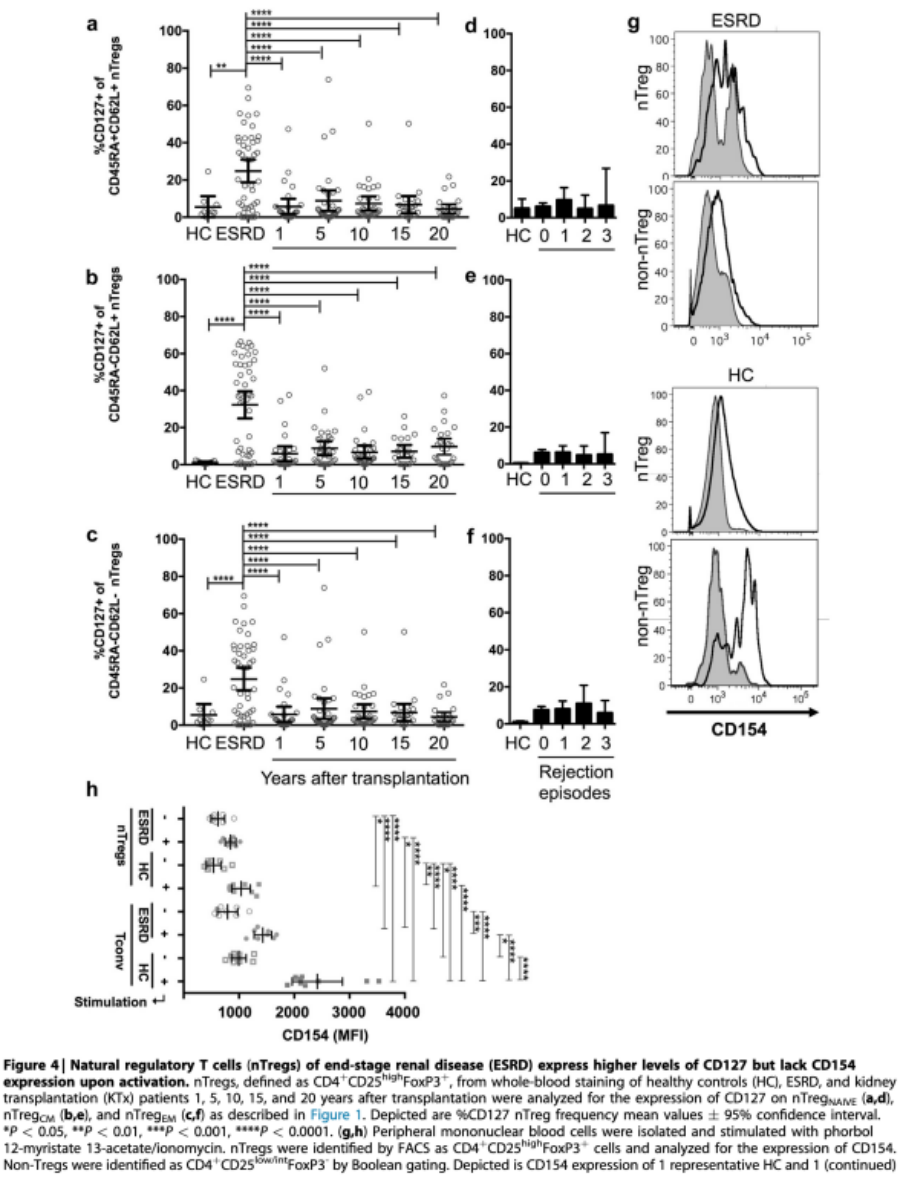
图4
4.ESRD患者自体nTreg产品的产生是可行的
最后,为了证明ESRD患者自体nTreg治疗的适应症,从ESRD患者的外周血中收集50毫升血液。健康志愿者作为独立对照(图5a-e),使用CliniMACS分离ESRD患者和正常对照的nTregs,并在Good Manufacture Practice洁净室条件下进行多克隆扩增。在本研究的实验中,来自ESRD患者的nTregs迅速扩增,细胞数量部分超过了健康志愿者的nTregs培养物产量(图5a)。所有独立于原发肾脏疾病的ESRD患者之间的扩张率、产量和纯度具有可比性。此外,终产物的纯度,定义为终产物中的CD25high Fox P3+细胞,与正常对照的nTreg培养物和先前公布的数据(图5b和c)相当。为了排除Tconv或诱导性Tregs的存在,这些Tregs可能短暂表达CD25和FoxP3,但可以通过激活时效应细胞因子的特征性形成来区分,用佛波酯13-乙酸酯/离子霉素刺激细胞,并分析IL-2和干扰素-γ。本研究发现,与正常对照相比,ESRD患者的IL-2和IFN-γ产生细胞的数量略高,但仍然很低(图5c)。此外,从ESRD患者体外扩增的nTregs中几乎检测不到CD127的表达(图5d)。最后,在混合淋巴细胞反应中测定nTreg细胞产物在功能水平上抑制效应T细胞活化的能力。效应T细胞活化后上调CD154和CD69,可作为替代标志物。本研究发现ESRD患者来源的nTregs以剂量依赖的方式有效抑制效应T细胞CD154和CD69的上调。抑制能力与本团队之前报道的来自健康供体的数据一致(图5e)。综上所述,这些数据表明,从透析依赖的ESRD患者体内生成自体nTregs是可行且安全的。移植前血液透析可检测到CD127+ nTregs水平升高,但在扩增过程中不构成安全性问题。
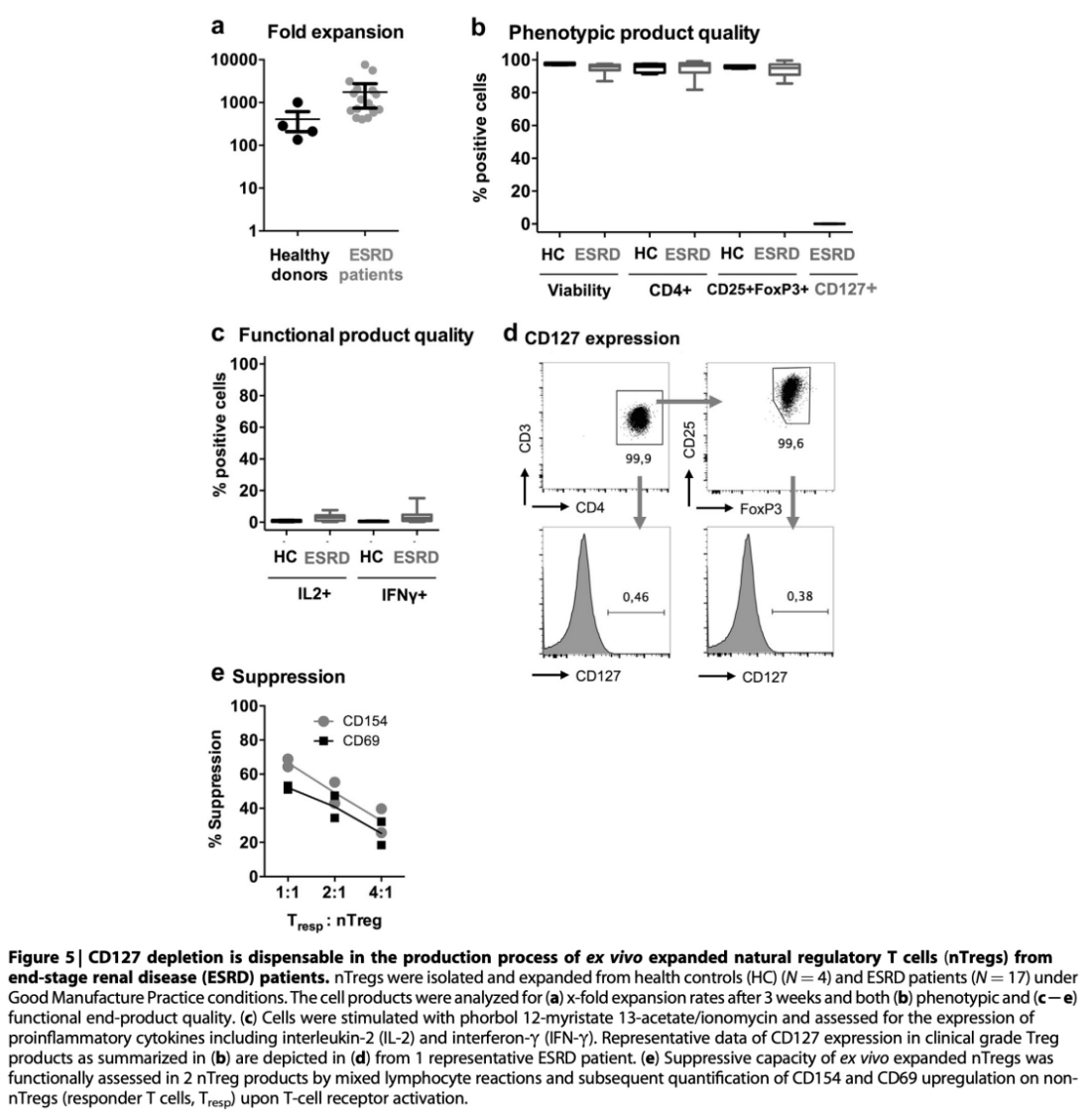
图5
研究结论:
制备自体的、高纯度的nTreg产品是可行的,并且过继性nTreg治疗适用于等待或已接受同种异体肾移植的患者。未来,实施过继性nTreg治疗可能使我们能够显著减少或完全撤销维持免疫抑制治疗,并最大限度地降低移植物排斥反应、药物毒性和感染易感性的风险。

汇报人:李向东
导师:陈飞
审核:周菁、李俊虹、任建君



