精读分享│【Cancer Discovery】:进展期胃癌接受一线氟嘧啶和铂类化疗后的早期反应和肿瘤免疫微环境重塑
英文题目:Early Tumor–Immune Microenvironmental Remodeling and Response to First-Line Fluoropyrimidine and Platinum Chemotherapy in Advanced Gastric Cancer
中文题目:进展期胃癌接受一线氟嘧啶和铂类化疗后的早期反应和肿瘤免疫微环境重塑
期刊:Cancer Discovery(IF=29.7)
单位:韩国首尔成均馆大学、麻省理工学院和哈佛大学的布罗德研究所、马萨诸塞州总医院血液肿瘤科、韩国首尔延世大学、韩国首尔三星医疗中心
发表时间:2022年4月

摘要
化疗在进展期胃癌(AGC)的一线治疗中占据核心地位,然而,接受治疗的患者反应却呈现出显著的异质性,且目前对于影响化疗反应的具体调节因素仍知之甚少。为了推动这一领域的进展,深入了解标准化疗对肿瘤免疫微环境(TME)的影响显得尤为关键。为此,本研究针对未接受过治疗的HER2阳性和HER2阴性进展期胃癌患者,采集了他们的治疗前和治疗中的样本,并进行了全外显子测序、bulk-RNA测序以及单细胞转录组学分析。通过这些综合分析,本研究成功定义了与铂类化疗反应密切相关的特征。研究发现,化疗反应与治疗过程中TME的重塑紧密相关,这包括自然杀伤(NK)细胞的募集、肿瘤相关巨噬细胞的减少、M1型巨噬细胞的复极化,以及效应T细胞的增加。而对于那些对化疗无反应的患者,本研究观察到PD-L1的表达或调节较低或缺失,治疗期间Wnt信号通路增加、B细胞浸润增多,以及表达LAG3的T细胞增加,同时还伴随着树突状细胞的减少。值得注意的是,在早期治疗的样本中,本研究并未观察到显著的基因组变化。综上所述,本研究不仅绘制了标准化疗过程中TME调节的详细图谱,还为未来的治疗策略提供了新的思路和可能的方向。
研究背景
胃癌是全球第五大常见恶性肿瘤。多数患者在初诊时便已处于局部晚期或伴有其他器官转移。近年来,多项国际III期临床试验有力验证了抗PD-1药物与标准一线5-氟嘧啶和铂类化疗联合应用在胃食管癌治疗中的显著疗效,然而其治疗应答率具有显著的异质性。
细胞毒性化疗在AGC的治疗中占据着举足轻重的地位,它不仅能够有效减小肿瘤体积,还能显著缓解患者症状。当前大多数学者认为,化疗与免疫疗法的强强联合有望进一步改善治疗效果。这一理论基于一个核心假设,即细胞毒性化疗具备重塑肿瘤微环境(TME)的潜力,并能有效促进免疫介导的肿瘤杀伤效应,而这种效应在PD-1阻断和抗肿瘤T细胞反应的再激活下将得到显著增强。值得注意的是,包括奥沙利铂在内的铂类药物能够上调树突状细胞(DC)上的PD-L1表达,并在小鼠结肠癌模型中显著增强免疫细胞的浸润。同时,在临床前研究中,抗代谢药物5-氟尿嘧啶(5-FU)也展现出了促进DC抗原呈递和选择性杀伤髓源性抑制细胞(MDSC)的潜力。然而,尽管5-FU和奥沙利铂在临床前研究中展现出了诱导肿瘤微环境中有利免疫条件的巨大潜力,但目前尚无直接证据表明这种情况可同样在患者中发生。因此,对于AGC患者在接受标准5-FU/铂类单药治疗前后TME的详细变化仍知之甚少。
为了解决这些问题,本研究全面深入地分析了接受一线标准化疗但未使用PD-1抑制剂治疗的AGC患者的治疗前和治疗中的活检组织样本。通过运用全外显子测序(WES)、全转录组测序(WTS)、单细胞RNA测序(scRNA-seq)和多重免疫荧光(mIF)等先进技术,对5-FU和铂类化疗前后肿瘤和免疫组分的变化进行了全面解析。本研究提供了高分辨率的数据,展示了在AGC患者在接受标准一线化疗后的应答者与无应答者TME的显著差异。这一研究成果有望为靶向TME的治疗方法提供宝贵的参考和指导,从而进一步扩大受益于化疗及其与免疫疗法联合应用的患者群体。
技术路线
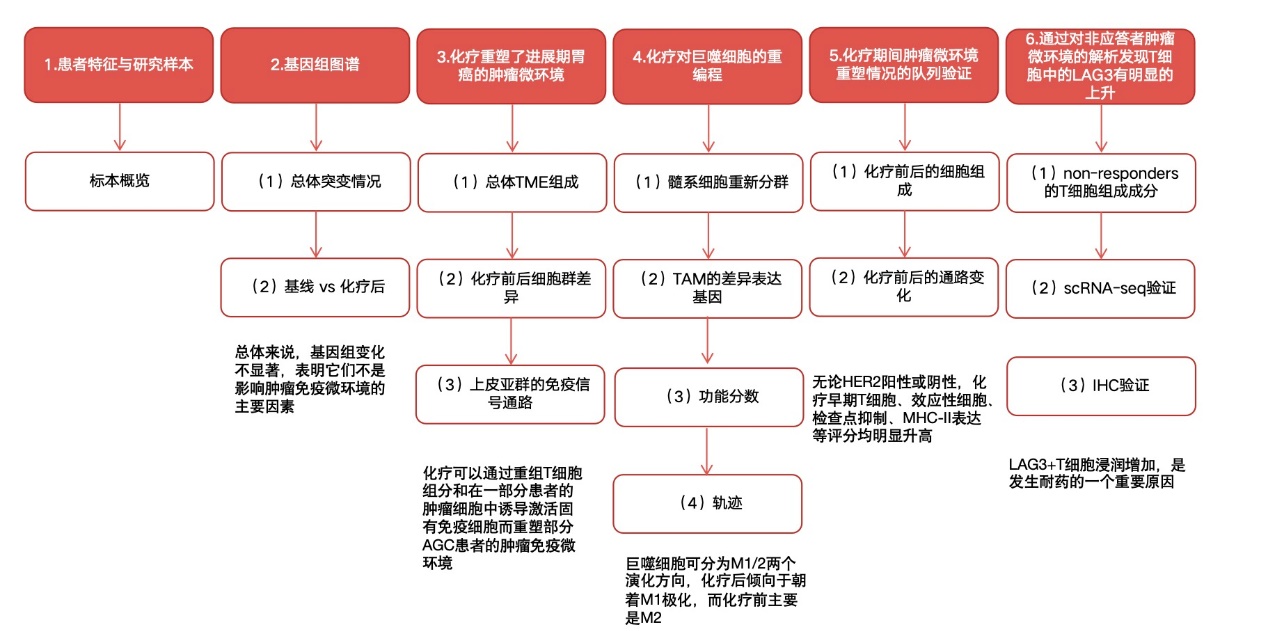
研究结果
1.患者特征与研究样本
本队列由12名于2018年11月至2019年5月期间在韩国三星医疗中心确诊的转移性进展期胃癌(AGC)患者构成,这些患者均接受了一线化疗(如表1所示)。患者的中位年龄为56岁(33岁~75岁)。其中,HER2阳性AGC患者占比41.7%(5名),而PD-L1阳性肿瘤患者占比58.3%(7名)。无患者呈现EB病毒阳性或高微卫星不稳定性(MSI-H)特征。在疗效评估方面,五名患者在接受两周期一线化疗后实现了部分缓解(应答者);三名患者则维持病情稳定,且四名患者病情出现进展(非应答者)(如图1A、1B所示)。
所有患者均进行了化疗前活检,并进行了WES和WTS测序;其中五名患者进行了化疗期间的活检,并进行了WES和WTS。此外,11名患者进行了化疗前的单细胞RNA测序(scRNA-seq),7名患者进行了化疗期间的scRNA-seq(图1A)。
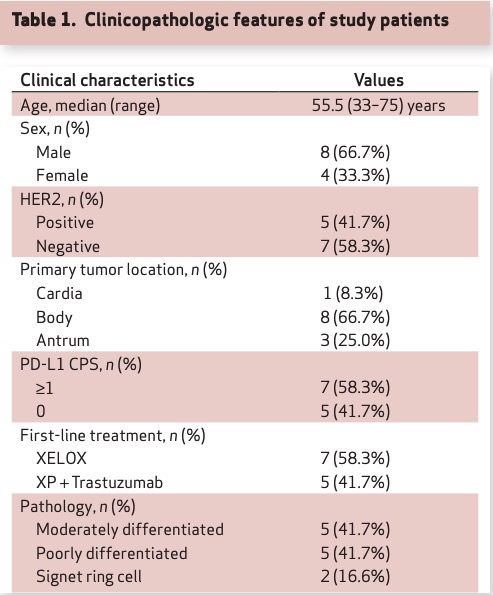
表1 本队列患者的临床病理特征
2.本队列患者的外显子突变图谱
根据TCGA的分类,三名患者具有基因组稳定型(GS)肿瘤,而其余九名患者为染色体不稳定型(CIN)肿瘤。本研究分析了化疗前和化疗中的样本的WES数据,并发现了高可信度的体细胞突变,包括化疗前样本中的1,454个碱基置换和49个插入/缺失突变,以及化疗中样本中的534个碱基置换和18个插入/缺失突变。与先前的报道一致,本研究观察到了在TCGA胃癌队列中富集的基因突变,包括染色质组蛋白修饰因子和转录因子(图1C和D)。TP53、PIK3CA、APC、ELF3、MACF1、ARID2和MSH3基因的突变在化疗前和化疗中样本中均有出现,表明这些克隆突变发生在两个样本的最近共同祖先中,并在治疗过程中保留了这些突变的肿瘤克隆。为了表征在AGC中产生点突变的突变过程,本研究在COSMIC目录中分析了18个AGC组织的WES突变特征(12个化疗前样本和6个化疗中样本)(图1E和F)。大多数单核苷酸置换(SBS)为C>T转换。这些突变谱表明,先前定义的内源性过程突变特征与5-甲基胞嘧啶脱氨基作用和年龄相关,负责AGC的体细胞单核苷酸变异(SNV)。总体而言,经过两个周期的铂类化疗后,观察到的早期基因组变化有限,提示早期突变变化并不是引起后续TME变化的主要因素。
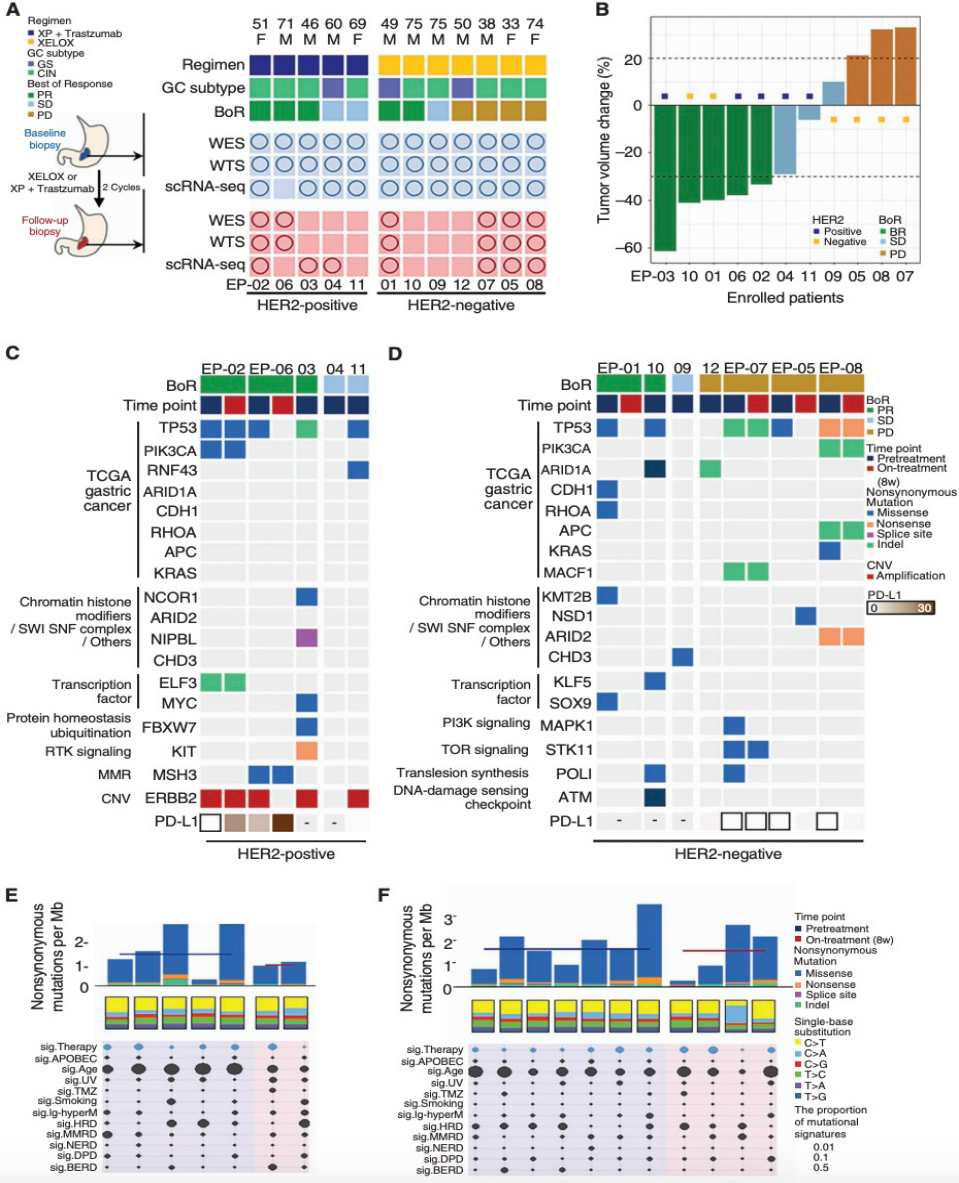
图1
3.化疗将胃癌肿瘤免疫微环境(TME)重塑为具有免疫应答特征
接下来,本研究整合了12个化疗前和6个化疗中样本的RNA-seq数据,以表征化疗前后AGC的免疫微环境。研究者将每个肿瘤样本分类为四种先前研究定义的微环境亚型(免疫耗竭型、纤维化型、免疫富集型、免疫富集/纤维化型)(图2A)。本研究在应答者和非应答者患者之间TME组成上未观察到明显的基线差异(图2A)。基因集变异分析(GSVA;图2B)揭示了治疗前和治疗中的样本在经典通路的基因上显示出不同的富集模式。其中,与M2型巨噬细胞(抗炎、免疫抑制)相关的基因在治疗后样本中显著受抑,表明常规化疗期间M1/M2再极化增加。PD-1通路在治疗中样本中显著激活(P = 0.033),表明卡培他滨联合奥沙利铂(XELOX)或卡培他滨联合顺铂/曲妥珠单抗(XPT)化疗正在重塑AGC的TME。且PD-1通路和炎症小体在治疗中的增加在应答者中更为常见。相反,治疗中Wnt通路的增加在非应答者中富集,这可能会限制T细胞的浸润。
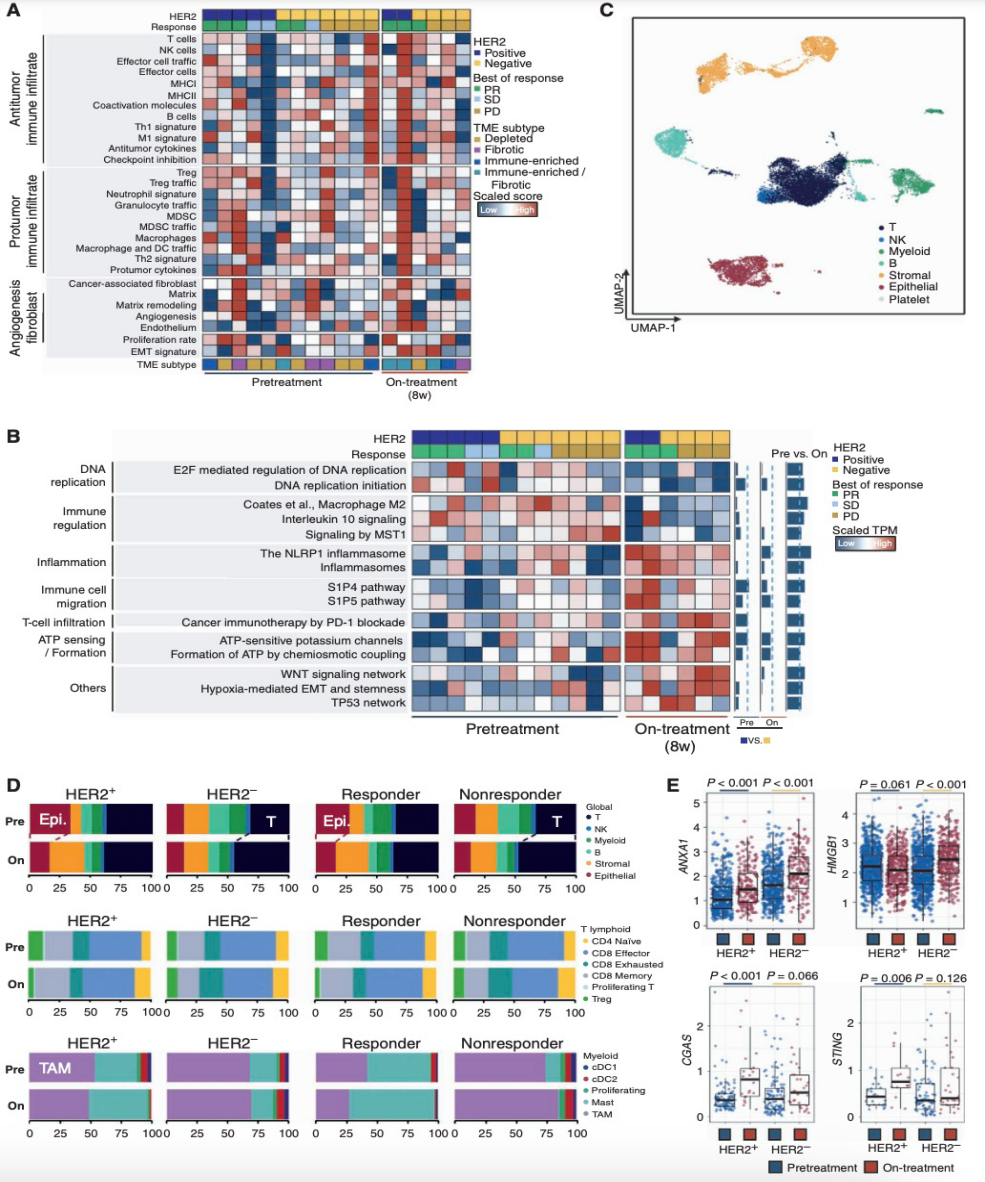
图2
4.化疗将胃癌肿瘤免疫微环境(TME)重塑为具有免疫应答特征
本研究继续分析了治疗前(n = 11)和治疗中(n = 7)的活检样本的单细胞基因表达谱。经过质控,本研究共收集了18,911个细胞(10,651个来自治疗前样本,8,260个来自治疗中样本)。通过无监督聚类识别了七种主要细胞类型:上皮细胞、基质细胞、T细胞、NK细胞、髓系细胞、B细胞以及血小板和未定义细胞群(图2C)。在治疗中样本中,T细胞比例呈现增加趋势,尤其是在HER2阴性AGC中(图2D)。与治疗前样本相比,应答者在治疗中样本中效应CD8+细胞的比例更高(图2D)。治疗期间仅在应答者中观察到T调节细胞(Treg)的减少。另一方面,在非应答者中,治疗中样本中耗竭性T细胞的比例增加,而在治疗前样本中比例较低(图2D,右中)。与应答者相比,非应答者在治疗前样本中肿瘤相关巨噬细胞(TAM)的比例更高,且治疗中样本中的比例进一步增加(图2D)。
5.化疗激活肿瘤细胞中的先天免疫通路
为了深入了解化疗过程中TME中T细胞数量增加的机制,本研究分析了上皮细胞群体中的免疫信号通路(图2E)。值得注意的是,损伤相关分子模式(DAMP)家族中代表性基因的表达显著增加,包括ANXA1和HMGB1,这种增加在HER2阳性和HER2阴性的进展期AGC患者中均有观察到。此外,参与先天免疫信号传导的基因,如cGAS和STING,在HER2阳性治疗中样本中表现出表达增加。这些数据表明,常规细胞毒性化疗可能通过重组T细胞群体并在某些患者的肿瘤细胞中诱导先天免疫信号通路,来促进AGC中TME内的抗肿瘤炎症反应。
6.化疗重新编程肿瘤相关巨噬细胞(TAMs)
研究者们假设抗原呈递细胞可能在化疗过程中重组TME并招募T细胞方面发挥重要作用。研究者将髓系细胞再次聚类为5个主要亚型,并集中研究了TAMs(n = 1,425;图3A)。通过治疗前和治疗中的样本中识别出了1,003个差异表达基因:治疗中样本中显著上调的包括促炎基因,如S100A8、S100A9、IRF1和ITGAX,以及MHC I类抗原呈递基因,如HLA-B和HLA-C;而抗炎分子如SPP1、LGALS1、APOE和APOC1在化疗期间则表现为下调(图3B)。通路分析表明与M2型(抗炎)巨噬细胞相关的基因在治疗中样本中的表达降低,尤其是在HER2阴性AGC样本中。另一方面,与髓系分化、抗原处理和呈递以及MHC I分子上的肽加载相关的基因在治疗中样本中比治疗前样本中的表达更高,与化疗诱导的巨噬细胞调节相一致(图3C)。
为了更好地理解化疗条件下巨噬细胞表型的重组,研究者使用Slingshot工具包重建了TAMs的分化轨迹(图3D)。将表达单核细胞样巨噬细胞标志物(CD14、FCN1)的细胞群设为起点,观察到两条不同的轨迹:其中一条延伸至M2巨噬细胞特异性基因,而另一条延伸至M1巨噬细胞相关基因。在治疗前样本中,M2巨噬细胞的比例(91.9%)远高于M1巨噬细胞(8.1%)。然而,治疗中样本中的TAM亚群倾向于M1巨噬细胞,比例达到了35.8%。综上所述,这些数据表明常规化疗导致了M1/M2极化的增加。
为了证实这些观察结果,研究者检查了一名应答者(EP-02)的配对活检样本。与scRNA-seq数据一致,该患者的CD8+ T淋巴细胞和CD68+巨噬细胞浸润显著增加。有趣的是,该患者在基线时PD-L1为阴性(CPS = 0),但在经过两个周期的XELOX化疗后PD-L1为阳性(CPS = 20)。
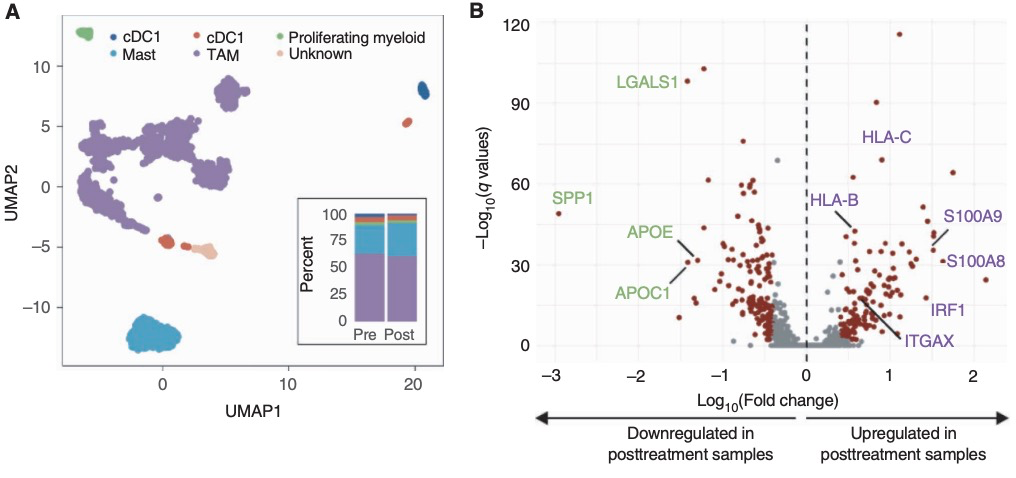
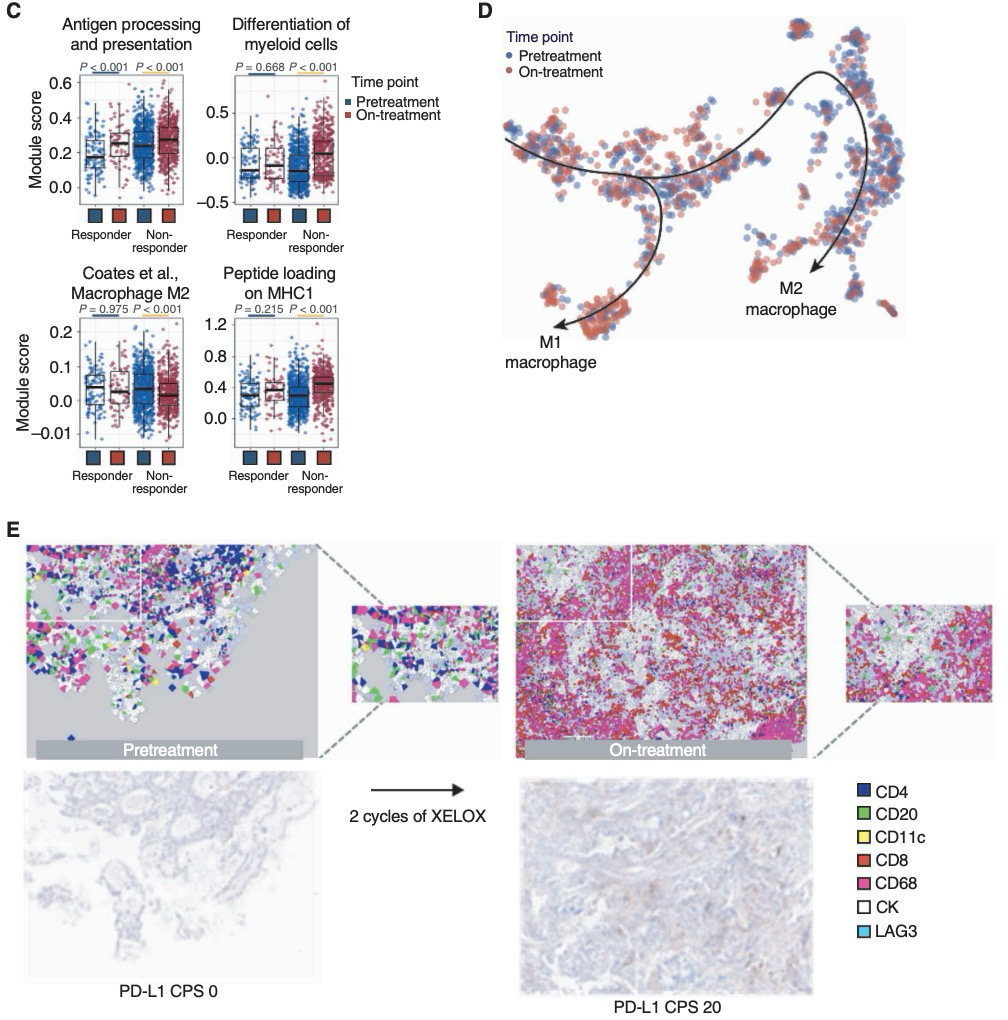
图3
7.一线化疗早期肿瘤微环境(TME)重塑的独立外部验证
为了验证之前的发现,研究者们对正在进行的临床试验中连续入组的17名进展期AGC患者的治疗前和治疗中肿瘤样本进行了研究(样本在一个周期的5-FU和铂类化疗后采集)。分析显示,治疗中TME中的效应细胞群体增加。GSVA算法显示,治疗中样本中M2型巨噬细胞显著受抑,PD-1信号通路激活,验证了之前的scRNA-seq结果(图4A)。研究者还观察到与T细胞受体信号传导、共刺激和效应细胞相关的通路在治疗中富集。如将每个肿瘤样本分类为四种先前定义的TME亚型(图4B),大多数患者接受一个周期的化疗后发生了动态变化:14个免疫耗竭或纤维化的治疗前TME样本中,有7个(50.0%)在治疗期间转变为免疫有利的TME(图4C)。在HER2阳性AGC患者中,治疗前和治疗中的TME炎症反应较HER2阴性AGC患者更为强烈。此外,涉及效应细胞(包括T细胞和Th1细胞)、检查点抑制和MHC-II表达的表达特征在接受治疗后的患者中均显著增加(图4E)。总体而言,这些结果进一步支撑了化疗治疗过程中TME的早期重塑。
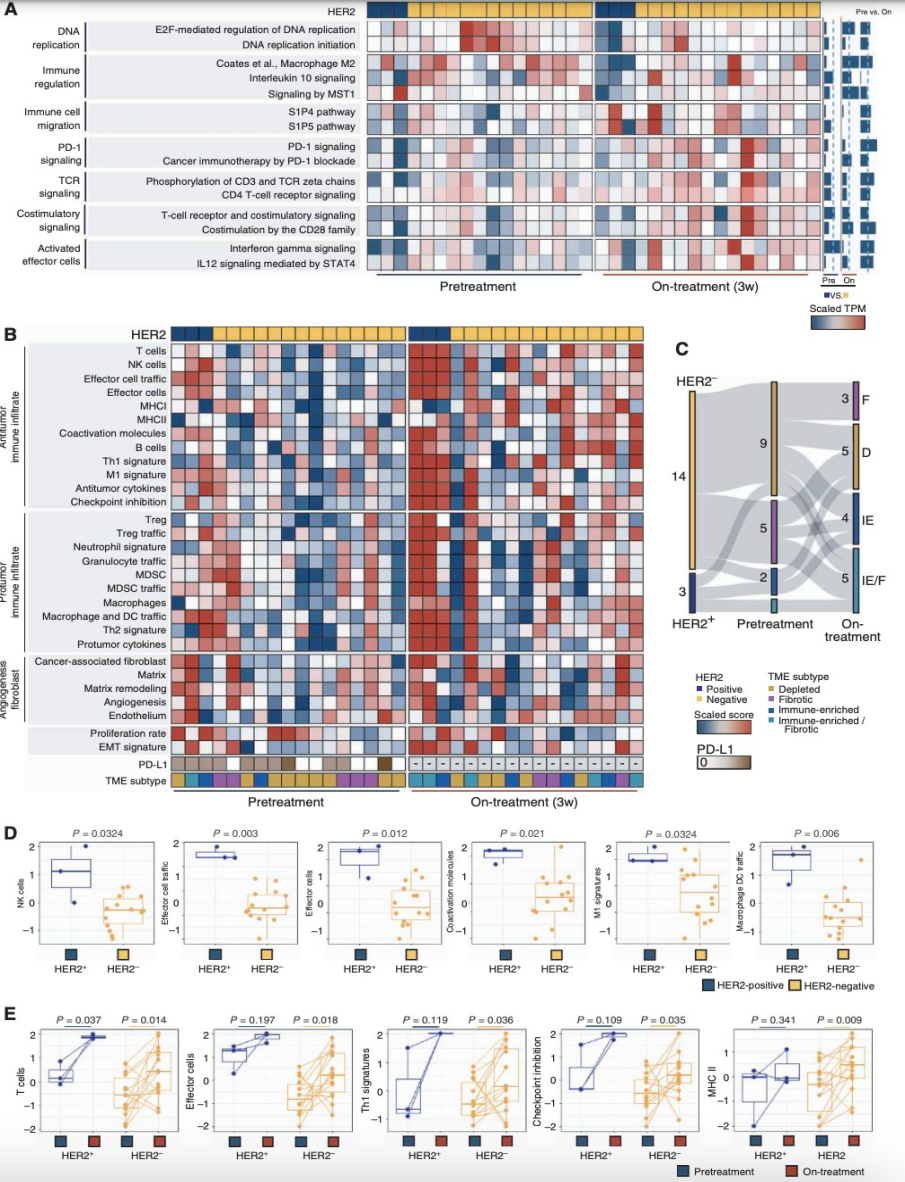
图4
8.一线化疗后T细胞中LAG3表达的早期增加与疗效不佳相关
鉴于化疗对免疫系统的明显重塑作用,研究者接着假设耗竭性T细胞群体,可能在化疗无应答中起作用。研究者将T细胞进一步分为六个亚型:T调节细胞(Treg)、初始CD4细胞、增殖性T细胞、记忆性CD8细胞、效应性CD8细胞和耗竭性CD8细胞(图5A)。研究者进一步重点关注了3位无应答者,他们对标准的XELOX化疗有初始抗性。两名患者的原发胃肿瘤中存在MET扩增,三名患者在基线时均为PD-L1阴性(CPS = 0),且在化疗中未能上调PD-L1表达。TIGIT的表达在MET扩增患者的T细胞中有所富集(图5B)。与MET野生型患者相比,MET扩增患者的终末分化T细胞比例更高(图5B)。为了了解耗竭性T细胞的空间分布,研究者重点分析了一名MET扩增AGC患者的配对样本,该患者在两周期的XELOX化疗期间病情迅速进展(图5C)。使用CODEX进行的多重免疫荧光(mIF)显示,在基线时肿瘤周围有大量的CD11c+树突状细胞和CD8+淋巴细胞;经过两个周期的化疗后,TME主要被巨噬细胞和肿瘤细胞、CD20+ B细胞浸润,几乎没有树突状细胞(图5D)。另一名病情进展的患者在治疗中的LAG3+细胞和CD20+细胞比例高于治疗前肿瘤中的比例(图5E)。在另外两名初始病情进展的患者中观察到了类似的现象,这些患者在mIF中LAG3蛋白表达以及在scRNA-seq中LAG3 mRNA表达均有所增加(图5F)。
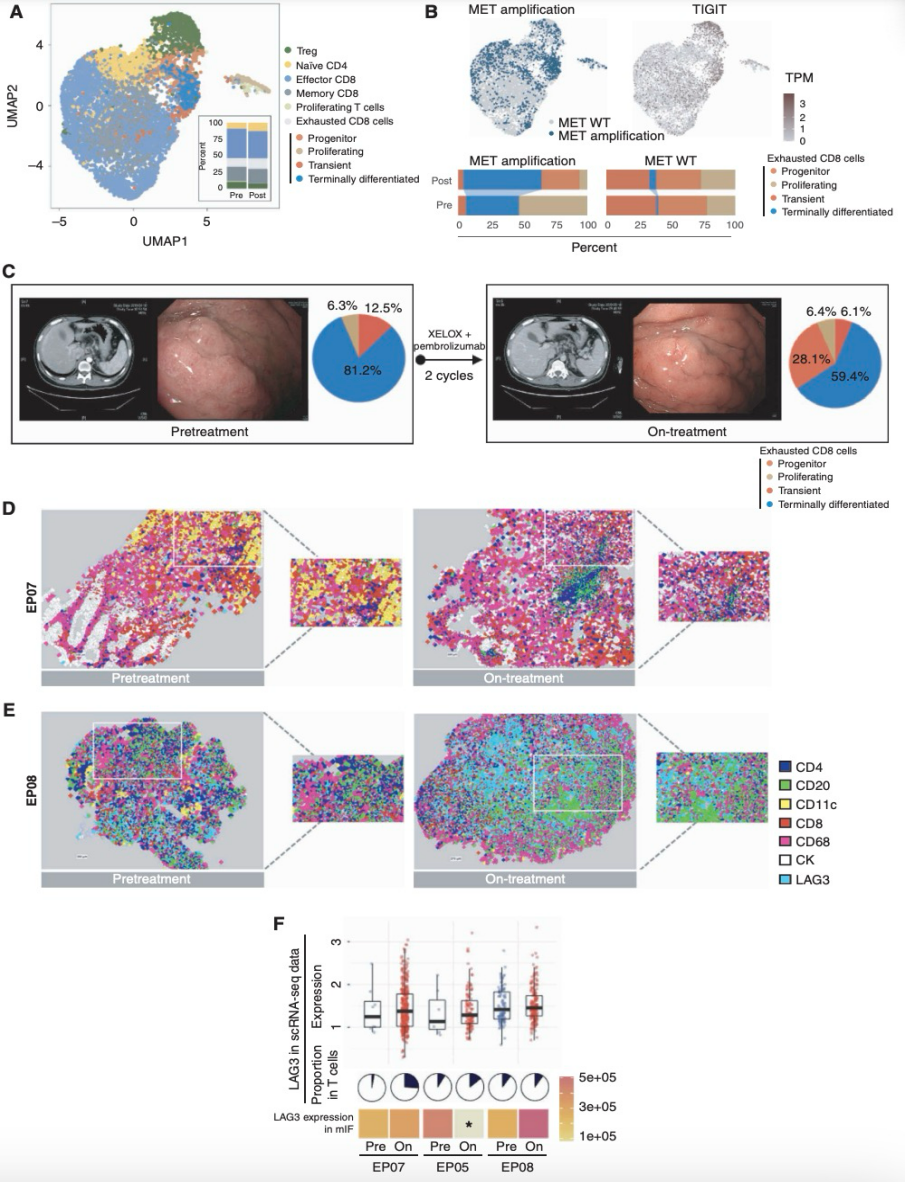
图5
研究结论:
总体而言,本研究提供了一个针对初治进展期AGC的初步和验证数据集,有助于生成详细的TME图谱,为正在临床测试的新型联合治疗方案提供证据支持。

汇报人:宋瑶
导师:赵宇
审核:饶郁芳、庞文都、任建君



